INTRODUCCIÓN
La resonancia magnética de mama (RM) con imágenes dinámicas, proporcionan información sobre la morfología transversal de la lesión, características funcionales, vascularización/perfusión y permeabilidad; a ello se debe su nomenclatura actual de Imágenes de RM de mama con Realce de Contraste Dinámico (DCE-MRI)1-3). La RM de mama ha evolucionado a imágenes de alta resolución que evalúan múltiples parámetros a diferencia del enfoque inicial convencional, que usó solamente las secuencias con contraste para evaluar tumores. La interpretación debe hacerse con radiólogos experimentados en imágenes mamarias, pues como toda tecnología en evolución, la curva de aprendizaje requiere de un tiempo suficiente, para una mayor de certeza de la información4.
La sensibilidad de la RM en el carcinoma mamario es del 88 al 100, su especificidad llega al 725,6. La RM mamaria está indicada de acuerdo a la European Society of Breast Imaging en la detección de cáncer de mama en mujeres con alto riesgo, evaluación del efecto de la quimioterapia neoadyuvante, evaluación de mujeres con implantes mamarios, carcinoma de mama primario oculto, sospecha de recurrencia local, cuando no se puede realizar biopsia con aguja, en la resolución de problemas (hallazgos equívocos en la mamografía/ecografía) y en la estadificación preoperatoria del cáncer de mama recién diagnosticado (ipsilateral y contralateral); sin embargo la National Comprehensive Cancer Network en su más reciente versión del 2022, coincide con esta guía, en algunas observaciones: detección de mujeres con un riesgo > 20% de tener un primario de mama en su vida; agrega al carcinoma oculto de mama, la enfermedad de Paget y el carcinoma lobular invasivo pobremente definido con otras herramientas; finalmente, la estadificación preoperatoria la pone en categoría 2B (basados en bajos niveles de evidencia)7,8.
El uso de imágenes preoperatorias de RM en pacientes con cáncer de mama sigue siendo un tema controversial y actualmente no hay consenso sobre si confiere beneficio o no, ya que no ha demostrado ventajas sobre las imágenes estándar. Por ello, necesitamos saber cuál es el beneficio real que alcanzan las pacientes en relación a la decisión quirúrgica basada en esta herramienta.
MÉTODOS
Criterios de inclusión de los estudios
Meta-análisis; estudios clínicos prospectivos o retrospectivos, unicéntricos o multicéntricos; estudios clínicos observacionales, retrospectivos, con grupo control, en pacientes con cáncer de mama (invasivo, carcinoma ductal in situ y/o carcinoma lobular o ductal infiltrante), que comparen la RM preoperatoria versus no RM.
Resultados buscados. Tasas de: tumorectomía o mastectomía, reoperación quirúrgica, recurrencia loco-regional o a distancia, supervivencia libre de enfermedad o progresión y supervivencia global.
Criterios de exclusión de los estudios
Estudios clínicos que evalúan cáncer de mama con otras histologías diferentes al adenocarcinoma mamario.
Estudios clínicos que incluyeron pacientes con tratamiento neoadyuvante.
Estudios clínicos que incluyeron pacientes con metástasis o pacientes con otros cánceres sincrónicos.
Estudios clínicos anteriores al año 2000.
Localización y selección de los estudios relevantes
Desde el 01 de enero del 2000 hasta el 31 de marzo del 2021, se realizó la búsqueda con tres diferentes motores de datos: MEDLINE/PUBMED, LILACS y SCIELO. En MEDLINE/PUBMED se buscó todos los artículos médicos que contenían la palabra “Preoperative Magnetic Resonance AND Breast Cancer”; se encontraron 3606. En la plataforma LILACS y en SCIELO se buscó la palabra “Magnetic Resonance AND Breast Cancer” y “Resonancia magnética AND Cáncer de mama” se encontraron 152 y 70 artículos respectivamente. Del total recolectado, se evaluó el cumplimiento de los criterios de inclusión y exclusión y finalmente se seleccionó: 53 artículos para la revisión. La información fue trasladada a tablas diseñadas para ordenar la información en función al resultado buscado.
RESULTADOS
Todos los estudios clínicos presentaron dos grupos de pacientes: un grupo de pacientes con RM preoperatoria (RMP) y otro grupo de pacientes con cáncer de mama que solo usó mamografía y ecografía mamaria, pero no RM (noRMP).
Cáncer de mama (Todos los tipos histológicos)
Estudios retrospectivos y comparativos
LaTabla 1muestra los estudios retrospectivos, comparativos, entre los grupos RMP y noRMP. Fisher publicó que la tasa de recurrencia fue de 1/86 (1,2%) versus 9/133 (6,8%) y se detectó carcinoma contralateral en 2/121 (1,7%) versus 9/225 (4%), ambos estadísticamente significativos9. Contrariamente, Solin no encontró diferencias significativas en la tasa de recurrencia loco-regional, supervivencia global, supervivencia sin enfermedad metastásica, ni en la presencia de cáncer de mama contralateral en los grupos RMP versus noRMP10.
Angarita en Canadá y Grady en EEUU, encontraron diferencias significativas en el número de nuevos tumores hallados en pacientes RMP vs. noRMP(11,12). Otros estudios demostraron un aumento significativo de la tasa de mastectomías iniciales y finales versus las cirugías conservadoras (BCS), en los grupos con RMP11-19, sin embargo, otras investigaciones demostraron lo contrario20-26. Dos estudios encontraron una significativa menor frecuencia de márgenes positivos y tasa de reoperaciones en las pacientes con RMP versus noRMP27,28. Otros estudios no encontraron diferencias significativas13,30.
Yi en Corea del Sur, encontró que las pacientes con RMP tuvieron mejor supervivencia libre de recurrencia loco-regional ipsilateral, que aquellas noRMP31. Hill en Estados Unidos encontró en un análisis univariado, que la recurrencia loco-regional fue de menor en pacientes sometidas a RMP versus noRMP, con un seguimiento promedio de 8 años, sin embargo, el análisis multivariado demostró que la RMP no estaba asociada a la recurrencia loco-regional32. Como contraparte, estudios de largo plazo como el de Ryu, Zeng y Gervais con un seguimiento >5 y 10 años, no demostraron diferencia significativa en la supervivencia libre de recurrencia loco-regional en los grupos con y sin RM preoperatoria33-35. Finalmente, Onega analizó una base de datos multicéntrica (The Breast Cancer Surveillance Consortium) y demostró que la mortalidad específica y ajustada por cáncer de mama no fue significativa entre ambos grupos de comparación36
Meta análisis de la RM en cáncer de mama multifocal/multicéntrico
En el 2008 se publicó un meta-análisis cuyos resultados mostraron que la RM detectaba enfermedad adicional en el 16% de las mujeres con cáncer de mama, el valor pronóstico predictivo fue del 66% y la relación de positivos verdaderos/falsos positivos fue de 1,91; la conversión desde una escisión local amplia a una mastectomía fue del 8,1%, demostrándose que la RM en este contexto, provocaba una mayor extensión de la cirugía, en un grupo importante de mujeres37.
Meta análisis y estudios prospectivos y randomizados de la RM en cáncer de mama
El primer estudio clínico prospectivo, aleatorizado, controlado y multicéntrico fue publicado en el 2010; fueron enrolados 1623 pacientes con cáncer de mama en 45 centros hospitalarios del Reino Unido. El estudio COMICE comparó RMP (n=816), versus noRMP (n=807). Se demostró que el uso de RM no se asoció de forma significativa con una reducción de la tasa de reoperación38.
Posteriormente el Estudio MONET, con 211 pacientes en el grupo noRMP y 207 pacientes en el grupo RMP, demostró que la cirugía conservadora (BCS) fue similar en ambos grupos (68% versus 66%); Las reoperaciones por márgenes positivos después de BCS fue significativamente mayor en el grupo con RMP versus el grupo control39.
Un meta-análisis publicado por Houssami y colaboradores en el 2013, encontró una tasa de mastectomía inicial significativa del 16,4% versus 8,1%; no hubo diferencia en la tasa de reoperación después de BCS y mastectomía general en los grupos noRMP y RMP correspondientemente40.
El año 2014 el Estudio POMB, que incluyó a 440 pacientes con cáncer de mama menores de 56 años, en Suecia, asignó aleatoriamente un grupo a RMP (n=220) y otro noRMP (n=220). El grupo con RMP tuvo una mayor tasa de BCS que el grupo control, sin embargo, hubo cambio en la decisión de mastectomía en 23/153 pacientes (15%). La tasa de reoperación fue significativamente menor en el grupo de RMP: 11/220 (5%) versus 33/220 (15%) en el control41.
Un nuevo metaanálisis de Houssami en el 2014 con 3169 pacientes, demostró que la supervivencia libre de recurrencia local a ocho años fue similar en pacientes con RMP (97%) versus noRMP (95%); la supervivencia libre de recurrencia a distancia a ocho años tampoco difirió entre los grupos (89% versus 93%)42.
Otro metaanálisis publicado el 2017 por Houssami y colaboradores, incluyó 19 estudios: tres estudios prospectivos, controlados y randomizados (COMICE, MONET y POMB) y el resto fueron estudios retrospectivos, comparativos; se incluyó 85.975 pacientes con y sin RMP. El uso de RM se asoció a mayor tasa de mastectomía [OR: 1,39 (1,23; 1,57)]; no hubo evidencia de incremento de las tasas de reoperación o márgenes positivos; el grupo con RM tuvo más probabilidades de recibir mastectomía profiláctica contralateral [OR: 1,91 (1,25; 2,91)](43).
Cáncer de mama temprano [Carcinoma ductal in situ (CDIS)]
El 2015 fue publicado un meta-análisis con 3252 pacientes con diagnóstico de carcinoma ductal in situ (1077 con RMP y 2175 noRMP); el grupo con RMP tuvo mayor probabilidad de tener una mastectomía inicial (OR ajustado: 1,76,). No hubo diferencias significativas en la proporción de mujeres con reoperación después de BCS44.
En laTabla 2, se ha organizado los diferentes estudios retrospectivos que evalúan CDIS en el contexto del uso o no de la RM. La sensibilidad de la RM permite la detección de un mayor número de tumores por lo cual Petrillo detectó 19.7% DCIS adicionales en contraposición a las imágenes convencionales, sin embargo, también hubo un 11,6% de falsos negativos45. Lam evidenció 30% de biopsias entre las pacientes que usaron RM vs 7% en aquellas que no, asimismo, el número de cirugías fue significativamente mayor46. Los resultados son bastante controversiales, ya que otros investigadores encontraron una mayor proporción de mastectomías entre las pacientes que usaron RMP en relación al grupo que solo usó imágenes convencionales47-49; sin embargo, Davis demostró en un estudio similar, que no había diferencia significativa en ambos grupos50-52.
Kropcho el año 2011, no encontró diferencias significativas en el hallazgo de márgenes positivos después de cirugía por CDIS, entre los grupos con RMP y sin ella (24,7% vs 30,7%); sí hubo diferencia en la tasa de reoperación entre ambos grupos (17,7% vs 4,1%)53. Yoon el 2020 encontró una tasa de reoperación menor en el grupo que tuvo RMP [OR: 0,33 (IC 95% 0,12-0,92)]54. Contrariamente a estos autores, Allen y So, no encontraron diferencias significativas en las tasas de reoperación en el CDIS en estos dos grupos de pacientes con y sin uso de RM55,56.
Cáncer de mama temprano (Carcinoma lobular o ducto-lobular)
LaTabla 3muestra los estudios retrospectivos, comparativos, realizados en el contexto del cáncer de mama de tipo lobular o mixto, es decir de histología ductal y lobular (ducto-lobular), entre pacientes que tuvieron RMP y aquellas noRMP. La tasa de mastectomía entre ambos grupos no demostró diferencia estadística en cuatro ensayos clínicos realizados57-60. A pesar de ello, existe una tendencia a una mayor tasa de reoperaciones en los estudios clínicos de Mann y Ha en el grupo con RMP [OR: 3,29 (IC 95% 1,22-8,85)57y (OR: 0.140)60y una tendencia a ser mayor en la publicación de Moloney (38,0% vs 23,4%)61.
Finalmente, Ha el 2019, en un estudio unicéntrico, después de un seguimiento de 9 años, encontró que la tasa de recurrencia loco-regional por cáncer de mama con componentes lobulares o mixto, no fue significativa y la supervivencia global tampoco entre RMP versus noRMP62.
DISCUSION
La mayoría de las neoplasias malignas de mama son adenocarcinomas, que constituyen más del 95% de los cánceres de mama y se clasifican como in situ o invasivos. En el carcinoma in situ, las células están restringidas dentro del sistema lobulillar-ductal mamario, mientras que en el carcinoma invasivo las células se diseminan más allá de esa estructura. Por tanto, se ha considerado para esta revisión sistemática, los carcinomas invasivos (tanto ductal como lobular o mixto) y el carcinoma ductal in situ, pero no, carcinoma lobular in situ, ya que es considerado un precursor no obligado del carcinoma de mama63,64.
En un grupo mayoritario de estos estudios, las pacientes con RMP fueron más jóvenes y tuvieron mayor densidad mamaria. Las mujeres premenopáusicas tienen más probabilidades de tener fenotipos agresivos de tumores de mama, y también mamas más densas que aquellas postmenopaúsicas65. Estos sesgos pueden alterar los resultados de los estudios y generar conclusiones controversiales.
La multifocalidad/multicentricidad del cáncer de mama, evaluados en exámenes patológicos minuciosos de las mamas extirpadas, tiene un rango entre 20% y 60%66,67. La RM mamaria, mejoró la sensibilidad para evidenciar tumores no detectados por otros medios; las primeras publicaciones de la RM en cáncer de mama se basaron en estudios observacionales. En este contexto, Kuhl publicó el 2007 que “la RM de mama había demostrado ser muy importante en la estadificación local del cáncer de mama, permitiendo obtener mayor precisión del tamaño y la extensión tumoral, detectar la enfermedad multifocal, multicéntrica o contralateral, extensiones intraductales, haciendo la cirugía más precisa y evitando operaciones innecesarias, por lo cual debería usarse en el estudio de todas las pacientes que se someten a un tratamiento de conservación en el cáncer de mama”68.
Un metaanálisis del año 2014, con 22 estudios y 67.557 pacientes, encontró enfermedad multifocal en el 9,5% de los casos; el análisis multivariado mostró menor supervivencia global (HR: 1,65) y tendencia a una peor supervivencia libre de enfermedad (HR: 1,96) que la enfermedad única, sin embargo, cuando se excluyeron los estudios con heterogeneidad significativa, no hubo diferencia significativa en la supervivencia global69. Yerushalmi encontró que la tasa acumulativa a 10 años para recurrencia local, en cáncer de mama unifocal o multifocal/multicéntrico, tratadas con mastectomía (887 pacientes) versus BCS (300 pacientes), fue de 6,5% (58/887) frente al 5,7% (17/300) respectivamente70. Un metaanálisis posterior que incluyó este último estudio, concluyó que las publicaciones elegidas para la revisión sistemática fueron históricas, de moderada calidad, con escaso poder estadístico, seguimiento limitado y con sesgos de selección que favorecieron la BCS en lugar de la mastectomía en pacientes de bajo riesgo71.
Muchos cirujanos fueron más agresivos en la enfermedad multifocal/ multicéntrica, lo cual resultó en mayor número de mastectomías en los estudios retrospectivos y comparativos que evaluamos en las tablas 1-3, en pacientes con RMP. BCS y mastectomía han demostrado una supervivencia global similar comprobados por dos estudios con un seguimiento de 20 años72,73, una percepción, sin evidencia científica sólida, ha llevado a pensar que la mastectomía podría ser relevante en la enfermedad multifocal/multicéntrica. No obstante, la mastectomía está basada claramente en una decisión, pero no establece de modo categórico el beneficio a mediano o largo plazo para la paciente. A ello hay que agregar que muchas de estas pacientes son sometidas a tratamientos complementarios adyuvantes cuyos efectos no son medidos.
Los márgenes positivos y reoperación complementaria posterior a una BCS, se basaron en criterios de “margen suficiente” para evitar la recurrencia, y cada institución creó sus propios parámetros para realizar una reoperación. El año 2014, el National Surgical Adjuvant Breast Project, consideró que, si el margen de resección estaba libre de células cancerosas a nivel microscópico era suficiente para evitar la reoperación; hubo diferentes interpretaciones que condujeron a un exceso de reoperaciones (entre 25% y 40%), no encontrándose enfermedad patológica en cerca del 50% de ellas74. El 2016, la mayoría de instituciones académicas apoyaron la “no presencia de tumor en la tinta” como la definición de margen negativo, así se consiguió disminuir de 22% a 14% la tasa de reoperaciones75. De ello se deduce, que las diferentes publicaciones mostradas en las tablas 1-3, que evaluaron los márgenes positivos y la tasa de reoperación (obviamente interrelacionados), tuvieron sus resultados sobre una base no estandarizada y por ende difícilmente comparativos entre sí, aun así, la tendencia fue una mayor tasa de reoperaciones en las pacientes que no tuvieron RMP, a ello se suma, que tampoco se evaluó como influenció el tratamiento complementario que recibieron post cirugía.
Probablemente, los resultados que mejor reflejan las ventajas de tener o no una RMP en cáncer de mama temprano son: tasa de recurrencia loco-regional o a distancia, la supervivencia libre de enfermedad o de recurrencia local o a distancia y finalmente la supervivencia global. Varios estudios han investigado las tasas de recurrencia ipsilateral en pacientes con cáncer de mama temprano con BCS asociados al uso de tratamiento adyuvante, en el cáncer invasivo ductal, lobular o mixto, con tasas de recurrencia a 10 años que van entre 2,6% y 6,2%76y en carcinoma ductal in situ, con tasas de recurrencia anual entre 1,22% y 1,65%77. Estudios randomizados, controlados, multicéntricos que compararon tumorectomía sola versus tumorectomía más radioterapia, han demostrado que el riesgo de recurrencia local está significativamente reducido hasta en un 70% en un período de 10 años78. En los estudios retrospectivos y comparativos de esta revisión se encontró resultados antagónicos que no permiten evaluar el verdadero peso diferencial entre el uso o no de la RMP, en cáncer de mama temprano.
Respecto a los estudios prospectivos, randomizados y controlados, el primero en realizarse fue el estudio COMICE38el cual no encontró que la densidad mamaria influyera en la tasa de reoperación en forma significativa; un año después, el Estudio MONET39en pacientes con lesiones no palpables de mama, halló que la tasa reoperación era significativamente mayor en las pacientes con RMP. Finalmente, el Estudio POMB40que fue diseñado específicamente para pacientes menores de 56 años, encontró que la RMP resultó en una menor probabilidad de requerir una reoperación. Sin embargo, estos resultados no están midiendo la injerencia de los tratamientos posteriores a la cirugía que han demostrado disminuir significativamente las tasas de recurrencia a largo plazo. El hecho de que ni el estudio COMICE ni el estudio MONET mostraran ningún beneficio para la RMP fue inesperado, sin embargo, Kestelman79sostiene que ambos estudios tuvieron una serie de limitaciones metodológicas: inexperiencia del uso de la RM tanto a nivel de radiólogos como los propios cirujanos, bajas tasas de reoperación sin una explicación congruente, inexperiencia en la toma de biopsias guiadas por RM, entre otros.
En relación a los meta-análisis, el primero de ellos realizado por Housami37en el 2008 demostró que la RM detectó enfermedad adicional en 16% de las mujeres con cáncer de mama, sin embargo, la relación de positivos verdaderos/falsos positivos fue de 2:1, es decir, de cada tres mujeres diagnosticadas y biopsiadas a través de la RMP, una era falso positivo; la conversión a mastectomía fue del 8,1%; fue uno de los primeros estudios en poner en duda la utilidad de la RMP. El mismo autor publicó 2 metaanálisis más41,43demostrando que el uso de RMP se asoció a una mayor tasa de mastectomía, mas no de reoperación. Existen críticas a estos metaanálisis sobre la base que se incluyó sólo tres ensayos aleatorios y hubo serias deficiencias metodológicas80.
La ubicación intraluminal del CDIS puede generar dudas respecto a los verdaderos límites del tumor, que permitan una cirugía conservadora, por ello se pensó que la RM podría ser de ayuda como herramienta preoperatoria. Un metaanálisis45en pacientes con CDIS demostró que la RMP no mejora el control de los márgenes positivos, ni la tasa de reoperación. En uno de los pocos estudios que evaluaron la recurrencia loco-regional, Pilewskie51en 2321 pacientes con CDIS y tumorectomía demostró que la RM no tuvo un impacto significativo en la recurrencia a 5 años.
El cáncer de mama de histología lobulillar invasivo es conocido por estar asociado con una mayor dificultad en la definición de la extensión del tumor mamario, lo que hace difícil la detección temprana; a ello se suma su propensión a diseminarse a tejidos vecinos y a veces a distancia por lo cual algunos médicos lo perciben como tumores con pobres resultados, a pesar que la mayoría es hormono-dependiente81. Muchos investigadores consideran la RMP mamaria una herramienta potencial para la planificación de la cirugía de conservación de la mama, en esta variedad histológica. La publicación que hizo Ha62el año 2019, con un seguimiento de 9 años, desnudó esta posición cuando encontró que la recurrencia loco-regional por cáncer de mama con componente lobular o mixto, no era significativa en los grupos con y sin RM preoperatoria.
Las indicaciones de la RM en cáncer de mama son claras y precisas; el uso rutinario en la evaluación preoperatoria del cáncer de mama temprano no tiene niveles altos de evidencia que demuestren que mejora la planeación y ejecución quirúrgica o que reduce el número de cirugías, o lo que es más importante, que reduce la recurrencia local o a distancia o mejora la supervivencia en el largo plazo82.
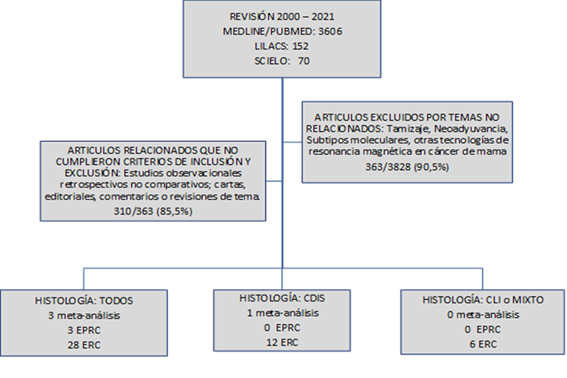
Figura 1: Flujo de Búsqueda de los artículos pertinentes del uso de la RM en pacientes con cáncer de mama temprano.CDIS: Carcinoma Ductal in SituCLI: Carcinoma Lobular InvasivoEPRC: Estudio Prospectivo, Randomizado y ControladoERC: Estudio Retrospectivo y Comparativo uni o multicéntrico
Tabla 1. Estudios Observacionales, retrospectivos uni o multicentricos, comparativos (RM vs no-RM preoperatoria) en cáncer temprano de mama Invasivo y ductal in situ
| Autor/Año | Edad media (RM+ vs RM-) | N | RM % | D Tratamiento Quirúrgico | Mastectomia (RM+ vs RM-) | Margen positivo (RM+ vs RM-) | Reoperación (RM+ vs RM-) | Recurrencia RLR o RD (RM+ vs RM-) | Otros (RM+ vs RM-) | Observaciones |
| Fischer (Alemania) 2004 | 57,1 vs 55,2 | 346 | 121 (35%) | 87 (38,7%) vs 35 (28,9%) | RLR 6,8% vs 1,2% (p<0,001) | Carcinoma contralateral 4,0% vs 1,7% (p<0,001) | Seguimiento medio > 40 meses | |||
| Solin (USA) 2008 | 53,0 vs 56,0 (p=0,026) | 756 | 215 (28%) | RLR 3% vs 4% (p=0,51) | SG (86% v 87%, p=0,51). Metastasis (89% vs 92%, p=0,16), | Seguimiento: 8 años | ||||
| Pengel (Países bajos) 2008 | 56,1 vs 59,6 (p=0,02). | 349 | 173 (49,5%) | CCM a Mx 16/173 (9,2%) | 13,8% vs 19,4% (p=0,17) | Seguimiento medio 54,1 meses | ||||
| Bleicher (USA) 2009 | 52,5 vs 59,0 (p<0,001) | 577 | 130 (22,5%) | OR 1,80 (CI 95% 1,08-3,00, p=0,024) | 13,8% vs 21,6% (p=0,20) | Tiempo hasta cirugia 56,9 vs 38,1 días (p=0,010) | Pacientes con RM+ fueron más jóvenes (52,5 vs 59,0 años p<0,001), | |||
| Angarita (Canada) 2010 | 54,6 vs 64,4 (p< 0,0001) | 147 | 71 (48%) | Inicial 12% vs. final 26% | Tiempo hasta tratamiento. 36,0 vs 32,3 días (p=0,15). | |||||
| Weber (USA) 2012 | 53,6 vs 59,5 (p=0,001) | 313 | 120 (38%) | 47 (39,2%) vs 65 (33,7%) vs p=0,67 | Mx 10 (8,3%) vs 16 (8,3%) p= 0,92 | > Densidad mamaria MR+ (22,3% vs 68,4% p=0,001). | ||||
| Grady (USA) 2012 | 63,5 (31-99) | 184 | 79 (43%) | Cirugía adicional 11% vs 26% (p=0,04) | ||||||
| Wang (USA) 2013 | Por grupos | 36277 | 2554 (7%) | (37,4% vs 31,7%) p<0,0001 | Base de datos SEER-Medicare | |||||
| Obdeijn (Países Bajos) 2013 | 54,0 vs 55,2 (p=0,32) | 123 | 123 (100%) | 42 (34.1%). Mx: (29 , 23.6%). | 15,8% vs 29,3% p<0,01 | 18,9% vs 37,4% p<0,01. | Grupo histórico (control) | |||
| Petrillo (Italia) 2013 | 34,8 vs 34,7 (p=0.570) | 246 | 122 (50 %) | 437% vs 53% (p=0.011) | Pacientes menores de 40 años | |||||
| Killelea (USA) 2013 | 53 vs 60 (p<0,001) | 628 | 369 (59%) | 23% vs 26% p=NS; | Mx bilateral: 20% vs 12% <0,005 | |||||
| Sung (USA) 2014 | 52,0 vs 55,0 | 348 | 174 (50%) | 29% vs 45% p=0,02 | LRR (p=0,33) SLE (p=0,73) | > densidad mamaria (28% vs 6%, p < 0,0001) | Tiempo medio seguimiento después de tto fue de 8 años | |||
| Fancellu (Italia) 2014 | 53,9 vs 56,4 (p=0,10) | 237 | 109 (46%) | 18/109 (16,5%) | 13,7% vs 7,0% (p<0,05) | 4,1% vs 8,6% (p=0,9) | Tamaño tumoral > RM+ 16,8& vs 13,9 mm (p <0,001). | |||
| Fortune-Greeley (USA) 2014 | Por grupos | 20332 | 2471 (12,2%) | OR: 1,33 (IC 95% 1,19-1,48) | Base de datos SEER-Medicare | |||||
| Parsyan (Canadá) 2015 | 55,3 vs 66,3 (p<0.001) | 765 | 307 | 20,5% vs 17,2%, (p=0,254) | 7,5% vs 8,7% (p=0,54) | Pacientes > 30 años | ||||
| Arnaout (Canadá) 2015 | Por grupos | 53,015 | 7824 (14,8%) | [OR: 1,73 (IC 95% 1,62-1,85)] | Mastectomia contralateral [OR:1,48 (IC 95% 1,23-1,77) | Base de datos de salud de Ontario, Canada | ||||
| Patel (USA) 2015 | 51,7 vs 51,7 (p=0,978) | 250 | 154 (62%) | 79 (51,3%) vs 39 (40,6%) p=0,100 | [OR = 4,33; (CI 95% 2,01-9,35; p < 0.001)] | |||||
| Yi (Corea del Sur) 2015 | 48,5 (20-89) | 742 | 371 (50%) | [HR: 0,15; IC 95% (0,07-0,32)]* | [HR: 0,03; IC 95% (0,04-0,21)] (p<0,001)** | *Supervivencia libre de RLR ipsilateral ** SLR mama contralateral | ||||
| Ozanne (USA) 2016 | Por grupos | 55997 | 9055 (16,2%) | 37,1% [OR: 1,04 (IC 95% 0,.98-1,11)] | [OR: 0,96 (IC 95% 0,89 - 1,03) | Base de datos SEER-Medicare | ||||
| Lai (Taiwan) 2016 | 52,2 vs 52,7 (p=0,31) | 1468 | 735 (50,1%) | 5,0% vs 9,0% (p<0,01). | 11,7% vs 3,2% (p<0,01) | |||||
| Gervais (Canada) 2016 | 56,8 (25-92 ) | 470 | 27 (5.8%) | 10 años: 1,6% vs 4,2% (p=0,37) | Seguimiento medio 97 meses | |||||
| Ryu (Corea del Sur) 2016 | 48,9 vs 50,5 (p=0,098) | 954 | 743 (77,8%) | SLRLC (p=0,938), SLE (p=0,507) | SG (p=0,655). | Seguimiento medio 64.5 meses MR+ ; 78.5 meses MR- | ||||
| Brück (Finlandia) 2017 | 61,0 vs 61,0 (p=0,617) | 100 | 50 (50%) | 10/50 (20%) | 6/50(12%) vs 2/50 (4%) (p=0,140) | 14% vs 24% (p=0,202) | Biopsias 14/50 (28%) 7/14 (50%) fueron malignos | Mayores de 35 anos. Estadío I | ||
| Hill (USA) 2017 | 60,0 vs 59,0 (p=0,12) | 1396 | 664 (47,6%) | 4,0% vs. 8,0% a 8 años (p=0,04)* | RM no asociado RLR [RR: 0,77 (0,45-1,28)]** | * Análisis univariado **Análisis multivariado | ||||
| Onega (USA) 2017 | Por grupos | 13097 | 2217 (16,9%) | 39,8% [OR: 1,32 (IC 95% 1,16-1,50)] | Mastectomia contralateral [OR: 1,32 (IC 95% 1,05-1,65)] | The Breast Cancer Surveillance Consortium (BCSC) | ||||
| Wang (USA) 2018 | Por grupos | 24379 | 4691 (19,2%) | 3,2 vs 4,1*[AHR: 0,92; IC 95% (0,70-1,19)] | Mortalidad 5,3 vs 8,7* [AHR: 0,89 (IC 95% 0,73-1,08)] | Base de datos SEER-Medicare *Por 1000 personas-año | ||||
| Onega (USA) 2018 | Por grupos | 4454 | 917 (20,6%) | Mortalidad* [HR: 0,90 (IC 95% 0,72-1,12) | *Específica y ajustada por cáncer de mama | |||||
| Zeng (USA) 2020 | 43,4 vs 43,6 (p=0,62) | 512 | 65% | 7.9 vs. 8.2%, p = 0.88 | RD 6.4 vs. 6.6%, p = 0.92 | Edad ≤ 50 Seguimiento 5.8 anos |
RM: Resonancia Magnética; D: Variación; RLR: Recurrencia Loco-Regional; RD: Recurencia a distancia; SG: Supervivencia Global; CCM: Cirugía Conservadora de mama o Tumorectomía; OR: Odds Ratio; Mx: Mastectomía; NS: No Significativo; SLRLC: Supervivencia Libre deRecurrencia Loco-Regional; SRL: Supervivencia libre de recurrencia; SLE: Supervivencia Libre de Enfermedad; HR: Hazard Ratio; AHR: Hazard Ratio Ajustado; IC 95%: Intervalo de confianza al 95%.
Tabla 2. Estudios Observacionales, retrospectivos uni o multicentricos, comparativos (RM vs no-RM preoperatoria) en cáncer de mama ductal in situ
| Autor/Año | Edad media (RM+ vs RM-) | N | RM % | D Tratamiento Quirúrgico | Mastectomia (RM+ vs RM-) | Margen positivo (RM+ vs RM-) | Reoperación (RM+ vs RM-) | Recurrencia RLR o RD (RM+ vs RM-) | Otros (RM+ vs RM-) | Observaciones |
| Allen (USA) 2010 | 60,5 vs 64,4 | 99 | 64 (64,6%) | 20,3% vs 25.7% p=0,62 | 21,2% vs 30,8% p=0,41 | 21,2% vs 30.8% p=0,41 | ||||
| Itakura (USA) 2011 | 50,0 vs 59,0 (p<0,001) | 149 | 38 (25,5%) | 45% vs 14%, p<0,001 | MR+ tuvieron DCIS m+ás grandes (1,6 vs 1,0 cm; p=0,007) | |||||
| Kropcho (USA) 2011 | 55,0 vs 62,0 (p<0,001). | 158 | 60 (38%) | 17,7% vs 4,1% (p=0,004) | 24,7% vs 30,7% p = 0,414 | |||||
| Davis (USA) 2012 | ND | 218 | 154 (71%) | 8,9% vs 7,8% p=NS | 34% vs 39% p=NS | |||||
| Pilewskie (USA) 2013 | 53,0 vs 60,0 (p<0,0001) | 352 | 217 (61,2%) | 34,6 vs 27,4% p=0,20 | 14,3% vs 20,0% (p=0,19). | |||||
| Petrillo (Italia) 2017 | 63,3 vs 51,4 (p<0,001) | 362 | 117 (32,3%) | RM+ 19,7% DCIS adicionales y 11.6% de falsos negativos. | ||||||
| So (USA) 2017 | 56,4 vs 63,6 (p<0,001) | 176 | 97 (55,1%) | 28,9% vs 26,6% p=0,87). | ||||||
| Keymeulen (P. Bajos) 2019 | 50,0-74,0 (84,7%), | 10173 | 2382 (22,9%) | [OR: 2,11 (IC 95% 1,91-2,33)] | [OR: 0,99 (IC 95% 0,85-1,16)] | Mx secundaria [OR: 1,17 (IC 95% 1,00-1,37)] | *Registo Cáncer de Holanda < 75 anos | |||
| Lam (USA) 2019 | 55,7 vs 53,8 (p=0,29) | 373 | 332 (89%) | Biopsia 30% vs. 7% p=0,002; N° cirugías 1,2 vs 1,5 p<0,001 | ||||||
| Balleyguier (Francia) 2019 | 56,0 vs 58,0 | 352 | 178 (50,6)% | 18% vs 17% (p=0,93] | [OR: 0,68 (IC 95% 0,41-1,1; p=0,13)] | |||||
| Shin (Corea del Sur) 2019 | 54,0 vs 49,0 (p=0,001) | 541 | 430 (79,5%) | 3% (Apropiado 54%) | [OR: 0,39 (IC 95% 0,16-0,93 p=0,03) | [OR: 0,33 (IC 95% 0,12-0,92 p=0,03) | ||||
| Lamb (USA) 2020 | 60,2 vs 50,6 (p<0,001) | 963 | 236 (24,5%) | 34,3% vs 19,4% p<0,001 | 36,0% vs 37,4%p=0,85 |
RM: Resonancia Magnética; D: Variación; RLR: Recurrencia Loco-Regional; RD: Recurencia a distancia; OR: Odds Ratio; Mx: Mastectomía; NS: No Significativo.
Tabla 3. Estudios Observacionales, retrospectivos uni o multicentricos, comparativos (RM vs no-RM preoperatoria) en cáncer temprano de mama lobular o mixto
| Autor/Año | Edad media (RM+ vs RM-) | N | RM % | D Tratamiento Quirúrgico | Mastectomia (RM+ vs RM-) | Margen positivo (RM+ vs RM-) | Reoperación (RM+ vs RM-) | Recurrencia RLR o RD (RM+ vs RM-) | Otros (RM+ vs RM-) | Observaciones |
| Mann (Países bajos) 2010 | 56 vs 61 (p=0,001) | 267 | 99 (37%) | 48% vs 59% p=0,098 | [OR: 3,29 (IC 95% 1,22-8,85). | |||||
| Heil (Alemania) 2011 | 57,8 vs 63,6 p=0,003 | 178 | 92 (52%) | 38% vs 30% p=0,119 | Cirugía bilateral 14 vs 3 patientes; p=0,002). | |||||
| Sinclair (Escocia) 2016 | ND | 138 | 59 (42,8%) | 40.70% | 32% vs 30% p=0,71 | |||||
| Ha (Corea del Sur) 2018 | 49,9 vs 51,5 p=0,035 | 603 | 369 (61,2%) | 25,5% | Mx inicial (OR: 0,876; p=0,528) | 39.3% vs 65.5% | (OR: 0.140; P<0.001) | Mx final (OR: 0,744; p=0,151) | ||
| Ha (Corea del Sur) 2019 | 48,6 vs 50,6 p=0,036) | 287 | 120 (41,8%) | RLR (HR:1,204; p=0,796) | SG (HR: 0,485; p=0,231) | |||||
| Moloney (Irlanda) 2020 | 56,4 vs 65,6 (p<0,001). | 218 | 70 (32.1%) | 38,0% vs 23,4% (p=0,057). |
RM: Resonancia Magnética; D: Variación; RLR: Recurrencia Loco-Regional; RD: Recurencia a distancia; SG: Supervivencia Global; OR: Odds Ratio; Mx: Mastectomía; NS: No Significativo; HR: Hazard Ratio.
CONCLUSIONES
No existe hasta el momento una clara evidencia del beneficio de la RM preoperatoria en las pacientes con cáncer de mama loco-regional; los estudios de investigación que han evaluado la tasa de mastectomías versus tumorectomías, la tasa de reoperación, la recurrencia loco-regional y la supervivencia libre de progresión tienen resultados controversiales. Es necesario estudios adicionales de tipo prospectivo, multicéntricos, aleatorizados, comparativos y bien diseñados que definan mejor el rol de la RM preoperatoria en cáncer de mama locorregional.











 texto en
texto en 


