INTRODUCCIÓN
El cáncer es una enfermedad que ha ido incrementando su incidencia en países desarrollados y en vías de desarrollo, esperando un incremento de casos del 47% (28,4 millones) entre el 2020-2040, debido a factores de riesgo que no sólo son socioeconómicos o modificables como la sobrepoblación sino también no modificables como la edad1-4.
Esta expansión global, sitúa al cáncer como la primera causa de muerte prematura, logrando una disminución de hasta 3 años de la esperanza de vida en países como Noruega y del Oeste de Europa5. La Global Cancer Statics 2020, reportó la aparición de 19,3 millones de casos nuevos de cáncer y casi 10 millones de muertes por el mismo; también se comprobó que los casos de cáncer de mama sobrepasaron al cáncer de pulmón con 2.3 millones de nuevos casos (11,7%) contra 11,4% respectivamente, aunque el cáncer de pulmón sigue siendo la neoplasia con mayor mortalidad con 1,8 millones de muertes seguida por el cáncer colorrectal, hepático, de estómago y de mama4.
Los estudios globales en cáncer de mama han demostrado que con la estandarización de la edad a 45,9 se ha incrementado la mortalidad y los años de vida ajustado por discapacidad (AVAD); también por medio del índice sociodemográfico (SDI) se obtuvo que la mortalidad disminuyó en mujeres entre los rangos de edades de 15-49 y 50-696. Así mismo, disminuyó su incidencia en las regiones con alto SDI y aumentó considerablemente en las zonas con mediano y bajo SDI7.
La detección precoz del cáncer de mama en mujeres juega un rol fundamental, ya que un diagnóstico tardío favorecería la progresión de la neoplasia hasta estadios avanzados como III o IV8. Siendo los factores causantes del retraso del diagnóstico los educativo, el estado civil, no reconocer los signos ni síntomas de la enfermedad, el miedo a la muerte y el no tener servicios de salud cercanos9-11.
En varios países se ha abierto la posibilidad del empleo de plantas medicinales como complemento o alternativa de tratamiento de bajo costo y fácil acceso en ciertas regiones, siendo el Perú un país megadiverso en cuanto a especies vegetales existen investigaciones que reconocer sus aportes terapéutico como es el caso de Morinda citrifolia, Annona muricata, Uncaria tomentosa, Cenchrus echinatus L, demostrando propiedades anticancerígenas12-15.
Se ha encontrado que el extracto etanólico del Cenchrus echinatus L. posee taninos, compuestos fenólicos, alcaloides, flavonoides y aminoácidos libres en mayor proporción, y en menor cantidad quinonas y glicósidos13-15. Asociando a los polifenoles como responsables de la actividad antiulcerosa, cardioprotectora, hepatoprotectora14, hipolipemiante15, anticancerígena16-18y antioxidante19-20.
En el 2000 la OECD (Organisation for Economic Cooperation and Development) recomienda como necesaria la determinación de toxicidad aguda y la dosis letal media (DL50) de productos medicinales21-22. Así también se evalúa posibles cambios espontáneos en el comportamiento de roedores23. Siendo un producto inocuo cuando los valores de DL50 superan los 5 000 mg/Kg23-25.
Existen especies silvestres con propiedades mutagénicas, estrogénicas e inmunosupresoras entre las cuales encontramos al DMBA y N-Methyl-N-nitrosourea (NMU)26-28. Donde el DMBA induce a la aparición promedio de 4,7 tumores mamarios hormonodependientes en ratas, con características histopatológicas y alteraciones genéticas de la neoplasia descrita en humanos29.
En la actualidad hay un número limitado de productos vegetales estudiados, sus componentes, la determinación de su eficacia terapéutica y la dosis a utilizar. Por tales motivos nos planteamos determinar la seguridad y el efecto protector del extracto etanólico de Cenchrus echinatus L. (cadillo) sobre el cáncer de mama inducido por DMBA en Rattus rattus.
MÉTODOS
Diseño y área de estudio
Se realizó un estudio experimental tipo observacional, prospectivo con enfoque longitudinal.
Población y muestra
Se trabajó con 2 poblaciones de roedores (Mus músculus y Rattus rattus var albinus), estando las muestras conformadas por 84 ratones albinos machos Balb/C53 (25 ± 5 g de peso corporal) para la determinación de DL50; 20 ratas Holtzman (10 ratas machos y 10 ratas hembras de 160 ± 20 g de peso corporal) para evaluar la toxicidad a 45 días y 50 ratas hembras Holtzman (80 ± 10 g de peso corporal), para la evaluación del efecto anticancerígeno de mama, todos los especímenes procedieron del bioterio del Instituto Nacional de Salud Lima-Chorrillos.
Variables e instrumentos
Para la variable extracto de Cenchrus echinatus L., se evaluó la seguridad oral en dosis única (DL50) en ratones y la seguridad oral en dosis repetidas en ratas, también se consideró el screening fitoquímico del extracto. Mientras que para la variable cáncer de mama se realizó la inducción de cáncer de mama en ratas con DMBA y se evaluó el efecto del extracto de Cenchrus echinatus L., administrado por vía oral durante 16 semanas. Los instrumentos estuvieron conformados por fichas de recolección de donde se registraron las masas corporales, número de muertes (DL50); masas corporales, masa de órganos blandos, bioquímica sanguínea (seguridad a dosis repetida), tipos y cantidad de metabolitos secundario (screening fitoquímico); número, tamaño y ubicación de los tumores mamarios, bioquímica sanguínea (Efecto protector del extracto frente al cáncer de mama).
Procedimientos
Recolección de la planta: La muestra vegetal, plantas completas de Cenchrus echinatus L. fueron recolectadas en el caserío de San José, distrito de Santiago de Cao, Provincia de Ascope. Departamento de la Libertad.
Identificación taxonómica: La muestra vegetal fue clasificada según el sistema de Cronquist del año 1988 en el Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos (Constancia N° 140-USM-2010).
Obtención del extracto etanólico: Las muestras fueron seleccionadas, lavadas y deshidratadas a 40ºC en un horno con aire circulante, luego se pulverizaron en un molino de mano y se maceró con etanol de 96° a temperatura ambiente durante 7 días; posteriormente se filtró y se eliminó el solvente en una estufa a 40°C, hasta obtener un peso constante. El residuo obtenido, se denominó extracto etanólico, el cual se conservó en frasco de color ámbar a 4ºC30.
Estudio fitoquímico: Se preparó una batería de tubos conteniendo 1 mL de una solución alcohólica de extracto de Cenchrus echinatus L. a los que se les practicaron las reacciones de Gelatina, tricloruro férrico, Dragendorff, Molisch, NaOH 10%, Vainillin sulfúrico, Liebermann, Shinoda y Ninhidrina, con el fin de determinar la presencia y cantidad de metabolitos secundarios31.
Determinación de la dosis letal 50 (DL50): Se formaron 14 grupos aleatorios de seis ratones cada grupo, los que los tratamientos fueron administrados por vía oral y por única vez, el primer grupo recibió solución suero fisiológico 5 mL/kg (SSF), y los demás grupos extracto etanólico de cadillo en dosis de 10, 100, 500, 1 000, 5 000, 7 500, 10 000, 12 500, 15 000, 17 500, 18 750, 19 375 y 20 000 mg/kg de peso corporal respectivamente. Los ratones fueron observados durante las primeras 24 horas y posteriormente de manera diaria dentro de un periodo de 14 días, anotándose la sintomatología tóxica, peso y número de muertes, la DL50 fue calculada haciendo uso del método estadístico de los Probits24-32.
Determinación de la toxicidad oral a 45 días: Se realizó teniendo en cuenta el ensayo 407 de la OECD-1995, se utilizó 20 ratas cepa Holtzman (diez de ambos sexos), se formaron cuatro grupos de cinco ratas, las que recibieron SSF 5 mL/Kg y extracto etanólico de cadillo 100 mg/kg por vía oral, durante los 45 días, se llevó un control semanal de los pesos de las ratas, finalmente se anestesiaron con pentobarbital sódico 30 mg/Kg por vía intraperitoneal (V.I) y se les extrajo una muestra de 5 mL de sangre por punción cardiaca, la que sirvió para determinar la sanguínea, luego las ratas fueron eutanizadas con 100 mg/kg de pentobarbital sódico V.I. y se les práctico una laparatomía para extraerles los órganos blandos y su evaluación macroscópica.
Diseño experimental para la determinación del efecto protector del extracto: Se utilizaron 50 ratas albinas hembras distribuidas de manera aleatoria en cinco grupos de diez ratas cada grupo: El 1° grupo recibió SSF 5 mL/Kg, 2° grupo DMBA 20 mg/rata33, los grupos 3°, 4° y 5° recibieron DMBA, además del extracto a dosis de 10, 100 y 200 mg/Kg respectivamente, todos los tratamientos fueron administrados por vía oral (V.O) haciendo uso de una cánula metálica.
Inducción de las masas tumorales: Se utilizó DMBA, el que se administró al inicio de la experimentación, por V.O en dosis única de 20 mg/rata33, utilizándose como vehículo 1 mL de aceite de oliva, se llevó el control semanal del peso de las ratas, así como, el número, tamaño y ubicación de las masas tumorales, durante cuatro meses, las mismas que fueron comparadas numéricamente y porcentualmente con el grupo control que recibió DMBA 20mg/Kg, utilizando la siguiente fórmula: % inhibición de masas tumorales = ((C-T)/C) *100, donde C=control, T=tratamiento.
El análisis anatomopatológico: La semana 16, las ratas fueron eutanizadas con una sobredosis de pentobarbital sódico (100 mg/Kg) administrado V.I. y se les extrajo las masas tumorales de mamas para su evaluación macro y microscópica, las que se conservaron en formol al 10% para su estudio anatomopatológico.
Análisis estadísticos
Se utilizó el programa estadístico SPSS versión 17, que nos permitió determinar estadígrafos, evaluar diferencias y homogeneidad (prueba de Kolmogorov-Smirnov) entre grupos. La comparación de las medias se realizó con ayuda de la prueba t de Student, Chi-cuadrado, análisis de varianza, entre otras. Para los diferentes análisis se consideró la p<0,05. Los valores promedios del peso corporal a dosis repetidas se comparan por un método no paramétrico, la prueba de la U de Mann-Whitney.
RESULTADOS
En laTabla 1, se puede apreciar que el extracto etanólico de Cenchrus echinatus contiene taninos, compuestos fenólicos, alcaloides, flavonoides y aminoácidos libres en abundante cantidad, quinonas y glicósidos en regular cantidad, no identificándose la presencia de esteroides triterpénicos.
Tabla 1. Estudio fitoquímico del extracto de Cenchrus echinatus L.
| Reacción de Identificación | Metabolito Secundario | Cantidad |
| Gelatina | Taninos | +++ |
| Tricloruro férrico | Compuestos Fenólicos | +++ |
| Dragendorff | Alcaloides | +++ |
| Mayer | Alcaloides | +++ |
| Hidróxido de sodio | Quinonas | ++ |
| Alfa naftol | Glicósidos | ++ |
| Liebermann | Esteroides y triterpenos | - |
| Shinoda | Flavonoides | +++ |
| Ninhidrina | Aminoácidos libres | +++ |
Dónde: (+++) = Abundante cantidad; (++)=Regular cantidad o positivo, (+)= Poca cantidad o trazas; (-)= Ausencia
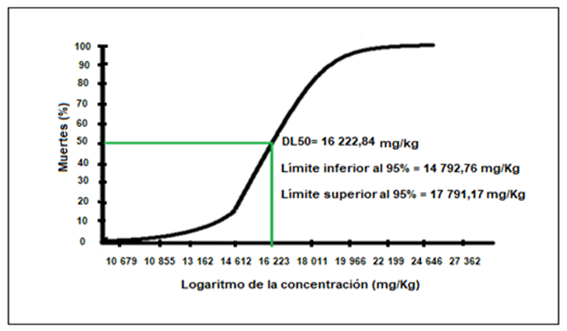
En laFigura 1, se observa el número de muertes de ratones debido a la administración oral de concentraciones crecientes de extracto etanólico de Cenchrus echinatus L. desde los 10 mg/Kg hasta los 20 000 mg/Kg de peso, siendo la DL50 (dosis que causa la muerte del 50% de los especímenes) de 16 223 mg/Kg.
En laTabla 2, a. Se muestran los valores de bioquímica sanguínea evaluados durante la evaluación de la seguridad oral a 45 días del extracto etanólico de Cenchrus echinatus L., representados por: Colesterol total, Lipoproteína de alta densidad (HDL), triglicérido, glucosa, urea, Transaminasa Glutámico Pirúvica (TGP), fosfatasa alcalina. También en b. Se evidencia los valores de numeración y fórmula leucocitaria representado por la cantidad de: Abastonados, segmentados, eosinófilos, basófilos, monocitos, linfocitos y leucocitos. Así mismo en c. Muestra los pesos de los órganos blandos de las ratas como el estómago, bazo, riñón, hígado, pulmón, corazón y cerebro. Todos los parámetros se muestran considerando el valor médido con su respectivo error estándar, los grupos tratamientos estuvieron conformados por ratas machos (M) y hembras (H), los que recibieron SSF 5 mL/Kg y 100 mg/kg de extracto etanólico de Cenchrus echinatus L respectivamente.
Tabla 2. Seguridad oral a dosis repetida del extracto etanólico de Cenchrus echinatus L. en ratas 2a. Parámetros de bioquímica sanguínea. 2b. Numeración y fórmula leucocitaria. 2c. Pesos de órganos blandos de ratas.
| 2a. | |||||||||||||||
| TTO | Colesterol total (mg/dL) p<0,701 | HDL (mg/dL). p<0,655 | Triglicéridos (mg/dL). p<0,782 | Glucosa (mg/dL). p<0,860 | Urea (mg/dL) p<0,809 | TGP (U/L) p<0,415 | Fosfatasa alcalina (UI/L) p<0,743 | ||||||||
| VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | ||
| SSF (M) | 156,8 | ± 9,5 | 43,2 | ± 2,1 | 150,0 | ± 7,2 | 88,9 | ±3,3 | 16,2 | ±2,2 | 24,0 | ±5,8 | 150,0 | ±16,6 | |
| Ext (M) | 165 | ±12,6 | 43,8 | ± 2,7 | 156,8 | ± 9,4 | 89,5 | ±4,0 | 17,2 | ±2,2 | 29,8 | ±7,2 | 127,6 | ±15,8 | |
| SSF (H) | 166,6 | ± 5,0 | 41,2 | ± 1,1 | 159,3 | ± 4,1 | 92,6 | ±4,2 | 19,8 | ±2,9 | 26,8 | ±4,4 | 136,4 | ±16,4 | |
| Ext (H) | 173 | ± 9,8 | 40,4 | ± 2,5 | 152,4 | ± 4,6 | 89,4 | ±5,0 | 17,8 | ±2,2 | 23,4 | ±2,7 | 138,6 | ±4,3 | |
| 2b. | |||||||||||||||
| TTO | Abastonados (%) p<0,407 | Segmentados (%) p<0,665 | Eosinófilos (%) p<0,225 | Basófilos (%) p<o,418 | Monocitos (%) p<0,366 | Linfocitos (%) p<0,857 | Leucocitos (U/mm3) p<0,473 | ||||||||
| VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | ||
| SSF (M) | 1,4 | ± 0,4 | 59,2 | ± 2,0 | 0,6 | ± 0,4 | 0,0 | ±0,0 | 1,6 | ±0,4 | 37,2 | ±1,6 | 8434,0 | ±549,3 | |
| Ext (M) | 2,4 | ± 1,0 | 57,4 | ± 1,9 | 2,4 | ±0,9 | 0,0 | ±0,0 | 0,6 | ±0,2 | 37,2 | ±3,4 | 7 924,0 | ±751,8 | |
| SSF (H) | 0,6 | ± 0,4 | 61,0 | ± 2,5 | 2,0 | ± 1,0 | 0,0 | ±0,0 | 1 | ±0,3 | 35,4 | ±3,0 | 8060,0 | ±951,1 | |
| Ext (H) | 1,8 | ± 0,9 | 62,0 | ± 2,3 | 0,6 | ± 0,2 | 0,2 | ±0,2 | 0,8 | ±0,2 | 34,6 | ±1,9 | 8308,0 | ±885,9 | |
| 2c. | |||||||||||||||
| TTO | Estómago p<0,456 | Bazo p<0,024 | Riñón p<0,000 | Hígado p<0,001 | Pulmón p<0,120 | Corazón p<0,019 | Cerebro p<0,000 | ||||||||
| VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | ||
| SSF (M) | 4,9 | ± 0,8 | 1,6 | ± 0,2 | 1,2 | ± 0,2 | 10,0 | ±0,4 | 1,9 | ±0,3 | 1,0 | ±0,1 | 1,5 | ± 0,0 | |
| Ext (M) | 4,2 | ± 0,4 | 1,0 | ± 0,1 | 0,9 | ± 0,1 | 10,5 | ±0,7 | 1,8 | ±0,2 | 1,1 | ±0,1 | 1,6 | ± 0,0 | |
| SSF (H) | 3,9 | ± 0,7 | 0,9 | ± 0,1 | 1,1 | ± 0,0 | 9,7 | ±0,2 | 1,5 | ±0,2 | 0,7 | ±0,1 | 1,5 | ± 0,0 | |
| Ext (H) | 4,8 | ± 0,5 | 0,8 | ± 0,1 | 1,1 | ± 0,1 | 10,3 | ±0,5 | 1,6 | ±0,2 | 0,9 | ±0,1 | 1,7 | ± 0,0 | |
Dónde: TTO= tratamiento, SSF=SSF 5 mL/kg, Ext= Extracto 100 mg/kg, (M)= rata macho, (H)= rata hembra, VM= valor medio, EE= error estándar.
En laTabla 3, Se muestran los parámetros considerados al evaluar el efecto protector del extracto etanólico de Cenchrus echinatus L. a la semana 16 de experimentación, como son: 3a. bioquímica sanguínea representados por: Colesterol total, Lipoproteína de alta densidad (HDL), triglicérido, glucosa, urea, Transaminasa Glutámico Pirúvica (TGP), fosfatasa alcalina. También en 3b. Se evidencia los valores de numeración y fórmula leucocitaria representado por: Abastonados, segmentados, eosinófilos, basófilos, monocitos, linfocitos y leucocitos. Todos los parámetros se muestran considerando el valor médido con su respectivo error estándar, los grupos tratamientos estuvieron conformados por ratas hembras.
Tabla 3. Evaluación del efecto protector del extracto etanólico de Cenchrus echinatus L. en ratas 3a. Parámetros de bioquímica sanguínea. 3b. Numeración y fórmula leucocitaria.
| 3a. | ||||||||||||||
| TTO | Colesterol total (mg/dL) p<0,786 | HDL (mg/dL). p<0,910 | Triglicéridos (mg/dL). p<0,571 | Glucosa (mg/dL). p<0,205 | Urea (mg/dL) p<0,809 | TGP (U/L) p<0,000 | Fosfatasa alcalina (UI/L) p<0,024 | |||||||
| VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | |
| SSF | 158,3 | ±10,1 | 50,0 | ± 5,5 | 118,8 | ±10,6 | 84,8 | ±2,2 | 14,0 | ±1,5 | 12,8 | ±0,9 | 105,5 | ±9,8 |
| TX | 171,4 | ± 5,9 | 49,8 | ± 2,6 | 141,0 | ±10,2 | 93,6 | ±2,5 | 18,5 | ±1,6 | 27,0 | ± 2,8 | 139,4 | ±11,4 |
| TX-E10 | 164,0 | ± 10,5 | 54,2 | ± 3,2 | 134,0 | ±10,8 | 85,8 | ± 5,0 | 14,2 | ±1,2 | 17,2 | ±2,4 | 136,4 | ±4,2 |
| TX-E100 | 162,7 | ± 7,2 | 50,1 | ± 3,6 | 137,4 | ±8,0 | 86,1 | ±3,2 | 16,2 | ±0,5 | 13,8 | ±1,3 | 118,6 | ± 6,2 |
| TX-E200 | 160,1 | ± 8,4 | 52,4 | ±3,0 | 133,4 | ±6,2 | 84,3 | ±3,5 | 14,8 | ±1,3 | 14,1 | ±1,7 | 108,4 | ± 5,2 |
| 3b. | ||||||||||||||
| TTO | Abastonados (%) p<0,408 | Segmentados (%) p<0,502 | Eosinófilos (%) p<0,469 | Basófilos (%) p<o,705 | Monocitos (%) p<0,284 | Linfocitos (%) p<0,742 | Leucocitos (U/mm3) p<0,171 | |||||||
| VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | VM | EE | |
| SSF | 0,7 | ± 0,3 | 63,8 | ± 3,9 | 1,3 | ± 0,5 | 0,0 | ±0,0 | 0,3 | ±0,3 | 33,1 | ±4,0 | 5 293 | ± 251 |
| TX | 1,6 | ± 0,5 | 62,7 | ± 2,5 | 2,3 | ± 0,9 | 0,0 | ±0,0 | 1,8 | ±0,6 | 33,2 | ±3,1 | 7 470 | ± 764 |
| TX-E10 | 1,2 | ± 0,6 | 56,2 | ± 3,9 | 2,2 | ± 0,8 | 0,0 | ±0,0 | 0,6 | ±0,2 | 38,6 | ±3,2 | 6 982 | ± 822 |
| TX-E100 | 0,7 | ± 0,3 | 62,6 | ± 3,1 | 1,3 | ± 0,8 | 0,1 | ±0,1 | 1,2 | ±0,4 | 34,9 | ±3,3 | 6 822 | ± 468 |
| TX-E200 | 1,2 | ± 0,3 | 59,3 | ± 1,9 | 0,7 | ± 0,3 | 0,1 | ±0,1 | 1,2 | ±0,4 | 37,1 | ±1,8 | 6 269 | ± 452 |
En laFigura 2, 2a. se aprecia una mayor cantidad de formación de masas tumorales en el grupo DMBA 20 mg/rata (39 unidades), distribuidas 23 a nivel torácico, seis a nivel abdominal y diez a nivel inguinal, así también una menor formación de masas tumorales en el grupo que recibió DMBA + Cadillo 200 mg/Kg con un total de nueve masas tumorales distribuidas siete a nivel torácico y dos a nivel inguinal. También se observa en 2b. En relación al grupo que recibió el DMBA 20 mg/rata (39 masas tumorales) y el grupo DMBA + cadillo 200 mg/kg (nueve masas tumorales) existe un 76,92% de inhibición porcentual de masas tumorales.
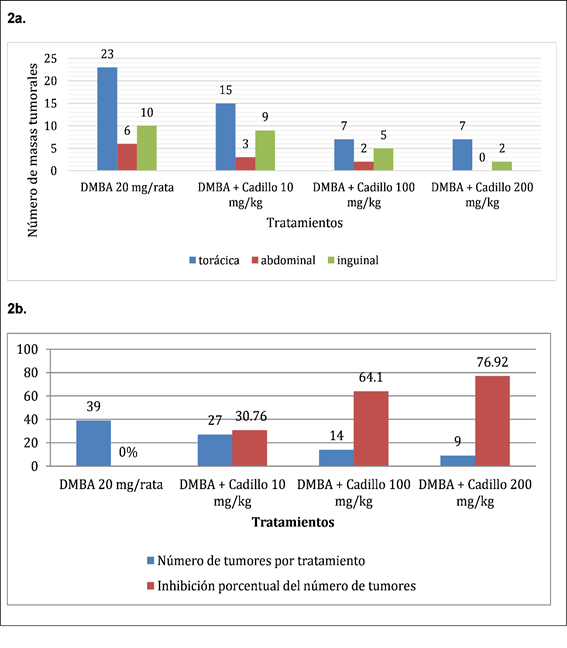
Figura 2: Evaluación del efecto protector del extracto etanólico de Cenchrus echinatus L. a. Número y ubicación de masas tumorales. b. Número de tumores por tratamiento e inhibición porcentual de masas tumorales
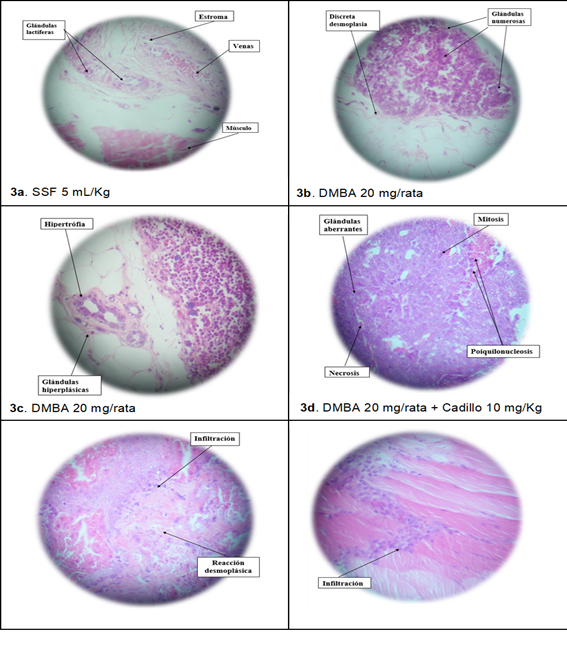
Figura 3: Estudio anatomopatológico de las masas tumorales al evaluar el efecto protector del extracto etanólico de Cenchrus echinatus L. sobre el cáncer de mama inducido por DMBA en ratas (objetivo 400X)
En lafigura 3. Se observan el estudio anatomopatológico de las masas tumorales: 3a. Glándula mamaria normal; 3b y 3c. Zonas hiperplásicas y adenocarcinoma mamario. 3d. Adenocarcinoma mamario con metástasis. 3e. Glándula mamaria con infiltración inflamatoria. 3f. Glándula mamaria con nódulo linfático más infiltración de células mononucleares en zona muscular.
DISCUSIÓN
Cenchrus echinatus L. es una planta anual, originaria de América, de la familia Poaceae, de naturaleza cespitosas con tallos erectos o decumbentes, ramificados y glabros de 15-85 cm de alto, se pueden encontrar en playas, sitios perturbados, trópicos y subtrópicos; a una altitud de 0-760 metros40.
El estudio fitoquímico del extracto evidenció la presencia de abundante cantidad de flavonoides, que además de presentar baja toxicidad se considera un producto vegetal de uso seguro, con actividad protectora sobre el cáncer de mama, así como propiedades antioxidantes, antiinflamatorias, entre otras41.
Al evaluar la toxicidad oral del extracto etanólico de Cenchrus echinatus L., se observó, una dosis letal mediana (DL50) de 16 223 mg/kg, además de un aumento sostenido de pesos de los ratones desde 27 - 33 g durante 14 días, no llegándose evidenciar signos de toxicidad o muerte de los ratones a dosis por encima de los 5000 mg/kg por vía oral, consideradas prácticamente no tóxicas42. Además, según las normas de la Comunidad Europea (2000) clasifica la toxicidad aguda oral, como no tóxico cuando se supera la dosis de 2000 mg/kg. Pudiendo este compararse con la Directriz 407 de la OCDE donde en un estudio se eligieron dos inmunosupresores muy conocidos, azatioprina (AZA) y ciclosporina A (CysA), como compuestos modelo en un rango de dosis que no causa signos tóxicos visibles en los animales durante un período de tratamiento de 28 días43.
En la evaluación de la seguridad oral a 45 días se encontró que el extracto de Cenchrus echinatus L. no interfirió en el desarrollo de las ratas albinas ya que los pesos corporales de los especímenes incrementaron de manera gradual en todos los grupos desde los 78-170 g; los valores bioquímica sanguínea (Colesterol total, HDL, glucosa, urea, TGP, fosfatasa alcalina, abastonados, segmentados, eosinófilos, basófilos, monocitos, linfocitos y leucocitos) y el estudio macroscópico de los órganos blandos (Estómago, bazo, riñón, hígado, pulmón, corazón y cerebro) no mostraron alteraciones importantes, las variaciones encontradas están dentro del rango establecido en el CENPALAB, 2010 para esta especie44-45.
El DMBA es un hidrocarburo policíclico aromático, altamente lipofílico, el que, para causar la carcinogenicidad de mama requiere de su bioactivación e interacción con el ADN, convirtiéndose en epóxidos y generando mayor formación de radicales libres, donde los lóbulos uno y dos de la glándula mamaria presentan el índice proliferativo celular más alto y por tanto tienen más actividad metabólica, lo cual queda confirmado con nuestros resultados ya que observamos una mayor proliferación de masas tumorales en el grupo que recibe sólo DMBA (4 tumores por rata), ubicándose la mayor proliferación a nivel torácico.
Por otro lado, se conoce que los estrógenos son responsables de la iniciación y promoción del cáncer de mama; así, la inhibición de la síntesis de estrógenos por luteína (4-tetrahidrochalcona) puede ser efectiva en la prevención del cáncer de mama, al inhibir fuertemente la aromatasa. Añadiendo que posiblemente, algunas sustancias presentes en el extracto de Cenchrus echinatus L., hayan favorecido los hallazgos obtenidos en el presente estudio.
Nuestro hallazgo principal fue la eficacia protectora del extracto etanólico de Cenchrus echinatus L., al evidenciarse una disminución de la aparición de masas tumorales desde 39 unidades con DMBA hasta nueve unidades con Cenchrus echinatus L 200 mg/Kg. Siendo comparado con un estudio realizado a 32 ratas Sprague Dawley hembras de 21 días de edad, a las cuales se les administró por vía intraperitoneal N-metil-N-nitroso urea (NMU), obtuvieron que el tratamiento con sirolimus disminuyó las expresiones de ER y PgR del cáncer de mama y a su vez redujo el tamaño de las masas tumorales46.
En un estudio donde se empleó NMU como inductor de cáncer mamario y sirolimus como tratamiento, la histología de las masas tumorales no presentaron subtipos histológicos de carcinoma invasivo agresivo de ningún tipo especial (NST)46, mientras que en nuestro estudio se evidenció una proliferación epitelial y mioepitelial de las células en la mayoría de los tumores mamarios, mostraron una eficacia anticancerígena del extracto de 30.76%, 64.10% y 76.92% a dosis de 10, 100 y 200 mg/Kg de extracto de cadillo respectivamente, cuyo efecto protector se atribuye a la presencia de los flavonoides que inducen apoptosis al activar la caspasa 8 y Bax, inhibiendo la expresión del Bcl-2 y permitiendo la liberación de citocromo C47.
Por tanto, siendo el cáncer de mama un gran problema de salud a nivel mundial, con mayor frecuencia en la mujer, se hace necesaria la búsqueda de nuevos productos seguros y eficaces para afrontar esta enfermedad29.
Los resultados de este trabajo de investigación presentaron sus limitaciones en cuanto a la observación del comportamiento de los animales de experimentación durante la evaluación de la seguridad oral del extracto, así mismo realizar estudios de seguridad a largo plazo como la toxicidad crónica, con la administración de tratamientos por otras vías de administración y la incorporación de parámetros como las especies reactivas de oxígeno en sangre, así como la actividad antioxidante y antiangiogénico del extracto podrían apoyar el presente estudio.
CONCLUSIÓN
Se logró obtener el extracto etanólico de Cenchrus echinatus L, el cual al contar con metabolitos secundarios importantes como los flavonoides, compuestos fenólicos y taninos en mayor cantidad se considera como producto vegetal de uso seguro y además tendría implicancias sobre el cáncer de mama.
En condiciones experimentales se ha demostrado que el extracto etanólico de Cenchrus echinatus L. administrado por vía oral durante 16 semanas es protector del cáncer de mama inducido por 7,12-Dimetilbenzo[a]antraceno en ratas hembras, al evidenciarse una disminución del número y tamaño de las masas tumorales, así como una mayor protección del extracto etanólico de Cenchrus echinatus L. a dosis de 200 mg/Kg.











 text in
text in