INTRODUCCIÓN
El Linfoma de Células Grandes T Anaplásico (ALCL por sus siglas en inglés), descrito inicialmente en 19851, pertenece a la familia de linfoma de células T, es un tipo único de linfoma, expresa fuertemente el antígeno CD30. Ésta neoplasia es relativamente infrecuente, encontrándose en alrededor del 2 al 8% de todos los linfomas no Hodgkin, entre el 10% al 20% de los linfomas de alto grado y el 16% de los linfomas T2.
Según la Organización Mundial de la Salud (OMS)3, la expresión de la kinasa 1 del Linfoma Anaplásico (ALK1 por sus siglas en inglés) determina la presencia de dos entidades diferentes: el ALCL ALK+, que representa el 70%, es más común en niños y adolescentes, sexo masculino con un curso menos agresivo y de mejor pronóstico; y el ALCL ALK -, considerada como entidad provisional, más común en personas adultas, sin predominio de género, baja incidencia de síntomas sistémicos y peor pronóstico4,5. Ambas entidades comparten características similares, sobre todo las morfológicas y la sobreexpresión del CD30, que permite diferenciar del resto de los linfomas de células T periféricos.
El Índice Pronóstico Internacional (IPI) es una herramienta utilizada como Índice predictor de la sobrevida de los pacientes con linfoma no Hodgkin, en los últimos años se ha introducido un índice pronóstico para linfoma de células T (PIT), que incluye el compromiso de la médula ósea, el cual es poco frecuente en ALCL, ambos índices son similares en esta patología6, por lo que aún no ha sido del todo aprobada para ALCL.
El tratamiento sigue siendo la quimioterapia combinada asociada a antraciclinas7, que alcanza hasta un 80% de respuesta completa, con rangos de recaída de aproximadamente 25%; en pacientes con enfermedad residual (sobre todo en linfomas mediastinales) la Radioterapia está indicada.
El presente estudio busca determinar las características epidemiológicas, clínico-patológicas y de pronóstico de los pacientes mayores de 14 años con ALCL, diagnosticados en el Instituto Nacional de Enfermedades Neoplásicas (INEN) en Lima, Perú, entre los años 2006 a 2016, esto permitirá conocer la forma de presentación en nuestra población y así poder tomar la mejor opción de manejo y seguimiento. Además, servirá de base para futuros análisis y mejoras en el tratamiento.
MÉTODOS
Diseño y área de estudio
Estudio descriptivo, retrospectivo de paciente con el diagnóstico de Linfoma Anaplásico, diagnosticados en el INEN Lima, Perú, entre los años 2006 y 2016.
Población y muestra
Se analizaron 91 Historia teniendo como criterios de inclusión a todos los pacientes de 14 años o más, con el diagnóstico patológico de Linfoma Anaplásico de Células Grandes, de cualquier localización y sin tratamiento previo, se excluyeron: 2 pacientes menores de 14 años, 2 pacientes referidos como Linfoma anaplásico pero que no contaban con patología en el INEN y 1 paciente con tratamiento previo en otra Institución; se trabajó con las 86 Historias Clínicas restantes que cumplían con los criterios de inclusión.
Variables e instrumentos
El diagnóstico anatomopatológico de linfoma Anaplásico de Células Grandes se realizó bajo las recomendaciones de la OMS3que describe la presencia de células linfoides grandes, pleomórficas con abundante citoplasma y presencia frecuente de núcleo en herradura (hallmark cell), con expresión intensa de CD30, y la inmunopositividad o no para ALK, este diagnóstico excluye los Linfomas B con expresión de CD308,9. Además, se analizaron las características Epidemiológicas, el estadiaje y la sobrevida de los pacientes.
Procedimientos
Los resultados de anatomía patológica de cada historia clínica, que incluían los estudios de Inmunohistoquímica con expresión principalmente de CD30 (Clona Ver-Hz, Dako, Dinamarca), ALK (Clona ALK1, Dako, D), CD3 (Policlonal Dako Dinamarca), EMA (Clona E29, Dako D), CD45 (Clona 2B11, Dako, Dinamarca) y CD20 (Clona L26, Dako, D), fueron reevaluados y confirmados por un patólogo experto.
Las características epidemiológicas evaluadas fueron edad, sexo, procedencia, calidad de vida del paciente usando la escala Eastern Cooperative Oncology Group (ECOG), fecha de diagnóstico, fecha de última consulta y estado de sobrevida.
Para el estadiaje se analizaron los estudios de imagen, que incluían radiografías y/o tomografías, aspirado de médula ósea con biopsia de hueso, todas reevaluadas por radiólogos y patólogos de nuestra Institución, para luego usar los parámetros del Sistema de Estadiaje de Ann Arbor10.
Para determinar el Índice Pronóstico Internacional (IPI)11, se utilizaron los siguientes parámetros: mayores de 60 años de edad, calidad de vida del paciente, número de sitios ganglionares, estadío clínico, compromiso extraganglionar y lactato deshidrogenasa por encima del valor normal.
Los pacientes recibieron como esquema de tratamiento quimioterapia con esquema CHOP o CHOP-like12. La respuesta al tratamiento fue evaluada utilizando los criterios de Respuesta de la Sociedad Americana de Oncología Clínica(13).
Análisis estadístico
Se realizó un análisis descriptivo a través de frecuencias, porcentajes y medidas resumen (promedio y rango). Para el análisis de la sobrevida libre de progresión, el tiempo de seguimiento se consideró desde la fecha de inicio del primer tratamiento hasta la fecha de recurrencia/progresión, de muerte o último control; para el análisis de la sobrevida global, el tiempo de seguimiento se consideró desde la fecha de inicio del primer tratamiento hasta la fecha de muerte o último control. En la estimación de la sobrevida se usó el método de Kaplan-Meier y diferencias entre curvas de sobrevida se probaron con el logrank test. La selección de factores que aumentan el riesgo de muerte se realizó a través del modelo de regresión de Cox. Un valor p<0.05 se consideró para una diferencia y un riesgo significativo. El análisis estadístico se realizó mediante el sistema estadístico SPSS 22.0.
RESULTADOS
Las características de los pacientes se detallan en laTabla 1. Hubo 86 pacientes en estudio con una edad promedio de 43 años (rango, 15 a 88 años), de ellos, 49 (57,0%) eran hombres y 37 (43,0%) mujeres. Más del 50% de pacientes tuvieron un buen estatus perfomance ECOG 1. Según los niveles de DHL, 48 (55,8%) pacientes lo tenían elevado. Según la expresión de ALK, el 18 (20,9%) pacientes fueron positivos, 53 (61,6%) fueron negativos, y 15 (17,4%) no contaban con este resultado. Según el estadío, 19 (22,1%) fueron estadío I, 29 (33,7%) fueron estadío II, 12 (14,0%) estadío III y 24 (27,9%) fueron estadío IV, en 2 (2,3%) pacientes no se especifica el estadío.
De acuerdo al índice pronóstico internacional, 34 (39,5%) fueron bajo riesgo (BR), 23 (26,7%) intermedio bajo (IB), 20 (23,3%) intermedio alto (IA) y 6 (7,0%) alto riesgo (AR), en 3 (3,5%) pacientes no se especifica el índice por no tener los datos completos registrados en la historia. Recibieron quimioterapia 67 pacientes (79.6%), radioterapia 3 (3,4%) y no recibieron tratamiento 16 (17%), las causas fueron sepsis (5 pacientes), no deseo de terapia (4 pacientes) y traslados a otra institución (6 pctes). De los pacientes que recibieron quimioterapia, 24 (35,8%) alcanzaron respuesta completa (RC), 10 (14,9%) respuesta parcial (RP) y 33 (49.3%) no respuesta y/o progresión de enfermedad.
La distribución de casos ALK+ y ALK- por grupos de edad. Mediante la prueba de T para muestras independientes, refleja que la edad promedio para pacientes con ALK + fue significativamente menor que la de pacientes ALK - (27.9 años vs 47.4 años p<0.05). En el grupo de pacientes ALK+, el 25% eran menores 17 años, 50% con edades menores de 22.5 años y el 25% con edades superiores a 34 años. Se identificó 01 valor distante al resto (caso atípico) de un paciente de 58 años. En el grupo de ALK-, el 25% eran menores de 30 años, 50% menores de 50 años y 25% superiores a 62 años, no se evidenciaron casos atípicos.
Tabla 1. Características de los pacientes.
| Características | n (%) |
| Edad, años | |
| Promedio / Rango | 43 / [15-88] |
| Sexo | |
| Hombre | 49 (57,0) |
| Mujer | 37 (43,0) |
| Calidad de Vida (ECOG) | |
| 1 | 50 (58,1) |
| 2 | 26 (30,2) |
| 3 | 6 (7,0) |
| 4 | 4 (4,7) |
| DHL (UI / L) | |
| Normal | 33 (38,4) |
| Elevado | 48 (55,8) |
| NSE | 5 (5,8) |
| Bulky (tumor ≥10cm) | |
| Si | 25 (29,1) |
| No | 57 (66,3) |
| NSE | 4 (4,7) |
| ALK | |
| Negativo | 53 (61,6) |
| Positivo | 18 (20,9) |
| NSE | 15 (17,4) |
| Estadío Clínico | |
| I | 19 (22,1) |
| II | 29 (33,7) |
| III | 12 (14,0) |
| IV | 24 (27,9) |
| NSE | 2 (2,3) |
| IPI | |
| Bajo | 34 (39,5) |
| Intermedio bajo | 23 (26,7) |
| Intermedio alto | 20 (23,3) |
| Alto | 6 (7,0) |
| NSE | 3 (3,5) |
| Quimioterapia | 67 (79,6) |
| Radioterapia | 3 (3,4) |
| No tratamiento | 16 (17,0) |
| Cuadro infeccioso | 5 |
| Desacuerdo familiar | 4 |
| Perdido vista/OI | 6 |
| Total | 86 (100) |
NSE: no se especifíca. DHL: Deshidrogenasa Láctica.
Los rangos de sobrevida libre de progresión (SLP) a 5 años para pacientes ALCL ALK+ y ALK- fueron de 62,2% y 20,7% respectivamente (HR: 4,52; CI 95%, 1,6-12,74; p=0.004). El Índice Pronóstico Internacional (IPI) (Figura 1) identificó diferentes grupos de riesgo a través de toda la cohorte, la SLP a 5 años fue de 56,8% para IPI bajo, 18,4% para intermedio-bajo, 20,9% para IPI intermedio y 0% para alto riesgo; algo similar ocurrió con el PIT, que también mostró alto riesgo de mortalidad en el grupo alto e intermedio-alto comparado con el grupo bajo e intermedio-bajo (HR: 6,25; IC 95%, 2,96-12,79; p= 0.05).
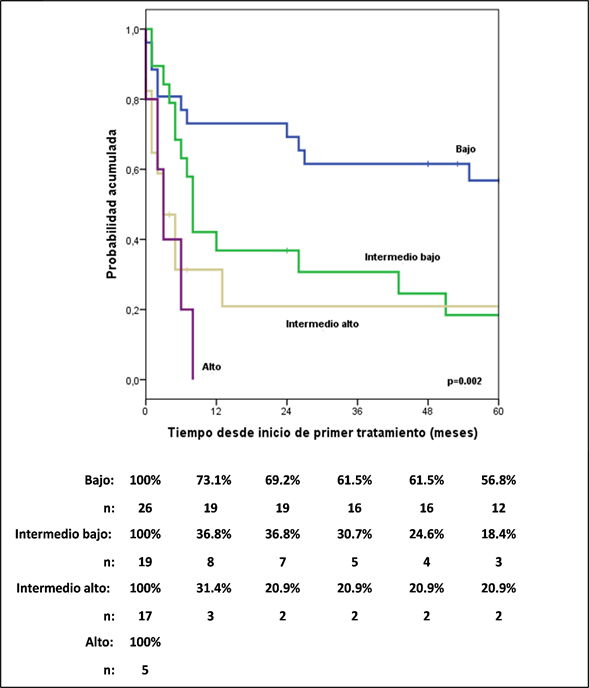
Figura 1 Curvas estimadas de la sobrevida libre de progresión por Índice Pronostico Internacional (IPI)
Al desarrollar un análisis multivariado, incluyendo las características ALK, DHL, estadio e IPI, y eligiendo las características más influyentes, resultó que un ALK negativo tiene aproximadamente 6 veces más riesgo de progresión respecto a un ALK positivo, y que los IPI intermedio bajo, intermedio alto y alto tienen te 3, 6 y 6 veces más riesgo de progresión respecto a un IPI bajo, respectivamente (Tabla 2). Respecto a la sobrevida global, la mediana del tiempo de seguimiento fue de 72 meses. La sobrevida global estimada a 1, 3 y 5 años fue de 61.4%, 46.8% y 40.8%, respectivamente. En el grupo de pacientes con ALK+ la sobrevida global a 1, 3 y 5 años se estimó en 85.6%, 77% y 67.4%, respectivamente; y en el grupo con ALK- se estimó en 54.1%, 36.3% y 30.2% a los 1, 3 y 5 años, respectivamente. Se encontró una diferencia significativa entre ambos grupos.
Tabla 2. Análisis univariado y multivariado de asociación de características con la sobrevida libre de progresión.
| Univariado | Multivariado | Multivariado* | |||||
| Características | n | p | HR | p | HR | p | HR |
| ALK | |||||||
| Positivo | 15 | 1,00 | 1,00 | 1,00 | |||
| Negativo | 43 | 0,004 | 4,52 (1,6-12,74) | 0,001 | 7,28 (2,37-22,33) | 0,001 | 5,97 (2,02-17,59) |
| DHL | |||||||
| Normal | 27 | 1,00 | 1,00 | ||||
| Elevado | 39 | 0,009 | 2,32 (1,23-4,36) | 0,404 | 1,48 (0,59-3,69) | ||
| Estadio | |||||||
| I | 14 | 1,00 | 1,00 | ||||
| II | 25 | 0,437 | 1,42 (0,59-3,44) | 0,914 | 1,06 (0,36-3,17) | ||
| III | 8 | 0,338 | 1,71 (0,57-5,1) | 0,671 | 0,75 (0,19-2,84) | ||
| IV | 21 | 0,028 | 2,74 (1,12-6,73) | 0,299 | 1,92 (0,56-6,55) | ||
| IPI | |||||||
| Bajo | 26 | 1,00 | 1,00 | 1,00 | |||
| Intermedio bajo | 19 | 0,034 | 2,28 (1,07-4,88) | 0,375 | 1,69 (0,53-5,38) | 0,022 | 2,67 (1,15-6,22) |
| Intermedio alto | 17 | 0,002 | 3,47 (1,58-7,65) | 0,084 | 3,36 (0,85-13,24) | <0,05 | 6,14 (2,34-16,12) |
| Alto | 5 | 0,002 | 5,64 (1,92-16,61) | 0,107 | 3,45 (0,77-15,52) | 0,003 | 5,58 (1,76-17,68) |
* Método de selección de variables
En el grupo de pacientes con DHL normal la sobrevida global a 1, 3 y 5 años se estimó en 89.1%, 70% y 61%, respectivamente; y en el grupo con DHL elevado se estimó en 41.5%, 28.9% y 25.3% a los 1, 3 y 5 años, respectivamente, se encontró una diferencia significativa entre ambos grupos. En el grupo de pacientes con estadio I la sobrevida global a 1, 3 y 5 años se estimó en 73.3%, 66.7% y 66.7%, respectivamente; en el grupo con estadio II se estimó en 71.2%, 53.3% y 42.6% a los 1, 3 y 5 años, respectivamente; en el grupo de pacientes con estadio III la sobrevida global a 1, 3 y 5 años se estimó en 75%, 45% y 22.5%, respectivamente; y en el grupo con estadio IV se estimó en 36.7%, 24.4% y 24.4% a los 1, 3 y 5 años, respectivamente. Se encontró una diferencia significativa entre los grupos. En el grupo de pacientes con IPI BR la sobrevida global a 1, 3 y 5 años se estimó en 85.2%, 70.4% y 65.7%, respectivamente; en el grupo con IPI IB se estimó en 66.9%, 46.3% y 30.9% a los 1, 3 y 5 años, respectivamente; en el grupo de pacientes con IPI IA la sobrevida global a 1, 3 y 5 años se estimó en 31.4%, 15.7% y 15.7%, respectivamente; y en el grupo con IPI AR se estimó en 0.0% a los 9 meses. Se encontró una diferencia significativa entre los grupos (Figura 2).
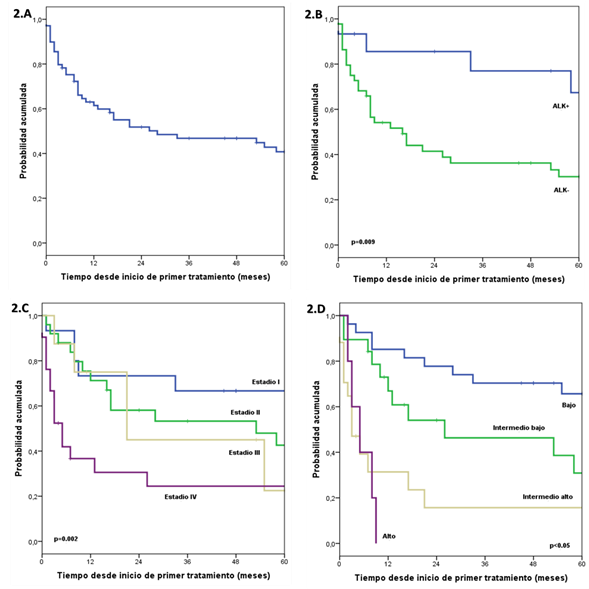
Figura 2 Curva estimada de la sobrevida global (2A), curvas estimadas de la sobrevida global por expresión de ALK (2B), por estadio clínico (2C) y por IPI (2D)
En el análisis multivariado, incluyendo las características ALK, DHL, estadío e IPI, resultó que ALK negativo tiene 5 veces más riesgo de muerte respecto a un ALK positivo, y que los IPI intermedio bajo, intermedio alto y alto tienen 3, 10 y 9 veces más riesgo de muerte respecto a un IPI bajo (Tabla 3).
Tabla 3. Análisis univariado y multivariado de asociación de características con la sobrevida global.
| Univariado | Multivariado | ||||
| Características | n | p | HR | p | HR |
| ALK | |||||
| Positivo | 15 | 1,00 | 1,00 | ||
| Negativo | 44 | 0,015 | 3,69 (1,29-10,63) | 0,003 | 5,63 (1,77-17,94) |
| DHL | |||||
| Normal | 28 | 1,00 | |||
| Elevado | 39 | 0,002 | 3,12 (1,53-6,35) | ||
| Estadio | |||||
| I | 15 | 1,00 | |||
| II | 25 | 0,206 | 1,94 (0,69-5,38) | ||
| III | 8 | 0,204 | 2,24 (0,65-7,76) | ||
| IV | 21 | 0,005 | 4,31 (1,55-11,96) | ||
| IPI | |||||
| Bajo | 27 | 1,00 | 1,00 | ||
| Intermedio bajo | 19 | 0,07 | 2,22 (0,94-5,28) | 0,032 | 2,98 (1,09-8,08) |
| Intermedio alto | 17 | <0,05 | 5,49 (2,35-12,81) | <0,05 | 10,37 (3,71-28,95) |
| Alto | 5 | <0,05 | 8,87 (2,82-27,93) | <0,05 | 9,17 (2,64-31,94) |
DISCUSIÓN
EL ALCL es un linfoma de curso clínico agresivo y heterogéneo, con mayor prevalencia en niños y adultos jóvenes. La mayoría de los estudios reportan una respuesta mejor al tratamiento en pacientes jóvenes alcanzando un rango de respuesta entre 60%-90%. Sibón y colaboradores reportaron en pacientes menores de 40 años, sobrevida independientemente del estatus de ALK14,15. Recientes análisis promueven la quimioterapia de altas dosis seguida de Trasplante de Células Progenitoras para prolongar el tiempo de sobrevida; e allí, la importancia de la búsqueda e identificación de factores pronósticos para la seleccionar de la población más agresiva para ofrecerles regímenes de terapia más intensos y óptimos.
En nuestro estudio, analizamos características epidemiológicas, clinicopatológicas y pronóstico de pacientes con ALCL. Se encontró una mediana de edad de 40 años, independiente del estatus de ALK, que es algo mayor respecto a otras series donde la mediana de edad era menor de 35 años16,17, el rango de hombres/mujeres fue de 1,3:1, similar a otras series publicada con un rango de 1,6-1,8:1. Los pacientes con expresión de ALK fueron más frecuentes en la primera y segunda décadas de la vida, con una mediana de edad de 22 años, que es menor respecto a otras publicaciones como la de Ferrari et al. 201218donde presentan una mediana de edad de 34 años. Otros estudios, como el de Savage et al2, encontró que los ALCL ALK positivos comprometen piel, tejido celular subcutáneo y/o médula ósea, nosotros encontramos 3 pacientes con compromiso visceral, hepático y esplénico, y apenas 2 pacientes con compromiso de médula ósea.
Diversos estudios consideran al ALCL como una enfermedad quimiosensible, en algunos casos inclusive comparable al Linfoma de Células Grandes B Difuso, en relación al tratamiento con indicación de iniciar quimioterapia de primera línea basado en antraciclinas12el esquema estándar es CHOP y en casos de recaídas con esquemas en base a platino. Estudios muestran una respuesta global entre 70% y 80%19, mayor a lo encontrado en nuestro estudio, donde alcanzó un 50.7% luego de una primera línea de tratamiento.
En nuestro análisis, se evidenció que la respuesta completa alcanzada luego de la primera línea de quimioterapia, tiene mejor pronóstico y mayor tiempo de sobrevida global respecto a los pacientes que sólo alcanzaron respuesta parcial. La literatura indica que la respuesta parcial o completa luego de la administración de la quimioterapia, en base al esquema CHOP o CHOP like, puede llegar hasta un 65%, en nuestro estudio dicha respuesta a una primera línea de tratamiento llego hasta 50.7%.
La sobrevida a 5 años para los pacientes con ALK+ fue del 62.5%, similar a los 60% reportados por Savage et al; para los pacientes ALK - fue de 29.6% inferior a los 36% reportados en el mismo estudio, evidenciándose, también descrito en otros estudios, que el ALCL ALK + es un importante factor favorable en la sobrevida2. Se ha evidenciado que el ALK juega un rol importante en la linfomatogénesis5, sugiriendo fuertemente que su inhibición sería suficiente para atenuar el crecimiento y sobrevida de las células del ALCL ALK+, considerándose como un blanco molecular potencial en la terapia de esta enfermedad y en otras donde se ha demostrado su presencia como el Cáncer de Pulmón y Tumor Miofibroblástico Inflamatorio 20,21. Un estudio mostró que la mejor evolución de los pacientes con ALCL ALK+ puede estar asociada también a mayores niveles de apoptosis por quimioterápicos que las células ALK-22lo que incrementaría las mayores respuestas y mejor pronóstico en estos pacientes.
Se identificaron además otros factores que de manera independiente podrían ser considerados como factores pronósticos: la Deshidrogenasa láctica por encima del valor normal, el índice Pronóstico Internacional y el estadío clínico6, todos con significancia estadística, mientras existen otros trabajos que no consideran que éstos sean factores independientes23.
Nosotros encontramos como factor pronóstico la positividad para ALK y índice pronóstico internacional con diferencia estadística significativa.
Las limitaciones del estudio han sido ser un estudio retrospectivo y que el 17% de la población no recibió tratamiento oncológico.
CONCLUSIONES
El ALCL es una enfermedad agresiva, con distribución heterogénea respecto a la edad y ligeramente más frecuente en varones, en donde puede considerarse como factores pronósticos la expresión del ALK (donde su expresión determina la existencia de dos entidades diferentes por la edad de presentación y agresividad) y el Índice pronóstico internacional. El tratamiento en base a antraciclinas permite obtener una respuesta global mayor al 50% con una sobrevida global a 5 años de 38.5%.











 text in
text in 


