INTRODUCCIÓN
El Síndrome de Guillain-Barré (SGB) se define como una polirradiculoneuropatía aguda, caracterizada por una parálisis flácida, ascendente y simétrica de las extremidades, rápidamente progresiva con hiporreflexia o arreflexia, que puede asociarse con alteraciones sensoriales y déficit de nervios craneales en algunos pacientes. Se presenta en mayor frecuencia en adultos jóvenes, siendo los varones más afectados que las mujeres (proporción 3:2)(1,2). Con el avance de la investigación médica, el término de SGB comenzó a aplicarse a un amplio espectro de polirradiculoneuropatías inflamatorias agudas adquiridas, mediadas inmunológicamente y presumiblemente desencadenadas por una infección previa (postinfecciosas), con variados mecanismos fisiopatológicos (desmielinización, lesión axonal motora o sensitivo-motora)(3,4).
Entre Enero y Marzo de 2016 a nivel mundial se registraron brotes del SGB en 8 países(1), vinculados con la emergencia del virus Zika como infección concomitante en muchos casos notificados en la Región de las Américas(5). Asimismo, a finales de verano de 2018 y otoño de 2019, el norte y centro de Perú había reportado un desmesurado incremento de casos por SGB y debido a la extensión geográfica donde se produjeron y las características clínicas de los pacientes afectados, se sugirió una etiología viral, siendo Zika y Enterovirus D68 los principales sospechosos(6). Sin embargo, gran número de casos no identifican los agentes infecciosos y con mayor probabilidad terminarán para fines de registros epidemiológicos como casos de origen idiopático.
Es necesario ampliar nuestro panorama epidemiológico considerando otros agentes etiológicos probables como los virus, que también son ampliamente reconocidos por la literatura científica pero cuya participación suele ser poco estudiada y desestimada ya sea por la falta de recursos, complejidad en su detección o simplemente por dificultad en la interpretación de pruebas serológicas y moleculares. El presente artículo reúne información actual sobre las asociaciones reconocidas y probables entre infecciones virales con el SGB que deberían ser tomadas en cuenta frente al incremento de casos registrados en los últimos años en la Región de las Américas. Asimismo, se describen herramientas de laboratorio clínico que permitan su adecuada investigación e interpretación, ya que este suele ser un obstáculo frecuente que motiva la sub-notificación de microorganismos principalmente virus, como parte de la probable etiología de este síndrome.
METODOLOGÍA
En el presente artículo se ha revisado todo lo concerniente al SGB y su etiología viral, usando la base de datos MEDLINE accedido desde PubMed, Web of Science, Scopus, Scielo, Biblioteca Virtual de Salud (BVS). La búsqueda se realizó en forma aislada o una combinación de estas palabras clave “Síndrome de Guillain-Barré” y sus combinaciones con "virus / etiología". Se identificaron artículos originales, revisiones, reporte de casos o serie de casos e información obtenida en páginas web que desarrollan el tema central del artículo.
FISIOPATOLOGÍA DEL SGB
Se han descrito distintas variantes o subtipos del SGB de acuerdo a sus características clínicas y neurofisiológicas, dentro de ellas: la polineuropatía desmielinizante inflamatoria aguda (PDIA), la neuropatía axonal motora aguda (NAMA), la neuropatía axonal sensitivo-motora aguda (NASMA) y el Síndrome de Miller-Fisher (SMF)(3). Los diferentes subtipos están mediados por mecanismos inmunes que involucran autoanticuerpos provocando daño estructural y funcional fundamentalmente en la mielina y axones del sistema nervioso periférico (SNP)(4,7). La inmunopatogénesis difiere en cada uno de ellos; sin embargo se puede agrupar a los que implican células y anticuerpos contra constituyentes de la mielina del SNP (PDIA); y a los subtipos de compromiso fundamentalmente axonal (NAMA, NASMA y SMF) (Figura 1)(3,8). Aunque ambos elementos de la respuesta inmune (Linfocitos T y B) desempeñan un papel importante, la comprensión actual sostiene que el SGB está mediado por anticuerpos que dañan la membrana de mielina y axones del SNP, debido a reactividad cruzada con epítopos bacterianos y/o virales por mimetismo molecular(9,10). En la Figura 1 se presenta cómo la lesión a neuronas del SNP mediada por anticuerpos, clasica a los subtipos de SGB en dos grupos. Los que dañan a la membrana mielínica y los que dañan a la membrana axonal con el consiguiente fallo de conducción.
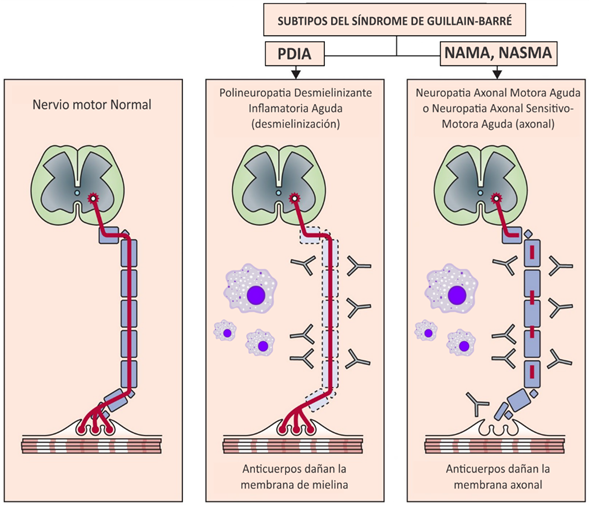
Figura 1: Principales subtipos de SGB. La lesión a neuronas del SNP mediada por anticuerpos, clasifica a los subtipos de SGB en dos grupos. Los que dañan a la membrana mielínica y los que dañan a la membrana axonal con el consiguiente fallo de conducción
La forma más común de SGB es la PDIA que surge de la desmielinización del nervio periférico, mediada por anticuerpos, macrófagos y deposición del complemento en las membranas de mielina de las células de Schwann (Figura 2). El proceso de desmielinización es generalizado y afecta a la mayoría de las extremidades mielinizadas, motores craneales axiales, inferiores y nervios sensoriales, pero curiosamente no afecta axones mielinizantes que inervan músculos extraoculares que son los afectados en el SMF(11). En contraste con PDIA, el objetivo principal para el ataque del sistema inmune en las variante NAMA y NASMA es la membrana del axolema. Este proceso inflamatorio ocurre predominantemente ya sea en las raíces nerviosas o terminales nerviosas distales (Figura 1). El ataque inmune puede conducir al bloqueo de la conducción por lesión axonal reversible en el mejor de los casos, o la transacción axonal completa en el peor. La degeneración walleriana (desestructuración del axón y de su vaina de mielina tras una lesión en la parte proximal del axón o del soma neuronal) es un evento típico en esta variantes de SGB(11). Los gangliósidos, residuos de carbohidratos unidos a una fracción lipídica, se encuentran formando parte superficial de membranas celulares en el sistema nervioso periférico(12,13). Se han caracterizado hasta 188 tipos aproximadamente en vertebrados(14)y constituyen blancos específicos moleculares clásicos de anticuerpos antigangliósidos (AGA) presentes en esta enfermedad. El mimetismo molecular entre los agentes infecciosos y los gangliósidos desempeña un papel importante en la inducción de estos anticuerpos que contribuyen a procesos de inflamación-desmielinización del nervio periférico en pacientes con SGB(15). Diversos estudios muestran que los lipooligosacáridos (LOS) de organismos infecciosos contienen epítopos que son similares a los gangliósidos en nervios periféricos, por ejemplo, en Campylobacter jejuni, los LOS imitan muy bien a los gangliósidos de membrana GM1, GM1b, GD1a y GalNAc-GD1a y los anticuerpos anti-LOS producidos contra la infección tienen reactividad cruzada con los anticuerpos antigangliósidos que resultan en lesiones a las fibras nerviosas periféricas (Figura 2)(15).
De la misma manera, en pacientes con NAMA, los anticuerpos contra los LOS de C. jejuni y H. influenzae tienen reactividad cruzada con inmunoglobulinas IgG subclases IgG1 e IgG3 que se unen a los gangliósidos produciendo daño axonal, dependiente del complemento(15). En modelos animales, estas lesiones axonales se deben a la fijación del complemento con reclutamiento de macrófagos y deposición de complejos de ataque (Figura 2)(16).
Esta cascada inmunológica interrumpe la integridad anatómica y fisiológica de las membranas expuestas en los terminales nerviosos y nodos de Ranvier, provocando un bloqueo de la conducción nerviosa. En pacientes con SMF la debilidad oculomotora se ha asociado con anticuerpos anti-GQ1b, donde el gangliósido GQ1b es el objetivo antigénico en los nervios que inervan los músculos extraoculares (Figura 2)(7,11). A diferencia de NAMA, la cascada inmunológica implicada en PDIA se entiende menos por varias razones. Primero, un rango más amplio de estimulantes inmunes causa PDIA, que incluye infecciones bacterianas, virales y reacciónes post vacunación. En segundo lugar, los biomarcadores de anticuerpos específicos aún no se han caracterizado. Alternativamente, las células T específicas del nervio, dirigidas contra antígenos aún desconocidos, podrían jugar un papel más importante en PDIA de lo que se conoce actualmente (Figura 2)(11).
En la Figura 2 se presenta el mimetismo molecular entre los agentes infecciosos y los gangliósidos de membrana presentes en los nodos de Ranvier, la vaina de mielina en las células de Schwann o en los nervios terminales que inervan los músculos oculomotores, desempeña un papel importante en la inducción de anticuerpos antigangliósidos. Estos,con la activación del complemento,el reclutamiento de macrófagos circulares y el complejo de ataque producen daño en la membrana por desprendimiento de mielina en PDIA o daño axonal directo en NAMA y en el síndrome de Miller-Fisher. Los cambios patológicos producen falla de la conducción nerviosa y la consiguiente debilidad muscula.
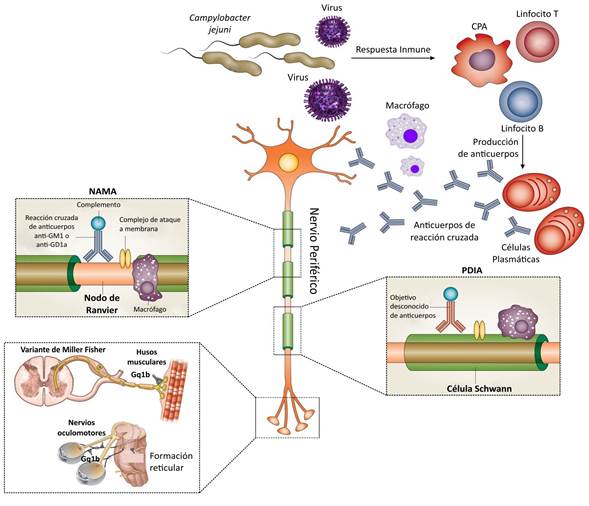
Figura 2: El mimetismo molecular entre los agentes infecciosos y los gangliósidos de membrana presentes en los nodos de Ranvier, la vaina de mielina en las células de Schwann o en los nervios terminales que inervan los músculos oculomotores, desempeña un papel importante en la inducción de anticuerpos antigangliósidos. Estos, con la activación del complemento, el reclutamiento de macrófagos circulares y el complejo de ataque producen daño en la membrana por desprendimiento de mielina en PDIA o daño axonal directo en NAMA y en el síndrome de Miller-Fisher. Los cambios patológicos producen falla de la conducción nerviosa y la consiguiente debilidad muscular
PROBABLE ROL DE LOS VIRUS COMO CAUSANTES DEL SÍNDROME DE GUILLAIN BARRÉ
Citomegalovirus y los anticuerpos antigangliósidos como evidencia del factor autoinmune en el SGB.
La infección por Citomegalovirus (CMV) es muy frecuente y de distribución mundial. Ocurre a cualquier edad, con una mayor incidencia durante los primeros años de vida. El CMV es la principal causa de infección vírica congénita, estimándose que la infección está presente entre el 0,5-1 % de todos los recién nacidos, de los cuales aproximadamente un 10% desarrollará síntomas(17). Se describen múltiples complicaciones (1,7-5,2%) de diversa gravedad, siendo muy frecuente las de origen neurológico como encefalitis, meningitis y el SGB(17).
Desde finales de los años 60 se conoce la asociación entre CMV y el SGB, estudios han demostrado que alrededor de 12-13 % de los pacientes con SGB tenían una infección previa por CMV(18). Actualmente se considera la infección viral más común asociada a este síndrome, identificándose hasta en 15% de pacientes por detección de anticuerpos IgM específicos y en el 62% de pacientes por detección de ADN(19). Se calcula que el riesgo de padecer SGB después de una infección por CMV puede llegar de 0,6-2,2 casos por cada 1 000 personas(20). Asimismo, se ha sugerido que el mimetismo molecular con estructuras neuronales en la infección primaria por CMV es más probable que en el curso de reactivación de virus, debido a la menor especificidad de anticuerpos y la afinidad temprana después de la infección(19). Por otro lado, el SGB se presenta de manera esporádica en los pacientes con trasplante renal, en ellos el uso de medicamentos antivirales orales en combinación con inmunoglobulinas y plasmaféresis refieren un relativo éxito(21), sin embargo, faltan estudios analíticos y ensayos clínicos al respecto.
En la infancia el SGB después de infecciones por CMV se informa rara vez y si se presentara, a menudo inicia con síntomas graves y tiempos de recuperación más prolongados. Sin embargo, la forma axonal sensorial-motora del síndrome después de la infección por CMV tiene buen pronóstico de desenlace con una pronta y completa recuperación en niños(22).
En los casos que reportan asociación entre CMV y SGB se suelen detectar tanto IgM anti-CMV como anti-GM2 positivos(22), incluso, algunos estudios describen incrementos de IgM anti-GM2, anti-GalNAc-GD1a y de anticuerpos contra la miosina, una proteína existente en cantidades traza en los nodos de Ranvier. Sin embargo, estos dejan de ser detectables 4 meses después de la terapia(23). Es importante tomar en cuenta el estudio serológico en búsqueda de estos marcadores durante el curso del SGB, debido a que cada vez se hace más relevante la probable asociación de anticuerpos antigangliósidos (AGA) frente a anticuerpos anti-CMV durante el curso de esta enfermedad(24).
La expansión del virus del Zika en América y su probable relación con el SGB
El virus aislado por primera vez en el bosque Zika de Uganda en África cerca de los años 50, reapareció en 2007, con reportes importantes de fiebre que tuvieron lugar en la isla de Yap, en el Pacífico occidental (Micronesia)(25). Años después, la Polinesia Francesa se vio afectada por primera vez por ZIKV(26)y aunque en años recientes el riesgo de microcefalia y otras anomalías cerebrales congénitas fueron las principales complicaciones asociadas al virus(25), durante el brote de octubre de 2013 y abril de 2014, un estudio reportó que de 42 pacientes con SGB, 37 (88 %) presentaron un síndrome viral compatible con ZIKV en una mediana de 6 días antes del desarrollo de los síntomas neurológicos. Las características y evolución correspondieron con el subtipo NAMA de SGB(27,28).
Así mismo, en 2016, Colombia registró 68 pacientes con SGB, de los cuales el 97% tuvieron síntomas clínicos compatibles con la infección por ZIKV, hallándose tanto ARN del virus como anticuerpos antiflavivirus en el 40 y 43% de los pacientes. Se sugirió incluso que se reconsidere al SGB como una complicación parainfecciosa, en lugar de postinfecciosa(28,29). Sin embargo, debemos tomar en cuenta que esta probable relación se sugirió en base a estudios descriptivos donde se reportaron casos de SGB durante un brote de Zika evaluando parámetros como frecuencia e incidencia , más no existen estudios concluyentes al respecto, siendo necesario realizar estudios analíticos para determinar la asociación entre esta arbovirosis con diferentes alteraciones neurológicas como SGB(30).
El Modelo de mejora dependiente de anticuerpos (ADE) del virus Dengue y su relación con el SGB
El virus Dengue representa la más importante arbovirosis que afecta al ser humano en la actualidad, tanto en el síndrome febril como en el tipo grave puede incluir signos neurológicos como la mielitis transversa aguda, la encefalomielitis diseminada aguda y el SGB(31). A pesar de que en la mayoría de los informes no se describe la desmielinización como una complicación específica(32,33), existen reportes de series de casos que lo relacionan con el SGB(31) y otros donde relacionan la variante NASMA como una posible complicación neurológica por DENV(34).
La fiebre hemorrágica y el síndrome de choque del Dengue surgen a través de mecanismos inmunopatológicos luego de la infección secuencial de un individuo con estos serotipos heterólogos relacionados antigénicamente. Se cree que la "potenciación inmune" juega un papel importante en la patogénesis. Se han encontrado varios determinantes antigénicos para anticuerpos que potencian la infección en la glicoproteína de la envoltura. Por lo tanto, los mismos anticuerpos de reacción cruzada de una infección previa podrían actuar contra los determinantes antigénicos que conducen a la desmielinización bajo un modelo de mejora dependiente de anticuerpo(ADE)(32,35). Sin embargo, respecto a las manifestaciones nerviosas, existe una gran controversia acerca de si los signos neurológicos asociados a la infección por DENV, son debidos a la infección directa en el tejido nervioso, o si estos son el resultado de la disfunción nerviosa asociada a daños o fallas en órganos extraneurales, como en el caso de la encefalopatía hepática, o a la presencia y circulación constante de mediadores inflamatorios sistémicos o metabolitos aumentados por la infección, que modulan la función neurológica.
Para dilucidar esto, se requeriría de análisis clínicos y paraclínicos completos y del uso de imagenología compleja, sin embargo éstos casi nunca se hacen(36).
El Virus Epstein-Barr antecede a SGB principalmente en niños
El virus del Epstein-Barr (EBV) puede presentar manifestaciones neurológicas que incluyen encefalitis, meningitis aséptica e incluso SGB, la mayoría de los cuales, reportados principalmente en niños(37-39). Estudios han demostrado que hasta el 90% de pacientes que desarrollaron SGB pueden presentar títulos elevados de IgG para EBV y de anticuerpos anti-GM1 y GM3(40).
La presencia de infección por EBV en el SGB es relativamente rara, con una tasa de incidencia relacionada de 0,36% y aunque la evolución en niños es frecuentemente completa, al parecer esta no sería así de presentarse en menores de 2 años(41). Se ha asociado al SMF, con infecciones primarias de EBV, tanto en niños como en adultos, donde se encontraron anticuerpos antigangliósidos anti GQ1b en el 90% de casos de SMF y serología positiva para VCA y EBNA así como la presencia del virus en plasma, lo que sugiere una infección primaria tardía(42). Sin embargo es importante interpretar adecuadamente este tipo de eventos debido a que la presencia de anticuerpos frente a EBNA indicaría una infección con anterioridad aproximada de 3 meses, haciendo improbable la participación de este virus en el SGB debido a ser un evento demasiado tardío.
Una verdadera asociación entre el virus y el síndrome debería determinarse con la presencia de anticuerpos IgM frente a VCA en ausencia de anticuerpos EBNA, lo cual revelaría una infección muy reciente y contribuye a dilucidar la causa de la enfermedad.
La infección por el Virus de la Varicela Zóster está asociada con un subtipo desmielinizante de SGB. El virus de la Varicela Zoster (VVZ) pertenece a la familia Herpesviridae, de la cual se conoce que tiene tropismo por el sistema nervioso periférico. Las complicaciones neurológicas están reportadas tras la infección por este virus. De estas, la encefalitis es la más común (1: 1 000) personas(43)y el SGB la menos común (1: 15 000) personas(44) Menos de 50 % de estos casos han sido reportados en la literatura y, cuando ocurren, es casi siempre por la reactivación del VVZ latente en Herpes zóster (culebrilla)(43). Sin embargo, en Bangladesh se ha descrito la frecuencia de SGB precedido de infección primaria por el VVZ. Entre 2010 y 2016 de 536 pacientes sólo el 1,3% (7 pacientes) tuvieron varicela en las 4 semanas anteriores al inicio de SGB. Los anticuerpos anti-VVZ IgM estaban presentes y los anti-GM1 fueron negativos en todos los casos. La infección con VVZ se asocia con el subtipo desmielinizante de SGB, claramente distinto de la forma axonal de SGB que predomina en este país(45). Sin embargo, en otras partes se ha sugerido un modo alternativo de patogénesis en PDIA, que actualmente no se conoce bien(43).
El SGB suele presentarse en fases tempranas de la infección por el Virus de Inmunodeficiencia Humana (VIH)
La afectación neurológica en los pacientes infectados por VIH es frecuente e involucra al sistema nervioso central como periférico. Se ha planteado que el 30% de estos, presentan afectación neurológica como primera manifestación de la infección por VIH y se reconoce como causa de muerte en 11% de los mismos(46,47).
En 1985 se describió por primera vez la asociación del SGB y el VIH en un paciente con SIDA. Luego se describieron a tres pacientes con SGB, al inicio de la infección por VIH, antes del SIDA(48). Actualmente, se considera que el SGB en pacientes infectados con el virus precede al SIDA manifiesto y a la evidencia de inmunosupresión(48,49). Un estudio de 32 pacientes con SGB en Zimbabue encontró que 16 (55%) tenían infección por VIH(50).Aunque algunos pacientes tenían SIDA y SGB, se ha sugerido que el SGB se produce temprano en la infección por VIH con altos recuentos de linfocitos CD4 (> 500)(48,49). En Tanzania, se ha confirmado esta asociación, con una prevalencia de 30,5% (11 de 36 pacientes) del virus en pacientes con SGB. Los pacientes con SGB y seropositivos, tuvieron una duración más corta de inicio, mayor compromiso neurológico y una tasa de mortalidad más alta 45,5% (5/11) versus 16% (4/21) en comparación con los seronegativos(50,51).
En los últimos años el rol de VIH ha tomado tal relevancia que algunos investigadores refieren la necesidad de que los pacientes con síntomas de SGB, independientemente de la historia clínica, se les deba ofrecer una prueba de VIH. Debido a que el síndrome puede ser la primera señal de que un paciente es VIH positivo(52)y si bien el SGB suele presentarse principalmente antes de la fase SIDA, se debe considerar que en estadios avanzados las infecciones concomitantes con otros virus especialmente el CMV, podría desarrollar la enfermedad(46).
SGB post exposición al virus Influenza y el probable efecto de su vacuna
Las manifestaciones neurológicas son una complicación importante de la infección de Influenza. Se ha informado sobre una gran variedad, de las cuales, las convulsiones febriles y la encefalopatía son las más comunes y aproximadamente tres cuartas partes de los casos se presentan en niños(53,54). Un estudio francés determinó que de 73 pacientes con SGB de causa no identificada, el 13,7% presentaron evidencia serológica de virus Influenza A, mientras que el 5,5% Influenza B(55).
Así también, un estudio encontró un aumento de SGB a los dos meses de infección asociado a cuadros similares de Influenza o infección respiratoria aguda. Sin embargo, se ha reportado en forma esporádica SGB en casos de Influenza 2009 AH1N1(56). Así mismo, en un estudio realizado en Noruega de 490 casos de SGB durante 2009 - 2012, 410 ocurrieron después del 1 de octubre de 2009 de los cuales 46 casos nuevos ocurrieron durante el período pico de la pandemia de influenza. Lo que indicó que hubo un riesgo significativamente mayor de SGB durante y después de la infección por influenza pandémica(57).
Por otro lado, también existen reportes de SGB después de la exposición a la vacuna contra la influenza. En 1976, en Estados Unidos iniciaron un programa de inmunización masivo contra la cepa A/NJ/76 de Influenza H1N1, de 40 millones de vacunas distribuidas luego del cual se informó un total de 532 casos de SGB post-vacunación(58). Se ha propuesto que los compuestos virales de la vacuna, bajo ciertas condiciones, podría resultar en una estructura que simula epítopes de gangliósidos y con ello explicarse el mimetismo molecular(56).
Los virus de la Hepatitis y el SGB
Existe evidencia de que los virus de la hepatitis, sobretodo el de la hepatitis A como antecedente al desarrollo de SGB, en cuanto a este virus, existe basta literatura que lo sindica como frecuente complicación, la cual estaría relacionada principalmente a casos suscitados en adultos jóvenes de entre 21 a 34 años(59-62);se debe resaltar que ningún reporte halló que niños se vieran afectados luego de la infección por este virus. En cuanto a la hepatitis E (VHE), se conoce que puede causar manifestaciones extrahepáticas. Se han informado varios casos con infecciones de VHE asociados con trastornos neurológicos, que incluyen SGB, neuritis braquial y polirradiculopatía. Curiosamente, un tercio de los pacientes con SGB muestran alteraciones leves de la función hepática sin una causa obvia(63,64). En algunos reportes se ha encontrado asociación de hasta 5 % de pacientes con SGB que recientemente presentaron una infección por (VHE) con niveles elevados de anticuerpos IgM anti- VHE, sin embargo no se detectaron anticuerpos antigangliósidos(65). Por lo que hace poco probable su asociación. En cuanto a los virus de hepatitis B y C, se sabe que el primero rara vez se ha implicado en las polineuropatías agudas mediadas por el sistema inmunitario que se clasifican bajo el término SGB; estas asociaciones han representado aproximadamente el 1 % de los casos de SGB, siendo muy raro su reporte(66). En tanto al segundo se debe examinar en pacientes de alto riesgo para prevenir la progresión silenciosa de la hepatitis C crónica y sus manifestaciones extrahepáticas potencialmente graves en las que en casos raros se incluye también el SGB(67).
Enterovirus D68: una causa distinta de parálisis flácida
Los enterovirus (EV) son un grupo numeroso de virus, entre los que se encuentran los Coxsackievirus, Echovirus, Enterovirus 68-71 y Poliovirus. Los seres humanos son el único huésped natural. La infección es muy contagiosa por contacto directo luego ingresa al SNC, aunque no puede dilucidarse si ésto ocurre durante la viremia secundaria o por migración ascendente a través de los nervios periféricos. Las infecciones asintomáticas y menores son más frecuentes que las formas paralíticas, con una relación ≥ 60:1 siendo la fuente principal de diseminación de la enfermedad(68). El Enterovirus D68 puede causar una amplia gama de trastornos respiratorios en los niños, desde faringitis y bronquitis hasta neumonía más grave e insuficiencia respiratoria. Los adultos sanos también pueden infectarse con el Enterovirus D68 (EV D68), aunque generalmente presente con una gama más leve de síntomas respiratorios(68). Sin embargo, el EV D68 está fuertemente asociado, tanto en niños como en adultos, con mielitis flácida aguda (MFA)(69), la cual es un síndrome complejo caracterizado por la aparición repentina de debilidad en una o más extremidades o en los músculos respiratorios y bulbares como resultado del daño de las neuronas motoras inferiores(70). Algunos informes de Perú señalaron la implicancia del EV D68 en el desarrollo de SGB, sin embargo no existe evidencia que la respalde como una probable causa del síndrome, un hecho que fue ampliamente discutido por un estudio respecto al tema(71).
Parvovirus humano B19 y la evidencia heterogénea como antecedente a SGB
Los últimos 10 años han sido testigos del aumento de casos de SGB asociados con Parvovirus humano B19 (PVB19). Los datos en la literatura sobre la incidencia de las manifestaciones neurológicas siguen siendo dispersos, heterogéneos y la información epidemiológica no se puede extrapolar con precisión(72). Sin embargo, existen neuropatías muy similares a SGB y sus variantes asociadas a (PVB19), con mayor frecuencia en niños después de desarrollar el eritema infeccioso (quinta enfermedad).
Los síntomas incluyen debilidad muscular de las extremidades inferiores con alteraciones sensoriales leves, arreflexia en algunos casos y otros con degeneración axonal mielinizada y no mielinizada, compatible con neuropatía sensorial motora aguda(73).
El SMF se ha reportado en algunos casos pediátricos con diplejía facial, desmielinización anormal con alteraciones de la conducción nerviosa motora y sensorial, aunque sin anticuerpos antigangliosidos lo cual haría dudar un tema de mimetismo molecular detrás de este evento(74). Inclusive se ha comunicado de un SMF atípico denominado síndrome anti-GQ1b con parálisis aguda unilateral del tercer nervio craneal(75). Sin embargo, en ninguno de estos casos se hizo mención específicamente de un SGB.
DISCUSIÓN
El SGB es una enfermedad inflamatoria del sistema nervioso periférico y es la causa más común de parálisis flácida aguda. En el Perú entre 2012 y 2017 se reportaron 955 casos de SGB, con una mayor frecuencia en hombres y en la población de 20 a 59 años. La incidencia nacional de SGB por cada 100 mil habitantes fue de 0,91 en 2017, siendo más alta en adultos mayores y en hombres. Asimismo, la tasa de letalidad global fue de 3,5%, la cual fue más alta en los mayores de 60 años. Sin embargo en 2018 y 2019 el número de casos experimentó un incremento dramático principalmente en la costa norte del país, haciendo sospechar de un origen post infeccioso, tal cual sucedió en las epidemias de virus Zika en la Polinesia Francesa en 2013 y en América Latina y el Caribe en 2015 - 2016 donde el número de casos de SGB también siguieron éste patrón(76).
En los últimos años se han presentado brotes importantes de la enfermedad y en este contexto, el buscar un agente etiológico se hace cada vez más justificable debido a que a pesar del carácter autoinmune de la misma, los patrones estaciones, el número de casos y las características clínicas previas hacen sospechar la presencia de un agente infeccioso involucrado. Respecto a ello, en 2019 algunos reportes en Perú indicaron que el Enterovirus D68 tendría alguna relación con el SGB. Sin embargo, esto último fue ampliamente discutido(77).
El rol de algunos virus en el desarrollo de SGB es cada vez más evidente. Tal es el caso de CMV, cuya relación se conoce desde los años 60 del siglo pasado. Es tal la evidencia que lo respalda, que estudios de diseño analítico han logrado calcular riesgos de padecer SGB frente a la infección por este virus(20). Asimismo, algunos estudios han logrado relacionarlo a la presencia de anticuerpos antigangliósidos(24). Del mismo modo, el virus Zika durante el 2013 se presentó como una importante causa de SGB y aunque estudios observacionales respaldaron este hecho, podría existir un sesgo de selección en el sentido de que todas las evidencias respecto a estos casos se suscitaron durante el desarrollo de un brote de virus Zika.
Al analizar el rol de virus Varicela Zóster en el desarrollo de la enfermedad parece no ser tan relevante, en un estudio de 2019, de todos los agentes infecciosos reportados en pacientes diagnosticados con SGB se halló anticuerpos frente a este virus en tan solo el 1% de los mismos(78). Esta baja frecuencia se atribuiría a que el número de casos de varicela han disminuido debido a la vacuna y aunque se presenta de manera esporádica, en algunos casos de SGB, es importante considerar el rol de este virus como posible agente etiológico(79).
En otros casos, aunque la evidencia es consistente, la menor frecuencia de los mismos hace difícil poder valorar su impacto real sobre la enfermedad, como lo ocurrido en la infección por el virus del dengue, en el cual, al parecer, el desarrollo del SGB depende del fenómeno de amplificación de la infección dependiente de anticuerpos (ADE) que se suscita tras segundas o terceras infecciones con el virus. En cuanto a VEB, aunque existen reportes al respecto, hay dificultad de interpretar adecuadamente los estudios serológicos que presentan pacientes con SGB. Para lo cual se debe considerar la ausencia de marcadores frente a EBNA y presencia de VCA, lo cual evidenciaría una infección reciente. En cuanto a VIH la evidencia actual enfatiza que se debe ofrecer pruebas de descarte a pacientes con SGB, ya que este síndrome a menudo puede ser el primer signo de la infección por este virus(52).
Al parecer tanto en la vacunación como en la infección viral por Influenza se reporta como riesgo de desarrollar SGB. Sin embargo, se debe considerar que al evaluar la tasa de incidencia de SGB en población noruega durante el pico de la pandemia de 2009 en relación con otros períodos se obtuvo un 1,46 [intervalo de confianza (IC) del 95% (1,08-1,98). Asimismo, la razón de riesgo ajustada (HR) de SGB dentro de los 42 días posteriores al diagnóstico de influenza pandémica fue de 4,89 (IC 95% 1,17-20,36). Después de la vacuna anti pandémica, la HR ajustada fue de 1,11 (IC del 95%: 0,51 a 2,43). Todos estos datos revelaron que hubo un riesgo significativamente mayor de SGB durante la temporada de pandemia y después de la infección por influenza pandémica. Sin embargo, la vacunación no aumentó el riesgo de padecer la enfermedad(57). Respecto a este tema un meta análisis evaluó el posible efecto adverso de las vacuna antigripales en la producción del SGB, en el mismo, se enfatizó, que esta probabilidad no debería afectar negativamente en su aceptación debido a la muy poca información relevante que existe al respecto, resaltando la falta de monitorización continua sobre la seguridad de las vacunas antigripales(80).
Los virus mencionados anteriormente se caracterizan por presentar envoltura, de este modo, podríamos sospechar que solo los virus envueltos producirían SGB, lo cual estaría respaldado por la presencia de gangliósidos en la estructura que la forma y que sería responsable del mimetismo molecular. Sin embargo, el virus hepatitis A, un virus desnudo, presenta evidencia robusta de estar implicado en la producción del SGB. El rol de este virus en SGB se explicaría en el hecho de que a pesar de carecer de envoltura, éste, posee una cubierta de lípidos descrita recientemente(81), la misma que podría presentar gangliósidos responsables del mimetismo molecular. Otros virus mencionados como antecedente de SGB , que se han reportado en casos esporádicos son el virus de la rubéola y del reciente SARS-CoV-2, del cual, aunque se ha reportado una importante participación en el daño neurológico, aún no se conoce si participa en el SGB(82).
El hecho de encontrar artículos que reportan de manera conjunta neuropatías como SGB y agentes infecciosos in situ(83); motivan cuestionar el rol que cumplen estos últimos en determinadas patologías. En este sentido, se sabe que las neuropatías generalmente se dividen en categorías post infecciosas y para infecciosas. La primera causada por reacciones autoinmunes al agente infeccioso, que reaccionan de forma cruzada con antígenos neurales de células de Schwann / mielina o axones en el nervio periférico. Como ocurre en el SGB, en los que la polineuropatía se desarrolla generalmente varias semanas después de la infección. En cuanto a la segunda, las neuropatías parainfecciosas generalmente se desarrollan durante una infección aguda o poco después de la misma. Éstas se desarrollan como consecuencia directa de la infección o como una respuesta hiperinmune inusual. Los agentes infecciosos que causan neuropatías por este mecanismo incluyen especies de Borrelia, Brucella, Clostridium botulinum y virus del Nilo Occidental, que pueden causar una enfermedad similar a la poliomielitis(84). Respecto a esto, de acuerdo a la fisiopatología del desarrollo del SGB descrita líneas arriba (Figura 2), no existe evidencia de que este síndrome tenga un carácter parainfeccioso, por lo tanto, cualquier aislamiento de agente infeccioso concomitante con el desarrollo del síndrome no debería ser considerado como probable agente causal(77).
Los estudios más apropiados para investigar el rol de los virus en el SGB, deben estar orientados a la búsqueda de anticuerpos, debido a la naturaleza post infecciosa de la enfermedad. Estudios que busquen in situ algún virus representaría reconocer el carácter parainfeccioso de la misma; sin embargo, este enfoque está lejos de ser el más oportuno debido a lo anteriormente expuesto. Estudios serológicos enfocados en la búsqueda de agentes etiológicos de SGB son muy pocos, uno de los últimos referente a este tema reportan a influenza A y B, virus de hepatitis A, DENV, CMV y el EBV como antecedente importante de SGB después de Campylobacter spp.(78)
CONCLUSIONES
Ante la evidencia científica disponible, el rol que desempeñan los virus en la etiología del SGB es innegable. Si bien Campylobacter spp. sigue siendo el principal agente involucrado en este síndrome, muchos virus como: Influenza A, CMV, Zika entre otros, también están involucrados en su origen. Al parecer una condición importante y necesaria para que estos agentes infecciosos produzcan SGB sería la presencia de envoltura, la cual propiciaría el mimetismo molecular principalmente con anticuerpos antigangliósidos que desencadenarían posteriormente la enfermedad. Por ello, el rol de virus desnudos en la producción de SGB sería improbable.
Se debe considerar el carácter post infeccioso de la enfermedad, y no orientar la búsqueda de agentes etiológicos in situ, lo cual durante muchos años habría contribuido a notificar la causa de este síndrome como idiopática al no tener un hallazgo reportable. Una herramienta adecuada para este fin sería el estudio serológico, debido a que la presencia de anticuerpos nos revelaría eventos infecciosos ocurridos con anterioridad. Por último, es importante reconocer a los virus como agentes causales de SGB, sobre todo cuando se suscitan brotes de esta enfermedad, lo cual, por el patrón demográfico y clínico que presentan los pacientes hacen necesario pensar que exista un agente infeccioso circulando. Un hecho que debería reorientar las medidas de contención frente a esta enfermedad.











 text in
text in 


