INTRODUCCIÓN
La nueva pandemia de coronavirus es la mayor crisis de salud pública que el mundo aún enfrenta. Se ha estimado que más del 90% de los casos corresponden a población adulta y sólo entre 1 a 5% ocurre en población pediátrica1, de los cuales más del 90% son formas de presentación asintomática, leve o moderada, y sólo 5.9% casos graves2, este porcentaje es mucho menor comparado al 18.5% de casos severos reportados en la población adulta3.
La asociación entre la presencia de comorbilidad y enfermedad severa ha sido reportada en un estudio de 48 pacientes pediátricos admitidos a UCIP, de los cuales 40 niños (83%) tuvo alguna comorbilidad4, en otro estudio que incluyo 651 niños, 46% presento al menos una comorbilidad5.
El desarrollo de MIS-C ha sido descrito, el cual puede ser severo y presentar un compromiso cardiaco importante6. Se encontró que los pacientes con MIS-C presentaron 5 veces más riesgo de ser admitidos a UCIP5. En Perú, se determinó que la incidencia de COVID-19 en adultos es 13 veces más que lo niños7, sin embargo, el comportamiento del COVID-19 en pacientes pediátricos con comorbilidades complejas no se ha descrito.
El propósito de este estudio es describir las características clínico epidemiológicas y de tratamiento en niños con diagnóstico de COVID-19 hospitalizados en el INSN-SB, el cual se caracteriza por ser un centro quirúrgico especializado de alta complejidad.
MÉTODOS
Diseño y área de estudio
Durante el periodo del 1° de Marzo al 31° de Julio del 2020, se realizó un estudio observacional cuali cuantitativo retrospectivo.
Población y muestra
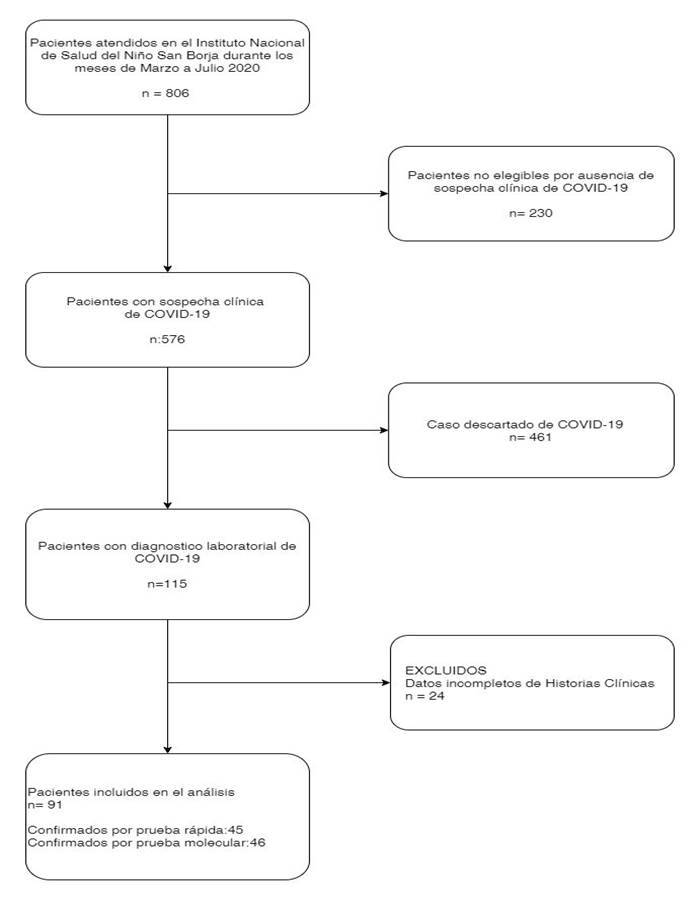
Por muestreo no aleatorio por conveniencia, se incluyeron a todos los pacientes menores de 18 años hospitalizados con diagnóstico confirmado por laboratorio de COVID-19 que tenían las variables de interés (N=91). Se revisaron las historias clínicas de pacientes tratados con COVID-19, el INSN-SB es un centro pediátrico de referencia con 306 camas. Para el mejor cuidado de los pacientes con COVID-19, 24 camas fueron dispuestas para pacientes con caso confirmado de COVID-19, 25 camas para pacientes con sospecha de COVID-19 y 12 camas para pacientes pediátricos con requerimiento de UCIP.
Criterios de elegibilidad: Pacientes con datos incompletos fueron excluidos y la evaluación clínica fue realizada por el médico pediatra de acuerdo a las guías de cuidado institucional.
Se consideró la definición de casos COVID-19 según la norma institucional del Ministerio de Salud del Perú (MINSA)8, así como la definición del MIS-C de la Organización Mundial de la Salud (OMS), la cual incluye a niños y adolescentes de 0 a 19 años con presencia de fiebre mayor o igual a tres días y otros criterios9.
La infección de COVID-19 fue diagnosticada por el test de inmunocromatográfica en sangre o por la prueba de reacción en cadena de polimerasa de un hisopado nasofaríngeo, dependiendo de la disponibilidad de las mismas.
Además, como parte de los criterios de hospitalización, los test de laboratorios confirmatorios se realizaron en pacientes asintomáticos previos al inicio de quimioterapia o en el periodo preoperatorio, los test e imágenes se indicaron por el médico pediatra y fueron realizados según la guía institucional. (Figura N°1)
Variables de estudio
Las variables epidemiológicas evaluadas fueron sexo, edad, procedencia por departamento, peso, talla, comorbilidad y contacto directo de pacientes COVID-19. Las variables clínicas incluidas fueron: fecha de inicio de síntomas y la presencia o no de síntomas como malestar general, tos, dificultad respiratoria, diarrea, dolor abdominal, náuseas, vómitos, cefalea, rinorrea, dolor faríngeo. Los signos clínicos considerados fueron la fiebre, inyección conjuntival, rash, disnea, roncantes, sibilantes, crepitantes, subcrepitantes, convulsiones, exudado faríngeo, edema pretibial o descamación de extremidades y lengua aframbuesada.
Procedimientos
Las pruebas de laboratorio de infección por SARS CoV-2 fueron tanto pruebas rápidas como moleculares. Además, se incluyeron: hemoglobina, leucocitos, fórmula leucocitaria, plaquetas, albúmina, creatinina, ferritina, proteína C reactiva, procalcitonina, velocidad de sedimentación (VSG), deshidrogenasa láctica (DHL), alanina aminotransferasa (ALT), aspartato aminotransferasa (TGO), bilirrubina total, fosfatasa alcalina, gamma-glutamil transferasa (GGT) tiempo de protrombina (TP), Dímero D..
El tratamiento recibido durante la infección por COVID-19 se describe en base a grupos de medicamentos (antibióticos, antifúngicos, antivirales, antiparasitarios, anticoagulantes, antipirético, inmunoglobulina humana, corticoides y vasoactivos)
Finalmente, se evaluó la severidad del cuadro clínico, requerimiento de UCIP y la fecha de admisión, además la presencia o no de MIS-C; así como, la estancia hospitalaria considerando la condición final del paciente y el punto de corte como el último día del mes de Julio 2020.
Análisis estadísticos
Los datos del estudio se recopilaron y administraron utilizando el sistema Integrado de Gestión Hospitalaria (SIS Galen Plus)(10)y las herramientas de captura de datos electrónicos REDCap(11,12)alojadas en el INSN-SB.
Se realizó un análisis descriptivo para las variables de interés; para las variables cuantitativas debido a una distribución asimétrica se analizaron las medianas y rangos intercuartílico (RIQ), y para las variables cualitativas se analizaron tablas de frecuencia.
El análisis bivariado se realizado para identificar las diferencias entre los tipos de hospitalización (salas generales y UCIP), para variables cualitativas se empleó el test de chi cuadrado y test de Fisher, mientras que para las variables numéricas se realizaron test no paramétricos. El análisis estadístico fue realizado con la versión 16 del programa STATA (StataCorp. 2019. Stata Statistical Software: Release 16. College Station, TX: StataCorp LLC). Todas las diferencias fueron consideradas con un valor de p < 0.05.
RESULTADOS
Entre marzo y Julio del 2020, 576 pacientes fueron admitidos al INSN-SB con sospecha de COVID-19, de los cuales el 19,9% (n=115) tuvieron diagnóstico confirmado por prueba molecular o rápida, se analizaron un total de 91 pacientes. La mayoría de pacientes fueron varones, siendo el grupo etario predominante los escolares: 61,5% (n=56) de los pacientes procedía de la ciudad de Lima y 89,1% (n=81) presentaba vacunación incompleta, 100% de los cuales (n=22) fueron admitidos a la UCIP. (Tabla 1)
Tabla 1. Características demográficas de los pacientes con COVID-19 atendidos en el INSN-SB (n=91).
| Características | Total | ||||
| n | % | ||||
| Sexo | |||||
| Femenino | 33 | 36,3 | |||
| Masculino | 58 | 63,7 | |||
| Edad (años) | 4 (1-8) | ||||
| Procedencia | |||||
| Lima | 56 | 61,5 | |||
| Provincias | 35 | 38,5 | |||
| Vacunación incompleta | 81 | 89,1 | |||
| Ingreso por cuadro quirúrgico | |||||
| Emergencia | 21 | 53,8 | |||
| Electiva | 18 | 46,2 | |||
| Contacto | |||||
| Familiar | 24 | 26,4 | |||
| Paciente | 4 | 4.4 | |||
| Desconocido | 63 | 69.2 | |||
| Prueba diagnóstica | |||||
| Prueba rápida | 45 | 49,4 | |||
| Prueba molecular | 46 | 50,6 | |||
| Radiografía | |||||
| Normal | 45 | 63,4 | |||
| Anormal | 26 | 36,6 | |||
| Presencia de comorbilidad | |||||
| Si | 49 | 53,8 | |||
| No | 42 | 46,2 | |||
| Presencia de MIS-C | |||||
| Si | 6 | 6.6 | |||
| No | 85 | 93.4 | |||
| Estado final del paciente | |||||
| Vivo | 82 | 90.1 | |||
| Fallecido | 9 | 9.9 | |||
*Mediana, RIC
En relación a la comorbilidad, se presentaron en un 53,8% (n=49), de los cuales 68,8% (n=15) fueron admitidos a UCI. En 31,2% (n=15) la comorbilidad más frecuente fue neurológica y 24,4% (n=12) cardiológica, seguido de 14,2% (n = 7) hematológica y 14,2% (n = 7) oncológica, finalmente en pacientes admitidos a UCIP, la comorbilidad más frecuente fue cardiológica 40% (n=6) y neurológica 20% (n =3). (Tabla 2)
Tabla 2. Comorbilidades de los pacientes con COVID-19 atendidos en el INSN-SB (n=91).
| Comorbilidades | Total | ||
| N | % | ||
| Presencia de comorbilidad | |||
| Si | 49 | 53,8 | |
| No | 42 | 46,2 | |
| Tipo de comorbilidad | |||
| Neurológica | 15 | 31,2 | |
| Cardiológica | 12 | 25,5 | |
| Hematológica | 7 | 14,9 | |
| Oncológica | 7 | 14,9 | |
| Gastrointestinal | 6 | 12,2 | |
| Traumatismo | 4 | 7,7 | |
| Neumológica | 4 | 7,7 | |
| Quemadura | 3 | 5,77 | |
| Otras | 2 | 3,8 | |
La sintomatología reportada fue malestar general 23,1% (n=21), tos 19,8% (n=18), dificultad respiratoria 14,3% (n=13), vómitos 12,1% (n=11); como signos evidenciados fiebre 39,6% (n=36), disnea 13,2% (n=12), roncantes 9,9% (n=9) y convulsiones 5,5% (n=5). (Tabla 3)
En general la mayoría de pacientes tuvo una radiografía de tórax normal 63,6% (n=14), con diferencias evidenciadas entre los niños admitidos a salas de hospitalización y aquellos admitidos a UCIP (74% vs 38%, respectivamente) o patrón radiológico anormal (26% vs 61,9%, respectivamente) (p < 0.01). Además el patrón radiológico más frecuente fueron los infiltrados intersticiales bilaterales en 57,7% (n = 15). (Tabla 3)
Tabla 3. Características clínicas y radiológicas de los pacientes con COVID-19 atendidos en el INSN-SB (n=91).
| Características | Total | ||
| n | % | ||
| Síntomas | |||
| Malestar general | 21 | 23,1 | |
| Tos | 18 | 19,8 | |
| Dificultad respiratoria | 13 | 14,3 | |
| Vómitos | 11 | 11,2 | |
| Dolor abdominal | 10 | 11,0 | |
| Rinorrea | 8 | 8,8 | |
| Náuseas | 6 | 6,6 | |
| Diarrea | 3 | 3,3 | |
| Dolor faríngeo | 3 | 3,3 | |
| Convulsiones | 2 | 2,2 | |
| Cefalea | 2 | 2,2 | |
| Signos | |||
| Fiebre | 36 | 39,6 | |
| Disnea | 12 | 13,2 | |
| Roncantes | 9 | 9,9 | |
| Sibilantes | 5 | 5,5 | |
| Convulsiones | 5 | 5,5 | |
| Subcrepitantes | 4 | 4,4 | |
| Adenopatías | 4 | 4,4 | |
| Rash | 3 | 3,3 | |
| Edema pretibial | 2 | 2,2 | |
| Lengua aframbuesada | 1 | 1,1 | |
| Inyección conjuntival | 1 | 1,1 | |
| Patrón radiológico de tórax | |||
| Intersticial bilateral | 15 | 57,7 | |
| Alveolar unilateral | 8 | 30,7 | |
| Intersticial unilateral | 3 | 11,5 | |
| Alveolar bilateral | 2 | 7,6 | |
Con respecto a la mortalidad, se observaron diferencias entre los niños admitidos a salas de hospitalización y aquellos admitidos a UCIP (4,3% vs 27,3%; p < 0.02). (Tabla 4)
Tabla 4. Mortalidad reportada en los pacientes de salas de hospitalización y UCIP con COVID-19 atendidos en el INSN-SB (n=22).
| Características | Salas de hospitalización | UCIP | Total | p valor | |
| Supervivencia | n=69 | n=22 | n=91 | ||
| Si | 66 (95,6%) | 16 (72,7%) | 82 (90,1%) | ||
| No | 3 (4,3%) | 6 (27,3%) | 9 (9%) | 0.061 | |
En relación al MIS-C, solo 6,6% (n = 6) de los pacientes presentaron los criterios establecidos por la OMS, la mayoría de estos pacientes no requirió admisión a UCIP (n=4).
En los pacientes que tuvieron exámenes de laboratorio al ingreso, encontramos que la principal alteración laboratorial fueron los niveles de Proteína C reactiva (PCR) 9,4 mg/L (2,1 - 96,7) y Dímero D 0,69 ug/ml(0,27 - 1,65), no evidenciamos mayor alteración respecto a la procalcitonina 0,14 (0,05-0,65) ni en los valores de TGP, TGO y creatinina, con respecto al hemograma la mediana de la hemoglobina fue 11,8 g/dl (9,8 - 12,8), además no encontramos leucocitosis, neutrofilia, desviación izquierda ni linfocitopenia marcada (leucocitos en 10 800x 103/uL(7 430 - 1 450), linfocitos 3 040x 103/uL. (1 820 -4 910), neutrófilos 5 045x 103/uL (3 095- 9 240). Mediante serología IgM, Mycoplasma pneumoniae fue el microorganismo más aislado 9,9% (n=9), seguido de Citomegalovirus 3,3% (n=3), Epstein Barr 2,2% (n=2) e Influenza 1,1% (n=1); los gérmenes gram positivos fueron aislados en 42,9% (n=9), en menor proporción se aislaron bacterias Gram negativas 38,1% (n=8) y hongos 19% (n=4). (Tabla 5)
Tabla 5. Características laboratoriales y microbiológicas de los pacientes con COVID-19 atendidos en el INSN-SB
| Características | Mediana | Rango intercuartilico | ||
| Hematología | ||||
| Hemoglobina | 11,8 | 9,8-12,8 | ||
| Leucocitos | 10800 | 7430-14570 | ||
| Linfocitos | 3040 | 1820-4910 | ||
| Monocitos | 630 | 450-960 | ||
| Neutrófilos | 5045 | 3095-9240 | ||
| Bastones | 0 | 0,0 | ||
| Plaquetas | 314000 | 233000-399500 | ||
| Bioquímica | ||||
| Proteína C reactiva | 9,4 | 2,1-96,7 | ||
| VSG | 28 | 15-50 | ||
| Creatinina | 0,33 | 0,22-0,45 | ||
| Albúmina | 4,01 | 3,49-4,5 | ||
| TGO | 31 | 22-43 | ||
| TGP | 17 | 13-32 | ||
| Ferritina | 276,10 | 93,8-468,1 | ||
| Bilirrubina total | 0,62 | 0,34-1,22 | ||
| Tiempo de protrombina | 14,8 | 13,7-16,2 | ||
| Fibrinógeno | 344,5 | 266-502 | ||
| Dímero D | 0,69 | 0,27-1,65 | ||
| Procalcitonina | 0,14 | 0,05-0,65 | ||
| CPK | 110 | 40-254 | ||
| CPK-MB | 29.9 | 24,5-38 | ||
| Lactato | 2 | 1,4-3,4 | ||
| DHL | 650 | 442-848 | ||
| Microbiología | n | % | ||
| Mycoplasma | 9 | 9,9 | ||
| Citomegalovirus | 3 | 3,3 | ||
| Epstein Barr | 2 | 2,2 | ||
| Influenza B | 1 | 1,1 | ||
| Herpes 1 | 1 | 1,1 | ||
| Parvovirus B19 | 1 | 1,1 | ||
| Tipo de aislamiento | n=21 | % | ||
| Gram positivos | 9 | 42,9 | ||
| Gram negativos | 8 | 38,1 | ||
| Hongos | 4 | 19,0 | ||
Con respecto a los medicamentos administrados, el 76,9% (n=70) de los pacientes recibió antibióticos, de los cuales los que tuvieron una mayor prescripción fueron las cefalosporinas 58,6% (n=41) y glucopéptidos en 40% (n=28), es importante mencionar también que 40% (n=25) pacientes recibieron carbapenems y los macrólidos como la azitromicina se empleó en un 17,1% (n=12). Los antiparasitarios se administraron en 25,3% (n=23) de los pacientes, hidroxicloroquina en 17,4% (n = 4). Los antipiréticos, principalmente paracetamol, fue usado en 89% (n =81) pacientes, mientras que 18,7 (n=17) recibió anticoagulantes, 31,9% (n=29) corticosteroides y 28,6 (n=26) drogas vasoactivas. En relación al MIS-C, 5,5 % (n=5) pacientes recibió inmunoglobulina humana (Tabla 6).
Tabla 6. Frecuencia de prescripción de medicamentos en los pacientes con COVID-19 atendidos en el INSN SB (n=91).
| Medicamentos | Total | ||
| n | % | ||
| Antibióticos | 70 | 76,9 | |
| Cefalosporinas | 41 | 58,57 | |
| Glucopéptidos | 28 | 40 | |
| Carbapenems | 25 | 35,71 | |
| Penicilinas + Inhibidores de la beta lactamasa | 14 | 20 | |
| Macrólidos | 12 | 17,14 | |
| Aminoglucósidos | 9 | 12,86 | |
| Lincosamidas | 9 | 12,86 | |
| Penicilinas | 8 | 11,43 | |
| Sulfamidas | 7 | 10 | |
| Quinolonas | 3 | 4,29 | |
| Oxazolidinonas | 1 | 1,43 | |
| Nitrofuronas | 1 | 1,43 | |
| Antifúngicos | 8 | 8,8 | |
| Azoles | 7 | 87,5 | |
| Equinocandinas | 1 | 12,5 | |
| Antivirales | 1 | 1,1 | |
| Análogos de los nucleótidos (Aciclovir) | 1 | 100 | |
| Antiparasitarios | 23 | 25,3 | |
| Nitroimidazoles | 20 | 86,96 | |
| 4 amino-quinolinas (Hidroxicloroquina) | 4 | 17,39 | |
| Benzimidazoles | 1 | 4,35 | |
| Anticoagulantes | 17 | 18,7 | |
| Heparina de bajo peso molecular (Enoxaparina) | 12 | 71 | |
DISCUSIÓN
En este estudio, se encontró que la mayoría de pacientes presentó un cuadro clínico leve a moderado, casi un tercio de los pacientes requirió ser admitido a UCIP en el contexto de comorbilidades asociadas. Además, se describe un grupo de pacientes con criterios diagnósticos de MIS-C de los cuales todos evolucionaron de manera favorable.
Similar a lo reportado en nuestro estudio, según la CDC de 576 niños hospitalizados tuvieron como mediana la edad de ocho años13, siendo predominante el sexo masculino13,14. Además, sólo un tercio de nuestros pacientes presentaron contacto familiar (26,4%), a diferencia de lo reportado en otros estudios donde señalan el antecedente de contacto familiar en más del 40% de casos14,15, este hallazgo se puede explicar debido a la falta de información sobre el diagnóstico en el entorno familiar.
A pesar que en nuestro estudio los síntomas respiratorios y la fiebre fueron las manifestaciones clínicas más frecuentes, 33% de pacientes presentaron síntomas gastrointestinales, en la literatura la presentación de manifestaciones gastrointestinales es variable y actualmente se describe en más del 20% de los casos6,13,16. Similar a otros estudios, la coinfección más frecuente fue Mycoplasma pneumoniae y en menor proporción con otros virus respiratorios14,17,18En relación a ello, se ha descrito que las infecciones virales respiratorias podrían predisponer el desarrollo de infecciones bacterianas sobreagregadas como por M. pneumoniae, debido a la alteración del aclaramiento mucociliar respiratorio y de la respuesta del sistema inmune19; sin embargo, la infección por M. pneumoniae podría también preceder a la infección viral20.
Similar a lo reportado por nosotros, se encuentra que las comorbilidades más frecuentes fueron las neurológicas en un 11% (65/614) y hematológicas-oncológicas 8% (45/614)6, sin embargo, otro estudio encontró como comorbilidad más frecuente al asma (12,3%), seguido por la anemia de células falciformes (7%)21, muchas de estas comorbilidades están en relación a patologías congénitas a diferencia de los adultos. Según severidad, en nuestro estudio se reportó que 68,2% de pacientes en UCIP presentaron comorbilidades, siendo un porcentaje alto al igual que otro estudio que describe más del 80% de pacientes hospitalizados en UCI con comorbilidades4
Observamos una elevación de PCR y Dímero D, en concordancia con lo encontrado en la literatura, se han descrito una variedad de alteraciones laboratoriales en COVID-19 sobre todo de marcadores inflamatorios séricos6,15,22,23, Un estudio encontró niveles elevados de PCR, procalcitonina, interleucina-6, ferritina y Dímero D, en relación con la severidad22. Nuestros hallazgos pueden deberse a la mayor proporción de pacientes con cuadros leves, moderados y debido a que para el análisis se incluyeron solo los exámenes iniciales.
En relación a los casos de MIS-C, en nuestro estudio encontramos seis pacientes con diagnóstico de MIS-C y dos requirieron admisión a UCIP similar a lo descrito en otro reporte peruano (⅛)(23), mientras que en otro estudio encuentran que los casos de MIS-C presentan 5 veces más probabilidad de ser admitidos a UCIP, sin embargo, ningún paciente con MIS-C falleció(6). En ambos estudios todos cursaron con evolución favorable. En contraste, en una revisión sistemática de MIS-C en niños y adolescentes se describió que MIS-C parece ser una condición de mayor severidad con 68% (531/783) de los casos requirieron ingreso a UCIP24
La prescripción de antibióticos fue alta a pesar de tener pocos hallazgos microbiológicos. En la literatura un meta-análisis describe tanto en adultos como niños que un 71,3% tuvo prescripción de antibióticos, a pesar de que la prevalencia de coinfecciones bacterianas y COVID-19 fue baja y la frecuencia de infección bacteriana secundaria en pacientes fue 14,3%(26), estos resultados sugieren que los antibióticos deberían ser prescritos bajo una clara sospecha clínica de infección bacteriana en pacientes con COVID-19.
En nuestro estudio el uso de la hidroxicloroquina fue poco empleado y el uso de inmunoglobulina se reservó fundamentalmente en pacientes con criterios de MIS-C, mientras que en una revisión sistemática 7,8% de niños recibieron hidroxicloroquina, 4,1% corticoides y 3,1% inmunoglobulina15Con respecto a la hidroxicloroquina, los hallazgos se pueden explicar por la poca evidencia científica reportada inicialmente sobre la misma, a diferencia de la inmunoglobulina endovenosa la cual está aceptada como terapia inmunomoduladora en el manejo de la enfermedad de Kawasaki y en el MIS-C6,23,26,27.
Nuestro estudio tiene algunas limitaciones como son el presentar información observacional retrospectiva, ausencia de pruebas basales completas planteados para COVID-19, en parte explicada por la diversidad de criterio clínico para la solicitud. Con respecto al diagnóstico de MIS-C, no a todos los pacientes se le realizó una prueba serológica de SARS-CoV 2, y en el presente estudio sólo se incluyeron los que tuvieron alguna prueba confirmatoria positiva.











 texto en
texto en