INTRODUCCIÓN
La colitis ulcerativa (CU) es la inflamación crónica e inespecífica del intestino caracterizada por periodos de actividad y remisión de la enfermedad. Su diagnóstico se basa en una serie de criterios clínicos, endoscópicos e histológicos1. La CU usualmente predomina en pacientes adultos de entre 30 y 40 años2. En México, la media de casos nuevos de CU aumentó de 28,8 en el periodo de 1987 a 1996, a 76,1 de 1997 a 20063. La incidencia y prevalencia tiene un comportamiento similar en el resto del mundo4. La presentación y el desarrollo se afecta por los cambios ambientales5.
El objetivo principal del tratamiento fue inducir y mantener la remisión a largo plazo. De acuerdo a la escala de Montreal, la actividad leve, moderada o severa determina el tratamiento6-9.
El tratamiento para actividad leve es el uso de ácido 5-aminosalicílico (5-ASA)10, agregando esteroides (por ejemplo, prednisona 40-60 mg por día) o equivalentes en caso de resistencia11. En la actividad moderada se recomienda agregar al tratamiento tiopurinas (azatioprina o mercaptopurina), que también se pueden usar en pacientes dependientes de esteroides12. Para la actividad severa se utiliza terapia biológica (adalimumab, infliximab, entre otros), y recientemente el inhibidor de quinasa Janus (JAK) para rescate. Se suele iniciar el tratamiento con esteroides intravenosos o ciclosporina como inducción a la remisión. Esta terapia tiene como objetivo mantener la remisión de la enfermedad13-15. El uso de infliximab con azatioprina tiene una respuesta superior en pacientes dependientes de esteroides, alcanzando una remisión a las 16 semanas de tratamiento16,17.
El tratamiento quirúrgico se reserva para urgencias o presencia de lesiones premalignas y malignas18,19.
Se ha propuesto el uso de terapia biológica en caso de resistencia al tratamiento primario19, pero la información es aún escasa.
Hasta el momento no existen predictores del comportamiento real de la enfermedad, que ayuden a mejorar el tratamiento e incluso a su prevención. Tampoco el estudio del manejo en caso de persistencia a pesar del tratamiento. Por eso la importancia de evaluar la respuesta al uso de la terapia biológica, ante la carencia de estudios a largo plazo.
El objetivo de este trabajo fue evaluar los resultados del tratamiento biológico a 12 meses en pacientes con CU refractaria al tratamiento convencional, en el Servicio de Coloproctología de un Hospital de tercer nivel en la Cd. de México, México.
MÉTODOS
Diseño y área de estudio
Se realizó un estudio descriptivo, retrospectivo, longitudinal en pacientes con CU que fueron refractarios al tratamiento convencional y que recibieron tratamiento biológico en el Servicio de Coloproctología en un Hospital de tercer nivel.
Población y muestra
Se revisaron los expedientes de los pacientes diagnosticados con CU en el Servicio de Coloproctología. Se incluyeron los casos identificados con diagnóstico confirmado de CU, que se encontraban bajo terapia biológica (adalimumab o infliximab) por 12 meses, previamente refractarios a tratamiento convencional (mesalazina, azatioprina y esteroides), de cualquier sexo y edad, que contaran con seguimiento endoscópico, bioquímico, clínico e histopatológico.
Variables e instrumentos
Se registraron los resultados de las evaluaciones: basal, a seis y a 12 meses del inicio de la terapia biológica, de las manifestaciones clínicas, bioquímicas, endoscópicas e histológicas.
Después de la evaluación basal se inició terapia biológica con inhibidor del factor de necrosis tumoral (anti-TNF) tipo Infliximab o Adalimumab. Como complemento se utilizó Azatioprina o 5-ASA.
Se recabó información de: edad, género, talla, peso, índice de masa corporal (IMC), antecedente de diabetes mellitus y/o hipertensión arterial, tiempo de enfermedad, tabaquismo, alcoholismo, apendicectomía. En cada evaluación se registraron características clínicas como número de evacuaciones al día, presencia de moco y/o sangre en heces, dolor abdominal, manifestaciones extraintestinales (artralgias, mialgias, uveítis y cirrosis), e ingreso a hospitalización por complicaciones asociadas. Las características bioquímicas registradas fueron hemoglobina, albúmina y proteína C reactiva (PCR) séricas, y velocidad de sedimentación globular (VSG). Endoscópicamente se evaluó la calificación de acuerdo a la escala endoscópica Mayo y el grado de actividad histopatológica.
Se aplicaron las siguientes escalas:
• Se midió la actividad de la enfermedad, con nueve características clínicas y bioquímicas: el número de deposiciones por día, sangre en heces, fiebre, taquicardia, hemoglobina, VSG, leucocitos totales, albúmina y potasio séricos20,21.
• La escala endoscópica Mayo para CU evalúa su actividad a través de la frecuencia de deposiciones, características del sangrado, hallazgos endoscópicos de la mucosa y valoración médica. La actividad se divide en: 0) normal, mucosa sin lesiones o en fase inactiva; 1) leve, leve eritema, disminución del patrón vascular, leve friabilidad; 2) moderada, marcado eritema, ausencia del patrón vascular, friabilidad, erosiones o úlceras puntiformes; y 3) intensa, sangrado espontáneo y ulceraciones7,21,22.
• La actividad histológica para la CU se clasifica como sin actividad, actividad leve, actividad moderada y actividad severa. Se reporta de acuerdo al estudio anatomopatológico.
• Todos los pacientes son interrogados acerca de sintomatología agregada a CU. Se buscó intencionadamente en los expedientes acerca de cualquier condición clínica relacionada o no con la aplicación de los medicamentos.
Procedimientos
El tratamiento biológico consistió en la administración de Infliximab o Adalilumab de acuerdo a los siguientes esquemas:
• La administración del Infliximab es a las cero, dos y seis semanas y posteriormente cada ocho semanas a dosis de cinco a diez mg/kg por vía intravenosa.
• El Adalimumab se administró a dosis de 160/80 mg u 80/40 mg subcutánea cada dos semanas23,24.
• La azatioprina se aplicó a dosis de 2,5-3 mg/kg/día25.
Análisis estadísticos
Se realizó mediante estadística descriptiva. Se utilizaron medidas de tendencia central y de dispersión para las variables cuantitativas. Se utilizó el programa estadístico SPSS versión 25,0 de IBM.
Aspectos éticos
El presente estudio cumplió con los principios éticos para la incorporación de pacientes en el estudio, con manejo de los datos personales con estricta confidencialidad. Todos los pacientes firmaron carta de consentimiento informado, al momento de aplicar la escala de calidad de vida. El protocolo fue aprobado por el Comité de Investigación en Salud n° 3 601 del Instituto Mexicano del Seguro Social, con número de registro R-2020-3601-090.
RESULTADOS
Se incluyeron 18 pacientes con edad media de 41,2 (±11,8) años, fueron diez (55,6%) mujeres y ocho (44,4%) hombres. La talla media fue de 1,61 (±0,8) metros, peso medio de 66,6 (±13,8) kilogramos, el IMC medio fue de 24,2 (±4) kg/m2. No se encontraron antecedentes de diabetes mellitus ni hipertensión en la población evaluada. El antecedente de tabaquismo estuvo presente en dos (11,1%) pacientes, de consumo habitual de alcohol en seis (33,3%) pacientes, y de apendicectomía en tres (16,7%) pacientes.
Evaluación basal
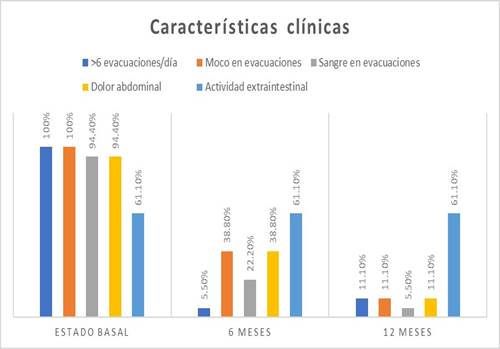
Se observó que los 18 pacientes incluidos presentaron más de seis evacuaciones al día, 18 reportaron moco en evacuaciones y 17 pacientes registraron hematoquecia y dolor abdominal. Además, 11 pacientes presentaron actividad extraintestinal (artralgias, mialgias, uveítis y cirrosis) (Figura 1).
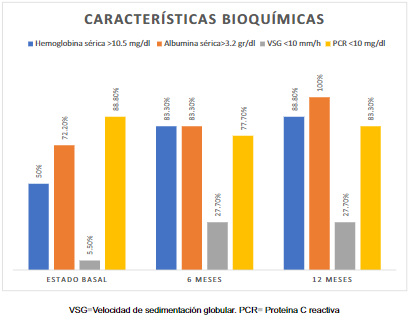
La hemoglobina sérica mayor de 10,5 g/dl se registró en 50% de los pacientes, la albúmina sérica mayor de 3,2 g/dl en 72,2%, la VSG mayor de 10 mm/h en 94,4%, y la PCR menor de 10 mg/dl en 88,9% (Figura 2).
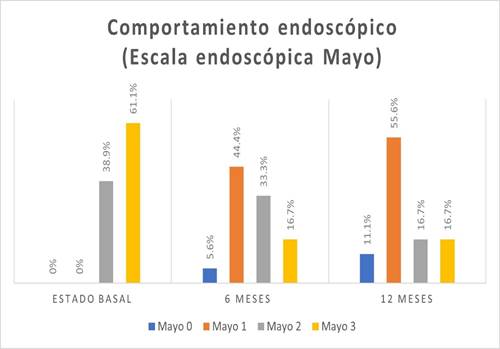
En la escala visual endoscópica de Mayo para CU, 11(61,1%) pacientes presentaron un nivel de Mayo 3 (Figura 3).
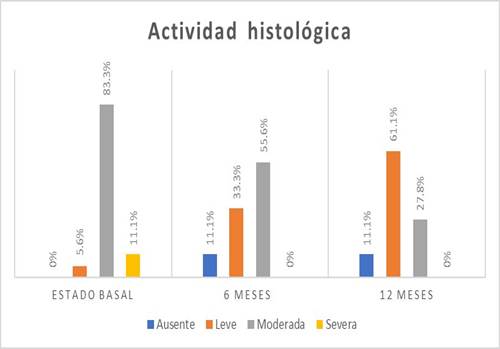
El grado de actividad histológica más frecuente fue la actividad moderada en 15 (83,3%) personas (Figura 4).
Respecto a las hospitalizaciones, 13 (72,2%) pacientes no ameritaron manejo hospitalario y en 5 (27,8%) pacientes fue necesaria la atención hospitalaria antes del inicio del biológico. El 100 % de los pacientes fueron refractarios al tratamiento convencional combinado para el control de la enfermedad antes del inicio del biológico.
Después de la evaluación basal se inició terapia biológica con agentes anti-Factor de Necrosis Tumoral tipo Infliximab en 10 (55,6%) pacientes y Adalimumab en 8 (44,4%) pacientes. Se complementó con Azatioprina en 50% de los pacientes, y con 5-ASA en el 83,3%.
Evaluación a los seis meses
Clínicamente, 17 pacientes presentaron menos de seis evacuaciones al día, siete pacientes tenían evacuaciones con moco, cuatro presentaron sangre en las evacuaciones y siete pacientes tuvieron dolor abdominal. Respecto a la actividad extraintestinal se encontraba presente en 11 pacientes (Figura 1).
Se encontró una concentración de hemoglobina >10,5 g/dl en 15 (83,3%) pacientes; la concentración sérica de albúmina fue >3,2 g/dl en 15 (83,3%) pacientes. La VSG fue <10 mm/h en 5 (27,8%) pacientes, y la PCR <10 mg/dl se encontró en 14 (77,8%) pacientes (Figura 2).
En la escala visual endoscópica, se encontró mayor frecuencia de nivel de Mayo 1 en 8 (44,4%) pacientes (Figura 3). La actividad histológica se encontró moderada en 10 (55,6%) pacientes (Figura 4).
Evaluación a los 12 meses del inicio del biológico
Se encontraron 16 pacientes con menos de seis evacuaciones al día, dos pacientes con moco en evacuaciones, un paciente con presencia de sangre en las evacuaciones y dos pacientes con dolor abdominal. La actividad extraintestinal se encontraba presente en 11 pacientes (Figura 1).
La concentración de hemoglobina fue >10,5 g/dl en 16 (88,9%) pacientes, la concentración sérica de albúmina >3,2 g/dl se encontró en 18 (88,9%) pacientes. La VSG fue mayor a 10 mm/h en 13 (72,2%) pacientes y en cuanto a la PCR era <10 mg/dl en 15 (83,3%) pacientes (Figura 2).
En la escala visual endoscópica de Mayo para CU, en 10 (55,6%) pacientes fue Mayo 1 (Figura 3). Se encontró actividad histológica leve en 11 (61,1%) pacientes (Figura 4).
No se registró sintomatología clínica diferente al cuadro inicial de CU que se presentara relacionada con la aplicación de los medicamentos hasta las 72 hrs posteriores a ellos.
DISCUSIÓN
La terapia biológica ha demostrado eficacia y seguridad sobre la CU, logrando remisión clínica, endoscópica, histológica y bioquímica(13,15).
En el seguimiento de los pacientes, una vez hecho el diagnóstico e iniciado el tratamiento, se recomienda control endoscópico a los tres a seis meses, clínicamente deben ser evaluados cada tres meses, una vez conseguida la remisión, la vigilancia puede ser cada seis a doce meses(26). El presente trabajo se realizó mediante un estado basal y dos cortes a seis y doce meses, analizando cuatro aspectos, el clínico, bioquímico, endoscópico e histológico.
La curación histológica es la remisión completa de la CU y se asocia a la reducción de complicaciones a futuro en la práctica clínica. En este trabajo se obtuvo una respuesta histológica adecuada y un paciente consiguió la remisión histológica completa más no una remisión profunda, la cual consiste en la ausencia de actividad clínica, endoscópica, histológica y bioquímica.
La terapia con infliximab es considerada la primera línea de tratamiento ante CU refractaria a tratamiento convencional y actividad severa. Induce y mantiene su remisión hasta a 52 semanas de su inicio(27). El tratamiento con infliximab predominó ligeramente en este trabajo. La mayoría de los pacientes registraron respuesta sostenida, la cual consiste en la ausencia de recaídas durante el tratamiento. Además, se utilizó la terapia combo, la cual consiste en el uso del biológico (Infliximab/Adalimumab), agregado el uso de inmunomodulador tipo azatioprina.
El infliximab registra una ventaja del 80% frente a placebo en un seguimiento a cinco años, con la reducción en 50% del riesgo de colectomía en pacientes con colitis ulcerativa severa(28). En el presente trabajo también se observa una respuesta superior de la terapia biológica con infliximab a los seis y 12 meses en relación a la terapia convencional, agregando además la percepción de calidad de vida de nuestros pacientes.
Adalimumab induce y mantiene la remisión en un 40 a 59,9% de los pacientes con actividad moderada a severa en seguimiento de uno cuatro años(29,30). La respuesta con adalimumab en este trabajo fue similar a la observada con infliximab; también en conjunto con la terapia combo. El seguimiento se registró a los 12 meses, y actualmente continúa.
Las reacciones adversas inmediatas asociadas al uso de infliximab y adalimumab son muy similares. Incluyen prurito, edema, urticaria, hipotensión o hipertensión, bradicardia o taquicardia, cefaleas, fiebre, shock anafiláctico, entre otros. A las 24 horas de la administración pueden presentarse artralgias, mialgias, urticaria, erupciones, fiebre o cefaleas(21). Los efectos adversos asociados a la azatioprina son fiebre, artralgia, erupción cutánea, malestar general, náuseas, pancreatitis aguda, leucopenia, trombocitopenia, anemia, infecciones y algunos casos hepatitis o tumores(22). En el presente estudio no se registraron efectos adversos. Ello argumenta en favor de la seguridad de los esquemas medicamentosos utilizados. Sin embargo, su presentación puede ocurrir en muestras mayores.
Es necesaria una comparación de una evaluación formal de la calidad de vida antes y después del inicio de la terapia biológica para conclusiones más robustas. También es deseable ampliar la muestra y el seguimiento a mayor plazo para evidenciar las diferencias entre ambos tratamientos.
En conclusión, la respuesta clínica, endoscópica, bioquímica e histológica en pacientes que refractarios al tratamiento convencional fue satisfactoria. Ninguno de ellos ha presentado eventos adversos, ni se han hospitalizado pacientes hasta el momento.











 texto en
texto en