INTRODUCCIÓN
El cáncer de mama sigue siendo la neoplasia maligna más frecuente y una de las más mortales en mujeres (teniendo el cuarto lugar), generando una carga de enfermedad insostenible alrededor del mundo, considerándose un importante objetivo de la salud global y prioridad en salud pública1,2. En el año 2020, se diagnosticaron 2,3 millones de casos nuevos, y hubo aproximadamente 690 mil muertes1-4. Se estima que para el año 2040, la incidencia sea cercana a los 3 millones de casos nuevos y 1 millón de muertes anual, debido al crecimiento y envejecimiento de la población1. A pesar de este sombrío panorama, las nuevas terapias antineoplásicas, proveen de herramientas que pueden modificar favorablemente la tasa de supervivencia5. No obstante, otras condiciones asociadas a la supervivencia y recuperación de estas mujeres, pueden emerger y ser objetivo tanto de atención primaria como especializada, como, por ejemplo, la recurrencia del cáncer a mediano o largo plazo4,5.
En la menopausia, suele aparecer el síndrome genitourinario menopaúsico (SGM), secundario a la disminución de la producción de estrógenos, causando síntomas vulvovaginales y vesicouretrales6. Estos síntomas son progresivos y se acentúan de acuerdo al pico de hipoestrogenismo, afectando considerablemente la calidad de vida de la mujer que lo padece. La terapia hormonal (TH), puede ser utilizada para el manejo de esta condición, mejorando sustancialmente la sintomatología, e incluso, siendo en algunos casos la única solución7,8. Esta puede ser tanto vaginal (THV) como sistémica (THS), siendo de uso más frecuente la primera7. Sin embargo, en aquellos casos de mujeres con antecedente de cáncer de mama positivo para receptor de estrógenos, evidencia sugiere que existe un incremento de riesgo de recurrencia, sin conocer exactamente si es prudente o no utilizarla, ni si es viable o no utilizarlo durante el proceso de adyuvancia o neoadyuvancia7-9. Teniendo en cuenta la incidencia elevada de cáncer de mama, cada vez en edades más tempranas, así como de la sintomatología frecuente del SGM moderado a severo, adicional a las iniciativas de disponer de evidencia científica que facilite la comprensión del proceso salud-enfermedad en cáncer de mama, y promueve la practica clínica basada en evidencia10,11, es necesario conocer qué ha concluido la evidencia más reciente y de mejor calidad. Con base en lo anterior, el objetivo de esta revisión consiste en analizar la evidencia actual en cuanto al riesgo de recurrencia de cáncer de mama en mujeres con requerimiento de THV.
MÉTODO
Se realizó una búsqueda bibliográfica utilizando los términos "Terapia de estrógenos vaginales", "Recurrencia" y "Cáncer de mama", junto con sus sinónimos, en las bases de datos PubMed, ScienceDirect y MEDLINE. Para seleccionar los artículos, se establecieron criterios de inclusión, dando prioridad a estudios originales, revisiones sistemáticas y metaanálisis que se enfocaran en evaluar el riesgo de recurrencia de cáncer de mama en mujeres que recibieron terapia hormonal vaginal. Los artículos debían estar disponibles en texto completo.
Se incluyeron artículos publicados hasta el año 2023, y también se incluyeron aquellos que describían factores de riesgo asociados a la recurrencia del cáncer de mama en mujeres, así como las manifestaciones posteriores a la adyuvancia o neoadyuvancia en estos casos. No se definieron criterios de exclusión. Las medidas de efecto se expresaron en sus medidas originales, como frecuencias, porcentajes, intervalos de confianza (IC), diferencia de medias (DM), diferencia de riesgo (DR), riesgo relativo (RR) uoddsratio (OR).
RESULTADOS
Factores asociados al riesgo de recurrencia del cáncer de mama en mujeres
De forma general, existen varios factores asociados a la recurrencia del cáncer de mama, ya sea de forma positiva o negativa. Asociado a terapias, una de las cuales suelen ser de uso frecuente en la práctica médica, son las estatinas. Harborg et al12llevaron a cabo un estudio de cohorte donde evaluaron la asociación entre el uso de estatinas y el riesgo de recurrencia de cáncer de mama, en 14.773 mujeres daneses postmenopáusicas tratadas con inhibidores de la aromatasa por cáncer de mama diagnosticado en estadíos tempranos. Durante un periodo de 5 años de seguimiento, los autores encontraron una incidencia de 32 casos por 3163 personas/año de seguimiento entre pacientes expuestas a estatinas, y 612 casos por 45.655 personas/año de seguimiento entre pacientes no expuestos, dando una tasa de incidencia (por 1000 personas/año) de 10,12 (IC 95%: 6,92 - 14,28) vs. 13,40 (IC 95%: 12,36 - 14,51), respectivamente. Luego de un análisis multivariado, encontraron que el uso de cualquier estatina se asoció con una reducción del riesgo de recurrencia a 5 años, de hasta un 28% (HR 0,72; IC 95%: 0,50 - 1,04). Así, encontraron que aquellas mujeres tratadas con inhibidores de la aromatasa por cáncer de mama, y que usaron estatinas, tuvieron menor riesgo de recurrencia a mediano plazo12. Ahern et al12, realizaron un estudio de cohorte prospectivo utilizando la misma base danés, encontrando que, en 18,769 mujeres seguidas durante una mediana de tiempo de 6,9 años, el uso de simvastatina (estatina lipofílica) se asoció con 10 recurrencias menos por cada 100 mujeres posterior a 10 años de seguimiento (DR -0,10; IC 95%: -0,11 a −0,08), comparado a aquellas que no recibieron estatinas. El uso de estatinas hidrofílica, se asoció aproximadamente con el mismo riesgo de no usar estatinas (DR 0,05; IC 95%: -0,01 a 0,11). De esta forma, se concluyó que, simvastatina, una estatina altamente lipofílica, se asoció con una reducción del riesgo de recurrencia de cáncer de mama, en mujeres con antecedente de carcinoma estadíos de I a III13.
Disponer de esta evidencia es fundamental, toda vez que algunos autores manifiestan que el riesgo de recurrencia de cáncer de mama permanece hasta 32 años posterior a la remisión14. Asociado a las características de la neoplasia, el diagnóstico antes de los 40 años, tumores positivos para receptor de estrógenos, tratamiento con cirugía conservadora, 4 o más ganglios linfáticos afectados, un tumor primario que mida 40 mm o más, entre otras variables; son potenciales predictores positivos para recurrencia14. Lafourcade et al15, a través de un estudio de cohorte iniciado en los años 90 en Francia, con una mediana de seguimiento de 7,2 años a 4926 mujeres, se presentaron 1334 casos de recurrencia y 469 muertes. En esta ocasión, se encontró que los tumores de gran tamaño (HR 1,64; IC 95%: 1,33 - 2,01 vs. HR 4,70; IC 95%: 2,27 - 9,75), de alto grado (HR 1,90; IC 95%: 1,36 - 2,66 vs. HR 6,54; IC 95%: 2,02 - 21,18), con afección de ganglios axilares (HR 1,54; IC 95%: 1,26 - 1,86 vs. HR 5,23; IC 95%: 2,63 - 10,42), y tumores negativos para receptores de estrógenos o progestágenos (HR 2,14; IC 95%: 1,70 - 2,70 vs. HR 9,76; IC 95%: 4,39 - 21,75), tuvieron mayor riesgo de recurrencia y muerte, respectivamente. Fumar posterior al diagnóstico, se asoció específicamente con mayor riesgo de recurrencia, comparado a nunca haber fumado (HR 1,55; IC 95%: 1,16 - 2,07)15. Con estos resultados, los autores manifestaron la necesidad de reconocer y diseñar programas de seguimiento y educación estrictos para la reducción del riesgo de recurrencia, considerando que algunos aspectos relacionados al estilo de vida, podrían impactar significativamente sobre este riesgo.
Los fitoestrógenos, son compuestos químicos con la capacidad de mimetizar la acción de estrógenos endógenos. Los principales fitoestrógenos son las isoflavonas, comunes en la dieta asiática (donde casualmente, la incidencia de cáncer de mama es menor en comparación a otras regiones del mundo), donde hay un elevado consumo de soya. Algunos autores han asociado el consumo de estos fitoestrógenos a través del consumo de soya, con reducción del riesgo de recurrencia y/o mortalidad en cáncer de mama. Pero, ¿qué dice la evidencia? Una revisión sistemática muy reciente16, encontró que, de 7 estudios incluidos con más de 18.500 mujeres, solo uno no encontró beneficios generales en cuanto al consumo de soya y recurrencia de este tipo de cáncer. No obstante, aquellos estudios que, si encontraron asociaciones, demostraron que estas eran heterogéneas. Dos estudios encontraron reducción del riesgo de recurrencia solo en mujeres postmenopáusicas, cuatro estudios encontraron reducción del riesgo de recurrencia y muerte en mujeres con tumores sensible a hormonas o que recibieron terapia hormonal. Cabe destacar, que no se encontraron efectos adversos en cuanto al consumo de soya, y los eventos de recurrencia o mortalidad. Entonces, aunque de forma inespecífica, el consumo de soya (fitoestrógenos) podría tener beneficios sobre el pronóstico de la recurrencia y muerte de cáncer de mama.16Otros estudios innovadores, han descrito que la suspensión de la terapia endocrina17, el índice de masa corporal18, y otros más factores, se correlacionan también positivamente con la recurrencia hasta 20 años después del diagnóstico17,18. Considerando lo anterior, se debe tener en cuenta también otras exposiciones que se asocian con este pronóstico, y sobre los cuales se debe trabajar para reducir el riesgo de recurrencia y mortalidad, en la mujer con antecedente de cáncer de mama (Figura 1).
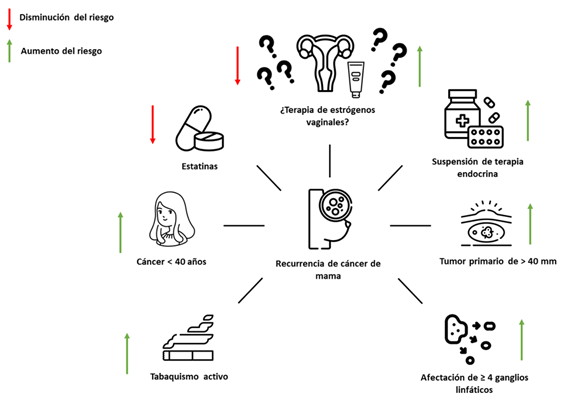
Figura 1. Resumen de algunos factores asociados positiva o negativamente con recurrencia de cáncer de mama. Fuente: autores.(12,13,14,15,17)
Manifestaciones posteriores a la terapia antineoplásica en la mujer con antecedente de cáncer de mama
Teniendo en cuenta que el pico de incidencia de diagnóstico de cáncer de mama oscila entre la quinta y sexta década de la vida, son muy frecuentes las manifestaciones peri y postmenopáusicas, a las cuales se le añaden los síntomas posteriores a quimioterapia. Este cuadro mixto tiende a ser más agresivo, puede durar hasta 15 años después del tratamiento, se presenta hasta en el 72% de los casos, y puede afectar en mayor medida la morbilidad, supervivencia, capacidad funcional y calidad de vida de la mujer. Algunos estudios revelan que las mujeres con este antecedente, tienen mayor número de síntomas y estos varían de acuerdo a la edad, tipo de quimioterapia recibida, antecedentes patológicos, consumo de medicamentos para comorbilidades no relacionados a la malignidad, etc. Dentro de las manifestaciones o diagnósticos más comúnmente reportados, están la tos, infecciones respiratorias, cutáneas y urinarias, fatiga, pobre calidad del sueño, linfedema (HR 8,6; IC 95%: 6,3 - 11,6), dolor torácico, osteopenia (HR 2,1; IC 95%: 1,8 - 2,4) y osteoporosis (HR 1,5; IC 95%: 1,2 - 1,9)19-21. En la esfera emocional, en comparación a grupos controles, las mujeres con antecedente de cáncer de mama tienen mayor riesgo de obtener menor puntaje escalas de calidad de vida mental y física, así como de síntomas depresivos (p = 0,03) y ansiosos (p <0,001)22.
Por todo lo anterior, se ha hecho énfasis en las necesidades del cuidado de soporte, para el manejo adecuado y oportuno de estas condiciones. La recurrencia en general (59,1%), acceso al mejor cuidado médico (52,7%), acceso a servicio de terapia complementaria (51,5%), cambios en las creencias (48,2%) y expectativas sobre la supervivencia (47,6%), son algunas de las preocupaciones que se asocian con manifestaciones en supervivientes con cáncer de mama. Estas se correlacionan con la edad de la paciente, tiempo desde el diagnóstico y la calidad de vida que tenga (p <0,01)23,24. El cuidado integral, también incluye tamizaje para condiciones cardiometabólicas, asociadas a la quimiotoxicidad. Hamood et al25llevaron a cabo un estudio de casos y controles con 2246 mujeres supervivientes de cáncer de mama, encontrando que haber utilizado terapia hormonal (HR 2,40; IC 95%: 1,26 - 4,55), tamoxifeno (HR 2,25; IC 95%: 1,19 - 4,26) e inhibidores de la aromatasa (HR 4,27; IC 95%: 1,42 - 12,84), se asoció con mayor riesgo de desarrollar diabetes en un promedio de tiempo de 6 años25. En la evaluación del riesgo metabólico y de eventos cardiovasculares en mujeres con cáncer de mama y bajo tratamiento con inhibidores de la aromatasa, se ha descrito que este grupo de fármacos elevan la probabilidad de sufrir algún evento cardiovascular (OR 1,16; IC 95%: 1,04 - 1,30), comparado con tamoxifeno26. Y aunque también se ha descrito una posible asociación entre el uso de estos dos agentes y demencia en supervivientes, algunos meta-análisis han confirmado que la evidencia disponible no es suficiente para establecer un estimado preciso (HR 1,04; IC 95%: 0,83 - 1,03)27. Este panorama, demuestra que las mujeres con antecedente de cáncer de mama, que eventualmente se les administró terapia neoadyuvante, tienen un abanico mucho más amplio de manifestaciones y síndromes (principalmente postmenopausia), comparado con grupos controles. Entonces, el tratamiento oportuno y personalizado, es esencial para mantener o mejorar la calidad de vida de estas mujeres28.
Estrógenos vaginales y otras terapias para el manejo de síndrome genitourinario menopaúsico moderado a severo en mujeres con antecedente de cáncer de mama: ¿cuál es mejor?
El SGM moderado a severo en mujeres con antecedente de cáncer de mama, probablemente sea de los cuadros clínicos más significativos, al afectar dos sistemas, el reproductivo y urinario29. La sintomatología y predisposición a infecciones del tracto urinario, y la limitación de la actividad sexual por dispareunia, resequedad, entre otras manifestaciones, deben ser manejadas para evitar la alteración de otras esferas29. Como ya se mencionó, los estrógenos vaginales son una terapia útil, pero que puede tener eventos adversos en estos casos en particular. ¿Qué dice la evidencia al respecto de su seguridad y eficacia en este grupo de riesgo?
Hace más de 5 años, una serie de casos con seguimiento a 18 años, evidenció que aquellas mujeres supervivientes de cáncer de mama y que usaron THV, no mostraron alteraciones en la densidad mamaria al ser evaluadas periódicamente por mamografía30. En su momento, se estableció entonces que el uso de dosis baja de THV podía ser seguro30,31. Lo anterior, soportado por las recomendaciones del consenso de la “North American Menopause Society and The International Society for the Study of Women's Sexual Health”, quienes, por medio de un panel de 16 expertos internacionales, manifestaron que la THV debía utilizarse como segunda línea, en el manejo del SGM32.
Sin embargo, hay que tener en cuenta otras terapias disponibles y sopesar el balance beneficio-riesgo, comparada con la THV. Jha et al33realizaron una revisión sistemática y meta-análisis, donde evaluaron el impacto de la terapia de laser vaginal para SGM en supervivientes de cáncer de mama. Se incluyeron 10 estudios con un total de 354 mujeres, evidenciando que esta terapia fue efectiva en el tratamiento del SGM, mejorando el índice de salud sexual vaginal [Vaginal Health Index] (DM -11,35; IC 95%: -13,35 a -12,05), y el puntaje obtenido de la escala visual análoga para dispareunia (DM 2,22; IC 95%: 1,98 - 2,46) y resequedad vaginal (DM 2,72; IC 95%: 2,50 - 2,93), así como función sexual y satisfacción general de los resultados a corto plazo (83,5%), sin eventos adversos relevantes.33Quick et al34ejecutaron un estudio ensayo con 64 mujeres, para evaluar la viabilidad y eficacia preliminar de la terapia de CO2 fraccionado en el SGM en mujeres supervivientes de cáncer de mama. Las pacientes recibieron 3 ciclos de intervención cada mes, y luego se hizo seguimiento hasta el cuarto mes. Se encontró que el 88,1% de las participantes no presentó eventos adversos serios, y que hubo una reducción considerable en la escala de evaluación vaginal [Vaginal Assessment Scale] (DM -0,99; IC 95%: -1,19 a -0,79), el índice de función sexual femenino [Female Sexual Function Index] (DM 9,67; IC 95%: 7,27 - 12,1), y el índice de distrés urinario [Urinary Distress Index] (DM -8,85; IC 95%: -12,75 a -4,75). Cabe resaltar, que, de forma representativa, estas mujeres tuvieron canceres positivos para hormonas (63%), fueron estadio I o II (86%), recibieron terapia endocrina (92%) y fueron manejadas con inhibidores de la aromatasa (68%). Entonces, lograron demostrar que la terapia laser de CO2 fraccionado es viable y reduce la sintomatología a corto plazo, siendo una potencia herramienta a considerar en el manejo del SGM en mujeres con estas características del cancer.34
Otras terapias no hormonales, consisten en geles, lubricantes e hidratantes vaginales, los cuales alivian temporalmente la sintomatología, pero con resultados poco significativos.35,36Por su parte, la terapia hormonal sistémica, demostró hace aproximadamente 20 años (HABITS study), el incremento significativo del riesgo de recurrencia de cáncer de mama (HR 3,5; IC 95%: 1,5 - 8,1), principalmente en mujeres con cáncer positivo para hormonas. Lo cual, en su momento generó controversia y ocasionó la difusión de una recomendación sobre la suspensión de este tipo de tratamiento en mujeres con antecedente de cáncer de mama.35Sin embargo, años después, un ensayo (Stockholm trial) encontró que, durante un seguimiento de aproximadamente 4 años, no hubo asociación entre este tipo de terapia y riesgo de recurrencia (HR 0,82; IC 95%: 0,35 - 1,9). No obstante, existió una heterogeneidad significativa entre los grupos analizados. Por lo que los investigadores hicieron énfasis en que sí podía existir el riesgo en el uso de THV.35
Los estrógenos vaginales, se administran a nivel vaginal por medio de tabletas, cremas u otras presentaciones, a dosis baja con acción a nivel local, y una muy mínima absorción sistémica.36Aunque se presume que el riesgo inherente de recurrencia por la elevada exposición es con el uso de terapia hormonal sistémica, también hay evidencia que sugiere que la THV puede influir positivamente sobre este riesgo. Pero, ¿en qué subgrupos? Muy recientemente, Cold et al9publicaron los resultados de un estudio de cohorte en mujeres danesas, con el objetivo de evaluar el riesgo de recurrencia de cáncer de mama, en mujeres con uso de THV vs. terapia hormonal sistémica. Se incluyeron 8461 mujeres con antecedente de cáncer no metastásico positivo para receptor de estrógeno de estadio temprano, que nunca habían utilizado algunas de estas terapias previo al diagnóstico. Posterior al diagnóstico, 1957 utilizaron THV y 133 terapia hormonal sistémica, evidenciando que, durante un periodo de seguimiento de aproximadamente 10 años para recurrencia y 15 años para mortalidad, el riesgo relativo ajustado de recurrencia con el uso de THV fue de 1,08 (IC 95%: 0,89 - 1,32) vs. 1,05 (IC 95%: 0,62 - 1,78) para terapia hormonal sistemática. Sin embargo, al hacer un análisis por subgrupos, se encontró que el único estimado significativo para recurrencia, fue para aquellas mujeres que fueron tratadas con inhibidores de la aromatasa (RR 1,39; IC 95%: 1,04 - 1,85). El estimado de mortalidad general para THV fue de 0,78 (IC 95%: 0,71 - 0,87) vs. 0,94 para terapia sistémica (IC 95%: 0,70 - 1,26).9Así, se pudo concluir, con base a la evidencia más reciente y de mejor calidad, que el riesgo de recurrencia en el uso de THV solo es significativo en aquellas mujeres con antecedente de cáncer de mama con las características tumorales descritas previamente, y tratadas con inhibidores de la aromatasa.
Este resultado, es compatible con recomendaciones realizadas por comités de trabajo delAmerican College of Obstetricians and Gynecologists37, y revisiones publicadas por expertos, quienes también mencionan otros factores a considerar, en la administración de este tipo de terapias en mujeres con antecedente de cáncer de mama (Tabla 1).38
Tabla 1. Factores a considerar a la hora de prescribir terapia hormonal vaginal en mujeres con antecedente de cáncer de mama.(37)
| Variable | A favor | En contra |
| Estadio del tumor | Hasta estadio II - metastásico con pobre expectativa de vida | A partir de estadio III - metastásico con prolongada expectativa de vida |
| Grado de enfermedad | Bajo - intermedio | Alto |
| Afección de ganglio linfático | No - < 4 | Si - > 4 |
| Cáncer sensible a hormonas | Negativo | Positivo |
| Terapia endocrina | Tamoxifeno | Inhibidores de la aromatasa |
| Tiempo desde el diagnóstico | Significativo | Reciente |
| Severidad de síntomas | Severa | Leve - Moderada |
| Uso de terapias no hormonales previas | Fallo terapéutico | No usados - Alta tasa de efectividad |
| Efecto sobre la calidad de vida | Significativa | No significativa |
| Identificación de factores de riesgo adicionales modificables | Alta probabilidad de eliminarlos | Baja probabilidad de eliminarlos |
| Identificación de factores de riesgo adicionales no modificables | Relativo | Relativo |
Fuente: Autores.
Pero, es necesario mencionar que la evidencia disponible sobre este tópico, proviene casi en su totalidad de países desarrollados, desconociéndose el comportamiento de esta condición en países como los latinoamericanos, donde las características genéticas y epigenéticas difieren significativamente comparadas con las de otras regiones del mundo. Entonces, basados en el elevado riesgo general del desarrollo de cáncer por la dieta occidental, estilo de vida poco saludable, etnia/raza y dificultades en el acceso oportuno a programas de tamizaje y control para el cáncer de mama, se presume que en nuestra región este riesgo sea mayor al descrito en la literatura mundial.
Perspectivas futuras
Tomando como referencia las metas estipuladas por consensos internacionales sobre el control del cáncer en países de bajos y medianos ingresos39, como los latinoamericanos, así como la carga fantasma que genera el cáncer de mama en nuestra región y la brecha existente en la evidencia sobre este topico40,41, se deben diseñar estudios adaptados al contexto sociodemográfico, cultural, económico, y de salud,42que estimen el riesgo de recurrencia y mortalidad, así como eficacia y seguridad a estas terapias, y percepción de las mujeres sobre los resultados y su respectiva calidad de vida, para constatar que se da solución al SGM con una terapia que se presume que es altamente eficaz, sin modificar desfavorablemente el riesgo de recurrencia de cáncer de mama en mujeres. Todo lo anterior, para reproducir el modelo de investigación basada en la evidencia43, producir investigación valida y valiosa, que pueda impactar sustancialmente en los desenlaces en salud del cáncer de mama, y que facilite el proceso de educación en salud en las mujeres postmenopáusicas,44para que ellas sean participes de su proceso del cuidado de la salud y puedan vivir plenamente.
Como limitaciones, mencionar que esta es una revisión narrativa, la cual realiza un análisis solamente cualitativo de la evidencia disponible, constituyendo evidencia insuficiente para soportar una recomendación o intervención en la práctica asistencial, la cual debe basarse en evidencia de mayor calidad.
CONCLUSIONES
Basados en la evidencia más reciente, de forma global, la terapia de estrógenos vaginales es una opción terapéutica eficaz y segura en el manejo del síndrome genitourinario menopaúsico en mujeres con antecedente de cáncer de mama, sin incrementar el riesgo de recurrencia, a excepción de aquellas tratadas con inhibidores de la aromatasa, en quienes se sugiere el uso de otras terapias para evitar acarrear este riesgo. Sin embargo, se desconoce con claridad este fenómeno en mujeres latinas, por lo que se deben ejecutar estudios que considere las variables propias de esta población, que puedan influir en la evolución y/o desenlaces del uso de esta terapia.











 texto en
texto en 


