INTRODUCCIÓN
El cáncer de riñón representa entre el 3.8% de todos los cánceres nuevos, con una mediana de edad al diagnóstico de 64 años. Según el Global Cancer Observatory 2020 (GLOBOCAN), a nivel mundial se tiene una incidencia de 431 828 nuevos casos, y una mortalidad de 1 790 368 casos. Asimismo, en Perú, según GLOBOCAN 2020 es la neoplasia número 11 en frecuencia (con una prevalencia estimada de 4466 casos), con una incidencia de 1924 nuevos casos y una mortalidad de 770 casos, así como una tasa de incidencia estandarizada por edad y sexo de 5.7 por 100 000 habitantes 1. A nivel local, según el Registro de Cáncer de Lima Metropolitana (2010 - 2012), el cáncer renal ocupa el décimo segundo lugar en incidencia (930 nuevos casos en varones y 491 en mujeres, respectivamente) 2. Según estadística del Departamento de Epidemiología y Estadística del Cáncer del Instituto Nacional de Enfermedades Neoplásicas (INEN), se ha reportado un total de 3663 casos nuevos de cáncer renal en los años 2000 - 2017 3.
El cáncer de riñón comprende varios subtipos histológicos con distinta genética y comportamientos clínicos; el más común es el cáncer de células claras (70%), el papilar (PRCC) (10 a 15%) y el cromófobo (5%). El resto corresponde a otras histologías. El carcinoma medular renal es raro (menos del 0.5%) y muy agresivo 4,5. Los factores pronósticos son el estadio clínico 6,7, grado histológico, extensión local del tumor, enfermedad ganglionar, y evidencia de enfermedad metastásica al diagnóstico 8,10. La sospecha inicia con el hallazgo de una masa renal por ecografía o por tomografía. Muchas veces el hallazgo es incidental. Los hallazgos clínicos de hematuria, masa y dolor en flanco (triada clásica) son cada vez menos frecuentes. Además, algunos síntomas sistémicos por enfermedad metastásica pueden presentarse como adenopatías, dolor óseo, pérdida de peso, entre otros 11,12. El tratamiento del cáncer renal es multidisciplinario, y su elección dependerá del estadío de la enfermedad, el tipo histológico, los factores inherentes al paciente y en el caso de la enfermedad metastásica de la clasificación de riesgo del cáncer renal metastásico.
El cáncer riñón sigue siendo una enfermedad cuya resolución definitiva es eminentemente quirúrgica y aunque actualmente se disponen de tratamientos modernos como agentes de terapias blanco inhibidoras de tirosinkinasa (TKIs), anticuerpos anti-VEGF, inhibidores mTOR, hasta la inmunoterapia (inhibidores de checkpoint PD-L1 y/o anti-CTLA-4), estos pueden dar respuestas clínicas durables, pero no podrán curar sin una completa extirpación quirúrgica 13. Los inhibidores de los puntos de control inmunitario, antiantígeno 4 del linfocito T citotóxico (CTLA-4) y, en especial, antirreceptor de muerte celular programada-1 (PD-1) o su ligando (PD-L1) son biomarcadores predictivos de respuesta clínica que permitan la correcta selección de los pacientes 14. La inmunoterapia en cáncer renal tiene como objetivo controlar las características de las células neoplásicas, mutaciones driver, el microambiente tumoral y la respuesta inmunitaria del huésped 15,16. La entidad oncológica del cáncer renal metastásico se aborda con un tratamiento basado en anti monoclonales con una perspectiva en la inmunoterapia combinada con respuesta clínica.
CASO CLÍNICO
Paciente varón de 54 años de ocupación oficial del Ejercito del Perú del grado de coronel en actividad. Procedente de la ciudad de Lima sin antecedentes personales de importancia. Antecedentes Familiares: Padre fallecido de fibrosis pulmonar. No presenta familiares de primer grado con cáncer.
Paciente cursa con historia de tos intermitente de aproximadamente 1 año de evolución, que empeoró en el último mes, asociado a astenia progresiva. Se evidenció anemia en otra institución (Hb: 10.2 g/dL) por lo que fue evaluado por el Servicio de Hematología del Hospital Militar Central en septiembre del 2018. Al debut con puntuaje de 01 en la Escala de actividad según el Eastern Cooperative Oncology Group (ECOG).
En sus exámenes de laboratorio se aprecia Hemoglobina: 8.4 g/dL, Leucocitos: 13500 /mm3, Neutrófilos: 10665, Ab: 0%, Plaquetas: 714000 /mm3, Ferritina: 1039 ng/mL., Glucosa: 91 mg/dL, Urea: 24 mg/dL, Creatinina: 0.84 mg/dL, Proteínas: 8.0 g/dL, Albúmina: 3.6 g/dL, Calcio: 8.5 mg/dL, DHL: 215 U/L.
En la Tomografía Espiral Multicorte (TEM) de Tórax sin contraste (28/08/19) se observa en lóbulo superior izquierdo (LSI) un nódulo pulmonar de bordes lobulados, de 27 x 17 mm, por probable secundarismo. Incidentalmente se aprecia parcialmente tumoración renal derecha. Posteriormente, se realiza TEM TAP con contraste (27/09/2018) donde se evidencia masa renal derecha a nivel de polo superior de 93 x 87 mm con mala interfase con borde subhepático adyacente y con la vena cava, con captación patológica del contraste (Figura 01). Resto (-) neoplasia, TEM Cerebro: (-) neoplasia.
Se realiza abordaje quirúrgico Nefrectomía Laparoscópica Derecha (25/10/2018) siendo el resultado del estudio anatomo-patológico un Carcinoma Renal de Células Claras. Tamaño tumoral: 8.2 x 7 cm. Grado nuclear (Fuhrman): Grado 3, patrón de crecimiento: Sólido y trabecular, Invasión: Limitada al riñón. Invasión linfovascular, perineural: (-) Invasión capsular: (-) Grasa perirrenal: (-) Vena renal: (-) Pelvis renal y uréter: (-). Se programa metastasectomía mediante el manejo quirúrgico por Resección de Nódulo Pulmonar izquierdo (19/11/2018) donde a la Macroscopía: Se recibe fragmento de tejido de 6 x 2.7 x 1.5 cm, con nódulo blanquecino de 1.5 x 1.3 cm y a la Microscopía: Carcinoma de células claras metastásico en pulmón con embolia vascular tumoral. Borde quirúrgico comprometido con la neoplasia.
La evaluación post - quirúrgica por el servicio de Oncohematologia del Hospital Militar central, presentó los siguientes resultados de laboratorio (04/12/2018): Hemoglobina: 12.2 g/dL, Leucocitos: 7100 /mm3 Neutrófilos: 4690 Ab: 0% Plaquetas: 400000 Urea: 38 mg/dL Creatinina: 1.24 mg/dL DC: 95.3 mL/min Calcio: 9.7 mg/dL Proteínas: 7.0 g/dL Albúmina: 4.2 g/dL.
Los estudios por imágenes postquirúrgicos TEM - TAP c/c de Tórax (07/12/2019): Mostraron cambios post quirúrgicos en segmento anterior de lóbulo superior izquierdo con imagen pseudonodular de bordes irregulares de 42 x 21 mm que capta medio de contraste en la periferia, sugiere seguimiento estrecho. Abdomen: Ausencia de riñón derecho + pequeña colección subcapsular hepática y a nivel de lecho quirúrgico renal (Figura 02).

Figura 2. TEM TAP c/c postquirúrgico: imagen pseudonodular, bordes irregulares de 42 x 21 mm. Fuente: historia clínica.
Se realizo PET/CT post Quirúrgico (02/01/2019) donde presento en lecho quirúrgico se observa lesión sólida pseudonodular de bordes mal definidos de 3.7 x 2.2 cm, con incremento del metabolismo con SUV máx de 3.1 que persiste en control tardío con SUV máx de 3.7, asociado a dos nódulos subcentimétricos inespecíficos por su pequeño tamaño; hallazgos altamente sospechosos de enfermedad neoformativa activa (Figura 03). Al presentar esta evidencia se cataloga como Cáncer renal de células claras metastásico pulmonar de riesgo intermedio/pobre más Enfermedad residual post metastasectomía pulmonar.
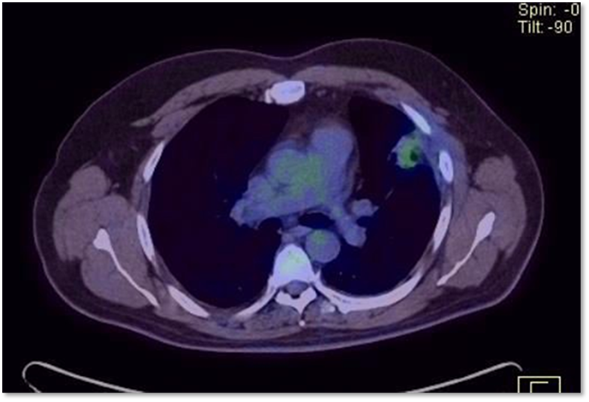
Figura 3. PET/CT post quirúrgico: lesión sólida pseudonodular de bordes mal definidos altamente sospechosos de enfermedad neo formativa activa fuente: historia clínica.
Se inicia tratamiento sistemico según guía clínica NCCN 2019 bajo el esquema basado en inmunoterapia Nivolumab + Ipilimumab (anti monoclonales). En la 1ª Reevaluación de Enfermedad (08/04/19). Post 4 ciclos de Nivolumab + Ipilimumab. El estudio por imágenes TEM Tórax c/c: Banda parenquimatosa fibrótica en lóbulo superior izquierdo con leve engrosamiento pleural, compatible con secuela inflamatoria. TEM Abdomen c/c: Secuela de Nefrectomía Derecha.
Presento los siguientes resultados de transaminasas donde se evidencia un incremento hasta un grado 2 y 3 generando toxicidad con el riesgo de interrumpir el tratamiento con inmunoterapia (Tabla 01).
Tabla 1: Resultados de transaminasas basal y postratamiento
| Basal | Post 1° IPI + NIVO | Post 2° IPI + NIVO | Post 3° IPI + NIVO | Post 4° IPI + NIVO | |
| TGO (UI/L) | 21.0 | 17.0 | 15.5 | 37.1 | 163 (g°2) |
| TGP (UI/L) | 18.2 | 12.8 | 11.3 | 44.1 (g°1) | 337.7 (g°3) |
Fuente: elaboración propia
Debido a la toxicidad en 2ª Reevaluación de Enfermedad (01/08/19) Post 6 ciclos de Nivolumab monoterapia. Los estudios de imágenes fueron negativos para neoplasia. TEM Tórax c/c: Tractos fibrosos en lóbulo superior izquierdo de aspecto residual. TEM Abdomen c/c: Riñón derecho ausente. Resto (-) Neoplasia. (Figura 04)
Continuo su tratamiento hasta completar los 2 años según lo establecido por la guía clínica americana NCCN donde no presenta evidencia de enfermedad y actualmente sigue en controles sin evidencia de enfermedad.
DISCUSIÓN
Para la decisión terapéutica de este caso se realizó la observación y control tomográfico en 3 meses en primer lugar se continuo con la evaluación de un estudio PET/CT al evidenciar secundarismo se procedió a realizar una nueva cirugía torácica re-resección y por último se inició tratamiento sistémico para enfermedad metastásica. El manejo de la enfermedad oligometastásica en cáncer de riñón debe ser personalizado y multidisciplinario. Los diferentes tratamientos como la terapia sistémica, cirugía y la radiocirugía estereotáctica corporal (SBRT) son opciones diversas para el manejo de esta neoplasia.
Los pacientes con enfermedad oligometastásica presentan un número pequeño de lesiones con cinética de crecimiento lento, la observación activa es una opción razonable, pero la enfermedad oligometastásica. La nefrectomía citoreductora asociado con inmunoterapia es principalmente retrospectiva y derivada de grandes bases de datos institucionales, se destaca que la selección de pacientes es crucial. La nefrectomía citoreductora debe reservarse para pacientes con no más de un factor de riesgo, aquellos que requieran paliación de síntomas locales, y para aquellos con enfermedad de bajo volumen estable o con respuesta completa tras la exposición a la terapia sistémica.
Se tuvieron consideraciones respecto al PET/CT en cáncer renal su empleo no tiene recomendación formal en guías internacionales. No cuenta con un rol en la evaluación de masa renal primaria (sensibilidad menor de 60%). Un resultado negativo no descarta malignidad. Excepción en Carcinoma papilar o neoplasias sarcomatoides. Para evaluación de enfermedad metastásica, CT, MRI, GGO, son estudios estándares.
Ocasionalmente, cuando existe una lesión sospechosa aislada, PET puede confirmar el diagnóstico de enfermedad metastásica. Rodríguez Martínez de Llano et al, observó que, en 58 pacientes el 43% el PET/CT modificó el manejo del paciente con RCC metastásico 17. Algunos estudios han evaluado el rol del PET y la variación del SUVmáx en la respuesta a TKI. El tratamiento se basó en International Metastatic Renal Cell Carcinoma Database Consortium criteria donde se catalogo con riesgo favorable. Para la mayoría de los pacientes con carcinoma de células renales de células claras (RCC) avanzado, la terapia sistémica generalmente se inicia de inmediato cuando hay enfermedad irresecable, ya sea metastásica o localmente avanzada.
La decisión de iniciar el tratamiento sistémico y la selección de los agentes depende de los síntomas relacionados con la enfermedad, las comorbilidades del paciente y la estratificación del riesgo tumoral. Nivolumab más ipilimumab está aprobado por la Administración de Drogas y Alimentos de los EE. UU. (FDA) para pacientes sin tratamiento previo con CCR avanzado de riesgo intermedio o alto. Las tasas de respuesta con terapias sistémicas de inmunoterapia combinada han evidenciado un cambio gradual hacia la terapia sistémica inicial y la consideración de nefrectomías citoreductoras en las fases tempranas y tardías en los pacientes que responden. En este caso lo usamos con enfermedad de riesgo favorable donde presento toxicidad por aumento de las transaminasas. Continuando el tratamiento hasta completar los dos años de tratamiento con agente único Nivolumab. Paciente actualmente sin evidencia de enfermedad oncológica con adecuado estatus performance (ECOG: 0).











 texto en
texto en 




