INTRODUCCIÓN
Los hongos comestibles son aproximadamente 25 especies y son apreciados principalmente por sus propiedades sensoriales, tales como aroma y sabor, además de tener valor nutricional por el porcentaje de proteínas (20-50%) y por los bajos porcentajes de carbohidratos y lípidos (< 1%), pudiendo ser utilizados en dietas con bajo porcentaje calórico siendo considerados también como fuentes de fibras, vitaminas y minerales (1). Pleurotus ostreatus un hongo comestible de alto valor nutricional por los niveles altos de aminoácidos esenciales como arginina, alanina, glutamina y ácido glutámico; carbohidratos como trealosa, manitol, amino azúcares, etc; alto contenido en agua (> 80%); tiene la presencia de proteínas (40%); vitaminas como ácido ascórbico, minerales como sodio, calcio, fósforo, hierro, potasio, manganeso, cobre, zinc y los lípidos como ácido oleico, linoleico, α-linolénico y el ácido palmítico (2). El presente trabajo tiene como objetivo identificar los ácidos grasos y los esteroides mayoritarios presentes en la fracción apolar del hongo P. ostreatus cultivados en residuos de pulpa de café, esta seta ostra fue producida por el Grupo de Investigación en Calidad Ambiental y Bioprocesos (GICAB) en la Facultad de Ingeniería Química y Textil de la Universidad Nacional de Ingeniería. La identificación de los compuestos se realizó por análisis de cromatografía gaseosa acoplada a espectrómetro de masas (CG-EM) y por análisis de sus espectros obtenidos por resonancia magnética nuclear de hidrógeno (RMN de 1H) y de carbono trece (RMN de 13C).
ANTECEDENTES
Pleurotus ostreatus también llamado seta ostra, es un hongo comestible, cultivado en gran escala por su alto valor nutricional en el mundo (3), lacase como antiviral (4), el péptido pleurostrina con actividad antifungal (5), el peróxido del ácido linoleico fue aislado y actuó como un excelente antinemátodos (6), Pleuran (β-glucana) es un agente inmunomodulatoria con potencial para el tratamiento de cancer, ergotioneina, lovastatina y ácido γ-aminobutírico (7). Un estudio del extracto acuoso de P. ostreatus demostró su eficiencia contra Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Streptococcus pyogenes, Shigella dysenteriae, Salmonella entérica, Candida albicans, Clavulina humicola, Trichosporon cutaneum, Aspergillus fumigatus, A. flavus, A. terreus, Diota rostrata, Coryphantha clavata y fue aislado del extracto acuoso el ácido 3-(2-aminofeniltio)-3-hidroxipropanoico (8).
Dentro los metabolitos secundarios presentes en P. ostreatus están los flavonoides miricetina, naringenina, hespiridina, formononetina y biochanina. Dentro de los ácidos fenólicos como ácido p-hidroxibenzoico, ácido sinápico, ferúlico, p-cumárico, protocatecuico, vanílico, cafeico, gálico, homogentísico, gentísico y ácidos clorogénicos (7); esteroides que tienen como esqueleto básico el ergosterol, presentándose con estructuras moleculares hidroxiladas y en algunos casos epidioxi, sea en las posiciones 5(, 8( o 5(,9( (9) ,(10).
3. METODOLOGÍA
3.1 PRODUCCIÓN DE HONGOS OSTRAS PLEUROTUS OSTREATUS CULTIVADO EN RESIDUOS DE CAFÉ
La producción de las setas ostras fue desarrollada en cuatro etapas: (1) inoculación, (2) incubación, (3) fructificación, (4) cosecha (11), como se muestra en la Fig. 1. La inoculación consistió en adicionar la semilla del hongo P. ostreatus en la pulpa de café (previamente pasteurizada con una humedad relativa (HR) de 70%), a razón de 50 g de semilla/kg de pulpa de café, una vez inoculado el residuo de la pulpa de café, se procedió a incubar la muestra a una temperatura (T) de 27 ± 1°C por un período de 20 días; seguidamente, cuando el micelio del hongo se colonizó en la pulpa de café, se procedió a fructificar las muestras a una T = 18 ± 1°C y HR de 90 ± 5% por un período de 15 días, y finalmente, se procedió a cosechar las setas ostras, las cuales se utilizaron para la identificación de los metabolitos mayoritarios.
3.2 EXTRACCIÓN E IDENTIFICACIÓN DE LOS METABOLITOS SECUNDARIOS
La muestra fresca fue pesada y congelada a -70°C antes de ser liofilizada. La seta ostra liofilizada fue pulverizada en mortero y sometido a maceración en metanol por tres veces consecutivas, después de cada maceración, la muestra era filtrada y el filtrado fue secado hasta evaporación total del solvente en la campana, fue de esta manera que se obtuvo el extracto bruto orgánico (EBO) de la seta ostra.
El EBO de la muestra fue sometido a partición líquido-líquido para obtener los residuos clorofórmico (RCHCl3), butanólico (RBuOH) y el residuo acuoso (RH2O) según la literatura (12). El residuo RCHCl3 de la muestra fue sometido a cromatografía en columna usando como fase estacionaria sílica gel fase normal y las fases móviles fueron éter de petróleo (EP), cloroformo (CHCl3) y metanol (MeOH), obteniendo tres fracciones, fracción de éter de petróleo (FEP), fracción clorofórmica (FCHCl3) y fracción metanólica (FMeOH). La FEP del residuo CHCl3 fue sometida a transesterificación para la obtención de los ésteres metílicos de los ácidos grasos según la literatura (13),
para su posterior análisis por cromatografía gaseosa acoplada a espectrómetro de masas (14). Con la intensión de identificar los esteroides mayoritarios, aproximadamente 2 mg de la FCHCl3 del residuo clorofórmico fue sometidas a análisis por cromatografía gaseosa acoplada a espectrómetro de masas (15) y 15,9 mg de FCHCl3 fueron sometidos a análisis por RMN de 1H y de RMN de 13C.
3.3 ANÁLISIS POR CROMATOGRAFÍA GASEOSA ACOPLADA A ESPECTRÓMETRO DE MASAS (CG-EM)
3.3.1PARA LOS ÉSTERES METÍLICOS
El análisis por cromatografía gaseosa fue realizado en un cromatógrafo a gas acoplado a un espectrómetro de masas (Shimadzu, modelo CGMS-QP2010 Ultra) con las siguientes condiciones de análisis: columna capilar Restek Rtx-5MS (30 m x 0,25 mm x 0,25 μm); temperatura del inyector 240 °C, temperatura del detector 230 °C; impacto de electrones a 70 eV, con gas de arrastre helio a un flujo de 1,23 mL/min, con split 1/5; con un programa de temperatura de 120ºC (2') - 280ºC (2'), 2ºC/minuto y con volumen de inyección de muestra de 3 μL (14).
La identificación de las sustancias componentes fue a través de la comparación de los espectros de masas con el banco de datos NIST 62.
3.3.2PARA LOS ESTEROIDES
Las condiciones de análisis de los esteroides fue: columna capilar Restek Rtx-5MS (30 m x 0,25 mm x 0,25 μm); temperatura del inyector y de la interface fue de 250°C y 320°C respectivamente; impacto de electrones a 70 eV, con gas de arrastre helio a un flujo de 1,23 mL/min, con split 1/5; con un programa de temperatura de 70ºC (5') - 315ºC (5'), 5ºC/minuto; y con volumen de inyección de 3 μL (15).
3.4 ANÁLISIS POR RESONANCIA MAGNÉTICA NUCLEAR
Los espectros de resonancia magnética nuclear de 1H y de 13C fueron registrados en un espectrómetro Bruker de 500 MHz. Para la obtención de los espectros de hidrógeno, se trabajó a una frecuencia de 500 MHz y para la obtención de los espectros de carbono 13 se trabajó a la frecuencia de 125 MHz. Los espectros fueron obtenidos en cloroformo deuterado (CDCl3) de la marca MERCK.
3.5 REACTIVOS, CONGELADORA Y LIOFILIZADOR
Los solventes utilizados en las extracciones, partición líquido - líquido y cromatografía en columna fueron de grado para análisis de las marcas MERCK. La sílica gel para columna fue de la marca espectrum y las muestras fueron congeladas en una ultra congeladora de la marca BINDER de la serie Nº 20170000011259 y liofilizadas en un liofilizador de la marca LABCONCO de 2,5L de la serie 170339971 I, con bomba LABCONCO modelo 117(A65312906).
4. ANÁLISIS DE RESULTADOS
Fue obtenido como muestra fresca del hongo P. ostreatus 200,81 g y después de liofilizar la muestra se obtuvo 29,51 g de muestra seca, observándose que tiene 85,31% de agua. El porcentaje de humedad encontrado en las muestras, es un valor alto, que está conforme reporta la literatura (1). La muestra seca fue molida en mortero y posteriormente macerada en metanol, del que se obtuvo 8,81 g de extracto bruto orgánico (EBO), representando el 4,42% de rendimiento. El EBO fue sometido a partición líquido-líquido, del que se obtuvo 257,9 mg (0,13%) de residuo clorofórmico (RCHCl3), 514 mg (0,26%) de residuo butanólico (RBuOH) y 6,6 g (3,29%) de residuo acuoso.
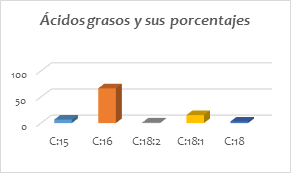
El residuo clorofórmico (257,9 mg) fue sometido a cromatografía en columna abierta para la obtención de tres fracciones: fracción de éter de petróleo (FEP) del que se obtuvo 38,3 mg que representa el 43,92%; fracción de cloroformo (FCHCl3) del cual se obtuvo 17,9 mg (20,53%) y la fracción metanólica (FMeOH) 31 mg que representa 35,55%. El total de la FEP fue sometida a transesterificación y analizado por CG-EM, a través del cual fue identificado 5 ácidos grasos mayoritarios, como los presentamos en función de su porcentaje de presencia en la tabla 1 y en la Fig. 2.
TABLA I Ácidos grasos en P. ostreatus.
| Ácidos grasos | % | |
|---|---|---|
| Ácido pentadecanoico | C:15 | 5,63 |
| Ácido palmítico | C:16 | 66,54 |
| Ácido linoleico | C:18:2 | 1,15 |
| Ácido oleico | C:18:1 | 15,28 |
| Ácido esteárico | C:18 | 3,01 |
Nota: Porcentaje e identificación de los ácidos grasos mayoritarios presentes en P. ostreatus
De los ácidos grasos identificados en la muestra P. ostreatus fue observado que el ácido palmítico está presente en 66,54%, valor que difiere de los publicado (1), (2) ya que lo observado en los hongos son los ácidos oleico y linoleico los mayoritarios.
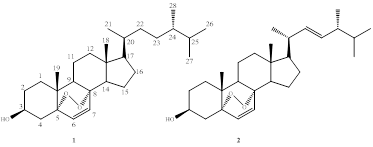
Fig. 3 Estructura de los compuestos 5α,8α-epidioxi-24(R)-metilcolesta-6en-3β-ol (1) y 5α,8α-epidioxi-22E-ergosta-6,22-dien-3β-ol (2).
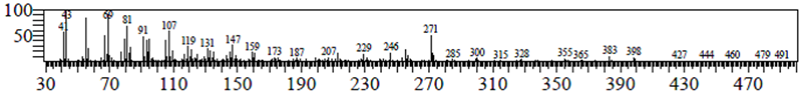
A través del análisis de los espectros de resonancia magnética nuclear y de masas obtenidos de la fracción clorofórmica (FCHCl3) fueron identificadas las moléculas 1 y 2 (Fig. 3). Los desplazamientos químicos de RMN del compuesto 1 están de acuerdo con los datos de la literatura (16) y el espectro de masas (Fig. 4) está conforme con los datos publicados [17]. Los fragmentos observados son m/z 398 (M+ - O2), 383 (M+ - O2 - CH3), 365 (M+ - O2 - H2O - CH3).
Compuesto 1.- Fue identificado como 5α,8α-epidioxi-24(R)-metilcolesta-6en-3β-ol por análisis del espectro de RMN1H (500 MHz, CDCl3) δ 0,82 (6H, s, H-18, d, J = 6,7 Hz, H-27), 0,83 (3H, d, J = 6,7 Hz, H-26), 0,88 (3H, d, J = 7,05 Hz, H-24), 0,89 (3H, s, H-19), 1,00 (3H, s, H-21), 3,97 (1H, m, H-3), 6,24 (1H, d, J = 8,55 Hz, H-6), 6,50 (1H, d, J = 8,5 Hz, H-7). RMN13C (125 MHz, CDCl3) δ 12,84 (C-18), 14,08 (C-28), 17,53 (C-26), 18,14 (C-21), 19,61 (C-19), 20,59 (C-11 y C-27), 23,37 (C-15), 28,79 (C-16), 29,98 (C-12), 31,49 (C-2, C-23 y C-25), 33,02 (C-22), 34,66 (C-1), 35,60 (C-20), 36,79 (C-4), 36,93 (C-10), 39,32 (C-24), 44,53 (C-13), 51,06 (C-9), 51,65 (C-14), 56,17 (C-17), 66,48 (C-3), 79,39 (C-8), 82,13 (C-5), 130,71 (C-7), 135,18 (C-6) (16).
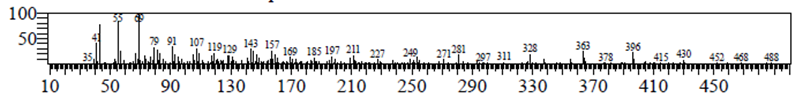
Compuesto 2.- Fue identificado como 5α,8α-epidioxi-22E-ergosta-6,22-dien-3β-ol por análisis de los espectros de masas y RMN1H (500 MHz, CDCl3) δ 0,82 (6H, s, H-18 y d, J = 6,7 Hz, H-27), 0,83 (3H, d, J = 6,7 Hz, H-26), 0,89 (3H, s, H-19), 0,9 (3H, d, J = 6,7 Hz, H-28), 1,00 (3H, s, H-21), 1,22 (1H, m, H-17), 1,23 (2H, m, H-11a y H-12a), 1,35 (1H, m, H-16a), 1,41 (1H, m, H-15a), 1,47 (1H, m, H-25), 1,5 (1H, m, H-9), 1,53 (1H, m, H-11b), 1,56 (1H, m, H-14), 1,58 (1H, m, H-2a), 1,6 (1H, m, H-15b), 1,63 (1H, m, H-1a), 1,65 (1H, m, H-16b), 1,85 (2H, m, H-2b y H-24), 1,93 (1H, m, H-4a), 1,95 (1H, m, H-1b), 1,96 (1H, m, H-12b), 2,01 (12, m, H-4b y H-20), 3,97 (1H, m, H-3), 6,24 (1H, d, J = 8,55 Hz, H-6), 6,50 (1H, d, J = 8,5 Hz, H-7), 5,15 (1H, dd, J = 15,25; 8,25 Hz, H-22), 5,22 (1H, dd, J = 15,25; 7,6 Hz, H-23). RMN13C (125 MHz, CDCl3) δ 12,84 (C-18), 17,53 (C-28), 19,61 (C-19 y C-26), 19,91 (C-27), 20,59 (C-11), 20,85 (C-21), 23,37 (C-15), 28,79 (C-16), 29,98 (C-12), 34,0 (C-25), 34,66 (C-2), 36,79 (C-4), 36,93 (C-10), 39,32 (C-1), 39,71 (C-20), 42,63 (C-24), 44,53 (C-13), 51,06 (C-9), 56,17 (C-17), 51,65 (C-14), 66,48 (C-3), 79,39 (C-8), 82,13 (C-5), 135,18 (C-6), 130,71 (C-7), 132,27 (C-23), 135,38 (C-22) (18). El análisis del espectro de masas (Fig. 5) está conforme la referencia bibliográfica (17) y los fragmentos observados son m/z 396 (M+ - O2), 363 (M+ - H2O - O2 - CH3), 337 (M+ - O2 - C3H7O).
CONCLUSIONES
A través del estudio fitoquímico de las fracciones apolares de la seta ostra Pleurotus ostreatus fue posible identificar la presencia del ácido palmítico como compuesto mayoritario, el cual es un ácido que está ampliamente distribuido en la naturaleza. Ocurre prácticamente en todas las plantas, animales terrestres y acuáticos y es considerado como un precursor de los ácidos grasos naturales saturados e insaturados de cadenas más largas (19). También fueron identificados dos esteroides 5α,8α-epidioxi, ambos esteroides ya aislados e identificados en hongos, siendo 5α,8α-epidioxi-22E-ergosta-6,22-dien-3β-ol la molécula más estudiada por su diversa actividad biológica como actividad antioxidante, inmunomodulatoria, antimicrobial, antitumoral, inhibidor de hemólisis, antiinflamatorio, etc y el compuesto 5α,8α-epidioxi-24(R)-metilcolesta-6en-3β-ol induce la apoptosis de las células de leucemia HL-60 (20).