INTRODUCCIÓN
La codeposición es una técnica electroquímica utilizada para que se produzca en forma simultánea la reducción de dos o más metales sobre una superficie base, en términos sencillos crear una aleación. En el caso del galvanizado mejorado, deberá contar junto con el zinc otro metal que pueda mejorar las propiedades del recubrimiento del zinc, como la dureza y la protección contra la corrosión, las velocidades de corrosión normales para el zinc como galvanizado están en el orden de 50 mpy, por lo tanto, mejorar (reducir) este valor ya sería un beneficio de la codeposición protectora. Se han probado con diferentes metales cobalto, níquel, cadmio, boro [1,2].
Debido a temas de toxicidad, de disponibilidad o costos, el níquel es el metal que se utilizó como elemento para mejorar el galvanizado estándar, en esta investigación. El níquel es un metal que se considera noble y por lo tanto muy estable en procesos de corrosión, además es un metal que se pasiva (forma una capa protectora, adherente, no soluble y no conductora) por lo tanto candidato a proteger contra la corrosión, además ofrece una mejora en la dureza (níquel dureza Vickers 356 Hv y zinc 45 Hv [3]) de la superficie y esto mejora el galvanizado estándar.
La electrodeposición de un solo metal depende de las siguientes variables: composición del baño (tipo y cantidad de las sales involucradas y del pH), aditivos involucrados (retardadores y abrillantadores) y de las condiciones de operación, como la densidad de corriente utilizada, temperatura y agitación del baño. A esta problemática para un solo elemento electrodepositado, en una codeposición se suma otros factores más, por ejemplo, la composición adecuada de los metales aleantes en el recubrimiento, además que la deposición suceda simultáneamente y en las proporciones requeridas, creando una metalografía (estructura cristalina) deseada, debido a que las características protectoras del recubrimiento, dependerá de todos estos factores.
Los tipos de baño para las codeposiciones de zinc/níquel son variadas, pudiendo ser estás en base a sales de sulfato, sales de cloruros (generalmente ligeramente ácidas) y las llamadas alcalinas (debido a su pH y el uso de óxidos en su composición), además se incluye el uso de aditivos y estos pueden ser del tipo retardadores o abrillantadores independientemente del tipo de baño utilizado. Los retardadores son especies químicas que tienen como función retardar la velocidad de reducción de la forma iónica del metal y de esta manera contribuir a una creación de una estructura cristalina ordenada (para que no tenga la apariencia oscura de “quemado”) y los abrillantadores van por lo mismo, son especies químicas que acompañan al ion hasta la superficie del cátodo, colocándolo en la posición adecuada y de esta manera se obtiene una estructura cristalina sin sitios de vacancia, contribuyendo a una superficie más lisa, más compacta y de esta manera contribuyendo al brillo de la superficie y a su dureza.
CONSIDERACIONES PREVIAS EXPERIMENTALES
Las condiciones de operación como la densidad de corriente, es de suma importancia, porque define muchas características: (1) el nivel de polarización y con esto la eficiencia catódica (parámetro que mide la fracción de la corriente en la reducción utilizada por las especies deseadas), (2) la velocidad de codeposición (orden del acomodo de los átomos reducidos), (3) también define el potencial eléctrico del cátodo (define la simultaneidad de la codeposición), (4) define la proporción de los metales a depositarse, (5) como también la forma como lo hacen, creando sistemas cristalinos diferentes (fases), los cuales definirán las propiedades químicas (corrosión) y físicas del recubrimiento (dureza), por tales razones la densidad de corriente juega un papel muy importante en la codeposición, de zinc y níquel.
El potencial eléctrico que se alcanza en los electrodos tanto ánodo y cátodo dependerá de la densidad de corriente circulada por el sistema y de la polarización, este potencial funciona como un umbral energético para que ciertas especies iónicas se oxiden o reduzcan, de tal manera que el potencial eléctrico define si el zinc y el níquel se codepositarán, además definirá la forma como se alcanzará el arreglo cristalino, la fase que deberá presentarse es la fase (gamma) según Abou-Krisha, Moonjae Kwon, Soroor Ghaziof y Bahadormanesh [3,4,5,6, 7], para esto se busca una proporción que está en el orden de 10-12% de níquel (Ni5Zn21) [1,3,5,7,8,9,10,11] la cual proporciona la mejor protección contra la corrosión, la proporción del níquel no debe superar ese rango porque se ha comprobado que si eso sucede el recubrimiento se comportará como cátodo y la base de acero comercial se comportaría como ánodo, invirtiéndose la función protectora del recubrimiento.
El potencial no sólo es una función de la densidad de corriente, sino además de un fenómeno que se crea en el sistema conocido como polarización (por concentración, por activación o por resistencia) que hace que el potencial varié a pesar de tener una misma densidad de corriente, este fenómeno origina una caída del potencial en el cátodo. La importancia del valor del potencial reside en si se encuentra un potencial asociado a un recubrimiento exitoso, este dato serviría para reproducir las mismas características del recubrimiento, utilizando un baño similar, usando el mismo potencial. Para que la polarización por concentración no afecte el potencial, se utiliza la agitación lo cual reduce el efecto de la polarización de este tipo y de esta manera la eficiencia catódica no se ve disminuida por la polarización.
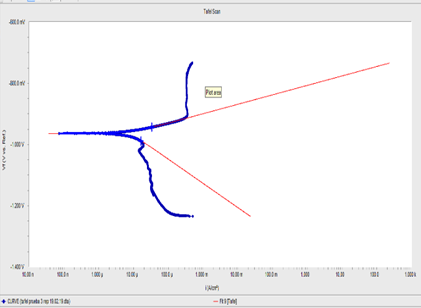
Para evaluar la velocidad de corrosión se usaron los métodos electroquímicos, como el método conocido como intercepto (pendientes de Tafel) y el método de RPL (resistencia de polarización) ambos métodos se utilizó un potenciostato marca Gamry Interface1010 T.
Para generar la corriente continua se utilizó el equipo rectificador de corriente autoregulable con tres salidas independientes de corriente, marca Singlet, de 6.4 amperios/32 voltios.
Para determinar la estructura y fases del recubrimiento Zn-Ni se usó la técnica Difracción de Rayos X, Difractómetro de Rayos X Philips X Pert Pro del Centro de Desarrollo de Materiales Avanzados y Nanotecnología, Facultad de Ciencias-UNI.
Para determinar la composición del recubrimiento (% de Ni y % de Zn) se utilizó la técnica de absorción atómica, con el equipo Espectrofotómetro de Absorción Atómica Savanta AA - GBC. (Facultad de Ingeniería Geológica, Minera y Metalúrgica, Laboratorio de Espectrometría).
La microdureza del recubrimiento Zn/Ni se midió usando un Microdurómetro marca MH HVS 1000 A CARL ZEISS JENA a partir de probetas de 2cm x 3cm aplicando una carga de 100 g por 15 s por diferentes zonas se midió reportando microdureza Vickers, con la siguiente relación.
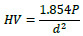
Donde d es la diagonal promedio de la superficie de la impronta y P la carga aplicada en kg.
La eficiencia catódica se calculó usando la ley de Faraday:
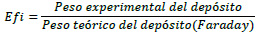
Si no se conoce la composición de Zn/Ni del depósito, se asume que hay un depósito de 90% de Zn y 10% de Ni, para evaluar el peso teórico.
ANTECEDENTES
Hay en la literatura algunas propuestas de codeposición de diferentes metales lo que incluye cobalto, boro y níquel, con el zinc, todas buscan mejorar las propiedades anticorrosivas del zinc, y alguna otra propiedad del mismo. [24]
Los artículos se basan en ofrecer las condiciones de baño y condiciones de operación primero para una codeposición exitosa, la mayoría usa baños alcalinos cianurados, que el baño pueda lograr la composición del zinc/níquel adecuada para tener las propiedades esperadas. [25]
Como también que aditivos podrían usarse en la composición del baño básico, y ofrecer algunas características metalográficas que redundarían sobre las propiedades del recubrimiento. [26]
Sobre las pruebas electroquímicas para evaluar las propiedades anticorrosivas de la codeposión, hay material extenso y claro, además forma parte de los temas ensayados en los laboratorios de corrosión.
METODOLOGÍA
La configuración del ensayo experimental consistió en una celda de polietileno de 2.3 l de capacidad, (se usó agua osmótica 5 mS/cm), para albergar dos ánodos de zinc calidad electrolítica 99.99% de pureza y dos ánodos de níquel calidad electrolítica 99.99% de pureza, en el medio de la celda la probeta o cupón de prueba (5x10 cm, 1 dm2) que inicialmente fue de bronce (por ser un material inerte) y luego se cambió a una probeta de acero comercial, debido a que este material es más utilizado en un galvanizado. Se utilizó agitación en las pruebas, usando un agitador magnético.
La parte experimental de la investigación tuvo tres objetivos (1) encontrar el tipo y composición del baño que permita la codeposición [4,15], (2) encontrar los aditivos adecuados (retardador y abrillantador) y las cantidades adecuadas, (3) la densidad de corriente diferenciada (para los ánodos de zinc y níquel) que permita el tipo de depósito y porcentaje buscado de Zn y Ni.
Inicialmente para la búsqueda del tipo de baño, no se usaron aditivos, para que de esta manera verificar las ventajas o desventajas del tipo de baño sin la contribución de especies químicas ajenas al mismo baño. Se comenzó utilizando baños de cloruros con la siguiente composición ZnCl2 38.16 g/l y NiCl2.6H2O 35.66 g/l pH 5, luego se utilizó el baño de sulfatos con la siguiente composición ZnSO4.7H2O 143.78 g/l y NiSO4.6H2O 52.57 g/l pH 3.8 y por último un baño alcalino con la siguiente composición NiSO4.6H2O 24.16 g/l, ZnO 10 g/l y NaOH 100 g/l pH 13. Todos los productos químicos usados son de calidad QP (químicamente puro, con pureza por encima del 99%)El baño de cloruros ocasiono formación de óxidos de níquel de color negro sobre los ánodos de níquel, en forma espontánea, sin el uso de corriente, lo cual originaba la incapacidad de este ánodo de suplir de iones de níquel al medio, por lo tanto, se descartó este tipo de baño.
El baño de sulfatos no ocasiono problemas operativos, ni depósitos extraños, no afecto a los electrodos tanto ánodos o cátodos y se obtuvo depósitos bastante aceptables. El baño alcalino ocasiono problemas de deposición muy rugosa, oscura, con material reducido no adherente (arborización). Por lo tanto, el baño más se adecuó a los objetivos fue el baño de sulfatos, el pH de este baño se regulaba usando ácido sulfúrico en la cantidad necesaria.
Para la búsqueda de los aditivos teníamos la bibliografía [1,7,10,12,13] que nos sugería el uso de los siguientes agentes químicos, ácido bórico, tiourea, sacarina, propilenglicol, EDTA, gluconato de sodio. Los retardadores ocasionan una disminución de la velocidad de reducción de los iones, en algunos casos formando complejos o especies químicas reteniendo el ion usando para ello los grupos funcionales que dispone el retardador, permitiendo de esta manera una deposición más uniforme y los abrillantadores, producen una superficie lisa y más compacta.
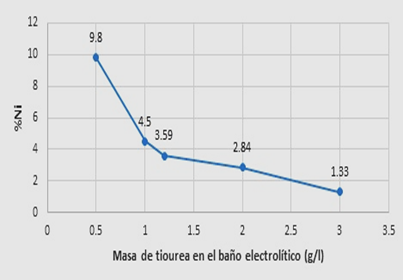
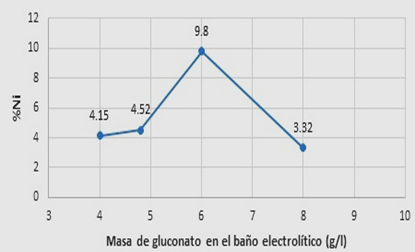
Se utilizaron las cantidades (pesos) recomendados en la bibliografía [12,13,19], como retardadores se usaron tiourea, sacarina, propilenglicol, EDTA, gluconato de sodio y como abrillantador fue el ácido bórico, posteriormente se modificaron las cantidades inicialmente recomendada en la bibliografía, esta variación dependía del éxito (apariencia, eficiencia del recubrimiento), algunas de esas cantidades usadas en los baños de sulfatos se observa en la tabla I, las variaciones de los pesos en relación a la tiourea (retardador para níquel) se justificaban de la siguiente manera, un aumento del peso reduciría el contenido de níquel en el recubrimiento, como se pudo comprobar en la figura 2, en relación al gluconato de sodio (retardador para zinc), el efecto se aprecia en la figura 3, se puede observar que hay un efecto significativo a 6 g/l sobre la presencia de níquel. Las técnicas utilizadas para generar las figuras 2 y 3, como no existe modelos o teoría sobre el efecto de que tiene cada aditivo sobre el peso % de Ni en el recubrimiento, fue prueba y error, evidenciando el efecto del incremento de peso y midiendo si efecto en el % de Ni en el recubrimiento.
Una vez ya definido el tipo de baño (sulfatos), lo siguiente fue definir las relaciones molares de Zn/Ni, en el baño, lo cual definiría el % de Ni, los resultados más exitosos se aprecian en la tabla II, estas pruebas consideraron dentro de la composición del baño la participación de aditivos (abrillantador/retardador), los cuales a su vez se hicieron variaciones en sus pesos en los baños de prueba, para observar el efecto sobre la composición de la electrodeposición.
TABLA I Composición de baños de sulfato y el uso de aditivos
| Prueba | Composición del baño (g/l) | pH | Relación molar de Zn/Ni en el baño | Densidad de corriente (A/dm2) |
| 164 | ZnSO4.7H2O (287.55g/l) NiSO4.6H2O (138.65g/l) H3BO3 (12.37 g/l) Tiourea (2g/l) Vainilla (2.5 g/l) Gluconato de Sodio (4 g/l) | 2.2 | 1.9 | 0.4 |
| 165 | 2.1 | 0.5 | ||
| 166 | 2.8 | 1 | ||
| 167 | ZnSO4.7H2O (319.97g/l) NiSO4.6H2O (233.41g/l) H3BO3 (12.37 g/l) Tiourea (2g/l) Vainilla (2.5 g/l) Alcohol Polivinilico (5 g/l) | 3.2 | 1.25 | 1 |
| 168 | 3.56 | 2 | ||
| 169 | 3.5 | 3 | ||
| 170 | ZnSO4.7H2O (319.97g/l) NiSO4.6H2O (233.41g/l) H3BO3 (12.37 g/l) Tiourea (2 g/l) Vainilla (3.75 g/l) Alcohol Polivinilico (5 g/l) | 3.24 | 1.25 | 0.4 |
| 171 | 3.6 | 0.5 | ||
| 172 | 3.4 | 1 | ||
| 173 | 3.1 | 2 | ||
| 174 | 3.58 | 3 | ||
| 175 | ZnSO4.7H2O (319.97g/l) NiSO4.6H2O (233.41g/l) H3BO3 (12.37 g/l) Tiourea (3 g/l) Vainilla (2.5 g/L) Alcohol Polivinilico (5 g/l) | 2.9 | 1.25 | 0.4 |
| 176 | 2.6 | 0.5 | ||
| 177 | 2.76 | 0.75 | ||
| 178 | 2.6 | 1 |
Las pruebas de codeposición iniciales fueron dirigidas para establecer la presencia de Ni en la película y por lo tanto los análisis químicos iniciales fueron de tipo cualitativo, sólo para verificar la presencia del níquel en el recubrimiento, estas pruebas se realizaron utilizando una marcha analítica [20], que incluía un ataque con ácido nítrico al 10%, a las limaduras del recubrimiento de la probeta, luego el uso de peróxido de hidrógeno al 3% para oxidar el Ni+1 a Ni+2, y luego una neutralización hasta pH 4 aproximadamente, para finalmente usar el reactivo dimetilglioxima para la identificación cualitativa del níquel, manifestado por un tono rojo a rosado, estas prueba sirvieron para dirigir los ensayos iniciales.
El análisis cuantitativo de la composición de Zn/Ni en el recubrimiento se usó absorción atómica, el procedimiento iniciaba con el desprendimiento como limaduras de la capa electrodepositada sobre el metal base (acero comercial), luego un ataque con 150 mL de una solución de 1.2 M de HNO3, a 90 °C por 30 minutos, para disolver totalmente la muestra.
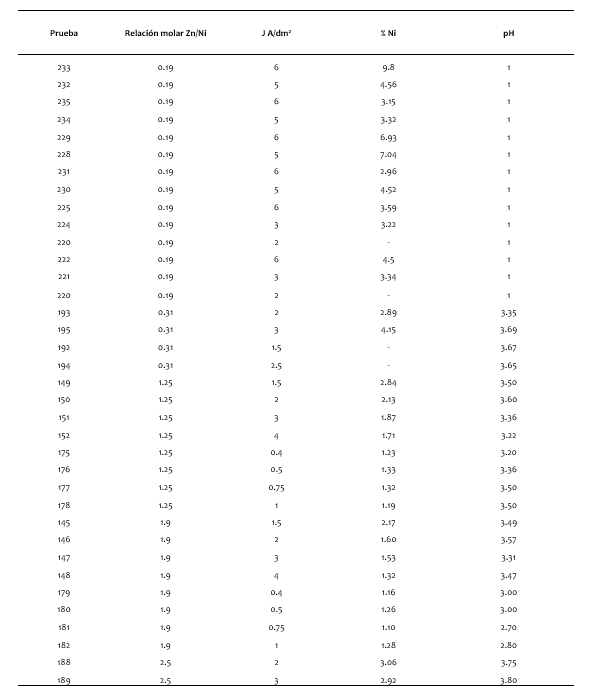
Las densidades de corriente eléctrica iniciales que se usaron estuvieron entre 0.5 a 3.0 A/dm2, para todos los baños a probar, debido a que es lo que se usa en la industria para recubrimientos de zinc [18], no consiguiendo los resultados esperados en apariencia y composición de Zn/Ni en el recubrimiento, como se observa en la tabla 2, que además incluye los reportes de absorción atómica de la composición de Ni en la película.
Las relaciones molares de Zn/Ni de 0.62, 1.
25, 1.9, 2.5, 3.0 y 6.0, que se usaron en los baños de sulfato se consideraron densidades de corriente de 1.5, 2. 3 y 4 A/dm2, y parte de estos datos se reporta en la tabla II. De este grupo de pruebas se estableció que los baños con una relación molar de 0.19 y 1.5 de Zn/Ni, se usaran densidades de corriente mayores de 4 A/dm2 y fueron las que tuvieron mejores resultados, como se observa en tabla II, estos resultados provocó que se usaran densidades de corrientes más altas como de 5 y 6 A/dm2, para ello además se utilizó diferentes proporciones de corriente variando entre 66/34, 70/30, 80/20 y 90/10 para los ánodos de níquel y zinc respectivamente, se repitieron las pruebas para verificar la consistencia de los resultados y estas probetas fueron evaluadas en su contenido de Zn y Ni por absorción atómica y esto se evidencia en la tabla III.
| Prueba | j(A/dm2) | %Ni | %Zn | Eficiencia catódica (%) |
|---|---|---|---|---|
| 233 | 6 | 9.8 | 90.2 | 61.9 |
| 232 | 5 | 4.56 | 95.44 | 48.24 |
| 235 | 6 | 3.15 | 96.85 | 60.33 |
| 234 | 5 | 3.32 | 96.68 | 48.77 |
| 229 | 6 | 6.93 | 93.07 | 34.13 |
| 228 | 5 | 7.04 | 92.96 | 37 |
| 231 | 6 | 2.96 | 97.04 | 60.7 |
Para medir la velocidad de corrosión del recubrimiento Zn/Ni se usó la prueba 233 con la que se obtuvo mayor cantidad de níquel 9.8% en la película recubierta, y esta a su vez se realizó tres ensayos, para diferentes concentraciones de medios como 3.5 % y 5 % de NaCl, según la tabla IV, para el método de RPL y la tabla V se muestra los resultados para ensayos de corrosión con el mismo tipo de probeta, pero con el método de pendientes (rectas) de Tafel o método de intercepto.
Para el cálculo de la velocidad de corrosión primero se empleó el método de las pendientes de Tafel figura 5, a partir de las curvas de polarización, para ello se tomó partes de la curva en donde el comportamiento es lineal, para poder emplear el método de extrapolación de las pendientes de Tafel. [3,5,7,14,16,18,19]
Tabla IV Velocidad de corrosión, método RPL.
| Método de Extrapolación de las rectas de Tafel, prueba 233 | ||||||
| Ensayo | ba (V/decade) | bc (V/decade) | E corr (mV) | I corr (A/cm2) | V corr (mpy) | Medio % NaCl |
| 1 | 0.0309 | 0.07910 | -963 | 8.530E-06 | 4.886 | 3.5 |
| 2 | 0.05220 | 0.06590 | -948 | 8.40E-06 | 4.792 | 3.5 |
| 3 | 0.02230 | 0.2602 | -974 | 12.10E-06 | 6.901 | 5.0 |
| 4 | 0.04370 | 0.05620 | -935 | 10.5E-06 | 6.012 | 5.0 |
Tabla V Velocidad de corrosión, método rectas de Tafel.
| Método Resistencia a la Polarización, prueba 233 | ||||
|---|---|---|---|---|
| Ensayo | E corr (mV) | I corr (A/cm2) | V corr (mpy) | Medio %NaCl |
| 1 | -991.6 | 1.576E-05 | 8.987 | 3.5% |
| 2 | -901.7 | 1.30E-05 | 5.872 | 3.5% |
| 3 | -921.4 | 4.07E-05 | 7.095 | 5.0% |
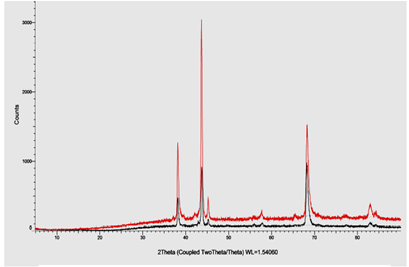
Fig. 6 Difractograma obtenido de dos partes diferentes de una probeta recubierta con la aleación de Zn/Ni (9.8% de Ni en el recubrimiento)
Los resultados de las tablas IV y V, se contrastan con una velocidad promedio para un recubrimiento de Zn puro de 10.55 mpy para 3.5 % NaCl [21,22], y se observa una mejora evidente.
Las fases presentes en el recubrimiento se analizaron mediante ensayo de difracción de rayos X a dos partes de una probeta (cuyas dimensiones fueron 1 x 2 cm) de la prueba 233. El difractograma de la figura 6 muestran picos de mayor intensidad en 43.7 y 68.2 grados que corresponden a las fases gamma 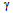 (Ni5Zn21) y delta
(Ni5Zn21) y delta  (Ni3Zn22) respectivamente. Otros picos de menor intensidad en 38.2, 45.3, 57.9 y 83.0 que indican también la presencia de Zn puro y fase
(Ni3Zn22) respectivamente. Otros picos de menor intensidad en 38.2, 45.3, 57.9 y 83.0 que indican también la presencia de Zn puro y fase 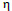 (solución sólida de Ni en Zn).
(solución sólida de Ni en Zn).
Los ensayos de microdureza Vickers y medida del espesor del recubrimiento Zn/Ni se hizo sobre la prueba 233 electrodepositada a 6 A/dm2, que fue la prueba en la que se obtuvo mayor contenido de níquel en la película, se realizaron a una carga 100 g por 15 s. en dos partes de la película, mostrado en la tabla VI.
Tabla VI Ensayo de microdureza HV, en la prueba 233
| Ensayo | Microdureza 1 (HV) | Microdureza 2 (HV) | Microdureza Promedio (HV) |
| 1 | 142.7 | 154.8 | 148.75 |
| 2 | 140.1 | 152.1 | 146.1 |
Estos resultados se contrastan con los valores de microdureza para galvanizado en caliente con 70 HV [23] y galvanizado electrolítico de Zn de 45 HV [4], evidenciando una mejora de esta propiedad.
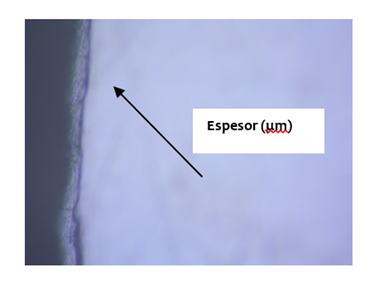
La medida del espesor de la película se hizo dividiendo la probeta (de la prueba 233) de 5 x 10 cm en 2 partes de las cuales de obtuvo cupones de 2.5 x 3 cm, para obtener un espesor promedio. Cada uno de las partes se analizó por separado midiendo el espesor en micras con un microscopio óptico con aumentos de 500X y se obtuvo las micrografías que se observan en las figuras 7 y 8.
ANÁLISIS DE RESULTADOS
El mejor baño de sulfato fue ZnSO4.7H2O (49 g/l) NiSO4.6H2O (268.8 g/l) H3BO3 (6.185 g/l) tiourea (0.5 g/l) gluconato de Sodio (6 g/l), corresponde a la prueba 233.
La densidad de corriente que dio mejores resultados fue de 6 A/dm2, con una relación de corriente de 90% para níquel y 10% para el zinc, dando como resultado un porcentaje de níquel en el recubrimiento de 9.8 %.
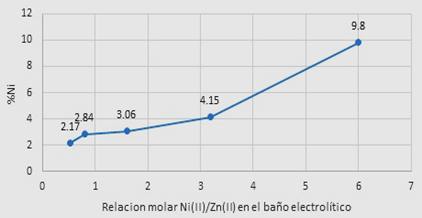
La mejor relación molar en el baño de Zn y Ni fue de 19/100, esto es debido al comportamiento anómalo del Ni.
La agitación sobre el baño mejora el recubrimiento incluso a mayor proporción de corriente sobre el ánodo de níquel.
La tiourea en cantidad 0.5 g/l funciona muy bien con retardador de zinc, mayores concentraciones disminuye el contenido de níquel.
El gluconato de sodio en cantidad 6 g/l funciona muy bien como retardador de zinc.
Existe un efecto sinérgico entre el ácido bórico, tiourea y gluconato de sodio obteniéndose los mejores recubrimientos.
El aumento de la cantidad de tiourea y ácido bórico no mejora el recubrimiento, en apariencia.
La sacarina y el glicerol, ambos como retardadores, no tienen efecto sinérgico con el ácido bórico como abrillantador.
Con vainilla y alcohol polivinílico como retardantes, se obtienen recubrimientos opacos y con manchas “quemadas” con bajo contenido de níquel.
El tipo de morfología del recubrimiento Zn/Ni y el difractograma de rayos X confirma la presencia de la fase 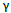 (Ni5Zn21).
(Ni5Zn21).
La presencia de un 9.8% de níquel en el recubrimiento mejora en un 300% la dureza del galvanizado estándar por método electroquímico.
El recubrimiento de zinc y níquel con un contenido de Níquel de 9.8% en un medio salino 3.5% NaCl, reduce la velocidad de corrosión en un 47%, y en un medio de 5% NaCl reduce la velocidad de corrosión en un 38%.
La presencia de un 9.8% de níquel aleado con Zinc da un tiempo de vida de hasta el doble con respecto a uno de Zinc puro, aunque el costo se eleva en 37%.
CONCLUSIONES
Con el uso de la corriente de 6 A/dm2, usando 90% de corriente para el níquel y 10% para el zinc, se obtuvo un 9.8% de níquel en la codeposición.
El baño que estuvo asociado a la mejor codeposición fue ZnSO4.7H2O (49 g/l) NiSO4.6H2O (268.8 g/l) H3BO3 (6.185 g/l) tiourea (0.5 g/l) gluconato de Sodio (6 g/l).
La agitación permite usar mayor densidad de corriente.
Se pudo establecer claramente las funciones de retardador y de abrillantador.
No sólo se obtuvo la composición de 9.8%, sino además la fase
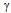 , que asegura un mejor comportamiento contra la corrosión.
, que asegura un mejor comportamiento contra la corrosión.Se obtuvieron mejoras contra los efectos de la corrosión, con 3.5% de NaCl se mejoró 47% y con un medio de 5% de NaCl una mejora de 38%.
La dureza con la codeposición de Zn/Ni, casi se triplico de 45 HV con un baño de zinc, a 145 HV con la codeposición.