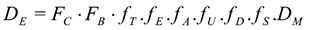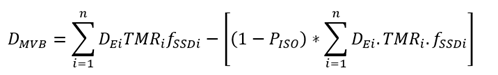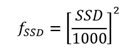1. INTRODUCCIÓN
La aplicación de las radiaciones ionizantes para el tratamiento del cáncer es un proceso muy complejo que incluye diversos aspectos, tales como: la localización del volumen a irradiar, la simulación, la prescripción, la planificación e implementación del tratamiento. Un aspecto importante para lograr un correcto tratamiento es administrando la dosis absorbida necesaria (DA) al volumen objetivo y, por tanto, causando el mínimo riesgo en los órganos circundantes. [1], [2], [3]
En un informe de la Comisión Internacional de Unidades y Medidas de Radiación, por sus siglas en inglés, la ICRU
concluyó que es necesario que la dosis (D) adecuada debe coincidir con la dosis prescrita por el médico especialista, lo cual debe cumplir con una exactitud de ±5% en un intervalo de confianza de 95% [3]. Para realizar mencionado tratamiento es fundamental contar con sofisticados servicios de radioterapia y, así mismo, cumplir con un óptimo programa de Garantía de Calidad (GC) en radioterapia, determinado por la Organización Mundial de la Salud (OMS) [2], [4], [5].
Actualmente en los programas de GC se utilizan los dosímetros: termoluminiscentes, que no son utilizados frecuentemente para el control de calidad a pesar de presentar ciertas ventajas, frente a otros dosímetros, como en la caracterización de pequeños haces de fotones [1], [2]; diodos, formados por dos cristales dopados de silicio o germanio en fósforo, son dispositivos que dependen en gran medida de la temperatura y de la dirección del haz, además de presentar mayor sensibilidad en energías mayores entre 6MV - 18MV [2], [6], [7], los transistores, de efecto de campo semiconductor de óxido de metal (Mosfet), además de depender en función de la temperatura poseen la ventaja de poder cubrir una amplia gama de energía desde fotones hasta electrones, de lectura rápida y razonable sensibilidad; sin embargo, tienen una vida media limitada debido a su pérdida de sensibilidad [2], [6], [8] y; finalmente, los dosímetros basados en la tecnología OSL (Optically Stimulated Luminescence) de cristales de óxido de aluminio dopados con carbono (Al2O3: C) denominados "nanodot", que presentan ventaja en los procesos de relectura, permitiendo el almacenamiento de la D y la posibilidad de lecturas múltiples [2], [9].
En esta investigación se implementó un sistema dosimétrico alternativo, los dosímetros nanodot. Los dosímetros nanodot se caracterizaron según sus cualidades dosimétricas [10], [11], [12], [13], [14] calibrados para energías de haz de fotones de 1,25 MeV y 6 MV, para haces de electrones de 5 MeV y en el rango D de 2 a 2300 cGy, se diseñaron los algoritmos de cálculo de D en el órgano y / o punto de interés, para su aplicación dosimetría in vivo, se diseñaron y confeccionaron los dispositivos para lograr las condiciones de equilibrio electrónico (Build up) para cada energía utilizada.
Para el desarrollo de la investigación utilizamos un Lector MicroStar y un conjunto de dosímetros nanodot que tienen una cubierta plástica de 0.04 g.cm2 como estructura intrínseca. El sistema dosimétrico se utiliza para medir la D entregada al volumen blanco en tratamientos de radioterapia, convencionales y especiales, mediante haces de fotones y electrones producidos por equipos de cobalto 60 y aceleradores lineales.
2. MATERIALES Y METODOLOGÍA
La caracterización de los detectores nanodot se realizó con un haz de fotones producido por un linac Varian (Clinac 600C) perteneciente al Centro de Radioterapia de Lima (CRL) y con haces de electrones producido por un linac Siemens Medical (Mevatron MXE2) perteneciente a Radioncologia SAC. La calibración se realizó en un equipo Cobalto-60 MDS Nordion (Equinox II) perteneciente al Instituto Nacional de Enfermedades Neoplásicas (INEN).
Para el estudio de la dependencia energética se utilizó un Linac de Siemens Medical (Mevatron Primus Hi Energy). La aplicación del sistema se llevó a cabo en las tres instituciones de radioterapia mencionadas anteriormente.
La medición o lectura de los detectores nanodot, así como su blanqueo (eliminación de la señal en el cristal de AL2O3: C) se realizaron en el Laboratorio de Dosimetría OSL de la empresa Nuclear Control SAC.
2.1 Caracterización de detectores de nanodot
Los dosímetros nanodot basados en la tecnología OSL de cristales de óxido de aluminio dopados con carbono (Al2O3:C) para su caracterización, calibración de haz y dosímetros, se utilizó un objeto simulador 1 (hojas de acrílico, 30 x 30 cm2 y espesor 2,8 cm), para la evaluación de la dependencia angular y para la verificación del algoritmo de cálculo, el objeto simulador 2 (Figura 1) diseñado y construido en acrílico de forma cilíndrica con diámetro externo con diámetro externo : 16 cm, seccionado a lo largo de su eje con espesor se utilizaron variables para la ubicación del dosímetro (nanodot o CI).

Fig. 1. Objeto simulador, cilindro de acrílico seccionado a lo largo de su eje para diferentes propósitos.
Para alcanzar el Build up de los dosímetros nanodot, se diseñó el objeto simulador 3 (Figura 2) en acero inoxidable utilizado para haces de 6 MV y 18 MV, 6 vigas de fotones MV y 18 MV; y en aluminio para haces de fotones de 60Co.
Se utilizó el lector Microstar para obtener la respuesta de los dosímetros de nanodot, calibrados en unidades mrad; así mismo, está conectado al sistema informático, que incluye el software uStar para la adquisición de datos. [15]

Fig. 2. El dosímetro Nanodot con su Build up de acero inoxidable de 2,0 mm equivalente a 15 mm de agua para un haz de fotones de 6 MV.
Con el fin de obtener mediciones de precisión, se utilizaron electrómetros de impedancia de entrada dinámica para minimizar las corrientes de fuga. El electrómetro se utiliza en modo actual, de esta manera hay una relación lineal entre la carga generada y la dosis. Las propiedades dosimétricas de los dosímetros de nanodot se verificaron utilizando un proceso reproducible para cada caso. Los dosímetros nanodot que se utilizaron como dosímetros en la medida de D, fueron sometidos a pruebas para verificar sus propiedades y/o cualidades dosimétricas.
El procedimiento de evaluación de cada una de las propiedades dosimétricas que permiten caracterizar el nanodot, se llevó a cabo bajo los criterios de reproducibilidad, linealidad, dependencia con la tasa de dosis, dependencia direccional, dependencia energética, desvanecimiento de la señal, descarga con el número de lectura, factor de corrección por acumulación y señal de fondo.
La calibración del sistema se llevó a cabo por etapas: la calibración del sistema de lector MicroStar (calibración gruesa) y luego la calibración de la respuesta del nanodot para la energía y D a investigar (calibración final).
2.2 Aplicación: Dosimetría in vivo
Con el objetivo de medir la D que estaría recibiendo el volumen blanco, durante la realización del tratamiento, se utilizan los dosímetros con su build up, respectivo. Posteriormente son colocados sobre la superficie de entrada en la piel del paciente y en el centro de cada uno de los campos de irradiación impartidos durante la sesión del tratamiento, con esto calculamos la D en la superficie de entrada del paciente (DE), a través de la respuesta del nanodot, los factores de corrección dados por la caracterización y por el factor de calibración respectivo.
La D calculada en el volumen blanco, DVB se obtuvo proyectando la entrada D (medida por el nanodot), DE a la profundidad de prescripción de la D para cada uno de los campos considerados en el plan de tratamiento, teniendo en cuenta la técnica utilizada, que son:
Donde:
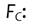 Factor de calibración para el rango de D empleada.
Factor de calibración para el rango de D empleada.
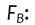 Factor de corrección, debida al material usado como espesor de equilibrio
Factor de corrección, debida al material usado como espesor de equilibrio
Electrónico (Build up).
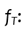 Factor de corrección correspondiente a la variación de la respuesta del
Factor de corrección correspondiente a la variación de la respuesta del
nanodot frente a la variación a la tasa de dosis.
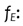 Factor de corrección debido al uso de un haz de radiación con energía
Factor de corrección debido al uso de un haz de radiación con energía
diferente al haz de calibración.
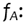 Factor debido a la variación de la respuesta del nanodot frente a cambios
Factor debido a la variación de la respuesta del nanodot frente a cambios
en la angulación del gantry.
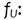 Factor de corrección correspondiente al número de uso del nanodot.
Factor de corrección correspondiente al número de uso del nanodot.
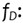 Factor de corrección correspondiente a la posición real del dosímetro
Factor de corrección correspondiente a la posición real del dosímetro
nanodot. Se calcula de la estimación de la posición del dosímetro, con SSD
(distancia de la fuente a la superficie del paciente), dado en mm.
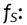 Factor de calibración del Lector microStar
Factor de calibración del Lector microStar 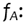 ,
,
a. Técnica SSD
Utilizando la siguiente expresión:
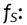 Representa la D medida en el volumen blanco,
Representa la D medida en el volumen blanco,
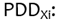 (Porcentaje de dosis en profundidad) del campo "i" a la profundidad "X" de
(Porcentaje de dosis en profundidad) del campo "i" a la profundidad "X" de
prescripción de D (datos proporcionados por el usuario),
DE: D en la superficie de entrada del paciente,
i: Campo indicado por cada sesión dada en el plan de tratamiento, y
n: Número de campos indicados en el plan de tratamiento.
b. Técnica SAD
La técnica SAD utilizamos la siguiente expresión:
Donde:
DMVB: Representa la D medida en el volumen blanco.
DE: D en la superficie de entrada del paciente, para cada campo utilizado.
TMR: Factor correspondiente a la relación tejido-aire, para cada campo utilizado, y es proporcionado por el usuario.
fSSD: Factor de corrección para la distancia, para cada campo utilizado, debido al hecho de utilizar un SSD (dado en mm) diferente a partir de la calibración del linac, y se calcula a partir de:
i: Campo indicado por cada sesión dada en el plan de tratamiento,
N: Número de campos indicados en el plan de tratamiento.
pISO: Valor en porcentaje correspondiente a la curva de isodosis que encierra el volumen tumoral.
Para la verificación del proceso de aplicación de dosimetría in vivo, se utilizó el objeto simulador 2, en el que el dosímetro de nanodot (con su respectivo build up) se coloca en la superficie del objeto simulador 2 y a la profundidad deseada se coloca la cámara de ionización (CI) que nos medirá la D en el punto de interés.
Este proceso se realizó para haces de 60Co donde se evaluó con las tablas de cálculo, y para el haz de 6 MV se evaluó con valores obtenidos por el software de planificación de tratamiento (SPT o TPS) STP Theraplan Plus para los cuales, antes del cálculo fue necesario realizar una tomografía computarizada al objeto simulador 2, como se muestra en la figura 3.
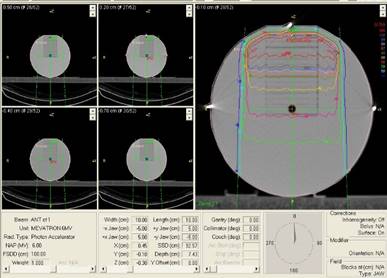
Fig. 3 TC del objeto simulador 2 cuya imagen es capturada por el TPS Theraplan Plus que diseñan los haces de radiación para aplicar.
En otro aspecto, la influencia del build up, que fue evaluada por dos métodos: método experimental que representa la variación en la D en el punto de interés debido a la presencia del material del build up. La medición de D está hecha para la técnica SAD y para haces de fotones de 60Co con el build up de aluminio y por la técnica de simulación de Monte Carlo (MC). El código de cálculo MCNP de la técnica MC reproduce la geometría, y procedemos a calcular la energía depositada en los puntos de interés a diferentes profundidades y porque se considera un punto de cálculo (volumen infinitesimal, constante) la dosis se considera directamente proporcional a la energía depositada en ese punto. [16], [17], [18]
3. RESULTADOS Y DISCUSIONES
Las evaluaciones realizadas de cada una de las propiedades dosimétricas del nanodot, muestran en sus resultados de su caracterización: reproducibilidad con incertidumbre inferior a ± 2,8%, linealidad de hasta 15 Gy con un coeficiente de r2 a 0,9997, con una dependencia con tasa de dosis menor a ± 2,1%, con una dependencia energética inferior al ± 2,0%, con una dependencia direccional inferior a ± 2,0% y una descarga de señal del 0,03% por lectura) y calibrada para energías entre 1,25 MeV y 6 MV.
Con respecto a la aplicación de dosimetría in vivo, se muestran los resultados de las evaluaciones realizadas en un grupo o pacientes sometidos a tratamientos de radioterapia en casos de técnicas convencionales, siendo clasificados según la ubicación anatómica del volumen objetivo, aplicando la técnica SAD y la técnica SSD. En vista de esto, se evidenciaron discrepancias superiores al 5%, que se corrigieron antes del final del tratamiento.
En el caso de la evaluación realizada en pacientes con cáncer de páncreas, la evolución de los valores D en cada sesión de tratamiento oscila dentro de un rango aceptable, pero muestra la necesidad de evaluarse cuando se presenta la comparación del total D. Prescripto y medido para dos situaciones, si lo evaluamos al 84% (del total de sesiones) y si lo evaluamos sólo al 20%, como se muestra en la Tabla I.
Tabla I Comparación de los valores del total D medido (DTM) con su incertidumbre (UDTM) y el total D prescrito (DTP) para el caso del paciente con cáncer de páncreas.
| Porcentaje de evaluación | DTM (cGy) | UDTM (cGy) | UDTM (%) | DTP (cGy) | Variación (%) |
| 84 | 4465,21 | 20,41 | 0,46 | 4500 | -0,77 |
| 20 | 4439,72 | 20,88 | 0,47 | 4500 | -1,34 |
En la exactitud respecto a la D prescrita (total) del tratamiento, se observa una mayor discrepancia para los casos en que el paciente es tratado con campos oblicuos, debido a la colocación física de los dosímetros en cada sesión de tratamiento. Por lo tanto, en cuanto a los casos de campos perpendiculares, el porcentaje de error confirmado es inferior al 5%.
En el caso del paciente 2 de la región abdominal, la diferencia supera el límite del 5% y esto se debió a que se observaron errores en el cálculo de la D prescrita, error que se corrigió después de analizar los resultados de la dosimetría in vivo. Sin embargo; podemos decir que para todos los casos el uso de dosímetros nanodot daría una verificación del tratamiento.
Tabla II Comparación de valores D obtenidos por el método dosimetría in vivo y por valores D medidos por el IC y por las tablas de tratamiento.
| D (cGy) | Comparación (%) | ||||||
|---|---|---|---|---|---|---|---|
| Equipo | Campo | C.L | Nanobot | Gráfico | C.L | Gráfico | |
| Equinox I 1,25 MeV | 5x5 | 42,9 | 42,4 | 43,01 | 1,16 | -1,44 | |
| 10x10 | 172,34 | 175,05 | 174,42 | -1,57 | 0,36 | ||
Tabla III Comparación de valores D obtenidos por el método dosimetría in vivo y por valores D medidos por la CI y los calculados por el TPS Theraplan Plus.
| Equipo | Campo | D (cGy) | Comparación (%) | |||
|---|---|---|---|---|---|---|
| C.L | Nanobot | Gráfico | C.L | Gráfico | ||
| MEVA 6MV | 5x5 | 74,94 | 75,78 | 75,69 | -1,12 | 0,12 |
| 10x10 | 82,53 | 81,75 | 83,2 | 0,94 | -1,77 | |
| 15x15 | 85,87 | 83,34 | 84,1 | 2,94 | -0,91 | |
En las tablas II y III se observa que al comparar los valores de la D obtenidos ya sean medidos y calculados por la CI y TPS están dentro de los valores de tolerancias (< 3%), mostrando así que los dosímetros Nanodot son adecuados para este tipo de medidas.
CONCLUSIONES
Los resultados encontrados en cada uno de los parámetros durante su caracterización, reproducen los beneficios y cualidades del dosímetro nanodot, lo que justifica su posterior aplicación en dosimétrico físico y clínico.
Ha sido posible identificar el material, adecuado; diseñar y construir un dispositivo para lograr el equilibrio electrónico, build up, en la ubicación de medición de la D con el dosímetro de nanodot.
Es viable realizar las calibraciones de los dosímetros nanodot para las energías entre 1,25 MeV y 6 MV para exámenes de radioterapia convencionales y al mismo tiempo calibrar, el nanodot para exámenes especiales de irradiación corporal total con 6 haces de fotones MV y 5 haces de electrones MeV.
El sistema dosimétrico basado en dosímetros de nanodot mide los valores D con incertidumbres inferiores al 2% con un nivel de confianza del 95%.
Las diferencias relativas de los valores de D estimados por el método desarrollado (nanodot y algoritmo propuesto) son inferiores al 3% en comparación con los valores medidos con la CI y son inferiores al 5% en comparación con los valores de D prescritos y/o planificados en tratamientos de radioterapia.
Una de las principales ventajas de los dosímetros de nanodot en comparación con los dosímetros existentes es la capacidad de releer, que sirve como testigo físico para el tratamiento de radioterapia.
De acuerd0 a los resultados se puede afirmar que los dosímetros de nanodot son adecuados para su uso en programas de control de calidad en centros de radioterapia, especialmente en mediciones de dosis no invasivas "dosimetría in vivo".
Los dosímetros nanodot representan una alternativa viable para la realización de la dosimetría física y clínica en la práctica de la radioterapia. Además, su calidad para mantener la información como testigo físico del procedimiento, garantizando un tratamiento con calidad y seguridad, evitando así posibles incidencias y/o accidentes.