Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Altoandinas
versão On-line ISSN 2313-2957
Rev. investig. Altoandin. vol.19 no.1 Puno ene./mar. 2017
http://dx.doi.org/10.18271/ria.2017.250
ARTICULO ORIGINAL
Análise de resíduos de agrotóxicos organoclorados em morango usando o método QuEChERS com CG- μECD
Analysis of organochlorine pesticide residues in strawberry by the QuEChERS method with CG Μecd
Franz Zirena Vilca1*, Walter Alejandro Zamalloa Cuba2; Carina Nazato3, Valdemar Luiz Tornisielo3
1 Facultad de Ingeniería Civil y Ambiental, Universidad Nacional Toribio Rodríguez de Mendoza - Chachapoyas Amazonas Perú
2 Escuela Profesional de Ingeniería Química, Universidad Nacional del Altiplano – Puno Perú
3 Centro de Energía Nuclear para la Agricultura de la Universidad de Sao Paulo – Brasil
* Autor para correspondência: Email: franzvilca@usp.br
RESUMO
Devido às propriedades físico-químicas dos agrotóxicos organoclorados, têm ocorrido contaminação do ambiente e da cadeia alimentar. O consumo destes produtos em baixas concentrações representa um perigo potencial à saúde humana. O método QuEChERS foi ajustado e usado para a determinação de resíduos de 12 agrotóxicos organoclorados (α- BHC, β - BHC, heptacloro, dicofol, endosulfan lacton, OP DDD, α - endosulfan, OP DDE, PP DDE, β - endosulfan, PP DDD, endosulfan sulfato) em 36 amostras de morango de três varejões na cidade de Piracicaba/São Paulo – Brasil, durante o período de outubro de 2010 até setembro de 2011. O método envolve extração com acetato de etila, partição sólida líquida com MgSO4 e CH3COONa seguido por clean up por dSPE com PSA. As análises foram realizadas com um equipamento GC–µECD utilizando uma coluna HP-5 30 m x 0,32 mm x 0,25 µm. O método foi validado usando uma amostra de morango sem resíduos de agrotóxicos (branco), fortificado a 0,01 e 0,1 mg kg-1; a recuperação média do método variou entre 72,9 a 120 % com RSD% < 9,6%. O método mostrou linearidade r2 ≥ 0,99 e os LOQs variaram entre 0,001 a 0,01 mg kg-1. Os resultados obtidos indicam que o método é sensível e não existe efeito matriz. Pode-se concluir que o método QuEChERS utilizando GC-µECD é uma alternativa para determinar resíduos de pesticidas organoclorados em morango. O método mostrou que seis das amostras analisadas apresentaram contaminação por endosulfan sulfato nas concentrações de 0,003 a 0,02 mg kg-1.
PALABRAS CLAVES: Cromatografía gasosa; Multiresíduo, Pesticidas, Validação
RESUMEN
Debido a sus propiedades físicas y químicas los plaguicidas organoclorados han contaminado el medio ambiente y la cadena alimentaria. El consumo de estos productos en bajas concentraciones es un peligro potencial para la salud humana. El método QuEChERS fue ajustado y utilizado para la determinación de residuos de 12 plaguicidas organoclorados (α- BHC, β - BHC, heptacloro, dicofol, endosulfan lacton, OP DDD, α - endosulfan, OP DDE, PP DDE, β - endosulfan, PP DDD, endosulfan sulfato) en 36 muestras de fresas de tres mercados en la ciudad de Piracicaba / Sao Paulo - Brasil, durante el período de octubre de 2010 a septiembre de 2011. El método consiste en la extracción con acetato de etilo, partición sólida líquida con MgSO4 y CH3COONa seguido por clean up por dSPE con PSA. Los análisis fueron realizados con un equipo GC–µECD utilizando una columna HP-5 30 m x 0,32 mm x 0,25 µm. El método fue validado usando una muestra de fresa sin residuos de agrotóxicos (blanco), fortificado a 0,01 y 0,1 mg kg-1; la recuperación varió entre 72,9 a 120 % con RSD% < 9,6%. El método mostro linealidad r2 ≥ 0,99 y los LOQs variaron entre 0,001 a 0,01 mg kg-1. Los resultados obtenidos indican que el método es sensible y no existe efecto matriz. Podemos concluir que el método QuEChERS utilizando GC-µECD es una alternativa para la determinación de pesticidas organoclorados en fresas. El método mostró que seis muestras presentan contaminación por endosulfan sulfato en las concentraciones 0,003 a 0,02 mg kg-1
KEY WORDS: Cromatografia gaseosa; Multiresiduo, Validación
ABSTRACT
Due their physical end chemical properties, organochlorine pesticides (OCPs) have been occured the contamination the environment and food chain. The consume of this products at low concentration dose represent a potential hazards to human health. The QuEChERS method was adjusted and used for the determination of 12 organochlorine pesticides (α- BHC, β - BHC, heptachlor, dicofol, endosulfan lacton, OP DDD, α - endosulfan, OP DDE, PP DDE, β - endosulfan, PP DDD, endosulfan sulfate) residues in 36 strawberries samples from three markets of the Piracicaba/ Sao Paulo – Brazil, during the period of October 2010 until September 2011. The method involved extraction with ethyl acetate, solid–liquid partition with MgSO4 and CH3COONa followed by dSPE clean up with PSA sorbent. Analyses were carried out with GC–μECD equipment. A HP-5 30 m x 0.32mm x 0.25 μm column was used. The method was validated using a strawberry sample without pesticides residues (blank), spiked at 0.01 and 0.1 mg kg-1; the average recovery by the method varied between 72.9 to 120% with RSD% < 9.6%. The method showed linearity r2 ≥ 0.99 and the LOQ ranged from 0,001 to 0.01 mg kg-1. It could be concluded that QuEChERS method used with GC-μECD is an alternative to determine organochlorine pesticides in strawberries. The results obtained indicate that this method sensitive and has no matrix effect. The method showed six of the samples analyzed have contamination by endosulfan sulfate at the concentrations of 0.003 to 0.02 mg kg-1.
KEYWORDS: Fruit; Gas Chromatography; Multi-Residue; Pesticides; Validation.
INTRODUÇÃO
O morango no Brasil destaca-se dentro do grupo de frutas de clima temperado, com produção de aproximadamente 105.000 toneladas, distribuídos em quatro mil hectares, sendo que o interesse pelo cultivo do morango é justificado pela alta rentabilidade da cultura, o amplo conhecimento e a aceitação da fruta pelo consumidor e pela diversidade de opções de comercialização e processamento do morango (polpa, sorvetes, geleias, compotas e sucos). O cultivo está concentrado nos Estados de Minas Gerais (41,4%), Rio Grande do Sul (25,6%), São Paulo (15,4%), Paraná (4,7%) e Distrito Federal (4%) (Ceuppens et al., 2015).
Centenas de agrotóxicos são utilizados em práticas agrícolas no mundo, não sendo raro encontrar teores residuais em produtos alimentícios, especialmente em frutas e vegetais. Assim, autoridades de controle estabeleceram limites máximos residuais (LMRs) a fim de preservar o ambiente e a saúde dos consumidores (Jouzi et al., 2017). A determinação de resíduos de agrotóxicos em matrizes alimentares tornou-se uma exigência, tendo em conta a toxicidade e estabilidade destes xenobióticos que uma vez presente nos alimentos, torna-se um alerta para a saúde humana.
Poluentes Orgânicos Persistentes (POPs), tais como os pesticidas (DDT, Aldrin, Dieldrin, Endrin, Heptacloro Hexacolorobenzeno (HCB) e Toxafeno) são substâncias químicas que persistem no ambiente, acumulando-se em concentrações altas no tecido adiposo e que é biomagnificado através da cadeia alimentar. Conseqüentemente, eles constituem sérios riscos ao ecossistema, aos invertebrados e a saúde humana (Moshi & Matoju, 2017). Os agrotóxicos organoclorados têm uma ampla variedade de efeitos agudos e crônicos para os seres humanos, dentro deles danos neurológicos, câncer e efeitos congênitos, além disso, muitos destes compostos são suspeitos de atuar como disruptores. Particularmente o controle de agrotóxicos organoclorados em frutas e vegetais é importante para que agências de controle possam alertar sobre a presença de resíduos destes agrotóxicos, especialmente por que esses alimentos, na maioria dos casos, são consumidos in natura e muitas sem lavagem.
O método QuEChERS (Quick, Easy, Cheap, Effective, Rugged and Safe) foi introduzido por (Anastassiades, Lehotay, Stajnbaher, & Schenck, 2003) e tem sido aplicado em diversos estudos a fim de analisar resíduos em diferentes matrizes; principalmente usado com sistemas cromatográficos acoplados a espectrometria de massas LC/MS/MS e GC/MS (NGUYEN et al., 2008). O objetivo deste trabalho foi ajustar e validar o método QuEChERS para a determinação de 12 agrotóxicos organoclorados usando CG-µECD em 36 amostras de morango provenientes de três varejões da cidade de Piracicaba no estado de São Paulo, Brasil.
MATERIAL E MÉTODOS
2.1. Reagentes e materiais
Padrões analíticos de (α-BHC, β-BHC, heptacloro, dicofol, endosulfan lacton, OP DDD, α - endosulfan, OP DDE, PP DDE, β - endosulfan, PP DDD, endosulfan sulfato), com mais de 98,9% de pureza foram obtidos de Dr. Ehrenstorfer (Augsburg, Germany) e ChemService (West Chester, PA, USA). Foram preparadas soluções estoque individuais numa concentração de (1 mg mL-1) em tolueno grau HPLC e armazenadas numa temperatura de -18 °C. As soluções de trabalho na diluição apropriada, foram preparadas previamente ao seu uso. O acetato de etila e tolueno foram de grau HPLC (J. T. Baker) e o ácido acético P.A, CH3COONa e MgSO4 anidro (J.T Baker) e PSA (Varian), foram adequados para análises de resíduos. Uma amostra de morango proveniente do sistema de produção orgânica, sem resíduos de pesticidas, obtida na cidade de Piracicaba foi utilizada como amostra branca, para o processo de validação do método. Foram analisadas 36 amostras de morango, provenientes de três varejões da cidade de Piracicaba no estado de São Paulo – Brasil, amostras coletadas no período de outubro de 2010 até setembro de 2011. Foi coletado um quilograma de amostra de morango; a amostra foi processada em processador de alimentos, separada uma sub amostra de 200 g que foi destinada para análise.
2.2. Equipamento
Um sistema cromatográfico de fase gasosa (Agilent, modelo 7890A), equipado com um micro detector de captura de elétrons (µECD) e coluna capilar Agilent HP (30 m x 320µm x 0.25µm) foi utilizado para a separação, detecção e quantificação dos agrotóxicos. O software ChemStation B.04.02 foi utilizado para o controle do instrumento e aquisição dos dados. As condições de operação do sistema CG- µECD foram: forno com temperatura inicial de 150 °C aumentando para 210 °C à taxa de 20 °C min -1 mantido por 3 min; 210 °C aumentando para 230 °C à 15 °C min -1 mantido por 5 min e 230 °C aumentando para 280 °C à 20 °C min -1. O gás de arraste utilizado foi o gás nitrogênio (N2) com um fluxo constante de 1 mL min -1; temperatura do detector foi de 300 °C, gás make-up (N2) de 39 mL min -1. O tempo total da corrida analítica foi de 15 minutos. A quantificação dos analitos foi realizada com curvas de calibração realizadas no extrato da matriz.
2.3. Preparo da amostra
Foi utilizado acetato de etila como solvente para a extração com MgSO4 e CH3COONa anidro seguido de um clean up por dispersão da fase sólida (dSPE) com absorvente PSA; 15 g de amostra de morango foram pesadas em um tubo de centrifuga de polipropileno de 50 mL, e então, foram adicionados 15 mL de acetato de etila, 6 g de MgSO4 e 1,5 g de CH3COONa anidro. A amostra foi agitada manualmente por 1 min, e em seguida centrifugada a 5000 rpm por 5 min. Para o clean-up, uma alíquota de 1 mL do sobrenadante foi transferido para um tubo de centrifuga de 2 mL contendo 50 mg de PSA e 150 mg de MgSO4, agitada manualmente durante 30 segundos e centrifugada a 5000 rpm por 5 min; 500 µL deste extrato foi colocado em um vial de 1,5 mL diluído com 500 µL de acetato de etila, foi injetado 1 µL no sistema CG- µECD no modo (pulsed split less) para a análise.
2.4. Validação do método analítico
A validação do método analítico foi realizada seguindo os seguintes parâmetros: linearidade, limites de detecção, limite de quantificação, precisão, exatidão e repetitividade (INMETRO, 2011; SANCO, 2014). A linearidade foi determinada através da construção de curvas analíticas em diferentes concentrações 0,0010; 0,0025; 0,0050; 0,0100; 0,0500; 0,0750; 0,1; 0,1500 e 0,2000 µg mL-1. Dois tipos diferentes de curvas de calibração foram preparados por uma série de diluições da solução estoque, uma em tolueno e outra no extrato da matriz morango. Este extrato foi obtido da extração do morango seguindo os procedimentos analíticos descritos.
Os estudos de recuperação foram realizados fortificando 15 g de amostra de morango homogeneizada, com a solução padrão dos pesticidas em dois níveis de fortificação (correspondentes aos LOQs e 10 vezes estes valores). Os valores de recuperação foram estabelecidos para cada agrotóxico, com sete repetições para cada nível de fortificação. Depois da fortificação a amostra foi deixada em repouso por uma hora e as amostras foram extraídas de acordo com o procedimento previamente descrito.
RESULTADOS E DISCUSSÃO
3.1. Validação do método
Os coeficientes de correlação para todos os compostos estudados foram r2≥ 0,99. Não foi observado efeito matriz significativo; os tempos de retenção (TR), limites de detecção (LOD) e limites de quantificação (LOQ) dos agrotóxicos analisados são mostrados na Tabela 1. Assim como no trabalho realizado por (Gebara, Ciscato, Monteiro, & Souza, 2011); os limites de quantificação foram na ordem de 0,001 mg kg-1 para analises de organoclorados em morangos sendo que o clean up utilizado pelos autores foi GPC (Cromatografia por Permeação a Gel), com o que conseguem uma boa limpeza da amostra, favorecendo à limites de quantificação mais baixos.
No Brasil não existem limites máximos residuais (LMR) para compostos organoclorados na matriz morango. A comunidade europeia estabelece LMR referenciais para estes tipos de compostos nesta matriz, sendo que os limites de quantificação do presente trabalho (Tabela 1) estão abaixo do menor LMR referencial estabelecido, de 0,01 mg kg-1.
Os experimentos de recuperações realizados nas concentrações de 0,01 mg kg-1 e 0,1 mg kg-1 apresentaram recuperações na ordem de 72,3 e 120,3 %, que estão dentro dos parâmetros estabelecidos pela comunidade europeia e o Brasil (INMETRO, 2011; SANCO, 2014), observou-se uma recuperação de 148,3 % na concentração de 0,01 mg kg-1 para o composto heptacloro; este efeito 28 % acima do limite estabelecido pode ser atribuído a uma leve interferência da matriz para esta concentração (Erney, Gillespie, Gilvydis, & Poole, 1993). Os desvios padrões relativos das recuperações realizadas no tempo zero e sete dias após foram ≤ 9,6 % o qual mostra que o método é preciso e exato (INMETRO, 2011; SANCO, 2014) .
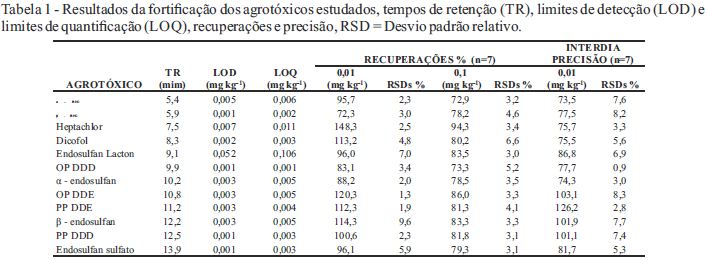
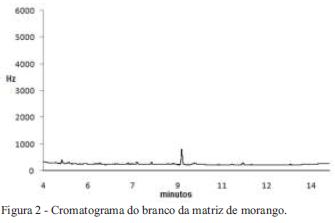
A Figura 1 mostra um cromatograma do extrato fortificado na matriz morango com os doze agrotóxicos, onde há uma separação eficiente para os compostos em estudo. Na Figura 2 é apresentado um cromatograma onde não são observados picos no tempo de retenção de cada composto em estudo o qual demonstra a seletividade do método.
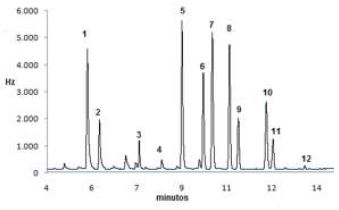
Cromatograma obtido do CG–µECD na concentração de 0,1 µg mL-1: (1) α – BHC, (2) β – BHC, (3) heptachlor, (4) dicofol, (5) endosulfan lacton, (6) OP DDD (7) α – endosulfan, (8) OP DDE, (9) PP DDE, (10) β – endosulfan, (11) PP DDD, (12) endosulfan sulfato
3.2. Análises das amostras
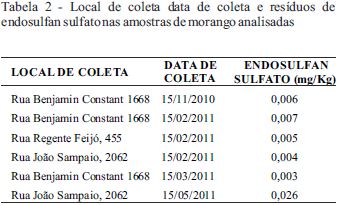
Foram analisadas 36 amostras dos quais seis apresentaram resíduos de endosulfan sulfato (Tabela 2); o uso de endosulfan na cultura de morango no Brasil não é permitido; sendo seu uso permitido somente para as culturas de algodão, cacau, café, cana-de-açúcar e soja, e é estabelecido um LMR para estas culturas de 0,006 mg kg-1 (MAPA, 2017).
Em três amostras as concentrações apresentadas estavam acima do limite estabelecido, por outro lado (MAPA, 2017) estabeleceu um LMR referencial de resíduos de endosulfan em morango de 0,05 mg kg-1; com o que as amostras analisadas apresentam resíduos abaixo deste limite.
Em um trabalho realizado por (Fernandes, Domingues, Mateus, & Delerue-Matos, 2011) para o monitoramento de organoclorados, em áreas com manejo integrado de pragas e agricultura orgânica encontrou três amostras contaminadas com β-endosulfan, sendo 0,007 mg kg-1 a maior concentração encontrada.
A meia vida do endosulfan sulfato no solo foi estimada em 120 dias até vários meses, (Awasthi, Ahuja, & Kumar, 2000) tendo em consideração esta referência há suspeita que este composto contaminou à cultura na sua primeira etapa de desenvolvimento, já que o endosulfan sulfato é um metabolito estável (Miles & Moy, 1979).
CONCLUSÕES
O método QuEChERS mostrou-se eficiente e sensível para a determinação de agrotóxicos organoclorados em amostras de morango.
Foi constatada a presença de resíduos de sulfato de endosulfam em seis amostras de morango analisadas.
REFERÊNCIAS BIBLIOGRÁFICAS
Anastassiades, M., Lehotay, S. J., Stajnbaher, D., & Schenck, F. J. (2003). Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce. Journal of Aoac International, 86(2), 412-431. [ Links ]
Awasthi, N., Ahuja, R., & Kumar, A. (2000). Factors influencing the degradation of soil-applied endosulfan isomers. Soil Biology & Biochemistry, 32(11-12), 1697-1705. [ Links ]
Ceuppens, S., Johannessen, G. S., Allende, A., Tondo, E. C., El-Tahan, F., Sampers, I., et al. (2015). Risk Factors for Salmonella, Shiga Toxin-Producing Escherichia coli and Campylobacter Occurrence in Primary Production of Leafy Greens and Strawberries. International Journal of Environmental Research and Public Health, 12(8), 9809-9831. [ Links ]
Erney, D. R., Gillespie, A. M., Gilvydis, D. M., & Poole, C. F. (1993). EXPLANATION OF THE MATRIX-INDUCED CHROMATOGRAPHIC RESPONSE ENHANCEMENT OF ORGANOPHOSPHORUS PESTICIDES DURING OPEN-TUBULAR COLUMN GAS-CHROMATOGRAPHY WITH SPLITLESS OR HOT ON-COLUMN INJECTION AND FLAME PHOTOMETRIC DETECTION. Journal of Chromatography, 638(1), 57-63. [ Links ]
Fernandes, V. C., Domingues, V. F., Mateus, N., & Delerue-Matos, C. (2011). Organochlorine Pesticide Residues in Strawberries from Integrated Pest Management and Organic Farming. Journal of Agricultural and Food Chemistry, 59(14), 7582-7591. [ Links ]
Gebara, A. B., Ciscato, C. H. P., Monteiro, S. H., & Souza, G. S. (2011). Pesticide Residues in some Commodities: Dietary Risk for Children. Bulletin of Environmental Contamination and Toxicology, 86(5), 506-510. [ Links ]
INMETRO. (2011). ORIENTAÇÃO SOBRE VALIDAÇÃO DE MÉTODOS ANALÍTICOS (pp. 19). BRAZIL: Coordenação Geral de Acreditação [ Links ]
Jouzi, Z., Azadi, H., Taheri, F., Zarafshani, K., Gebrehiwot, K., Van Passel, S., et al. (2017). Organic Farming and Small-Scale Farmers: Main Opportunities and Challenges. Ecological Economics, 132, 144-154. [ Links ]
MAPA. (2017). BRAZIL: MINISTERIO DE AGRICULTURA.
Miles, J. R. W., & Moy, P. (1979). DEGRADATION OF ENDOSULFAN AND ITS METABOLITES BY A MIXED CULTURE OF SOIL-MICROORGANISMS. Bulletin of Environmental Contamination and Toxicology, 23(1-2), 13-19. [ Links ]
Moshi, A. P., & Matoju, I. (2017). The status of research on and application of biopesticides in Tanzania. Review. Crop Protection, 92, 16-28. [ Links ]
SANCO. (2014). Guidance document on analytical quality control and validation procedures for pesticide residues analysis in food and feed. (pp. 42). European Union: EUROPEAN COMMISSION HEALTH & CONSUMER PROTECTION DIRECTORATE-GENERAL [ Links ]
ArtÃculo recibido 29-12-2016
ArtÃculo aceptado 22-03-2017
On line: 30-03-2017













