Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Altoandinas
versão On-line ISSN 2313-2957
Rev. investig. Altoandin. vol.19 no.2 Puno abr./jun. 2017
http://dx.doi.org/10.18271/ria.2017.271
ARTÍCULO ORIGINAL
Determinación interactiva de metales totales en las aguas de la bahía interior del Lago Titicaca- Puno Perú
Interactive determination by total metals in waters of inner Puno bay the Lake Titicaca-Peru
Edmundo Moreno Terrazas1*, George Argota Pérez2, René Alfaro Tapia1, Martha Aparicio Saavedra1, Sabino Atencio Limachi1, Gilmar Goyzueta Camacho1
1 Facultad de Ciencias Biológicas de la Universidad Nacional delAltiplano Puno Perú.
2 Centro de Investigaciones Avanzadas y formación Superior en Educación, Salud y Medio Ambiente "AMTAWI", Puno Perú.
* Autor para correspondencia gmorenot51@gmail.com
RESUMEN
La bahía interior de Puno, es un área restringida (16.0 km) y representa uno de los hábitats del Lago Titicaca con alto nivel de antropización, donde algunos elementos orgánicos e inorgánicos podrían estar superando las concentraciones umbrales permisibles. El objetivo de la investigación fue determinar en forma interactiva los metales totales disponibles en las aguas de la bahía interior del Lago Titicaca, Perú. Se realizó, entre enero y noviembre del 2016, mediante un muestreo no probabilístico por conveniencia y aplicando el método teórico por comparación entre seis estaciones de selección. El Cu, Zn, Pb, Cd, As, Hg fueron los elementos determinados y cuantificados mediante espectrometría de absorción atómica por plasma inductivamente acoplado con vista axial (ICP-AES). Se observó que entre las estaciones no hubo diferencias estadísticamente significativas (p≤0.05) cuando existió una disponibilidad de exposición entre todos los elementos, aunque al comparar cada elemento por estación, existieron diferencias para las épocas de lluvia (enero-febrero-marzo) y estiaje (septiembre-octubre-noviembre). Al comparar cada estación y entre épocas, no existió diferencias estadísticamente significativas, aunque los mayores niveles de concentración correspondieron a la época de estiaje. Se concluyó que existe exposición ambiental por metales en las aguas de la Bahía Interior y donde sus concentraciones son permanentes durante todo el período del año, pudiendo traer consecuencias negativas no solo para el ecosistema, sino además a la propia salud humana dada actividades de beneficio comunitario que se desarrolla en este espacio geográfico.
PALABRAS CLAVES: agua, metales, toxicología ambiental, bahía interior de Puno-Perú.
ABSTRACT
The inner Puno bay is a restricted area and one of the habitats of Lake Titicaca with high anthropization, where some organic and inorganic elements may be exceeding the thresholds allowable concentrations. The aim of the research was to determine interactively total metals available in the waters of the inner Puno bay of Lake Titicaca, Peru. It was conducted between January and November 2016 by a non-probabilistic for convenience and applying the theoretical method by comparison among six stations of selection. Cu, Zn, Pb, Cd,As, Hg were the determined and quantified elements using atomic absorption spectrometry by inductively coupled plasma with axial view (ICP-AES). It was observed that between the stations there were no statistically significant differences (p ≤ 0.05) when there was an availability of exposure among all the elements, although when comparing each element per station, there were differences for the rainy (January-February-March) and dry season (September-October-November). By comparing each station and between seasons, we found that there was no statistically significant difference, although the higher concentration levels were for the dryness season. We conclude that there is environmental exposure by metals in the waters of the Inner Bay and where their concentrations are permanent during the whole period of the year, being able to bring negative consequences not only for the ecosystem, but also to the human health itself given activities of community benefit that are developed in this geographic space.
KEY WORDS: water, metals, environmental toxicology, inner Puno Bay-Peru.
INTRODUCCIÓN
La degradación ambiental sobre la calidad de las aguas, está condicionando que este recurso natural renovable, esté siendo cada vez más limitante en diversas partes del mundo; pues la persistencia de contaminantes disueltos y/o acumulados, pudieran indicar en algunos casos, un estado irreversible para su valor de uso quizás como consecuencia de una mala interpretación sobre el Derecho Ambiental de ciertas generaciones en cuanto al manejo de este recurso (He et al.., 2014).
Dentro de las grandes incertidumbres para muchas sociedades está en conocer, cuál sería el costo ambiental de la contaminación de los recursos hídricos, pues la problemática no es tan simple como pudiera parecer, ya que la calidad no solo es referida a la variabilidad de los parámetros físico-químicos y microbiológicos, presencia de elementos químicos naturales que sobrepasan sus concentraciones o determinados xenobióticos disponibles como son los metales (Corwin & Bradford, 2008; Argota & Iannacone 2014ab; Wang & Zang, 2014), sino que entre las mayores preocupaciones estarían conocer, cuánto resultaría posible la recuperación y accesibilidad de los recursos hídricos, una vez que se encuentren afectados o impactados (Shortle, 2013; Dixit et al..., 2015).
Particularmente la exposición a metales en los ecosistemas acuáticos, constituyen un serio problema ambiental donde la comunidad científica dedica diversos esfuerzos e interés, ya que no son biodegradables (Qadir & Malik, 2011; Mirror, 2015), además, que se pueden bioacumular en organismos inferiores y luego biomagnificarse (Molina, Ibañez, & Gibon, 2012), pudiendo ocasionar riesgos irreparables sobre la salud humana (Wang et al..., 2015; Londoño, Londoño & Muñoz, 2016).
En el caso particular del Lago Titicaca, representa el más grande de agua dulce en América del Sur con una superficie de 8300 km2, longitud máxima de 195 km, 285 metros de profundidad máxima y una anchura media de 50 km, siendo además el navegable más alto del mundo (3808 m.s.n.m), está incluidos en la lista de humedales de importancia internacional después de la Convención de Humedales Ramsar en 1971, pues presenta una biodiversidad tanto en flora como fauna acuática de importancia (Constantini et al... 2004). Sin embargo, la contaminación de los ecosistemas acuáticos lénticos representa uno de los principales problemas ambientales a resolver (Samantray et al..., 2009), debido a que afecta la biodiversidad endémica, donde tal situación en sinergia con otras variables ambientales como las meteorológicas, pueden ocasionar efectos adversos como por ejemplo; la mortandad masiva de peces en el Lago Titicaca dado efectos de remoción de ecotoxicidad local (Argota, 2015).
Clásicamente se considera al Lago Titicaca con tres áreas bien definidas: primero, el Lago Grande (de mayor extensión con un área de 6.315 Km2 y profundidad máxima de 281 m); segundo, el Lago Pequeño (con un área de 1,250 Km2 y 45 m de profundidad máxima); y en tercer lugar, la Bahía de Puno (de 525 Km2 y una profundidad máxima de 45 m). Sin embargo, existe un área del Lago Titicaca que ha motivado la atención de los científicos, a partir de 1980. Esta área es denominada bahía interior Puno (16 Km2 ) la cual se ubica frente a la ciudad de Puno (PELT, 2000). Durante los últimos años, una de las zonas clasificadas como puntos hipereutróficos, es precisamente la bahía interior (ALT, 2005), debido a la contaminación generada por el ingreso de aguas sin tratamiento provenientes de los desagües y otras fuentes de la actividad humana de la ciudad de Puno en el transcurso de casi cincuenta años, lo que ha causado la degradación en esta parte del ecosistema (MINCETUR, 2005). No obstante, dentro de las preocupaciones sociales dadas la actividad de pesca que se realiza en esta zona, es importante conocer el estado actual de salud ambiental que presenta la Bahía Interior con relación a determinados elementos tóxicos.
El objetivo de la presente investigación fue determinar metales pesados en agua y sedimentos de la bahía interior del Lago Titicaca, Puno-Perú.
MATERIALES Y MÉTODOS
Objeto de investigación y periodo de estudio
Se estudió la bahía interior de Puno, la cual es una sección de la bahía o golfo de Puno, que a su vez forma parte del Lago Titicaca. Está ubicada frente a la ciudad de Puno (Departamento de Puno). Tiene una superficie alrededor de 16 km². Fue realizado el estudio entre enero y noviembre del 2016, correspondiendo a las épocas de lluvia y estiaje.
Esta investigación forma parte del proyecto "Evaluación ecotoxicológica de la carga contaminante y aplicación de un sistema de tratamiento mineral pasivo para aguas servidas que ingresan a la bahía interior de Puno, Lago Titicaca-Perú", ejecutado con docentes y recursos de la Universidad Nacional del Altiplano de Puno (UNAP) en colaboración científica con el Centro de Investigaciones Avanzadas y formación Superior en Educación, Salud y Medio Ambiente "AMTAWI".
Población y muestra
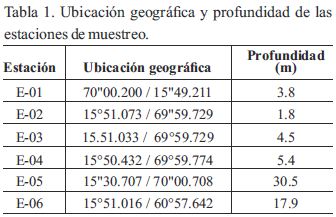
Se evaluó como matrices ambientales abióticas tanto el agua como sedimentos. Para ello, fueron seleccionadas seis estaciones mediante un muestreo no probabilístico por conveniencia o juicio (Tabla 1), donde se aplicó para interpretación de los datos, el método teórico por comparación.
El muestreo de las aguas se realizó mediante una botella Van Dorn, cuya capacidad fue de cinco litros donde el volumen de muestra tomada en cada estación fue aproximadamente de 1L (ISO: 1980, 1991, 1994). Las muestras se homogeneizaron en un tanque de polietileno previamente endulzado con agua de la propia Bahía Interior de Puno conservándose dichas muestras, a través de la presencia de HNO3 (1ML/100 L: H2O de muestra) para su traslado al Laboratorio de Minerales Elio Trincado Figueredo, Santiago de Cuba-Cuba para la determinación de los metales.
En el caso de los sedimentos fue utilizada una draga manual donde los sedimentos fueron conservados en bolsas de nylon para su secado a temperatura ambiente. Luego se pesó 2,0 g de sedimento seco, añadiéndose 40.0mL de agua regia HCl: HNO3 (3:1) y se calentó a una temperatura no mayor de 180°C hasta obtenerse sales húmedas para la determinación de metales.
Determinación de metales pesados en agua y sedimentos
Para la determinación de Cu, Zn, Pb, Cd, As, Hg se tomó 1L de agua, el cual se filtró mediante una membrana de acetato de celulosa de 45µm donde la solución resultante fue acidulada hasta un valor de pH < 2 utilizando HNO3.
El análisis de los metales en las matrices agua y sedimentos fue mediante un procedimiento de digestión ácida con HCl : HNO3 (Mir et al., 2016).
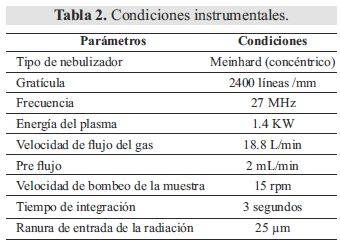
Luego la cuantificación se realizó mediante Espectrometría de Absorción Atómica por Plasma Inductivamente Acoplado con Vista Axial (ICPAES) de la firma alemana Spectro-Arco, según las condiciones reportadas en la Tabla 2. Todos los análisis se realizaron por triplicado a partir de muestras independientes.
Ante de las determinaciones de Cu, Zn, Pb, Cd, As, Hg fueron controladas algunas de las interferencias más significativas (Tabla 3), ya que conducen a la no veracidad del resultado.
El contenido total de los metales determinados se comparó con los Estándares Nacionales de Calidad de Agua, correspondiendo a la Categoría 2: Actividades de Extracción y Cultivo Marino Costeras y Continentales: Sub Categoría C4: Extracción y cultivo de especies hidrobiológicas en lagos o lagunas (MINAM, 2015).
Análisis estadístico de los datos Para el tratamiento de los resultados se aplicó como métodos estadísticos el análisis de la varianza factorial con réplicas para definir las fuentes de variación significativas y la prueba de intervalos múltiples de Duncan para determinar las magnitudes individuales de las diferencias que resulten significativas según lo expresado por Montgomery (1991). Todos los cálculos se realizaron utilizando el software profesional Statgraphics (Stapoint Technologies 1994-2001) donde los resultados se consideraron significativos a un nivel de confianza del 95% (p≤0.05).
RESULTADOS Y DISCUSIÓN
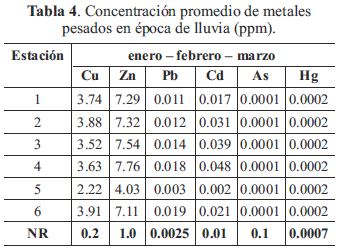
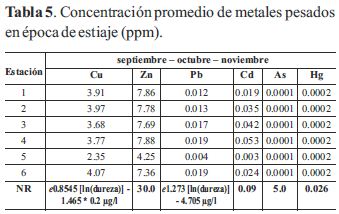
En las tablas 4 y 5 se muestran las concentraciones promedios de los metales en agua para las épocas de lluvia y estiaje.
Excepto As y Hg, el resto de los metales superaron los valores recomendados por la norma regulatoria, no solo en casi todas las estaciones de muestreo, sino además, en ambos períodos, lo cual representa un primer nivel de valoración en cuanto a su concentración total para la aparición de posibles efectos toxicológicos ambientales para el ecosistema.
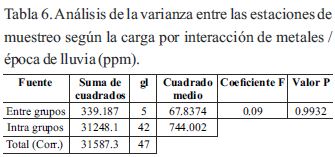
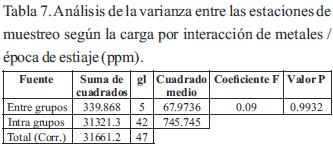
En las tablas 6 y 7 se muestran los análisis de las varianzas para comparar el comportamiento de las concentraciones de metales entre las estaciones durante las épocas de lluvia y estiaje. La tabla ANOVA descompone la varianza de los datos en dos componentes: un componente entre grupos y un componente dentro de grupos. El coeficiente F, que en este caso fue igual para las dos épocas (0.09), es el cociente entre el estimado entre grupos y el estimado dentro de grupos. Puesto que el valor P del coeficiente F fue mayor o igual que 0.05, no existió diferencia estadísticamente significativa entre el promedio de la carga de exposición por efecto de disponibilidad interactiva dada las seis estaciones con un nivel del 95.0% de confianza, lo cual indicó que el comportamiento de los tenores de concentración son similares por cada periodo.
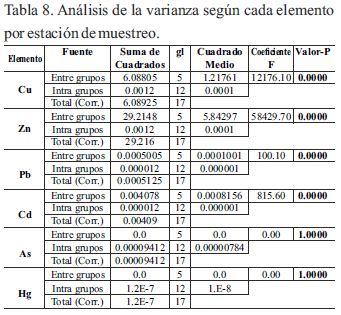
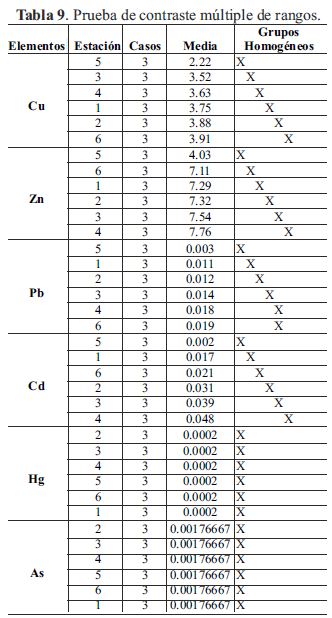
Para considerarse la movilidad y persistencia ambiental de los metales en todo el ecosistema según las estaciones, fue comparado únicamente durante el período de lluvia, el comportamiento de cada elemento entre las seis estaciones donde se observó, que existieron dado el ANOVA, diferencias estadísticamente significativas (tabla 8) y donde se muestra en la tabla 9, los resultados de las pruebas de rango múltiples por cada elemento determinado, donde el método empleado para discriminar entre los promedios fue, el procedimiento de diferencia mínima significativa (LSD) de Fisher.
Con este método hubo un riesgo del 5.0%, al decir que cada par de medias es significativamente diferente, cuando la diferencia real es igual a 0.
En el caso del Hg y Pb se comportaron ambos elementos de manera homogénea entre las seis estaciones, lo cual pudo indicó que no existió variación.
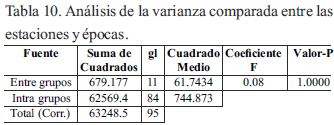
La Tabla 10 muestra, el ANOVA entre las épocas de lluvia y estiaje donde el valor P al ser ≥0.05, indicó que no existió diferencia estadísticamente significativa (95.0% de confianza), por cuanto este resultado muestra que el efecto de remoción ambiental, es prácticamente nulo
La determinación de metales en los cuerpos de agua, puede resultar igualmente relevante a la medición sobre parámetros físico-químicos de calidad ambiental, ya que evidencian de similar modo, el grado de afectación o deterioro que se va generando (Heidary et al., 2012). Es por ello que, considerando la presencia de algunos metales como elementos tóxicos, pueden presentarse en el tiempo, diversos efectos desde el nivel celular hasta organismo y población en cualquier ecosistema (Castañe et al..., 2013). Las alteraciones en el organismo ante los metales, está relaciona no solo con las concentraciones, sino además, el tiempo de exposición así como la vía de entrada del metal, igualmente es relevante (Jäeup et al..., 2012).
En este estudio se observó que dos elementos esenciales para los organismos acuáticos como el Cu y el Zn, superaron el límite máximo permisible según la subcatagoría (4) de referencia. Altas concentraciones de sales solubles de cobre, pueden generar diversos efectos como son la coagulación proteica e inflamación severa de mucosa digestiva donde al sobrevivir el organismo vertebrado, el desarrollo de hemólisis intravascular, es manifestado (Tamsyn et al..., 2017). No existe evidencia de efectos carcinogénicos ante la exposición al cobre o sus compuestos por ninguna vía de exposición, aunque la anemia hipocrómica, disminución de la tasa de crecimiento e infertilidad temporal son algunos de los principales efectos (García et al., 2012).
En peces, las concentraciones elevadas de Cu, afectan las branquias y donde los organismos pueden morir por efectos de hipoxias (Blewett et al..., 2017), además, de presentarse respuesta hepática transcripcional (Uren et al., 2017).
En el caso del Zn, el principal efecto ante las elevadas concentraciones en cuerpos de agua, puede estar dada en afectaciones sobre las defensas antioxidantes a niveles transcripcionales y enzimáticos relacionadas con moléculas de señalización y expresión génica a nivel del bazo (Jia et al., 2017).
El Pb, genera efectos agudos sobre el sistema nervioso central, dolor y debilidad muscular, crisis hemolítica-anemia grave y hemoglobinuria. Asimismo, afecta riñones con oliguria y albuminuria pero de igual modo, la exposición aguda puede causar la muerte. En condiciones de exposición crónica, aparecen daños gastrointestinales, neuromuscular, renal y reproductivo (Mcrill et al., 2013). En peces se han observado además, daños en las fibras musculares (Sia, Ramos & Sia, 2013), inflamaciones degenerativas en hígado y gónadas (Feist et al., 2015), así como ultraestructurales en el tejido branquial (Mohammed et al., 2016).
Dentro de los principales daños por exposición a cadmio, pueden encontrarse estrés oxidativo que conduce a la apoptosis extrínseca e intrínseca en el carcinoma hepatocelular (Nguyena, Willmore & Tayabali, 2013).
En el caso del arsénico, tiene puede provocar daños oxidativos celulares (Pandey & Bhatt, 2015), así como efectos negativos embrionarios, reducción del crecimiento y alteración de los niveles de somatomedina C (factor de crecimiento insulínico tipo I: IGF) en peces (Szymkowicz et., 2017).
Ante la exposición del mercurio en las aguas y sus posibles efectos en los peces puede encontrarse daños severos neurotóxicos (Antunes, 2016), en proteínas cerebrales (Berg et al..., 2010), reducción general de la actividad natatoria y anomalías conductuales para evitar el ataque ante posibles depredadores (Berntssen, Aatland, & Handy, 2003). La toxicidad del mercurio ha sido preocupante en la actualidad, pues muchas investigaciones siguen haciendo referencia a la tragedia ocurrida en Minima-Japón donde su exposición generó hasta la muerte humana (Carocci et al., 2014).
Aunque en este trabajo de investigación no fue analizada la exposición de metales en los sedimentos, esta matriz abiótica ambiental es una de las principales causas que justifica la contaminación de las aguas, ya que los metales se adsorben fácilmente en los sedimentos donde éstos actúan como sumidero y fuente secundaria de contaminación en las propias aguas y la biota acuática cuando resuspenden (Varol & Sen, 2012). La acumulación de los metales en los sedimentos depende de múltiples factores donde pueden mencionarse por ejemplo; las propiedades físico -químicas del agua y las propias concentraciones de los metales (Edokpayi et al., 2016).
Finalmente, la degradación ambiental de la bahía interior en los últimos años ha sido acelerada y ello obedece en lo principal, a las descargas urbano-domésticas que se tributan directamente sin tratamiento alguno donde puede señalarse que al ser clasificada como fuentes puntuales, quizás no es complejo su tratamiento; y por ende, las posibles consecuencias en el medio receptor, podrían ser totalmente reversibles. Dado que Puno como departamento tiene una marcada actividad minera donde muchos de sus ríos presentan aguas contaminadas por metales; y que finalmente, desembocan al Lago Titicaca (aunque no directamente a la Bahía Interior) pero al parecer, las elevadas concentraciones de los metales en la matriz agua, quizás se debe a procesos de movilidad ambiental.
Es importante mencionar que, aunque se han descrito actividades como la pesca y extracción de la totora en este ecosistema (Beltrán et al., 2015) se recomienda, una posible limitación en sus valores de uso, ya que la protección ambiental para esta zona, no es la adecuada.
Se concluyó que existe exposición ambiental por metales en las aguas de la Bahía Interior y donde sus concentraciones son permanentes durante todo el período del año, pudiendo traer consecuencias negativas no solo para el ecosistema, sino además a la propia salud humana dada actividades de beneficio comunitario que se desarrolla en este espacio geográfico.
AGRADECIMIENTOS
A la Universidad Nacional del Altiplano por el financiamiento de esta investigación con los recursos del canon minero (presupuesto nacional). Y al profesor, Humberto Argota Coello, asesor técnico principal del Laboratorio de Minerales "Elio Trincado Figueredo" perteneciente a la Empresa Geominera-Oriente en Santiago de Cuba-Cuba, por el compromiso y la responsabilidad profesional durante las determinaciones y comparaciones analíticas enviadas desde la República del Perú.
REFERENCIAS BIBLIOGRÁFICAS
Antunes, D.A., Appel, H.M., Culbreth, M., López, G.C., Farina, M. & et al., (2016). Methylmercury and brain development: A review of recent literature. J. Trace Elem. Med. Biol, 38, 99-107. [ Links ]
Argota, P.G., & Iannacone, J. (2014a). Computerized gecotox methodology for the prediction of ecotoxicological risk from exposure to contamination effects in environmental effluents and aquatic ecosystems. The Biologist, 12(2), 181-193. [ Links ]
Argota, P.G., & Iannacone, J. (2014b). Similarity in the prediction of ecological risk between the software gecotox® and biomarkers in Gambusia punctata (Poecilidae). The Biologist, 12(2), 85-98. [ Links ]
Argota, P.G. (2015). Aplicación GECOTOXIC para predicción de riesgo ambiental: caso estudio sobre mortandad de peces en la bahía interior del Lago Titicaca, Puno-Perú. Revista CAMPUS, 20(20), 11-19. [ Links ]
Autoridad Binacional Autónoma del Lago Titicaca: ALT. (2005). Diagnóstico del nivel de contaminación de los recursos hídricos del Lago Titicaca. Perú – Bolivia. [ Links ]
Beltrán, F.F.D., Palomino, C.P.R., Moreno, T.E.G., Peralta, G.C. Montesinos, T.D.B. (2015). Calidad de agua de la bahía interior de Puno, lago Titicaca durante el verano del 2011. Revista peruana de biología, 22(3), 335-340. [ Links ]
Berg, K., Puntervoll, P., Valdersnes, S. & Goksøyr, A. (2010). Responses in the brain proteome of Atlantic cod (Gadus morhua) exposed to methylmercury. Aquat. Toxicol, 100, 51-65. [ Links ]
Berntssen, M.H.G., Aatland, A. & Handy, R.D. (2003). Chronic dietary mercury exposure causes oxidative stress, brain lesions, and altered behaviour in Atlantic salmon (Salmo salar) parr. Aquat. Toxicol, 65, 55-72. [ Links ]
Blewett, T.A., Simón, R.A., Turko, A.J. & Wright, P.A. (2017). Copper alters hypoxia sensitivity and the behavioural emersion response in the amphibious fish Kryptolebias marmoratus. Aquatic Toxicology, 189, 25-30. [ Links ]
Carocci, A.; Rovito, N.; Sinicropi, M.S.; Genchi, G. (2014). Mercury toxicity and neurodegenerative effects. Rev. Environ. Contam. Toxicol, 229, 1-18. [ Links ]
Castañe, P.M., Eissa, B.L. & Ossana, N.A. (2013). Respuesta de biomarcadores bioquímicos, morfológicos y comportamentales de la carpa común, Cyprinus carpio, por exposición a muestras ambientales. Ecotoxicology and Environmental Contamination, 8: 41-47. [ Links ]
Constantini M.L., L. Savetta, G. Mancinelli & L. Rossi. (2004). Spatial variavility of the decomposition rate of Schoenoplectus tatora in a polluted area of Lake Titicaca. Journal of Tropical Ecology, 20, 325-335. [ Links ]
Corwin, D.L. & Brandford, S.A. (2008). Environmental impact and sustainability of degraded water reuse. Journal of Environmental Quality, 37, 1-7. [ Links ]
Dixit, R., Wasiullah, Malaviya, D., Pandiyan, K.; Singh, U.B. et al. (2015). Bioremediation of heavy metals from soil and aquatic environment: An overview of principles and criteria of fundamental process. Sustainability, 7, 2189-2212. [ Links ]
Edokpayi, N.J., Odiyo, O.J, Popoola, E.O. Msagati, A.M.T (2016). Assessment of Trace Metals Contamination of Surface Water and Sediment: A Case Study of Mvudi River, South Africa. Sustainability, 8, 1-13. [ Links ]
Feist, S.W., Stentiford, G.D., Kent, M.L., Ribeiro, S.A. & Lorance, P. (2015). Histopathological assessment of liver and gonad pathology in continental slope fish from the northeast Atlantic Ocean. Marine Environmental Research, 106, 42-50. [ Links ]
García, J., Méndez, J., Pásaro, E. & Laffon, B. (2012). Genotoxic effects of lead: An updated review. Environment International, 2(4), 623-636. [ Links ]
He, J., Zhang, H., Zhang, H., Guo, X., Song, M. & et al. (2014). Ecological risk and economic loss estimation of heavy metals pollution in the Beijiang River. Ecological Chemistry and Engineering, 21, 189-199. [ Links ]
Heidary, S., Imanpour, N.J. & Monsefrad, F. (2012). Bioaccumulation of heavy metals Cu, Zn, and Hg in muscles and liver of the stellate sturgeon (Acipenser stellatus) in the Caspian Sea and their correlation with growth parameters. Iranian Journal of Fisheries Sciences, 11, 325-337. [ Links ]
Järup, L., Hellstrom, L., Alfven, T., Carlsson, M.D., Grubb, A., & et al. (2012). Low level exposure to cadmium and early kidney damage: the Oscar study. Occupational and Environmental Medicine, 3(6), 668- 672. [ Links ]
Jia, L.Z., Lin, Z., Bin, S., Mei, Y.X., Ai, Y.Z. & Chang, W.W. (2017). Antioxidant defenses at transcriptional and enzymatic levels and gene expression of Nrf2-Keap1 signaling molecules in response to acute zinc exposure in the spleen of the large yellow croaker Pseudosciaena crocea. Fish & Shellfish Immunology, 52, 1-8. [ Links ]
Londoño Franco, L. F., Londoño Muñoz, P. T., & Muñoz Garcia, F. G. (2016). Los Riesgos De Los Metales Pesados En La Salud Humana Y Animal. Biotecnoloía En El Sector Agropecuario y Agroindustrial, 14(2), 145. [ Links ]
Mcrill, C., Boyer, L.V., Flodod, T.J. & Ortega, L. (2013). Mercury toxicity due to the use of a cosmetic cream. Journal of Occupational and Environmental Medicine, 3(3), 4-7. [ Links ]
Ministerio de Comercio Exterior y Turismo: MINCETUR. (2005). Diagnóstico ambiental de la Bahía Interior de Puno en el Lago Titicaca. Resumen ejecutivo. Lima, Perú [ Links ].
Ministerio del Ambiente: MINAM. (2015). Decreto Supremo: Decreto Supremo N° 015-2015-MINAM. Estándares de calidad de agua. Disponible en: http://www.ana.gob.pe/sites/default/files/normatividad/files/ds-ndeg-015-2015-minam.pdf [ Links ]
Mir, M.A., Mohammad, L.A., Md., S.I. Md., Z.R. (2016). Preliminary assessment of heavy metals in water and sediment of Karnaphuli River, Bangladesh. Environmental Nanotechnology, Monitoring & Management, 5, 27-35. [ Links ]
Mohammed, A.A., Mohd, S.A., Ismail, Y. & Muhammad, A.A. (2016). Ultrastructural effects on gill tissues induced in red tilapia Oreochromis sp. by a waterborne lead exposure. Saudi Journal of Biological Sciences, 23, 634-641. [ Links ]
Molina, C. I., Ibañez, C., & Gibon, F. M. (2012). Proceso de biomagnificación de metales pesados en un lago hiperhalino (Poopó, Oruro, Bolivia): Posible riesgo en la salud de consumidores Biomagnification process of heavy metals of a hiperhaline lake. Ecología En Bolivia, 47(2), 99-118. [ Links ]
Montgomery, C. (1991). Diseño y Análisis de Experimentos. Grupo Ed. Iberoamérica S.A de C.V. México DF.
Nguyena, K.C., Willmore, W.G. & Tayabali, A.F. (2013). Cadmium telluride quantum dots cause oxidative stress leading to extrinsic and intrinsic apoptosis in hepatocellular carcinoma HepG2 cells. Toxicology, 306, 114-123. [ Links ]
Normalization Standart International: ISO 5667-1. (1980). Water quality. Sampling. Part 1: Guidance on the design of sampling programmes. [ Links ]
Normalization Standart International: ISO 5667-2. (1991). Water quality. Sampling. Part 2: Guidance on sampling techniques. [ Links ]
Normalization Standart International: ISO 5667-3. (1994). Water quality. Sampling. Part 3: Guidance on the preservation and handling of samples. [ Links ]
Pandey, N. & Bhatt, R. (2015). Exiguobacterium mediated arsenic removal and its protective effectagainst arsenic induced toxicity and oxidative damage in freshwaterfish, Channa striata. Toxicology Reports, 2, 1367-1375. [ Links ]
Proyecto Binacional Lago Titicaca: PELT. (2000). Descontaminación de la Bahía Interior de Puno, Ministerio de la Presidencia del Perú/ INADE, Puno Perú. Pp 67 [ Links ]
Qadir, A., & Malik, R. N. (2011). Heavy metals in eight edible fish species from two polluted tributaries (Aik and Palkhu) of the river Chenab, Pakistan. Biological Trace Element Research, 143(3), 1524-1540. [ Links ]
Samantray, P., Mishra, B.K., Panda, C.R. & Rout, S.P. 2009. Assessment of wáter quality index in Mahanadi and Atharabanki rivers and Taldanda canal in Paradip Area, India. Journal of Human Ecology, 26, 153-161. [ Links ]
Shortle, J. (2013). Economic and Environmental markets: Lessons from Water-quality trading. Agricultural and Resource Economics Review, 42, 57-74. [ Links ]
Sia, S. G. L, Ramos, B.G. & Sia, S.Ma.L. (2013). Bioaccumulation and histopathological alteration of total lead in selected fishes from Manila Bay, Philippines. Saudi Journal of Biological Sciences, 20, 353-355. [ Links ]
Statgraphics Plus for Windows: SGPW. (2001). Version 5.1. Copyright 1994-2001 for Statistical Graphics Corporation. [ Links ]
Szymkowicz, D., Sims, C.K., Castro, M.N., Bridges, C.W. Bain, J.L. (2017). Embryonic-only arsenic exposure in killifish (Fundulus heteroclitus) reduces growth and alters muscle IGF levels one year later. Aquatic Toxicology, 186, 1-10. [ Links ]
Uren, W. T. M., Willians, D. T., Kadsiadaki. I, Lange, A., Lewis, C. & et al., (2017). Hepatic transcripional responses to copper in the three-spined stickleback are affected by their pollution exposure history. Aquatic Toxicology, 184, 26-36. [ Links ]
Varol, M. & Sen, B. (2012). Assessment of nutrient and heavy metal contamination in surface water and sediments of the upper Tigris River, Turkey. Catena, 92, 1-12. [ Links ]
Wang, C., Hu, X., Gao, Y., & Ji, Y. (2015). ZnO Nanoparticles Treatment Induces Apoptosis by Increasing Intracellular ROS Levels in LTEP-a-2 Cells. BioMed Research International, 1-9.
Wang, X., & Zang, S. (2014). Distribution characteristics and ecological risk assessment of toxic heavy metals and metalloid in surface water of lakes in Daqing Heilonjiang Province, China. Ecotoxicology, 23, 609-617. [ Links ]
Artículo recibido 30/03/2017
Artículo aceptado 12/06/2017
On line: 26/06/2017