Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Altoandinas
versão On-line ISSN 2313-2957
Rev. investig. Altoandin. vol.19 no.2 Puno abr./jun. 2017
http://dx.doi.org/10.18271/ria.2017.272
ARTÍCULO ORIGINAL
Optimización de sustratos para la producción de conidias de Trichoderma harzianum. Por fermentación sólida en la región de San Martín. Perú
Optimization of substrates for conidia production of Trichoderma harzianum By Solid Fermentation in the region of San Martin. Peru
Enrique Arévalo1, José Cayotopa1, Delmar Olivera1, Mar Gárate1, Erick Trigoso, do Bomfim Costa2, Betsabe Leon1
1 Instituto de Cultivos Tropicales; Laboratorio de Fitopatología – Región San Martín Perú;
2 Fundación Pau Brasil, Bahía, Brasil. Autor para correspondencia cayotopatorres@gmail.com
RESUMEN
Con la finalidad de optimizar sustratos alternativos al grano de arroz entero de buena calidad para la producción de conidias de Trichoderma harzianum, se realizó mezclas de residuos agrícolas (cascarilla de arroz entera, cascarilla de arroz molida, cáscara de maní) con arroz triturado de descarte conocido como Ñelen y fuentes nutritivas como agua, urea y carbonato de calcio (CaCo3 ) para seleccionar el mejor sustrato en el que se obtenga la mayor cantidad de conidias viables bajo un diseño completamente al azar, con 14 tratamientos y tres repeticiones. La producción se realizó en dos fases: producción de inóculo mediante fermentación líquida y producción masiva de conidias por fermentación sólida. Se evaluó el número de conidias por gramo de sustrato, porcentaje de germinación y pureza. La producción de conidias de T. harzianum fue superior a 1x1010 conidias. g-1 de sustrato en los residuos agrícolas que fueron mezclados con Ñelen, superando estadísticamente al sustrato convencional (arroz entero). La mayor concentración de conidias se dio en el tratamiento T7 (Cascarilla de arroz entera + Ñelen) seguido de T8 (Cascarilla de arroz molida + Ñelen) y T9 (Cáscara de maní + Ñelen) enriquecidos con urea. Asimismo, el porcentaje de germinación de conidias de T. harzianum mostró niveles superiores al 85%, siendo los tratamientos enriquecidos con agua con valores de germinación ≥ 90 %. Por consiguiente, todos los tratamientos presentaron 100% de pureza, lo cual indica que son aceptados por las normas de calidad y representan una mejor opción para la producción de este hongo.
PALABRAS CLAVES: multiplicación, antagonista, arroz, germinación, pureza
ABSTRACT
In order to optimize alternative substrates to whole rice grain of good quality for the production of Trichoderma harzianum conidia, mixtures of agricultural residues (rice husks whole, rice husks crushed and peanut husks) were carried out with crushed rice Known as Ñelen and nutrient sources such as water, urea and calcium carbonate (CaC03 ) to select the best substrate in which to obtain the largest number of viable conidia under a completely random design, with 14 treatments and three replicates. The production was carried out in two phases; production of inoculum by liquid fermentation and massive production of conidia by solid fermentation. The number of conidia per gram of substrate, percentage of germination and purity was evaluated. The production of conidia of T. harzianum was superior to 1x1010 conidia. g-1 substrate in the agricultural residues that were mixed with Ñelen, statistically surpassing the conventional substrate (whole rice grain). The highest concentration of conidia was in the treatment T7 (whole rice husk + Ñelen) continued T8 (ground rice husk + Ñelen) and T9 (peanut shell + Ñelen) enriched with urea. Likewise, germination percentage of T. harzianum conidia showed levels higher than 85%, being the treatments enriched with water with values of germination ≥ 90%. Therefore, all treatments were 100% pure, indicating that they are accepted by quality standards and represent a better option for the production of this fungus.
KEY WORDS: Multiplication, antagonist, rice, germination, purity.
INTRODUCCIÓN
El uso de especies del género Trichoderma en la agricultura han sido muy utilizados como agentes de biocontrol, para combatir hongos fitopatógenos como Rhizoctonia, Pythium, Sclerotium y Phytophthora entre otros, que afectan muchos cultivos de interés comercial como arroz, maíz, cebolla, tomate, fríjol, trigo, cacao, etc, debido a su versatilidad, adaptabilidad y fácil manipulación (Acosta Rojas & Villa, 2017; Chet, Benhamou, & Haran, 1998; Estrada Carchi, 2017; Guédez, Cañizález, Castillo, & Olivar, 2009; Infante, Martínez, González, & Reyes, 2009; Reyes Duque, Infante Martínez, & Martínez Coca, 2016). Siendo, Trichoderma harzianum un hongo filamentoso que habita en suelos donde los nutrientes de fácil asimilación son escasos, y es alta la competencia con otros organismos, además de formar asociaciones con las raíces de las plantas actúa como promotor de crecimiento, mejorando la absorción de nutrientes— (Harman, 2011; Vásconez & Imbaquingo, 2016). Así, al aplicar este hongo a las semillas, al sustrato en vivero, a las plantas en vivero, recién trasplantadas o plantas establecidas, éste coloniza las raíces formando una capa protectora sobre ellas por medio de diversos mecanismos generando un mayor crecimiento y resistencia a factores abióticos y bióticos (Chávez-García et al., 2008; Hoyos-Carvajal, Orduz, & Bissett, 2009; Ladino-Rey, Chaves-Betancourt, Rubio, & Chacin-Zambrano, 2017; Vera & Leon, 2016). Las necesidades nutricionales de Trichoderma sp. son bien conocidas, es capaz de degradar sustratos muy complejos como almidón, pectina y celulosa entre otros, y emplearlos para su crecimiento gracias al gran complejo enzimático que le confieren gran capacidad de interactuar de forma parasítica y simbiótica con microorganismos y plantas (Alamri, Mostafa, Hashem, & Alrumman, 2016; Gato, 2010; Kamali, Sahebani, & Pourjam, 2016; Mukherjee et al., 2012).
Para la producción masiva de este inoculante biológico se necesita usualmente fuentes de carbono y nitrógeno que promuevan su crecimiento y desarrollo, siendo los sustratos como arroz, avena, soya, trigo, cebada, entre otros utilizados para su producción mediante fermentación sólida, sumergida o bifásica tanto industrial como artesanal (Amaro Leal, Romero Arenas, Rivera, & Huerta, 2015; Ávalos & Geoconda, 2016; Gato, 2010; Ramos, Navarro, Zumaqué, & Violeth, 2008). Existen diferentes formulaciones de hongos antagonistas y su uso depende del modo de acción, es así que para el uso comercial el material seco es el preferido por la importancia del peso y la manipulación de los productos durante la comercialización (Bellino & Marroquín, 2015; Chávez-García et al., 2008; Gómez, Soberanis, Tenorio, & Torres, 2011). Actualmente , el grano entero de arroz sigue siendo uno de los sustratos más utilizados para reproducir Trichoderma spp., el cual tiene costo relativamente alto (Michel-Aceves et al., 2008). Es así que existe interés en la búsqueda de nuevos sustratos, medios de cultivo económico y eficiente, así como por ejemplo residuos orgánicos sub productos de la agroindustria que resulten de fácil adquisición, proporcionen un buen desarrollo y una elevada producción de conidias viables de hongos, y faciliten obtener una nueva metodología de producción masiva de biocontroladores que permitirá reducir el costo de producción y viabilizar un mayor uso de este antagonista en los diversos cultivos.
La utilización de subproductos agrícolas con altos contenidos celulósicos (Quiceno Villada, Gutiérrez, & Yaír, 2012) plantea la posibilidad de reemplazar los sustratos utilizados como el arroz y el trigo, los cuales actualmente su utilización es limitado por los altos costos. En la Región de San Martin, Perú, se producen gran cantidad de residuos agrícolas como la cascarilla de arroz (Oriza sativa) y cascara de maní (Arachis hypogaea) que pueden ser utilizados para evaluar la producción de conidias del hongo Trichoderma sp. mediante procesos de fermentación sólida artesanal y semi-industrial.
En base a la problemática presentada, la finalidad de esta investigación es encontrar un sustrato económico y de fácil adquisición, en el cual Trichoderma tenga un buen desarrollo y una elevada producción de conidias viables, siendo el objetivo seleccionar el mejor sustrato a base de residuos agrícolas en el que se obtenga la mayor cantidad de conidias de Trichoderma harzianum por fermentación sólida.
MATERIALES Y MÉTODOS
La investigación se realizó en el Laboratorio de Fitopatología del Instituto de Cultivos Tropicales (ICT), ubicado en la Provincia y Región de San Martín en Perú, a 315 msnm de altitud, a 06° 00' 28" de latitud sur y 76° 00' 18" latitud oeste.
Cepa de Trichoderma harzianum
Se adquirió una cepa de Trichoderma harzianum de SENASA - Lima en sustrato solido a base de arroz. Para su posterior propagación, la cepa fue aislada en medio agar papa dextrosa (20 gramos de dextrosa, 22 gramos de extracto de papa, 15 gramos de agar), fue incubado durante siete días a una temperatura de 25-28 °C.
Residuos agrícolas
Para evaluar la producción de conidias deTrichoderma harzianum en sustratos sólidos, se utilizaron residuos agrícolas tales como: cascarilla de arroz (Oriza sativa), cascara de mani (Arachis hypogaea) y arroz triturado de descarte conocido como Ñelen provenientes de los centros de procesamiento de productos agrícolas ubicado en la provincia y región de San Martin.
Producción de inoculante en medio líquido
Apartir de cultivos puros de una cepa de Trichoderma harzianum desarrollado en medio de cultivo agar papa sacarosa de siete días de edad, se obtuvieron discos (0.5 mm de diámetro) de medio colonizado con el hongo para ser inoculados en matraces conteniendo medio de cultivo líquido melaza levadura de cerveza (MLC) con cloranfenicol, luego fueron colocados en un agitador orbital a 160 RPM durante cuatro días a temperatura de 25°C (Gómez et al., 2011).
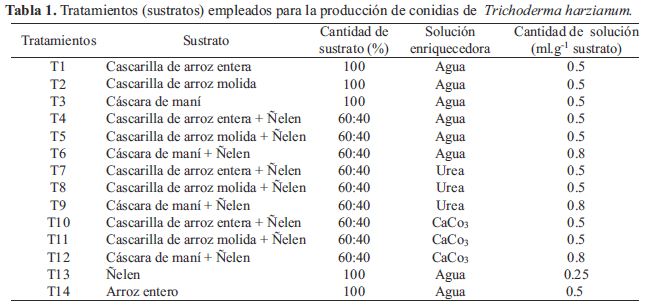
Preparación de los sustratos
La preparación de los sustratos consistió en realizar mezclas de los residuos agrícolas sólidos, según la Tabla 1. Para algunos tratamientos, se trituraron la cascarilla de arroz hasta obtener partículas de 3,0 mm de diámetro y la cascara de maní a 10 mm. Los sustratos fueron pesados en bolsas de polipropileno de 11x16 pulgadas de acuerdo a la proporción indicada, se colocaron en distintas bolsa, agregándole agua o la solución enriquecedora como carbonato de calcio y urea a razón de 4.5 y 2 g/litro disuelto en agua respectivamente, se realizó la mezcla hasta que todo el sustrato quedó húmedo, luego se engrampo las bolsas en el borde superior y se esterilizo en autoclave a 121 °C, 15 libras de presión por 45 minutos (Ramos et al., 2008). Se utilizó el sustrato arroz entero precocido como control humedecido con agua destilada en el mismo rango de humedad de los sustratos mencionados.
Inoculación de los sustratos con Trichoderma harzianum
Para la inoculación, se adaptó a la metodología propuesta por Velez et al. (1997), se trabajó con sustrato estéril y cultivos puros de la cepa de Trichoderma harzianum de 96 horas de incubación en agitación en medio liquido MLC. En condiciones asépticas se agregó una suspensión de conidias a los sustratos a razón de 0.04 ml.g de sustrato, una vez inoculado los sustratos se removió las bolsas para lograr una buena homogenización, finalmente se cerró las bolsas para evitar contaminación.
Proceso de incubación del hongo
Después de la inoculación, las bolsas fueron acondicionadas en sala de germinación en oscuridad a temperatura de 25 °C y humedad relativa del 80% por tres días con la finalidad de propiciar el desarrollo de micelio, transcurrido el tiempo, las bolsas fueron removidas ligeramente con el propósito de brindar oxigenación a los hogos para facilitar el desarrollo (Chávez-García et al., 2008; Michel-Aceves et al., 2008; Pérez, Ramírez, Martínez, & Algecira, 2002).
Esporulación y secado
A los siete días de incubación, abrir las bolsas para favorecer aireación y deshumedecer el sustrato generando una mayor esporulación hasta los 14 días. Los últimos cuatro días del proceso de esporulación los sustratos con los hongos se sometieron a temperatura de 16 °C para facilitar la desecación del sustrato. Finalmente, la cosecha de las conidias del hongo biocontrolador se realizó de manera directa envasando y sellando el producto (Gómez et al., 2011).
Recuento de conidias
Para el conteo de conidias se realizó diluciones seriadas a partir de un (1) gramo de sustrato colonizado con el hongo (conidias más sustrato) y se adicionaron a 9 ml de agua destilada estéril, por cada repetición se realizó la lectura de tres alícuotas de la dilución 10-2 en la cámara de conteo o neubaubuer para determinar la concentración de conidias (Bellino & Marroquín, 2015).
Porcentaje de viabilidad
La viabilidad de las conidias se determinó a partir de una alícuota de 0.1ml de la dilución de 10-2, se depositó esta alícuota en una placa petri conteniendo medio de cultivo agar agua, este procedimiento se realizó tres veces por cada repetición de cada tratamiento, luego las placas fueron incubadas a 25°C en oscuridad durante 16 horas y a través del microscopio se determinó las conidias germinadas y no germinadas (Velez et al., 1997).
Análisis estadístico
El experimento se condujo bajo un diseño completamente al azar con tres repeticiones, las unidades experimentales de cada tratamiento fueron distribuidas al azar. Los datos de número de conidias por gramo de sustrato fueron transformados a logaritmo base 10, y en consecuencia estos fueron procesados en un software estadistico InfoStat, versión 2008 (Di Renzo et al., 2008) para realizar el análisis de varianza (ANOVA) y la comparación de medias se realizó mediante la prueba de Duncan, con un nivel de significancia de 0.05%.
RESULTADOS.
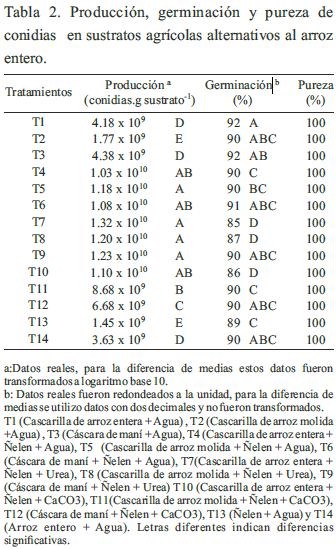
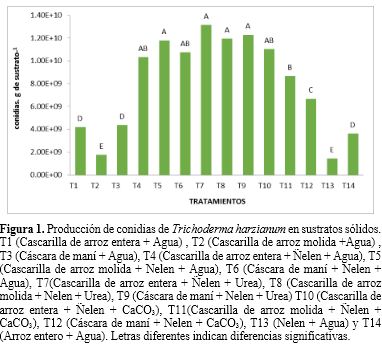
Según los resultados de las pruebas estadísticas, se determinó que existen diferencias estadísticamente significativas entre los tratamientos para los parámetros número de conidias.g de sustrato-1 y porcentaje de germinación (Tabla 2 y Figura 1). Adicionalmente, se puede observar que los residuos agricolas que fueron mezclados con Ñelen llegaron a alcanzar concentraciones superiores a 1 x 1010 conidias.g de sustrato-1, superaron al tratamiento T14 (sustrato arroz entero) en la producción de conidias (3.63 x 109). En general en todos los sustratos inicialmente se evidenció la formación de micelio de color blanco de Trichoderma harzianum y posteriormente, se observó un cambio gradual en la coloración a verde oscuro debido a la generación de conidias; sin embargo, creció de manera abundante y uniforme sobre la superficie de los sustratos con Ñelen (Figura 2). Siendo la mayor concentración de conidias en los tratamientos T7 (Cascarilla de arroz entera + Ñelen), T8 (Cascarilla de arroz molida + Ñelen) y T9 (Cáscara de maní + Ñelen) enriquecidos con Urea con valores de 1.32 x 1010, 1.20 x 1010 y 1.23 x 1010 conidias.g de sustrato-1 respectivamente, seguido del tratamiento T5 (Cascarilla de arroz molida + Ñelen) enriquecido con agua, no habiendo diferencias significativas entre estos; asimismo los tratamientos T4(Cascarilla de arroz entera + Ñelen) y T6 (Cáscara de maní + Ñelen) enriquecidos con agua y T10 (Cascarilla de arroz entera + Ñelen) con CaCO3 presentaron valores altos de producción de conidias con 1.03 x 1010 , 1.08 x 1010 y 1.10 x 1010 conidias.g de sustrato-1 respectivamente a diferencia de los tratamientos T1 (Cascarilla de arroz entera) , T2 (Cascarilla de arroz molida), T3 (Cáscara de maní), T13 (Ñelen) y T14 (Arroz entero) que no fueron mezclados con Ñelen presentaron los valores más bajos de producción de conidias con 4.18 x 109, 1.77 x 109, 4.38 x 109, 4.38 x 109 y 3.63 x 109 conidias.g de sustrato-1 respectivamente.
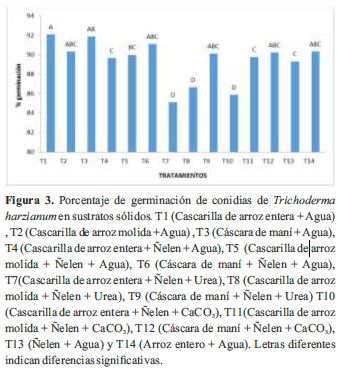
El porcentaje de germinación de Trichoderma harzianum se mostró por encima del 85% para todos los tratamientos, siendo 10 tratamientos que presentaron ≥ al 90% de germinación. Los tratamientos T7 y T8 enriquecidos con urea y T10 con CaCo3 presentaron los valores más bajos en germinación con valores de 85, 87 y 86% de germinación respectivamente, sin diferencias estadísticas significativas; sin embargo, presentaron alta concentración de conidias. Mientras que, los tratamientos que fueron enriquecidos con agua a excepción del T13 presentaron valores de germinacion >= 90 %. Por consiguiente, todos los tratamientos presentaron 100% de pureza, lo cual indica que son aceptados por las normas de calidad y representan una mejor opción para la producción de este hongo (Figura 3 y Cuadro 2).
DISCUSIÓN
Todos los sustratos evaluados superaron la concentración de conidias de 1x109 conidias. g-1 de sustrato; sin embargo, en todos los sustratos que fueron mezclados con Ñelen se evidenció un mayor crecimiento del hongo así como una rápida colonización del sustrato en seis días, relacionado con una coloración verde oscura con una concentración de conidias de hasta 1.32 x 1010 conidias. g-1 de sustrato que supero al sustrato arroz, la alta producción de conidias pudo deberse a la mezcla que se realizó de Ñelen (arroz partido)con cascarilla de arroz entera y molida y cascarilla de mani, ya que el arroz es un sustrato rico en carbono, representado por almidón, aproximadamente 70% (Pinciroli, 2011), proteínas y todos los elementos traza (Mg, Zn y Cu) que requiere Trichoderma sp., para su crecimiento (Samuels, 1996) y con la adición de la cascarilla de arroz y maní superaron estos niveles e hizo que las concentraciones de dichos elementos sean mayores y favorables para Trichoderma. Siendo la composición química: celulosa de 38% y lignina de 26.6% (Quiceno Villada et al., 2012) y 3.56% de proteínas (Valverde, Sarria, & Monteagudo, 2007) en la cascarilla de arroz, lo que favorece para la alimentación del hongo. Asimismo, las concentraciones obtenidas en este estudios supero a lo reportado por Ramos et al. (2008), en donde la mejor producción de conidias registró en el sustrato compuesto por cascarilla de algodón (enriquecida con soluciones de melaza) y semillas de Artocarpus incisa con valores de producción de conidias entre 2,1 x 108 y 8,38 x 108 conidias/g.; mientras que las más bajas concentraciones reportaron en cascarilla de arroz, del mismo modo supero a los sustratos de olote de maíz (13.33 x108 esporas/g.), rastrojo de maíz (4.2 x108 esporas/g.) y cáscara de cacahuate (5.94 x10 8 esporas/g.) (Rosas-Acevedo, Avalos, Rosas-Acevedo, Sánchez-Infante, & Sampedro-Rosas, 2008). Siendo las concentraciones obtenidas ideales para ser utilizadas en las aplicaciones en campo, sabiendo que para utilizar este hongo tanto en invernadero como en campo son necesarias concentraciones a partir de 1x106 a 1x108 esporas/ml (Cooney, Lauren, Jensen, & Perry-Meyer, 1997; Crozier et al., 2015), lo que indica que se utilizara en cantidades mínimas los sustratos estudiados.
Asimismo, en estos sustratos alternativos al arroz entero el porcentaje de germinación y de pureza son aceptados por las normas de calidad y representan una mejor opción para la producción de este hongo, cumpliendo con los requisitos establecidos por Velez et al. (1997) para el control de calidad de formulaciones del hongo. Asu vez, para considerar un biopreparado de calidad, este debe alcanzar la concentración de conidias, mayor o igual a 109 por gramo de sustrato (Gómez et al., 2011). De este modo, Pérez-Guerra, Torrado-Agrasar, López-Macias, and Pastrana (2003) recomiendan el proceso de fermentación sólida para la obtención de biomasa fúngica, debido a su alta tolerancia a bajas actividades de agua, su alto potencial para secretar enzimas hidrolíticas y a su morfología. Indistintamente, en otra investigación Pérez et al. (2002) reportaron que la mejor concentración de conidias se obtuvo con medios sólidos de arroz con 1.6xl09 conidias/g. De manera semejante, en este estudio los tratamientos enriquecidos con Urea fueron los que superaron concentraciones mayora 1 x 1010 , lo cual concuerda con lo reportado por Pandey (2003) quien menciona que el proceso de conidiogénesis en Trichoderma sp., bajo condiciones de cultivo sólido, está asociado a factores como el tamaño de partícula y del material, que resultan adecuados cuando se emplea arroz solo o suplementado con factores de crecimiento como vitaminas, alcanzando concentraciones superiores a 1010 conidias.g-1. A su vez, las mezclas de sustratos sólidos enriquecidos con fuentes nutritivas proporcionaron condiciones de humedad, textura, estructura y disponibilidad de nutrientes para la producción de conidias de Trichoderma harzianum, lo cual se confirma lo señalado por Hjeljord and Tronsmo (1998) al indicar que Trichoderma spp., para su producción masiva en condiciones in vitro presenta facilidad de cultivarse sobre diferentes sustratos de bajo costo.
Por otro parte el tamaño de partícula que se utilizó en este estudio fue adecuado para una mayor producción de conidias y fueron expuestos a temperaturas de 25°C y con exposición a la luz, obteniedo valores de 92% de germinación y 100% de pureza, se sabe que la humedad y tamaño de partícula en el material juega un papel fundamental, así como otros parámetros como luz y temperatura, sabiendo que Trichoderma sp., es fotosensible y se comporta mejor con condiciones de luz día o UV tipo A 366 nm, y temperaturas cercanas a los 25°C (Fonseca, 1998).
En general, los sustratos estudiados con fermentación sólida no influyeron significativamente en la germinación de las esporas, esto indica que durante el crecimiento del hongo sobre los sustratos utilizados, no se generan sustancias que afecten la germinación de las esporas (Cooney et al., 1997). Existen reportes, donde manifiestan que el proceso de fermentación sólida empleando como sustrato arroz-agua destilada a 25ºC y la exposición constante a la luz permitió mayor recuperación de conidias (45x1018conidias/mL), con 96% de germinación a 24 horas y una pureza estimada de 92,1% en fermentación solida frente a la fermentación sumergida que mostro un bajo porcentaje de germinación y pureza. Además, mencionan que todos estos parámetros pueden variar de acuerdo con los aislamientos de Trichoderma (Chávez-García et al., 2008). Del mismo modo en sustratos a base de olote de maíz obtuvieron una germinación de ufc del 99.0% y sobre cáscara de ajo 87.0% (Rosas-Acevedo et al., 2008).
CONCLUSIONES
La producción de conidias de Trichoderma harzianum fue superior a 1x1010 conidias. g-1 de sustrato en siete tratamientos que fueron mezclados con Ñelen, superando estadísticamente al sustrato convencional (arroz entero).
Siendo la mayor concentración de conidias en los tratamientos T7 (Cascarilla de arroz entera + Ñelen), T8 (Cascarilla de arroz molida + Ñelen) y T9 (Cáscara de maní + Ñelen) enriquecidos con Urea. Asimismo, el porcentaje de germinación de conidias de Trichoderma harzianum mostró niveles superiores al 85%, los tratamientos enriquecidos con agua presentaron valores de germinación >= 90 %. Por consiguiente, todos los tratamientos presentaron 100% de pureza, lo cual indica que son aceptados por las normas de calidad y representan una mejor opción para la producción de este hongo.
Agradecimiento
Al Fondo de innovación de Ciencia y Tecnología – Innóvate Perú, por brindar el financiamiento al presente trabajo de Investigación.
REFERENCIAS BIBLIOGRÁFICAS
Acosta Rojas, S., & Villa, J. A. (2017). Evaluación de Trichoderma spp como Control Biológico en una Plantación a Pequeña Escala de Cacao.Journal of Agriculture and Animal Sciences, 5(2).
Alamri, S., Mostafa, Y. S., Hashem, M., & Alrumman, S. (2016). Enhancing the Biocontrol Efficiency of Trichoderma harzianum JF419706 through Cell Wall Degrading Enzyme Production. International Journal of Agriculture and Biology, 18(4), 765-772. [ Links ]
Amaro Leal, L., Romero Arenas, O., Rivera, T., & Huerta, L. (2015). Producción de Trichoderma viride en diferentes sustratos agrícolas. [ Links ] Paper presented at the V Congreso Latinoamericano de Agroecología-SOCLA (7 al 9 de octubre de 2015, La Plata).
Ávalos, G., & Geoconda, V. (2016). Determinación de la estabilidad y viabilidad de Trichoderma harzianum Rifai en cinco sustratos usados para la elaboración de un biofungicida en formulación líquida. (INGENIERA EN BIOTECNOLOGÍA AMBIENTAL), Escuela Superior Politécnica de Chimborazo, Riobamba-Ecuador.
Bellino, C. M. B., & Marroquín, L. C. (2015). Producción de Trichoderma Harzianum en diferentes sustratos orgánicos. Portal de la Ciencia, 4, 68-74. [ Links ]
Cooney, J., Lauren, D., Jensen, D., & Perry-Meyer, L. (1997). Effect of Solid Substrate, Liquid Supplement, and Harvest Time on 6-n-Pentyl-2 H-pyran-2-one (6PAP) Production by Trichoderma spp. Journal of agricultural and food chemistry, 45(2), 531-534. [ Links ]
Crozier, J., Arroyo, C., Morales, H., Melnick, R. L., Strem, M. D., Vinyard, B. T., . . . Bailey, B. A. (2015). The influence of formulation on Trichoderma biological activity and frosty pod rot management in Theobroma cacao. Plant Pathology, 64(6), 1385-1395. doi: 10.1111/ppa.12383 [ Links ]
Chávez-García, M., Montaña-Lara, J. S., Martínez-Salgado, M. M., Mercado-Reyes, M., Rodríguez, M. X., & Quevedo-Hidalgo, B. (2008). Efecto del sustrato y la exposición a la luz en la producción de una cepa de Trichoderma sp.Universitas Scientiarum, 13(3), 245-251. [ Links ]
Chet, I., Benhamou, N., & Haran, S. (1998). Mycoparasitism and lytic enzymes. Trichoderma and Gliocladium, 2, 153-172. [ Links ]
Di Rienzo, J. A., Casanoves, F., Balzarini, M. G., Gonzalez, L., Tablada, M., & Robledo, C. W. (2008). InfoStat software estadistico, Manual del Usuario (Version 2008). Argentina.: Universidad Nacional de Córdoba. [ Links ]
Estrada Carchi, J. I. (2017). Efectos y épocas de aplicación de cinco dosis de trichoderma spp en las enfermedades del cultivo de arroz Oryza sativa L. Facultad de Ciencias Agrarias Universidad de Guayaquil.
Fonseca, L. (1998). Estudio preliminar sobre la dinámica poblacional del biocontrolador Trichoderma spp. en el suelo. (Trabajo de grado. ), Pontificia Universidad Javeriana, Bogotá DC. [ Links ]
Gato, C. Y. (2010). Métodos de conservación y formulación de trichoderma harzianum rifai. Fitosanidad, 14, 189-195. [ Links ]
Gómez, R. H., Soberanis, R. W., Tenorio, C. M., & Torres, S. E. (2011). Manual de producción y uso de hongos antagonistas. In SENASA (Ed.), (pp. 40). LIMA. Peru.
Guédez, C., Cañizález, L., Castillo, C., & Olivar, R. (2009). Efecto antagónico de Trichoderma harzianum sobre algunos hongos patógenos postcosecha de la fresa (Fragaria spp). Revista de la Sociedad Venezolana de Microbiología, 29, 34-38. [ Links ]
Harman, G. (2011). Trichoderma—not just for biocontrol anymore.Phytoparasitica, 39(2), 103-108. [ Links ]
Hjeljord, L., & Tronsmo, A. (1998). Trichoderma and Gliocladium in biological control: an overview. Trichoderma and Gliocladium, 2, 131-151. [ Links ]
Hoyos-Carvajal, L., Orduz, S., & Bissett, J. (2009). Growth stimulation in bean (Phaseolus vulgaris L.) by Trichoderma. Biological Control, 51(3), 409-416. [ Links ]
Infante, D., Martínez, B., González, N., & Reyes, Y. (2009). Mecanismos de accion de Trichoderma frente a hongos fitopatogenos. Revista de Protección Vegetal, 24, 14-21. [ Links ]
Kamali, N., Sahebani, N., & Pourjam, E. (2016). Effect of Trichoderma harzianum BI on chitinase and glucanase activity in tomato roots infected with Meloidogyne javanica and Fusarium oxysporum f. sp. lycopersici. Iranian Journal of Plant Pathology, 52(1). [ Links ]
Ladino-Rey, O. E., Chaves-Betancourt, G. A., Rubio, J. D., & Chacin-Zambrano, C. A. (2017). Evaluación de Trichoderma sobre hongos contaminantes de semillas de palma híbrida interespecífica OxG (Elaeis oleifera x Elaeis guineensis). Respuestas, 22(1), 96-102. [ Links ]
Michel-Aceves, A. C., Otero-Sánchez, M. A., Martínez-Rojero, R. D., Rodríguez-Morán, N. L., Ariza-Flores, R., & Barrios-Ayala, A. (2008). Producción masiva de Trichoderma harzianum Rifai en diferentes sustratos orgánicos.Revista Chapingo. Serie horticultura, 14, 185-191. [ Links ]
Mukherjee, M., Mukherjee, P., Horwitz, B., Zachow, C., Berg, G., & Zeilinger, S. (2012). Trichoderma–Plant–Pathogen Interactions: Advances in Genetics of Biological Control. Indian Journal of Microbiology, 52(4), 522-529. doi: 10.1007/s12088-012-0308-5 [ Links ]
Pandey, A. (2003). Solid-state fermentation. Biochemical Engineering Journal, 13(2), 81-84. [ Links ]
Pérez-Guerra, N., Torrado-Agrasar, A., López-Macias, C., & Pastrana, L. (2003). Main characteristics and applications of solid substrate fermentation. Electronic Journal of Environmental, Agricultural and Food Chemistry, 2(3).
Pérez, L., Ramírez, C., Martínez, M., & Algecira, N. (2002). Efecto de las variables, condiciones de la fermentación y del sustrato en la producción de Trichoderma harzianum. Revista de Protección Vegetal.
Pinciroli, M. (2011). Proteínas de arroz: propiedades estructurales y funcionales. Facultad de Ciencias Agrarias y Forestales.
Quiceno Villada, D., Gutiérrez, M., & Yaír, M. (2012). Alternativas tecnológicas para el uso de la cascarilla de arroz como combustible. (Bachelor's thesis), Universidad Autónoma de Occidente. [ Links ]
Ramos, E. Y. A., Navarro, R. I. Z., Zumaqué, L. E. O., & Violeth, J. L. B. (2008). Evaluación de sustratos y procesos de fermentación sólida para la producción de esporas de Trichoderma sp. Revista colombiana de biotecnología, 10(2), 23. [ Links ]
Reyes Duque, Y., Infante Martínez, D., & Martínez Coca, B. (2016). Eficacia de Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg para el control de Rhizoctonia solani Kühn en condiciones de campo. Revista de Protección Vegetal, 31(2), 107-113. [ Links ]
Rosas-Acevedo, J., Avalos, O., Rosas-Acevedo, A., Sánchez-Infante, A., & Sampedro-Rosas, L. (2008). Utilización de desechos orgánicos como sustrato para la producción de un fungicida natural en la región cafetalera del municipio de Tuxtepec, Oaxaca y Zihuatanejo, Gro. [ Links ]
Samuels, G. J. (1996). Trichoderma: a review of biology and systematics of the genus. Mycological Research, 100(8), 923-935. doi:http://dx.doi.org/10.1016/S0953-7562(96)80043-8 [ Links ]
Valverde, A., Sarria, B., & Monteagudo, J. P. (2007). Análisis comparativo de las características fisicoquímicas de la cascarilla de arroz. Scientia et technica, 1(37).
Vásconez, R. D. A., & Imbaquingo, C. K. E. (2016). AISLAMIENTO, CARACTERIZACIÓN Y EVALUACIÓN DE Trichoderma spp. COMO PROMOTOR DE CRECIMIENTO VEGETAL EN PASTURAS DE RAYGRASS (Lolium perenne) Y TRÉBOL BLANCO (Trifolium repens). La Granja, 25(1), 53-61. [ Links ]
Velez, P. E., Posada, F. J., Marin, P., Gonzalez, M. T., Osorio, E., & Bustillo, A. E. (1997). Tecnicas para el control de calidad de formulaciones de hongos entomopatogenos. . In Cenicafe (Ed.), (Primera edicion ed.). Colombia: Ospina, H.F. [ Links ]
Vera, J. L., & Leon, B. (2016). Efecto de métodos y dosis de aplicación de trichoderma veride en la aclimatación y crecimiento de vitroplantas de papa varidad imilla negra durante las épocas de Invierno Primavera. Revista de Investigaciones Altoandinas-Journal of High Andean Research, 18(1), 47-54. [ Links ]
Artículo recibido 11/11/2016
Artículo aceptado 21/06/2017
On line: 26/06/2017