Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Altoandinas
versão On-line ISSN 2313-2957
Rev. investig. Altoandin. vol.19 no.2 Puno abr./jun. 2017
http://dx.doi.org/10.18271/ria.2017.274
ARTÍCULO ORIGINAL
Comparación de sistemas de cultivo de embriones de alpacas
Comparison alpacas embryos cultivation systems
Pérez Durand, Manuel Guido1*; Zevallos Aragón Juan Pompeyo1; Perez Guerra, Uri Harold2
1 Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional del Altiplano, Puno, Perú.
2 Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, Lima, Perú.
* Autor para correspondencia guidpe@yahoo.es
RESUMEN
El presente estudio se llevó a cabo en laboratorio de Reproducción animal de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional del Altiplano Puno-Perú. El objetivo principal fue evaluar el efecto del cultivo in vitro e in vivo de los cigotos de alpacas producidos in vitro. Se utilizaron 226 Complejos cumulus ovocitos (CCOs), que fueron obtenidos de los ovarios procedentes de alpacas beneficiadas en el camal. Los ovarios fueron transportados en solución salina al 0.9% y suplementada con antibióticos. Los CCOs fueron aspirados de folículos de 2 a 6 mm. Los ovocitos fueron madurados en TCM 2520, suplementado con 2.2 mg/mL con bicarbonato de sodio, 0.0028 mg/mL de piruvato de sodio, 10% de suero fetal, 2 U.I./mL de gonadotropina coriónica equina, 10 U.I./mL de gonadotropina humana más 50 ug/mL de gentamicina y fueron cultivados a 38.5°C, bajo 5% de CO2, y alta humedad por 36 h. La fertilización se realizó en FERT TALP (10 ovocitos/gota). Para el cultivo in vitro se utilizó el SOFaa. Para el cultivo in vivo se utilizó el oviducto de hembras. Los resultados fueron evaluados: A las 120 h de cultivo in vitro post inseminación se observaron 19(17.4%) mórulas y 8 (7.3%) blastocitos y a las 168 h se observaron 18 (16.5%) mórulas y 7(6.4%) blastocitos. Del cultivo in vivo en el oviducto de las alpacas receptoras se recuperaron 3 blastocitos eclosionados, 5 blástulas y 2 blástulas colapsadas. En conclusión, tanto el cultivo in vitro como in vivo de cigotos producidos in vitro pueden ser utilizados en la producción de embriones de alpacas.
PALABRAS CLAVES: Ovocitos, cigoto, cultivo, embriones, alpaca.
ABSTRACT
The present study was carried out in a laboratory of Animal Reproduction of the Faculty of Veterinary Medicine and Animal Science of the National University of the Puno-Peru Highland. The main objective was to evaluate the effect of in vitro and in vivo culture of alpacas zygotes produced in vitro. We used 226 cumulus oocyte complexes (CCOs), which were obtained from the ovaries from animals that were beneficiated in the camal and transported in 0.9% saline and supplemented with antibiotics. CCOs were aspirated from follicles of 2 to 6 mm. The oocytes were matured in TCM 2520, supplemented with 2.2 mg/mL with sodium bicarbonate, 0.0028 mg/mL sodium pyruvate, 10% fetal serum, 2 IU/mL equine chorionic gonadotropin, 10 IU/mL chorionic gonadotropin Human plus 50 ug/mL gentamicin and were cultured at 38.5°C, under 5% CO2, and high humidity for 36 h. Fertilization was performed in FERT TALP (10 oocytes/drop). For the in vitro culture SOFaa was used. In vivo culture was used oviduct of females. The results were: At 120 h of culture in vitro post insemination, 19 (17.4%) morulae and 8 (7.3%) blastocytes were observed and at 168 h, 18 (16.5%) morulae and 7 (6.4%) blastocytes were observed. From the in vivo culture in the oviduct of the receiving alpacas 3 blastocytes hatched, 5 blastulas and 2 collapsed blastulas were recovered. Conclusion The in vitro and in vivo culture of the zygotes produced in vitro is possible to be used for the production of alpaca embryos.
KEY WORDS: oocyte, zygote, culture, embryos, alpaca.
INTRODUCCIÓN
Las alpacas y llamas habitan por encima de los 4 000 msnm y son criadas por pobladores de los andes del Perú, Estos animales les proveen de carne, fibra, estiércol, además del uso de las llamas como transporte (Novoa et al., 1970; Fernandez-Baca et al., 1970).
El desarrollo de las biotecnologías reproductivas en los camélidos sudamericanos, permitiría la propagación de los animales genéticamente superiores, especialmente los que poseen fibra fina y de colores naturales (Miragaya et al. 2006). Estudios realizados en producción de embriones in vitro con el objetivo de desarrollar protocolos en camélidos sudamericanos son pocos. En llamas (Del Campo et al., 1994; Sansinena et al., 2007; Conde et al., 2008), alpacas(Ratto et al., 2007; Ruiz et al., 2013; Arriaga et al., 2014; Huanca et al. 2014), reportan del 6 al 20% de producción de embriones en diferentes estadios. Mientras que en la especie bovina la producción de embriones in vitro es a nivel comercial, en forma de embriones frescos o congelados, oscilando las tasas de preñes entre 50 % y 40% respectivamente, favoreciendo una mayor eficiencia y el avance genético en esta especie (Sanches et al., 2016).
El objetivo principal del presente estudio fue producir embriones in vitro a partir de ovocitos recuperados de ovarios de alpacas beneficiadas en el camal. El cultivo de los embriones se realizó por dos métodos: a) en placas dentro una incubadora convencional y b) los cigotos fueron transferidos al oviducto de hembras receptoras sincronizadas (ovulación y formación de cuerpo lúteo) para completar su desarrollo.
III. MATERIALES Y MÉTODOS
3.1. Colección y maduración de los ovocitos
Los ovarios de las alpacas sacrificadas, fueron colectados del camal municipal de Nuñoa, ubicado en las coordenadas 14°28´48´´S, 70°38´28´´O, a 4023 msnm, Provincia de Melgar, Departamento de Puno. Fueron transportados dentro las 6 h siguientes al Laboratorio de Reproducción Animal de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional del Altiplano Puno-Perú. Los ovarios fueron acondicionados en bolsas pequeñas de polietileno con solución fisiológica (32 a 35°C), suplementado con 0.03 g/mL de Combipen (150 000 U.I. de penicilina G procainica, 150 000 U.I. de penicilina G sódica, 300 mg de sulfato de estreptomicina/mL, GENFAR S.A. Lima-Peru), estas bolsas con los ovarios se acondicionaron dentro de un dispositivo (Thermos) de agua caliente. En el laboratorio los ovarios fueron lavados dos veces con solución fisiológica suplementada con antibióticos. Los folículos(>de 2 mm), fueron aspirados con ayuda de una aguja de 20G adosado a jeringa de 5 mL. El líquido folicular obtenido fue depositado en un tubo Falcón de 15 mL y cerrado con su tapa, se dejó reposar por 20 min. Luego el sobrenadante fue eliminado con ayuda de una jeringa de tuberculina y el sedimento fue vertido a una placa Petri (10 x 35 mm), todos estos procesos se realizaron a una temperatura de 37ºC. Los complejos cumulus-ovocitos (CCOs) fueron seleccionados con ayuda de un microscopio-estereoscopio invertido (Leica) a 40X. Los CCOs fueron clasificados de acuerdo al criterio recomendado por Leisinger et al. (2014). Los CCOs seleccionados fueron lavados 3 veces, en solución fosfatada (PBS) suplementado con 4 mg/mL de BSA (Sero Albumina Bovina), mas 50 ug/mL de gentamicina (GENFAR S.A. Lima-Peru). Cada 10 CCOs fueron lavados dos veces en el medio de maduración y luego transferidos a 60 uL de medio de maduración. El medio de maduración consistió de TCM 2520, suplementado con 2.2 mg/mL con bicarbonato de sodio, 0.0028 mg/mL de piruvato de sodio, 10% de suero fetal, 2 U.I./mLde gonadotropina corionica equina(eCG; Folligon, IntervetPty. Ltd., Netherlands), 10 U.I./mL de gonadotropina corionica humana (hCG; N.V. Organon O.S. Holland) más50 ug/mL de gentamicina y fueron cultivados dentro una incubadora a 38.5ºC, bajo 5% de CO2 y con una humedad (> 90%) por 36 h.
3.2. Colección y preparación de los espermatozoides
Como donadores de espermatozoides se utilizaron dos machos con desviación de los conductos deferentes (Pérez y col., 2006). Para la colección de los espermatozoides los machos dadores fueron colocados sobre una mesa en posición decúbito lateral, siendo sujetados los miembros posteriores por dos auxiliares. La colección se realizo de acuerdo a lo descrito por Pérez y col.(2006), con la variación de que el medio de colección fue 1 mL de solución de tiroides modificado(SPERM TALP:100 mMNaCl, 3.1 mMKCl, 25.0 mM NaHCO3, 0.3 mM NaH2PO4 ,21.6 mM lactato de sodio, 2.0 mM CaC12, 0.4 mM MgC12 , 10.0 mM HEPES, 1.0 mM de piruvato de sodio, 3 mg/ml BSA fracción V y 50 ug/mLde gentamicina;Parrish et al. 1988). La suspensión de los espermatozoides por el método de swim up se llevo a cabo dentro la incubadora por 1 h a 38.5oC, con 5% de CO2 y alta humedad. Del sobrenadante se aspiró 700 uL y se centrifugo a 350 x g por 10 min, desechando el sobrenadante. El pellet formado por los espermatozoides fue re suspendido con 100 uL de solución de tiroides modificado ( FERT TALP: 114.0 mM NaCl, 3.2 mM KCl, 25.0 mM NaHCO3, 0.3 mM NaH2PO4, 10.0 mM lactato de sodio, 2.0 mM CaC12, 0.5 mM MgC12, 0.25 mM de piruvato de sodio, 6 mg/mL de BSA libre de ácidos grasosy 50 ug/mL de gentamicina; Parrish et al., 1988), la concentración de los espermatozoides fue ajustada a 5 x 106 de espermatozoides/mL (Conde et al.,2008), tomando en cuenta la motilidad total de los espermatozoides.
3.3. Fertilización in vitro
Las células del cumulus de los ovocitos madurados, fueron removidos por vorterizacion a 4000 rpm por 3 min, en 0.5 mL de PBS + 0.4 mg/mL de BSA, dentro un tubo de ensayo de 7 mL de capacidad. En los ovocitos desnudados se evaluó la maduración ovocitaria por presencia del corpúsculo polar bajo un microscopio estereoscopio invertido a 100X y 200X. Los ovocitos desnudados fueron lavados 2 veces en el medio FERT TALP (Parrish et al. 1988), luego transferidos a una gota de 44 uL de FERT TALP (10 ovocitos), dentro de placas Petri de 35 mm x 10 mm, cubiertos con aceite mineral. 10 min antes de la inseminación se suplementaron a la gota de fertilización 2 uL de la mezcla (500 uM de penicillamine, 250 uM de hipotaurina, 500 uM de epinefrina (Leibfried and Bavister 1982), 10 ug/mL de heparina (Conde et al. 2008) y 2 uL de la concentración de espermatozoides. Se incubaron por 24 h a 38.5ºC en una atmósfera húmeda con 5% de CO2 .
3.4. Cultivo de los cigotos
Los presuntos cigotos fueron vorterizados a 4000 rpm por 4 s para retirar el resto de los espermatozoides. Los cigotos se colocaron por 7 días más en medio de cultivo (10 a 15 cigotos en 50 uL cubiertos con aceite mineral) fluido oviductal sintetico (SOF) (Tervit et al., 1972) suplementado con el 2% (v/v) de aminoácidos esenciales, 1% (v/v) de aminoácidos no esenciales, 50 ug/mL de gentamicina mas 5% de suero fetal en los 4 primeros días de cultivo y el 1% en los 3 días siguientes. La incubación se realizó a 38.5ºC en una atmósfera húmeda con 5% de CO2 . El cambio de medio se realizó cada 48 h.
3.5. Evaluación del desarrollo embrionario in vitro
La división celular y el desarrollo embrionario se registraron en imágenes a las 48, 120 y 168 h post fertilización, con ayuda de un microscopio estereoscopio invertido a 100X y 200X y su aplicación (Leica application Suite Version 2.0.0, 2010).
3.6. Cultivo de cigotos en el oviducto de alpaca
A las alpacas receptoras (n=3), se les monitoreo la presencia del folículo pre-ovulatorio> 7mm, usando un ultra sonógrafo con transductor lineal a 7.5 MHz (Chison 550). Se indujo la ovulación con la aplicación (IM) de 8 ug de GnRH, a las 24 h se evaluó la ovulación por ultrasonografía. Los cigotos producto de la maduración y fertilización in vitro se colocaron en el oviducto de las alpacas 60 h (después de la fertilización) pos aplicación de GnRH. Para exteriorizar el oviducto de las alpacas se realizó la cirugía (laparatomia), se anestesio a la hembra administrando vía intravenosa 0.4 mg/de xilacina (Clorhidrato de Xilacina, 5mg/kg de ketamina (Ketamina, Laboratorios Veinfar I.C.S.A. Argentina). Para mantener la anestesia se colocó una cánula en la vena yugular para suplementar 5 mg de ketamina cada 15 min hasta los 30 min (Ratto et al., 2007). Por la incisión de 10 cm realizada en la línea alba a 4cm de la glándula mamaria, con ayuda de los dedos se exteriorizo el ovario. Se fijó entre los dedos el infundíbulo y a 2 cm del ovario, en dirección al ámpula se punzo el oviducto con una aguja 18G, para aperturar la pared del oviducto. Con ayuda del capilar de vidrio de un micro dispensador (Drurmmond Sxientific Company) calibrado para 5 uL los cigotos se cargaron en PBS + 10% de suero fetal y se introdujeron a una profundidad de 3.5 cm dentro el oviducto.
3.7. Recuperación de los embriones del oviducto de las receptoras
Las alpacas receptoras fueron puestas en ayuno por 24 h antes del día de la recuperación de los embriones y se procedió de la siguiente manera: a) 20 min antes de la recuperación se tranquilizaron aplicando 1 mg de maleato de acepromazina/Kg de peso vivo, b) Las receptoras fueron inmovilizadas sobre una mesa, pasando una cuerda por encima de la región de la cruz y grupa, c) Se introdujo la mano izquierda enguantada y lubricada por el recto para vaciar el contenido fecal, d) Se higienizo con abundante agua y jabón la región perianal, se secó con papel toalla y se desinfecto con alcohol, e) Se aplicó una anestesia epidural aplicando 1.5 mL de lidocaína clorhidrato al 2%, f) Con la ayuda de la guía para inseminación artificial se introdujo la sonda Foley Nro 16 Fr/Ch de dos vías para atravesar la cérvix y dirigirla hacia el cuerno cuyo ovario tenía el cuerpo lúteo, g) Ubicado el cuerno se ancló la sonda inflando el balón con 7 a 10 mL de aire, luego se retiró la guía, h) El medio de lavado PBS+1% de suero fetal se introdujo con ayuda de un tubos de plástico en forma ¨Y¨ conectado al frasco que contenía el medio y por gravedad se llenó la solución de lavado, hasta sentir la turgencia del cuerno uterino, momento en que se cerró el clip y luego se dejó salir el medio de lavado hacia el filtro colector, abriendo el respectivo clip, con la ayuda de suaves masajes del cuerno, i) Este procedimiento se repitió por tres a cuatro veces, luego se extrajo el aire del balón para retirar la sonda Foley, j) El filtro colector se llevó al laboratorio para que el contenido sea vertido en una placa Petri, se realizó la búsqueda de los embriones y posterior clasificación bajo el microscopio estereoscopio a 40X .
RESULTADOS
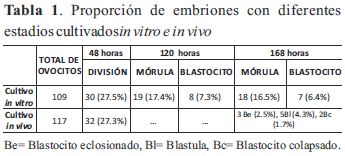
Para la producción de embriones de camélidos, se emplearon un total de 226 ovocitos de grado 1 y 2, recuperados de ovarios. Durante el cultivo se perdieron 5 embriones. Los resultados de producción de embriones directamente se evaluaron a partir de la división, 48 h pos inseminación y se muestran en la Tabla 1 y Fig. 1. El número de embriones asignados para el cultivo in vitro e in vivo fueron 30 y 32 cigotos respectivamente, para cada tratamiento. Durante la evaluación a las 48 h pos inseminación se observaron 11 ovocitos con la presencia del primer corpúsculo que no fertilizaron. También se observaron al momento de fertilizar 2 embriones en división con 2 células por efecto de la partenogénesis.
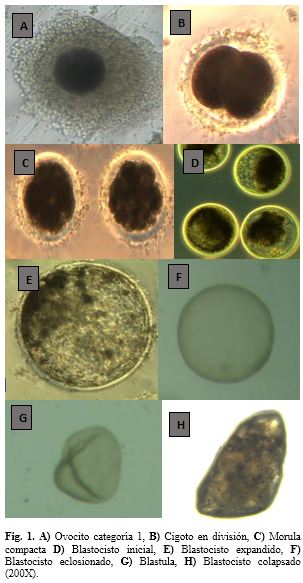
En la evaluación a las 120 h pos inseminación de los embriones del cultivo in vitro se observaron diferentes estadios: mórulas 19(17.4%) y blastocitos 8 (7.3%). Entre las cuales 16 fueron mórulas compactas y 3 embriones con 4 a 8 células con blastómeros de desarrollo desigual. 7 blastocitos estuvieron en el estado inicial y 1 blastocito expandido.
A la evaluación a la 168 h pos inseminación de los embriones en el cultivo in vitro se perdieron 2 embriones y se observaron 18 (16.5%) mórulas y 7 (6.4%) blastocitos. Donde 4 mórulas se mantenían como compactas, 3 embriones estuvieron detenidos con 4 a 8 células y en proceso de degeneración, 11 mórulas en proceso de degeneración y deformación. En los 7 blastocitos se observaron inicios de degeneración y deformación tornándose de color negro.
Los 32 cigotos que fueron asignadas para el cultivo in vivo se transfirieron a oviductos de 3 alpacas receptoras (10, 11, 11 cigotos). El lavado se realizó a los 5 días posteriores del cultivo en el oviducto de las alpacas receptoras. De los 32 cigotos transferidos a los oviductos de las receptoras se recuperaron 10 embriones, que hacen el 31.2% de tasa de recuperación, observándose los siguientes diferentes estadios: 3 blastocitos eclosionados, 5 blástulas y 2 blástulas colapsadas.
DISCUSIÓN
La producción de embriones in vitro, en el presente estudio fue el 22.9% de embriones a las 168 h post inseminación en diferentes estadios y categorías. Contrastando con previos estudios, realizados en llamas (Del Campo et al., 1994) obtuvieron 15.85% embriones con 2 a 16 células mientras que en alpacas aplicando diferentes tiempos de maduración (Huanca et al., 2014) lograron el 19.8% de porcentaje de división a las 72 h post maduración.
.Conservando los ovarios a diferentes temperaturas y con 16 h de conservación, Arriaga et al., (2014) reportaron el 27.3% de embriones divididos a la 72 h post maduración. La amplia variación de resultados reportados se podría deberse a las diferentes condiciones que han sido utilizadas por los diferentes autores para el proceso de la producción de embriones in vitro en camélidos. A pesar de estos resultados en la producción de embriones in vitro en camélidos sudamericanos faltarían. Es necesario realizar estudios para implementar los protocolos para esta especie y lograr los porcentajes elevados como los obtenidos en vacunos que llegan alrededor del 70% de división de los embriones, después de 44 a 48 h post fertilización con producción de embriones en estado de blastocito del 32% (Coleman et al., 2007). La presencia de embriones por partenogénesis en camélidos se manifiestan en un 3% (Del campo et al, 1994), lo que se ratifica en el presente trabajo.
En el presente estudio, a las 120 h de cultivo pos inseminación in vitro la proporción de embriones que se logro fue: 19 (17.4%) mórulas compactas y 8 (7.3%) de blastocitos tempranos. En la cronología del desarrollo embrionaria y la migración al útero, los embriones a los 5 días post ovulación, Picha et al. (2013), reportaron que el 100% de los embriones están estado de mórula y todavía permanecen en el oviducto. Existiendo una diferencia en el estadio de embriones a las 120 h (5 días) con el presente estudio, en donde se constató la presencia de blastocitos tempranos, esta variación podría atribuirse al efecto de los medios de cultivo utilizados y tipo de folículos aspirados para producción de embriones in vitro en la especie alpaca. En camélidos no existen reportes de embriones cultivados por 5 días o 120 h post fertilización in vitro, pero si reportan a partir de los 7 días post inseminación.
En el presente estudio a las 168 h post inseminación se lograron 18 (16.5%) mórulas, 7(6.4%) blastocitos. En todos los embriones se notó el inicio del proceso de degeneración y deformación. En llamas Del campo et al. (1994) reportaron el 5.6% de mórulas y 6.0% de blastocitos tempranos 7 días post inseminación y en el cultivo con la presencia con células oviductales de llama, en alpacas se han logrado el 21.1% de blastocitos de ovarios que se sometieron a una conservación por 16 h y a diferentes temperaturas antes de la colección de los ovocitos (Arriaga et al., 2014). La proporción de embriones producidos en alpacas en los estudios `previos y contrastados con los resultados del presente estudio son similares.
La presencia de embriones con procesos de degeneración y deformación a partir del 7 día de cultivo, se debe probablemente al protocolo aplicado, insumos u otros factores que no se pueden controlar en la altura (3870 msnm).
Después que los embriones fueron cultivados en el oviducto de las hembras receptoras por espacio de 5 días se recuperaron10 embriones de 32 cigotos que se colocaron. Los estadios de los embriones recuperados, fueron 3 en blastocitos eclosionados, 5 en estado de blástula y 2 en estado de blástulas colapsadas. Reportes de este tipo de cultivo de embriones no existen en camélidos siendo este estudio el primero que se presenta. Estudios en hembras con monta natural, sobre la cronología de desarrollo embrionario y migración uterina, indican que a los 8 días post ovulación están en estado de blastocito eclosionado y a los 9 días comienzan a alongarse (Picha et al., 2013) lo que nos permite inferir que los resultados de presente estudio coinciden en el desarrollo de los embriones, asumiendo que las 120 h es igual a 5 días, aquí se le suma 48 h post maduración que hacen 2 días y finalmente se le suma 24 h que corresponden a un día de fertilización. Realizando la sumatoria de los días correspondientes hacen (2+1+5) hacen los 8 días, donde los embriones están en estado de blastocito eclosionado. Pero en el presente estudio se recuperaron 2 embriones en estado de blástulas colapsadas, debido probablemente a la ruptura que se produjo en el momento de la colección por presiones externas, lo cual fue provocado por el sistema de colección que se uso en la técnica de recuperación.
El estado cronológico y morfológico de los embriones recuperados de las receptoras indica que el efecto del medio ambiente del oviducto actuó positivamente en su desarrollo. Así diversos estudios refieren que el embrión permanece después de la fertilización 3.5 a 4 días en el oviducto, durante este tiempo el embrión desarrolla y es mantenido por el fluido del oviducto, este periodo es crítico para los embriones de animales porque se incluye la activación genómica embrionaria, que sirve para la diferenciación, implantación y desarrollo fetal (Memili and First, 2000; Neimann and Wrenzycki, 2000). Lo que no sucedió con los embriones producidos in vitro.
CONCLUSIONES
Al cultivo in vitro se observaron diferentes estadios embrionarios (mórulas, blastocitos), en donde algunas de las cuales entraron en proceso de degeneración y deformación al final del cultivo. Los cigotos cultivados en el oviducto de hembras receptoras fueron más uniformes como blastocitos eclosionados y blástulas.
Es necesario seguir estudiando medios específicos para la producción de embriones in vitro en camélidos sudamericanos.
Agradecimiento Un especial agradecimiento al Proyecto de investigación Nro. 04-029-2015-OGAJ-UNAPUNO, financiado por la Vice-rectoría de Investigación de la Universidad Nacional del Altiplano.
REFERENCIAS BIBLIOGRÁFICAS
Arriaga IC, Huanca W, Terreros M, Becerra JJ, García PH, Ampuero A. 2014. Efecto de Temperatura y Tiempo de Almacenamiento de Ovarios de Alpacas sobre la Tasa de Maduración y División in vitro de Ovocitos. RevInvVet Perú 25(4), 477-486. [ Links ]
Coleman NV, Shagiakhmetova GA, Lebedeva IY, Kuzmina TI, Golubev AK. 2007. In vitro maturation and early developmental capacity of bovine oocytes cultured in pure follicular fluid and supplementation with follicular wall. Theriogenology 67, 1053 –1059. [ Links ]
Conde PA, Herrera C, Trasorras VL, Giuliano S, Director A, Miragaya MH, Chaves MG, Sarchi MI, Stivale D, Quintans C, Agüero A, RutterB, Pasqualini S. 2008. In vitro production of llama (Lama glama) embryos by IVF and ICSI with fresh semen. Anim. Reprod. Sci. 109, 298–308. [ Links ]
Del Campo MR, Del Campo CH, Donoso X, Berland M, Mapletoft R. 1994. in vitro fertilization and development of llama (Lama glama) oocytes using epididymal spermatozoa and oviductalcell co-culture. Theriogenology 41, 1219 –1229. [ Links ]
Fernadez-Baca S, Hansel W, Novoa C. 1970. Embryonic mortality in the alpaca. Biol Reprod 3, 243-251. [ Links ]
Huanca W, Condori R, Chileno M, Garcia P, Cainzo J, Becerra JJ. 2014. Evaluación de cuatro tiempos de cultivo sobre la tasa de maduración y división pos fecundación in vitro de ovocitos de alpaca. Rev Inv Vet Peru 25(4), 468-476. [ Links ]
Leibfried ML, Bavister BD. 1982. Effects of epinephrine and hypotaurine on in-vitro fertilization in the golden hamster. J ReprodFertil 66, 87-93. [ Links ]
Leisinger CA, Coffman EA, Coutinho da Silva MA, Forshey BS, Pinto CRF. 2014. Factors affecting in vitro maturation of alpaca (Lama paco) oocytes. Anim. Reprod. Sci. 150, 70-75. [ Links ]
Memeili E, First NL. 2000. Zygotic and embryonic gene expression in cow: a review of timing and mechanisms of early gene expression as compared with other species. Zigote 8, 87-97. [ Links ]
Miragaya MH, Chaves MG, Aguero A. 2006. Reproductive Biotchnology in south American camelids. Small Ruminant Research 61, 299-310. [ Links ]
Niemann H, Wrenzycki C. 2000. Alterations of expression of developmentally important genes in pre-implantation bovine embryos by in vitro culture conditions: implications for subsequent development. Theriogenology53,21-34. [ Links ]
Novoa C. 1970. Reproduction in camelidae (Review). J Reprod Fertil 22, 3-20. [ Links ]
Parrish JJ, Susko-Prurish J, Winer MA, First NL.1988. Capacitation of bovine sperm by heparin. Biol Reprod, 38,1171-1180. [ Links ]
Pérez MG, Apaza E, Deza H. 2006. Congelación de los espermatozoides procedentes de los conductos deferentes de camélidos. Allpaqa, Revista de Investigación del IIPC Vol. 11 Nro 01. pp 17-23, Puno-Perú [ Links ].
Picha Y, Tibary A, Memon M, Kasimanickam R, Sumar J. 2013. Chronology of early embryonic development and embryo uterine migration in alpacas.Theriogenology 79, 702-708. [ Links ]
Ratto M, Gómez C, Berland M, Adams GP, 2007. Effect of ovarian superstimulation on COC collection and maturation in alpacas. Anim.Reprod. Sci. 97, 246–256. [ Links ]
Ruiz J, Landeo L, Mendoza J, Artica M, Correa JE, Silva M, Miragaya MH, RattoM.2013. Vitrification of in vitro mature alpaca oocyte: Effect ofethylene glycol concentration and time of exposure in theequilibration and vitrification solutions. Anim. Reprod. Sci. 143, 72-78. [ Links ]
Sanches BV, Alvares P, Hayasi J, Lopes B, Colombo MH, Gaitkoski D, Basso AC, Robert D, Seneda MM. 2016. A new direct transfer protocol for cryopreserved IVF embryos. Theriogenology 85, 1147-1151. [ Links ]
Sansinena MJ, Taylor SA, Taylor PJ, Schimidt EE, Denniston RS, Godke RA. In vitro production of llama (Lama glama) embryos by intracytoplasmatic sperm inyection: Effect of chemical activation treatments and culture conditions. Anim. Reprod. Sci. 99, 342-353. [ Links ]
Tervit HR, Whitting DG, Rowson LEA. 1972. Succesful culture in vitro of sheep and cattle ova.J ReprodFertil 30, 493–497. [ Links ]
Artículo recibido 20/12/2016
Artículo aceptado 18/06/2017
On line: 26/06/2017