Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Altoandinas
versión On-line ISSN 2313-2957
Rev. investig. Altoandin. vol.19 no.3 Puno jul./set. 2017
http://dx.doi.org/10.18271/ria.2017.297
http://dx.doi.org/10.18271/ria.2017.297
ARTÍCULO DE REVISIÓN
Factores moduladores de la estacionalidad reproductiva en ungulados
Modulating factors of reproductive seasonality in ungulates
Adriana Pilar Urviola García; José Luis Fernández*
Facultad de Agronomía e Ingeniería Forestal, Pontificia Universidad Católica de Chile.
* Autor para Correspondencia: jlriverosf@uc.cl
RESUMEN:
El presente trabajo tiene como objetivo describir el comportamiento reproductivo estacional en ungulados hembras y machos, y la identificación de los factores que determinan la sincronía reproductiva. Se analizan los factores intrínsecos y extrínsecos que influyen en la estacionalidad reproductiva de ungulados. Los factores intrínsecos están relacionados con el mismo individuo ya sean características genotípicas y fenotípicas lo que implica que los aspectos reproductivos no pueden extrapolarse entre las distintas especies y se modifican por la acción de los factores externos como el fotoperiodo, disponibilidad de alimento, temperatura, latitud, entre otros. Dentro de los factores extrínsecos se identifican principalmente el fotoperiodo que está relacionado con la intensidad de luz y oscuridad a la que están expuestos los animales expresándose en la producción de melatonina, se describen los mecanismos de acción de esta hormona a nivel del sistema nervioso central (SNC), y sus efectos sobre la función reproductiva y por otro lado el factor nutricional que también es un importante regulador de la estacionalidad reproductiva, que podría estar estimulando el eje hipotálamo hipófisis, causando un efecto directo sobre la liberación de LH. A continuación se discuten las bases endocrinas que regulan la estacionalidad reproductiva comparada en especies pertenecientes a la subclase Eutheria, familias Bovidae, Camelidae, Equidae y Suidae, salvajes y domésticas.
PALABRAS CLAVE: Estacionalidad, reproducción, ungulados, fotoperiodo, nutrición, ciclos reproductivos.
ABSTRACT
The aim of the following review is to describe the seasonal reproductive behavior in male and female ungulates, and identify the determinants of reproductive synchrony. Intrinsic and extrinsic factors that influence the reproductive seasonality of ungulates analyzed. Intrinsic factors are related to the same individual such as genotypic and phenotypic characteristics, and implies that the reproductive aspects can not be extrapolated between species and breeds, and are modified by the action of external factors such as photoperiod, availability of food, temperature, latitude, among others. Among these factors are identified primarily photoperiod and food availability. The photoperiod and food availability are the main signals that determine melatonin levels, and this modulates the reproductive function. Photoperiod is related to the intensity of light and darkness that animals are exposed to and is expressed in the production of melatonin. They describe that the mechanisms of action of this hormone in the central nervous system (CNS) to exert their effects on reproductive function. The nutritional factor is also an important regulator of reproductive seasonality, which could be stimulating the hypothalamic pituitary gland, causing a direct effect on LH release. Then endocrine basis regulating reproductive seasonality in species belonging to the subclass Eutheria, families Bovidae, Camelidae, Equidae and Suidae, wild and domestic, stating differences between them are discussed.
KEYWORDS:Seasonality, reproduction, ungulates, photoperiod, nutrition, reproductive cycle.
INTRODUCCIÓN
Los patrones reproductivos en mamíferos ungulados responden a diversos factores que son en la mayoría complejos y poco entendidos (Lincoln and Short 1980; D. G. Hazlerigg and Lincoln 2011; Hut and Beersma 2011). La selección natural ha permitido su adaptación a diferentes hábitats favoreciendo que su reproducción ocurra armónicamente (Rhind, Rae, and Brooks 2001; D. Hazlerigg and Loudon 2008), este proceso de adaptación les ha permitido interaccionar con el medio ambiente y sus variaciones (Bronson 2009), resultante en la concentración de los nacimientos en la estación donde la disponibilidad de alimento es abundante (lo cual permite mayor producción de leche), y las condiciones climáticas son favorables (Rutberg 1984; Sinclair, Mduma, and Arcese 2000; Santiago-Moreno et al. 2006; Setchell et al. 1992; Gedir et al. 2016). En ungulados grandes se ha descrito que la estacionalidad coincide generalmente con la primavera o comienzos del verano (Bronson 1989; Reiter et al. 2009b), favoreciendo la supervivencia de los descendientes (Ogutu et al. 2015), lo que ha puesto en manifiesto que estas variaciones son modulados por un sistema de señalización neuroendocrino y sincronizados por el fotoperiodo (Bronson 1989). Se observan dos estrategias: 1) Ritmos estacionales que son controlados directamente por el fotoperiodo (Bradshaw and Holzapfel 2007) y 2) Ritmos circanuales y circadianos que son endógenamente controlados también por el fotoperiodo (Freeman and Zucker 2001), donde la melatonina es la hormona principal que modula los ritmos diarios y estacionales en todas las especies de mamíferos (Bartness & Goldman, 1989; Pévet, Vivien-Roels, & Masson-Pévet, 1991; Tephan Steinlechner, 1992). Su concentración varia con la longitud de las horas de luz y oscuridad (D. Hazlerigg and Loudon 2008; Dardente 2012), que son resultado de la inclinación del eje de la tierra y su órbita anual alrededor del sol (Bustos Obregon & Torres -Diaz, 2012).
Por otro lado existen diferencias muy importantes entre especies en su respuesta sexual al fotoperiodo (Tamarkin, Baird, and Almeida 1985), por lo tanto los mamíferos estacionales son clasificados en animales de días cortos, con gestaciones de corta duración, como las familias Cervidae, Suidae, Tragulidae, y animales con gestaciones de larga duración, como las familias Camelidae, Equidae, Elephantidae, Giraffidae, Rhinocerotidae, Tapiridae, Hippopotamidae, (Bittman, Dempsey, & Karsch, 1983; Chemineau, 1992; Tamarkin et al., 1985). Se ha observado una gran variabilidad en cuanto a la duración de las fechas de inicio y termino de la estación reproductiva tanto para hembras (Santiago-Moreno et al. 2000; Abecia et al. 2007) como para machos (Delgadillo Sánchez et al. 2003). En consecuencia existirían respuestas diferenciales del eje hipotálamo-hipófisis-gónada a los cambios lumínicos, que determinarían la longitud e intensidad de la estación reproductiva de las distintas especies (Fernández-Baca 1993).
Otro aspecto importante son los factores medioambientales como: humedad, temperatura, latitud, lluvias entre otros, y su interacción con los inherentes del individuo como, especie, raza y sexo, que son considerados capaces de modificar la actividad reproductiva en ungulados salvajes y domésticos (Bronson 2009; Burns, Fordyce, and Holroyd 2010; Giwercman and Giwercman 2011; Taberlet et al. 2011; Ogutu et al. 2015).
Adicionalmente se ha descrito como otro factor a la domesticación (Chemineau 1992), en que el hombre ha practicado la selección artificial basándose en características deseables (Ortavant et al. 1988) que entregaría como resultado un incremento en la eficiencia reproductiva de los animales, y en otras especies, reduciendo la estacionalidad (Setchell et al. 1992). Sin embargo, los mecanismos fisiológicos han conservado ciertos patrones de estacionalidad a pesar del proceso de domesticación generación tras generación (Ortavant et al. 1988).
El objetivo de la presente revisión, es describir la influencia de los distintos factores que intervienen en los ciclos reproductivos y los mecanismos neuroendocrinos que están involucrados en éstos.
Regulación medioambiental de la reproducción:
Los factores medioambientales que influyen en la reproducción de ungulados son: disponibilidad de alimento, relaciones sociales como la interacción de machos con hembras y aspectos físicos del medio ambiente como localización geográfica, los ciclos día/noche, temperatura, humedad y periodo de lluvias (Bronson 1989)
La influencia de la localización geográfica (latitud) sobre estacionalidad reproductiva, ha sido ampliamente descrita en caprinos (Capra hircus), cérvidos (Cervus elaphus) y ovinos (Ovis aries) (Thimonier and Sempere 1989). Bajo latitudes medias y altas (30-60°) la actividad reproductiva en la mayoría de estas especies coinciden con los días de luz decreciente (Arroyo 2011) y la duración de la gestación varía entre 5 y 6 meses (Bronson 1989).Su periodo de actividad reproductiva coincide con el otoño-invierno (Bronson and Manning 1991; Gedir et al. 2016) y el periodo de anestro estacional es caracterizado por la ausencia de ciclos estrales regulares y ovulación que coincide con las estaciones de primavera y verano (Abecia et al. 2007). Este comportamiento está asociado a los cambios fisiológicos en respuesta a las variaciones anuales de las horas de luz (Legan and Karsch 1980; Malpaux and Karsch 1990; Lincoln and Short 1980).
Por otro lado se ha demostrado que la disponibilidad de agua y la dieta son determinantes en la época reproductiva en ungulados de climas áridos y desérticos como la oveja canadiense (Ovis canadensis nelsoni), como mecanismo de adaptación alteran su dieta para equilibrar el agua y los nutrientes dependiendo de estado reproductivo en el que se encuentren (Gedir et al. 2016).
Por el contrario en especies con un periodo de gestación largo, cercano a un año característico de las familias Bovidae, Camelidae, Equidae y algunos de la familia Cervidae, se observa que la actividad reproductiva ocurre en la estación primavera-verano, cuando la duración lumínica del día es mayor (Palmer and Driancourt 1983). En estas especies, dada la duración del puerperio, se han observado periodos de reposo sexual que se alternan con periodos de actividad reproductiva (Bronson and Manning 1991). La ocurrencia de actividad reproductiva fuera de esta estación se considera poco frecuente en especies de días largos, siendo una excepción la yegua donde se ha reportado actividad reproductiva continua fuera de los periodos establecidos (Dardente 2012; Davison, McManus, and Fitzgerald 1998) al ser criadas en zonas ecuatoriales, por lo tanto la influencia de otros factores como el incremento o disminución de la vegetación y las precipitaciones fluviales podrían alterar seriamente la época reproductiva (Carranza et al. 2017).
En machos, se ha observado que el volumen, el peso testicular, la actividad espermatogénica y la secreción de testosterona, disminuyen durante los períodos de inactividad sexual y alcanzan los máximos valores coincidiendo con la estación reproductiva de las hembras. En especies salvajes la estacionalidad reproductiva se refleja en cambios anuales del tamaño testicular y de la secreción de testosterona, que a su vez están íntimamente relacionados con los cambios circanuales del crecimiento y desmogue de la cuerna, y con las variaciones estacionales de los parámetros de calidad espermática (Santiago-Moreno et al. 2006) En cérvidos salvajes como el gamo (Dama dama), se ha observado que el tamaño testicular mínimo (18mm diámetro) se alcanza en primavera (abril-junio), incrementándose significativamente a partir de agosto para alcanzar el tamaño máximo (39mm diámetro) en los meses de septiembre y octubre. Las concentraciones de testosterona comienzan a aumentar a mediados del verano, alcanzando su máximo (12 ng/ml) inmediatamente antes de iniciarse la actividad sexual (Asher, Monfort, and Wemmer 1999).
Por otro lado, hembras bovinas se consideran como poliéstricas continuas (Foote 1996), sin embargo, estudios realizados en ganado cebú y razas originadas en climas tropicales, reportan una marcada estacionalidad (Borisenkov, Kalinin, and Vakhnina 2004), manifestada por variaciones en la expresión de estro y en tasas de fecundación (Plasse, Warnick, and Koger 1970). Del mismo modo en ovinos la localización geográfica influye sobre fertilidad. Estudios en el sureste de México (Villagómez Amezcua Manjarrez et al. 2000), el estado de Florida (Plasse, Warnick, and Koger 1970) y Cuba (Rodríguez and Ponce De León 2013), describen las mayores tasas de fertilidad en primavera-verano y las menores en invierno-otoño (Villagómez Amezcua Manjarrez et al. 2000)
Según Villagomez y col (2012) los factores estacionales afectarían el estro en forma secuencial a través del año tanto en vacas como en vaquillas. Durante el verano, se observaría una reducción en la duración del estro, luego posteriormente durante el otoño disminuye la duración del estro y del ciclo estral y finalmente en el invierno solo se evidenciaría esta reducción en vaquillas. Además, un reciente estudio ha puesto en evidencia que las influencias ambientales durante las diferentes etapas de gestación pueden inducir cambios permanentes en la estructura, fisiología y metabolismo de la descendencia (Pinedo and De Vries 2017; B. M. Brown et al. 2016)
Los camélidos sudamericanos son especies que se desarrollan en ambientes extremos, (Jose Luis Riveros et al., 2009), con una estrategia de reproducción estacional que se limita a los meses lluviosos de verano, cuando existe mayor disponibilidad de forraje (San Martin et al. 1989; Franklin 2017; Sumar et al. 1996; B. W. Brown 2000). Por ejemplo, en camélidos salvajes como el guanaco (Lama guanicoe) y la vicuña (Vicugna vicugna), se ha observado que la receptividad sexual se produce durante la temporada de lluvias de diciembre a marzo en la Patagonia coincidiendo con la época de mayor disponibilidad de recursos (Post and Forchhammer 2008; Gustine et al. 2017) En estas especies, aún no se ha precisado el efecto que tendría el fotoperiodo sobre el inicio y finalización de la temporada reproductiva.
En otras especies, la mayor concentración de testosterona se alcanza en la etapa previa al inicio de la actividad reproductiva, y es superior a la existente durante el periodo de plena actividad. De esta forma se favorece el desarrollo de las glándulas sexuales accesorias y de las glándulas prepuciales (Chapman and Chapman 2009).
Temperatura:
Diversos autores indican que la eficiencia reproductiva está estrechamente relacionada con las temperaturas ambientales mínimas y máximas (Villagómez Amezcua Manjarrez et al. 2000).
Villagomez y col (2000) establecieron que existiría una asociación entre el fotoperíodo, la temperatura y la insolación con la presentación de estros en vaquillas, a diferencia de las vacas. Es posible entonces que las vaquillas sean más susceptibles que las vacas a las variables relacionadas con el sol, las cuales modificarían el umbral requerido por los esteroides ováricos, y de esta forma actuar sobre ciertos substratos neurales relacionados con las características conductuales del estro.
Un estudio en equinos de raza pura sangre en Australia, en base a la evaluación de registros durante 10 años (Guerin and Wang 1994), observaron diferencias significativas entre años en el momento de la primera ovulación. Los autores concluyeron que el inicio de la actividad reproductiva, estaría estrechamente relacionada con la amplitud térmica diaria. Otro estudio de campo, en el Reino Unido, indica que la transición de época de anestro a estación reproductiva, durante la primavera, se vería retrasada por bajas temperaturas, comparado con condiciones similares de fotoperiodo, nutrición y sistema de crianza. En consecuencia, en yeguas de raza pura sangre, la temperatura desempeñaría un papel importante sobre los ritmos circanuales (Nagy et al. 2000).
En machos de gran tamaño, las altas temperaturas influyen directamente sobre la actividad gonadal (Gomes and VanDemark 1974), dado que se observa una marcada disminución en la producción de espermatozoides y por ende baja calidad seminal, lo que reduciría la tasa de fertilidad potencial.
Fotoperiodo:
Los mamíferos están gobernados por señales ambientales, poseen un mecanismo sensitivo el cual le permite distinguir la duración del día y la noche captando los estímulos luminosos (Wehr 1997), y es la glándula pineal la que actúa como un nexo entre las funciones del fotoperiodo y la actividad reproductiva (Eloranta y col., 1995). El control fisiológico del fotoperiodo depende de 3 componentes esenciales: primero un fotoreceptor, que detecte la luz y un reloj biológico que distinga días largos de días cortos; segundo, una ruta neural que enlace el reloj biológico al aparato neuroendocrino y finalmente el sistema endocrino, que involucre la secreción de gonadotrofinas hipofisarias, el desarrollo gonadal y la retroalimentación gonadal vía esteroides sexuales.
Los ojos son fotoreceptores que permiten recibir la información de los cambios lumínicos a través del nervio óptico que está provisto de células ganglionares que tienen un fotopigmento denominado melanoxina (Panda et al. 2005). Éstas terminan en los núcleos supraquiasmáticos, localizadas en el hipotálamo sobre el quiasma óptico, que en conjunto constituyen el tracto retino-hipotalámico (Moore, Speh, and Patrick Card 1995; Hattar et al. 2002). Cada una de estas pequeñas áreas contiene miles de neuronas, que regulan todos los ritmos circadianos del cuerpo (Monecke, Sage-Ciocca, Wollnik, & Pevet, 2013; Reiter et al., 2009).
La inducción de la reproducción por el reloj circadiano depende de la temporalidad de los eventos lumínicos. Se ha documentado que el aumento de la melatonina nocturna es el mayor determinante en la inducción tanto de la actividad como de la inactividad reproductiva (Carter & Goldman, 1983; Elliott, 1976).
Melatonina
La melatonina es una hormona secretada y sintetizada por la glándula pineal, en respuesta a cambio en la intensidad de luz (Monecke et al. 2013). Su concentración fisiológica, se caracteriza por niveles muy bajos durante el día y elevados durante la noche (Wood and Loudon 2017).
En todas las especies de mamíferos estudiados hasta la fecha, los niveles de melatonina se incrementan por la noche (Santiago-Moreno et al. 2006) sin embargo las concentraciones varían entre y dentro de cada especie (Bronson 1989; Eloranta et al. 1992; Santiago-Moreno et al. 2000; Gómez Brunet et al. 2002; Zerbe et al. 2012). Algunas especies muestran un incremento de melatonina a corto plazo, mientras que en otras especies se extiende por casi todo el periodo de oscuridad.
(Reiter et al. 2009a), describe la existencia de tres patrones de secreción de melatonina. En el primer patrón observado en humanos, la secreción de melatonina comienza a aumentar gradualmente poco después del inicio de la oscuridad, hasta alcanzar su máxima concentración cerca de la mitad de la fase oscura; y posteriormente desciende hasta llegar a valores diurnos (Lewy et al. 1980). En el segundo, la producción de melatonina se incrementa rápidamente al llegar la oscuridad, permaneciendo alta durante todo este periodo y descendiendo al llegar la luz; este patrón se describe en ovinos (Ovis aries) (Rollag & Niswender, 1976), ratón de patas blancas (Peromyscus leucopus) (Petterborg, Richardson, and Reiter 1981) y otros. Finalmente, en el tercer patrón, las concentraciones de melatonina se elevan rápidamente cuatro a cinco horas posterior al inicio de la oscuridad, alcanzado su máximo para decaer antes del amanecer; patrón observado en algunas especies como el hámster dorado (Mesocricetus auratus) (Tamarkin, Baird, and Almeida 1985)
El establecimiento del ritmo diario de secreción de melatonina suele ser más tardío en las especies salvajes que en las domésticas (Santiago-Moreno et al. 2006). Estudios realizados en ovinos domésticos y salvajes, por (Gómez Brunet et al. 2002) han descrito que en muflones las diferencias entre las concentraciones diurnas y nocturnas de melatonina, no se evidencian hasta la primera semana de vida. En contraste, en crías domésticas, estas diferencias se observan desde las 24 horas del nacimiento. A pesar de lo anterior, ambas especies alcanzan concentraciones similares al llegar a la edad de 8-10 semanas.
En ungulados salvajes que habitan en latitudes medias y altas como el muflón (Santiago-Moreno et al. 2000; Gómez Brunet et al. 2002), el ciervo rojo, el reno (Eloranta et al. 1992), el jabalí (Tast et al. 2001) y el buey almizclero (Peltier, Robinson, and Sharp 1998), la secreción de melatonina varia a lo largo del año (Santiago-Moreno et al. 2006). En las diferentes estaciones (solsticios de verano e invierno y equinoccios de otoño y primavera), las concentraciones plasmáticas de melatonina son basales durante el día, aumentan rápidamente después de la puesta del sol, se mantienen elevadas durante la fase de oscuridad y vuelven a concentraciones basales después de la salida del sol (Santiago-Moreno et al. 2006). En especies que habitan zonas árticas, el ritmo de secreción de melatonina desaparece durante el invierno (con 24 horas oscuridad/día) y en verano (con 24 horas luz/día), y solamente se expresa en primavera y otoño de acuerdo con las variaciones del ciclo luz/oscuridad (Arendt 1998). Lo anterior, indicaría que la secreción de melatonina en estas especies no estaría controlada endógenamente, sino que respondería a las variaciones del fotoperiodo (Stokkan, Tyler, and Reiter 1994).
Ciclo anual de la reproducción:
La regulación fotoperiódica de la estacionalidad en los ovinos domésticos, establece que la información de los días largos de primavera sincronizaría el ritmo endógeno de la reproducción dando inicio a la estación reproductiva en otoño (Malpaux et al. 1996); mientras que los días cortos de invierno serían la señal reguladora de la duración normal del periodo reproductivo (Malpaux and Karsch 1990).
Barrell, Thrun, Brown, Viguie, & Karsch, (2000), determinaron que la percepción de señales fotoperiódicas (aproximadamente 70 días largos en torno al solsticio de primavera), lograban sincronizar el ritmo anual de reproducción y determinar el inicio de la actividad reproductiva en otoño. En consecuencia, el fotoperiodo regularía el ritmo anual de la reproducción, a través de dos caminos diferentes pero complementarios y dependientes: 1. Ajustando el periodo de actividad reproductiva a las condiciones naturales del medio ambiente y 2. Sincronizando el periodo de actividad reproductiva entre los individuos de la mismaespecie (Santiago-Moreno et al. 2006).
En yeguas se sabe que el fotoperiodo es el factor externo más importante que influye en la reproducción endógena circanual (Ginther 1990), la exposición a la luz durante el invierno y principios de primavera estimula la actividad ovárica en anestro y se utiliza comúnmente para adelantar el inicio de la temporada reproductiva de la cría (Burkhardt 1947). Sin embargo, la acción del fotoperiodo está sujeta a condiciones específicas, dado que la actividad reproductiva no siempre responde a la exposición a días largos. Esta respuesta, dependerá de varios factores como el estado de refractario variaciones de la duración de la luz, fotoperiodo presente y la existencia de una fase fotosensible durante la noche (Nagy et al. 2000).
Relación entre las variaciones del fotoperiodo y el sistema neuroendocrino
Los factores intrínsecos están relacionados con genotipo, y pertenecen al mismo individuo. Un ejemplo de factor intrínseco es la esperanza de vida en relación con las variaciones del medio ambiente, en un animal que tiene una esperanza de vida de aproximadamente un año o menos, la estacionalidad será apenas expresada, y el animal desarrollará estrategias de mejoramiento oportunistas (Pelletier and Ortavant 1975; Ungerfeld and Bielli 2003).
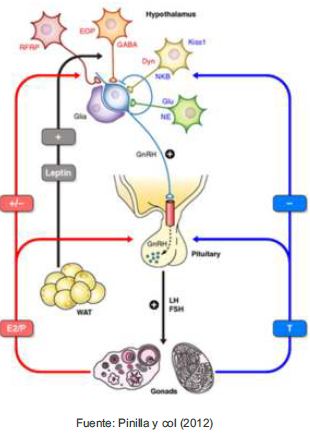
En reproductores no estacionales, la información que proviene desde los somas de las neuronas en el hipotálamo anterior regula la secreción de gonadotrofinas por la hipófisis anterior, sin la intervención de otros elementos. Una ruta un poco diferente se expresa en mamíferos de reproducción estacional, donde la glándula pineal actúa como el principal transductor neuroendocrino (Bustos Obregon & Torres -Diaz, 2012).
Los nervios simpáticos que salen de la región torácica de la médula, ascienden hacia el cuello y hacen sinapsis en los ganglios cervicales superiores (Kappers 1976), en que la glándula pineal es inervada por los nervios simpáticos post ganglionares. Las neuronas simpáticas liberan noradrenalina a los pinealocitos al inicio de cada noche regulando la producción y liberación de melatonina a la circulación nerviosa y sistémica (Reiter et al. 2009b). Estos eventos son regulados por un reloj circadiano presente en el núcleo supraquiasmatico y ocurren durante las horas de oscuridad (Bustos Obregon & Torres -Diaz, 2012)
El anestro estacional, es inducido por la dopamina, que se produce como resultado a la menor duración en la secreción de melatonina durante los días largos, mientras que en días cortos la mayor secreción de melatonina inhibe la producción de dopamina, con el subsecuente restablecimiento de la actividad estral y la ovulación (Malpaux et al. 1996).
La estación reproductiva en ovejas ocurre cuando la duración de las horas de luz es menor en comparación a las horas de oscuridad, observándose ciclos estrales regulares, conducta de estro y ovulación (Abecia et al. 2007). En el hemisferio norte, se presenta entre los meses de agosto a enero, sin embargo, varía de acuerdo a la raza y ubicación geográfica (Hafez 1952). El ciclo estral en ovinos tiene una duración aproximada de 17 días, durante el metaestro y diestro la concentración de progesterona alcanza valores de 1 ng ml-1 o más, ésta hormona se sintetiza y libera a partir de un cuerpo lúteo maduro y funcional ejerciendo un efecto de retroalimentación negativa a nivel hipotalámico e inhibe la secreción pulsátil de GnRH y por lo tanto de LH. De manera específica, la progesterona actúa a nivel del área pre óptica, en donde activa las neuronas GABA e induce a la síntesis de este neurotransmisor, el cual actúa en las neuronas productoras de GnRH e inhibe la síntesis de esta hormona (Evans et al. 2002). En este evento, es posible la participación de los péptidos opioides endógenos, neurotransmisores que se sintetizan principalmente en el núcleo hipotalámico A12 y en condiciones fisiológicas específicas (principalmente durante el anestro posparto) inhibiendo la frecuencia de pulsos de GnRH/LH (Abecia et al. 2007). Se han identificado ovejas que responden a los cambios en la amplitud del fotoperiodo ecuatorial, unas presentan anestro estacional (Goodman & Meyer, 1984), otras ovejas no responden a las variaciones en las horas luz por lo tanto ovulan todo el año y un último grupo de ovejas, refractarias al fotoperiodo que mantienen su actividad reproductiva a pesar de ser expuestas a fotoperiodos propios de latitudes altas >35° (Hafez 1952).
Por otro lado, ovejas de razas europeas lanares, expresan estacionalidad reproductiva similar a la de individuos de la misma raza que habitan o nacen en latitudes altas (Arroyo 2011), lo cual indica que los mecanismos neuroendocrinos clásicos que regulan el ciclo reproductivo anual en estas razas, se encuentran activos a pesar de encontrarse en una región cercana al ecuador (Abecia et al. 2007).
Factores nutricionales implicados en la reproducción
Los alimentos ingeridos por los mamíferos son metabolizados y asimilados como energía, la cual es utilizada con diferentes fines en el organismo. Primero deben cubrirse requerimientos energéticos para el funcionamiento celular, termorregulación y los gastos de energía para la obtención de alimentos (Brody 1945) Una vez cubiertas estas necesidades, el resto de energía se utiliza en crecimiento y en reproducción, de lo contrario se almacena como grasa (Edey, 1968). Por otro lado, la temperatura ambiente determina la demanda de termorregulación de un mamífero, por lo tanto, influye indirectamente en la cantidad de energía disponible para la reproducción (Bronson 1989).
Una serie de estudios han permitido comprender que la liberación de GnRH está íntimamente asociada a la nutrición y se reduce en animales desnutridos (Wade and Jones 2004). Sin embargo, no se ha precisado con claridad los mecanismos metabólicos que actúan bajo un plano nutricional deficiente. Se han estudiado distintos indicadores metabólicos, tales como la glucosa, ácidos grasos volátiles, algunos aminoácidos y ácidos grasos no esterificados (Keisler and Lucy 1996). Así mismo se han asociado mediadores endocrinos entre el estado nutricional y los procesos reproductivos, tales como: el factor de crecimiento asociado a la insulina (IGF-I), la hormona del crecimiento, la colesistoquinina, el neuropéptido Y (NPY), los péptidos opioides endógenos y la insulina (Keisler and Lucy 1996). En un estudio realizado por Snyder et al., (1999) con ovejas con condición corporal baja, ovariectomizadas y tratadas con implantes subcutáneos de estradiol, se observó una reducción en la concentración de IGF-I, y la inhibición del incremento de secreción de LH característica del inicio de la época reproductiva. En consecuencia, una nutrición inadecuada podría por si sola o en conjunto con otros factores, prolongar el anestro estacional (Abecia et al. 2007).
Otro péptido, asociado con la nutrición es la leptina; hormona que influye sobre la endocrinologíareproductiva (D Blache et al. 2000). En muchas especies la leptina se asocia con la reserva de tejido adiposo, donde se sintetiza y es liberada a circulación sistémica, luego al fluido cerebroespinal y posteriormente a los núcleos hipotalámicos, donde puede actuar sobre el apetito y modular la secreción de GnRH (Dominique Blache and Bickell 2011). Según Fitzgerald & McManus, (2000) la acumulación de grasa corporal también modificaría la estacionalidad reproductiva. En yeguas la condición corporal y la nutrición se han descrito como factores relacionados y que influirían sobre los ciclos reproductivos. A modo de ejemplo, (McDaniel, Kreider, and Thrasher 1979) observaron un efecto aditivo de la suplementación nutricional y el manejo artificial del fotoperiodo, sobre el incremento de la actividad reproductiva. Por otro lado, Henneke, Potter, & Kreider, (1984) observaron que el intervalo promedio a la primera ovulación fue significativamente mayor en yeguas con condición corporal <5 (1-9), en comparación con yeguas con condición corporal >5. Finalmente, Kubiak et al., (1987), observaron que en yeguas de transición con un bajo nivel de grasa corporal, el incremento en el consumo de energía disminuiría el intervalo a la primera ovulación, sin tener efecto sobre yeguas con condición corporal saludable.
En camélidos sudamericanos se ha reportado que la estacionalidad podría estar influenciada por el estado nutricional y disponibilidad de forraje. Sin embargo, en zoológicos de Estados Unidos donde alpacas y llamas son mantenidas en las mejores condiciones alimenticias y ambientales durante todo el año, carecen de estacionalidad y las hembras pueden tener crías durante todo el año (Sumar et al. 1996), Por otro lado, tanto en caprinos (Henniawati and Fletcher 1986; Mani, McKelvey, and Watson 1992)como en ovinos (Forcada, Abecia, and Sierra 1992; Rhind et al. 1998; Scaramuzzi and Martin 2008), se ha observado que la nutrición y el nivel de reservas corporales afectan la tasa de ovulación y fertilidad, describiéndose una correlación positiva entre la tasa de ovulación y plano nutricional.
Factores Sociales:
Se ha observado que en borregas jóvenes y cabras, la presencia del macho puede adelantar la presentación de la pubertad y lograr inducir la actividad reproductiva en las hembras adultas (Amoah and Bryant 1984). Las feromonas producidas por el macho, serían las responsables de estimular a la hembra anéstrica a ovular (TW and TW 1985). Sin embargo, un estudio realizado por Walkden-Brown et al., (1993) indicaron que tal respuesta ovulatoria en las hembras anéstricas no es sólo un simple reflejo relacionado con el olor, sino que se da como respuesta de la integración de una serie de informaciones sensoriales provenientes del macho, tales como la frecuencia e intensidad de las vocalizaciones. Por otro lado, se ha reportado la existencia de una sincronización precisa de la actividad reproductiva en diferentes especies animales como resultado de la estimulación por interacciones sociales entre hembras pertenecientes al mismo grupo, factor denominado "efecto hembra" (Delcroix, Mauget, and Signoret 1990). Adicionalmente, los resultados de otros trabajos indican que cuando un grupo de hembras en anestro se asocian con otro grupo de hembras que se encuentran en estro, la actividad ovárica de las primeras se ve estimulada (Walkden-Brown, Restall, and Henniawati 1993).
Finalmente, en camélidos sudamericanos, la exposición continua de los machos a las hembras puede tener un efecto inhibitorio sobre su actividad sexual, provocando una disminución de la libido (Sumar et al. 1996). Sin embargo, la actividad sexual se reanuda inmediatamente, posterior a la re-introducción de una nueva manada de hembras, factor denominado "efecto Coolidge" (Fernández-Baca 1993).
En guanacos machos se ha observado que un ambiente social puede afectar la liberación de glucocorticoides y testosterona, en respuesta a las interacciones sociales individuales y las demandas energéticas de la época reproductiva. El papel funcional del estrés y los ejes gonádicos en una fase crítica de la vida de un macho mamífero es determinante en el período de apareamiento, cuando todos los recursos están a disposición del macho se maximizan las posibilidades de éxito reproductivo (Ovejero Aguilar et al. 2016).
Domesticación:
Los procesos de domesticación han permitido reducir la estacionalidad reproductiva en comparación con lo que se observa en animales salvajes (Chemineau 1992). No obstante, los ciclos de reproducción estacional observada en ganado doméstico, son características heredadas de poblaciones salvajes (Ortavant et al. 1985; Bronson and Manning 1991). En bovinos, el proceso de domesticación condujo a la pérdida paulatina de la reproducción estacional; describiéndose actualmente como un animal poliéstrico típico. Por el contrario, la estacionalidad reproductiva sigue siendo manifiesta en la mayoría de las razas ovinas, caprinas y equinas originarias de latitudes >35º (Malpaux et al. 1996).
Se ha descrito que los camélidos sudamericanos domésticos y salvajes mantenidos en cautiverio en diferentes partes del mundo, han sido capaces de reproducirse durante todo el año (B. W. Brown 2000; Zuckerman 2009; SCHMIDT 1973; Sumar et al. 1996) Sin embargo, estudios ulteriores demuestran, un comportamiento estacional en estas especies (José Luis Riveros et al. 2010); que estaría relacionado con la disponibilidad de forraje y/o con el efecto del fotoperiodo.
Por último, en yeguas domésticas que se mantienen bajo condiciones de luz constante, ya sea días largos o cortos, se descrito que retoman su ritmo circanual a pesar de ser sometidas a factores que estimulen o inhiban las condiciones de iluminación (Palmer and Guillaume 1992; Ginther 1990). Esta condición se conoce como estado refractario y que se describe como la incapacidad de presentar una respuesta a cambios en el fotoperiodo.
Conclusiones:
Se han descrito diversos factores que están involucrados en la regulación de la estacionalidad reproductiva en ungulados silvestres y domésticos, dentro de ellos se ha visto que el fotoperiodo es el factor ambiental primario que regula los ciclos reproductivos anuales, seguido de factores medioambientales que influyen en la disponibilidad de alimento.
Las variaciones anuales en la síntesis y secreción de melatonina, en conjunto con los neurotransmisores, Dopamina, GABA e indicadores metabólicos como leptina, pueden modular el inicio o término de la época reproductiva. Sin embargo, la interacción del fotoperiodo con otros factores como la latitud influiría sobre la estacionalidad de ungulados salvajes y domésticos y por ende en la época de nacimiento de estas especies, limitándose a las condiciones medioambientales que son más favorables para las crías.
Así mismo se han identificado especies que responden a los cambios en la amplitud del fotoperiodo ecuatorial, mostrando anestro estacional; otras que no responden a las variaciones de la luz y ovulan durante todo el año y un último grupo de especies, extremadamente refractarias al fotoperiodo, que mantienen su actividad reproductiva a pesar de ser expuestas a fotoperiodos propios de latitudes altas (>35°).
En todas las especies el establecimiento de los ciclos circadianos, tienen lugar durante el periodo post natal, sin embargo, se han observado diferencias entre ungulados salvajes y domésticos. Es posible que la domesticación haya mejorado la eficiencia reproductiva de los animales, en algunos casos reduciendo la edad a la pubertad, en otros incrementando el tamaño de la camada, y en otros reduciendo la estacionalidad reproductiva.
En los últimos años nuestra comprensión de la regulación de la reproducción estacional en las diferentes especies de ungulados se ha incrementado significativamente. Esta nueva visión, sin duda, dará lugar a mejores estrategias de tratamiento para la inducción de la actividad reproductiva tanto en hembras como en machos. Una mejor comprensión de este fenómeno, requerirá de nuevos estudios que permitan dilucidar los mecanismos que controlan el desarrollo de los ciclos reproductivos y los periodos de anestro estacional en ungulados salvajes y domésticos, las diferencias entre ellos y la interacción entre los diversos factores que influyen constantemente sobre su reproducción.
REFERENCIAS BIBLIOGRÁFICAS
Abecia, J. A., J. A. Valares, F. Forcada, I. Palacín, S. Martín, and A. Martino. 2007. "The Effect of Melatonin on the Reproductive Performance of Three Sheep Breeds in Spain." Small Ruminant Research 69 (1–3): 10–16. doi:10.1016/j.smallrumres.2005.12.018. [ Links ]
Amoah, E. A., and M. J. Bryant. 1984. "A Note on the Effect of Contact with Male Goats on Occurrence of Puberty in Female Goat Kids." Animal Production 38 (1): 141–44. doi:10.1017/S0003356100041477. [ Links ]
Arendt, J. 1998. "Melatonin and the Pineal Gland: Influence on Mammalian Seasonal and Circadian Physiology." Reviews of Reproduction 3 (1): 13–22. doi:10.1530/ror.0.0030013. [ Links ]
Arroyo, J. 2011. "Estacionalidad Reproductiva de La Oveja En México." Tropical and Subtropical Agroecosystems 14 (3): 829–45. [ Links ]
Asher, G W, S L Monfort, and C Wemmer. 1999. "Comparative Reproductive Function in Cervids: Implications for Management of Farm and Zoo Populations." Journal of Reproduction and Fertility. Supplement 54: 143–56. http://www.ncbi.nlm.nih.gov/pubmed/10692851.
Barrell, Graham K., Lori A. Thrun, Martha E. Brown, Catherine Viguie?, and Fred J. Karsch. 2000. "Importance of Photoperiodic Signal Quality to Entrainment of the Circannual Reproductive Rhythm of the Ewe1." Biology of Reproduction 63 (3): 769–74. doi:10.1095/biolreprod63.3.769. [ Links ]
Bartness, T. J., and B. D. Goldman. 1989. "Mammalian Pineal Melatonin: A Clock for All Seasons." Experientia 45 (10). Birkhäuser-Verlag: 939–45. doi:10.1007/BF01953051. [ Links ]
BITTMAN, ERIC L., ROBERT J. DEMPSEY, and FRED J. KARSCH. 1983. "Pineal Melatonin Secretion Drives the Reproductive Response to Daylength in the Ewe*." Endocrinology 113 (6): 2276–83. doi:10.1210/endo-113-6-2276. [ Links ]
Blache, D, R L Tellam, L M Chagas, M A Blackberry, P E Vercoe, and G B Martin. 2000. "Level of Nutrition Affects Leptin Concentrations in Plasma and Cerebrospinal Fluid in Sheep." The Journal of Endocrinology 165 (3): 625–37. http://www.ncbi.nlm.nih.gov/pubmed/10828846. [ Links ]
Blache, Dominique, and Samantha L Bickell. 2011. "External and Internal Modulators of Sheep Reproduction." Reproductive Biology 11 (3): 61–77. http://www.ncbi.nlm.nih.gov/pubmed/22200880. [ Links ]
Borisenkov, M. F., A. I. Kalinin, and N. A. Vakhnina. 2004. "Seasonal Dynamics of Cattle Reproduction in the North." Russian Journal of Ecology 35 (3): 205–8. doi:10.1023/B:RUSE.0000025973.96876.18. [ Links ]
Bradshaw, William E., and Christina M. Holzapfel. 2007. "Evolution of Animal Photoperiodism." Annual Review of Ecology, Evolution, and Systematics 38 (1). Annual Reviews: 1–25. doi:10.1146/annurev.ecolsys.37.091305.110115. [ Links ]
Brody, Samuel,. 1945. Bioenergetics and Growth :with Special Reference to the Efficiency Complex in Domestic Animals /. New York: http://hdl.handle.net/2027/mdp.39015001929424. [ Links ]
Bronson, F. H. 1989. Mammalian Reproductive Biology. University of Chicago Press. [ Links ]
———. 2009. "Climate Change and Seasonal Reproduction in Mammals." Philosophical Transactions of the Royal Society of London B: Biological Sciences 364 (1534). http://rstb.royalsocietypublishing.org/content/364/1534/3331.
Bronson, F H, and J M Manning. 1991. "The Energetic Regulation of Ovulation: A Realistic Role for Body Fat." Biology of Reproduction 44 (6): 945–50. doi:10.1095/biolreprod44.6.945. [ Links ]
Brown, Britni M., Jon W. Stallings, John S. Clay, and Michelle L. Rhoads. 2016. "Periconceptional Heat Stress of Holstein Dams Is Associated with Differences in Daughter Milk Production during Their First Lactation." Edited by Dan Weary. PLOS ONE 11 (2): e0148234. doi:10.1371/journal.pone.0148234.
Brown, Bruce W. 2000. "A Review on Reproduction in South American Camelids." Animal Reproduction Science 58 (3–4): 169–95. doi:10.1016/S0378-4320(99)00081-0. [ Links ]
Burkhardt, John. 1947. "Transition from Anoestrus in the Mare and the Effects of Artificial Lighting." The Journal of Agricultural Science 37 (1): 64. doi:10.1017/S0021859600013083. [ Links ]
Burns, B.M., G. Fordyce, and R.G. Holroyd. 2010. "A Review of Factors That Impact on the Capacity of Beef Cattle Females to Conceive, Maintain a Pregnancy and Wean a calf—Implications for Reproductive Efficiency in Northern Australia." Animal Reproduction Science 122 (1–2): 1–22. doi:10.1016/j.anireprosci.2010.04.010. [ Links ]
Bustos Obreg?n, Eduardo, and Leandro Torres -D?az. 2012. "Reproducci?n Estacional En El Macho." International Journal of Morphology 30 (4). Sociedad Chilena de Anatomía: 1266–79. doi:10.4067/S0717-95022012000400004. [ Links ]
Carranza, Juan, Washington A. Yoong, Concha Mateos, Belén Caño Vergara, Chian L. Gómez, and Verónica Macías. 2017. "Reproductive Phenology of Creole Horses in Ecuador in the Absence of Photoperiod Variation: The Effects of Forage Availability and Flooding Affecting Body Condition of Mares." Animal Science Journal, July. doi:10.1111/asj.12818.
CARTER, DENNIS S., and BRUCE D. GOLDMAN. 1983. "Antigonadal Effects of Timed Melatonin Infusion in Pinealectomized Male Djungarian Hamsters ( Phodopus Sungorus Sungorus ): Duration Is the Critical Parameter*." Endocrinology 113 (4): 1261–67. doi:10.1210/endo-113-4-1261. [ Links ]
Chapman, Norma G., and D. I. Chapman. 2009. "Seasonal Changes in the Male Accessory Glands of Reproduction in Adult Fallow Deer (Dama Dama)." Journal of Zoology 189 (3). Blackwell Publishing Ltd: 259–73. doi:10.1111/j.1469-7998.1979.tb03962.x. [ Links ]
Chemineau. 1992. "Medio Ambiente Y Reproducción Animal." Nouzilly, Francia. http://www.fao.org/docrep/V1650T/v1650T04.htm. [ Links ]
Dardente, Hugues. 2012. "Melatonin-Dependent Timing of Seasonal Reproduction by the Pars Tuberalis: Pivotal Roles for Long Daylengths and Thyroid Hormones." Journal of Neuroendocrinology 24 (2). Blackwell Publishing Ltd: 249–66. doi:10.1111/j.1365-2826.2011.02250.x. [ Links ]
Davison, L A, C J McManus, and B P Fitzgerald. 1998. "Gonadotropin Response to Naloxone in the Mare: Effect of Time of Year and Reproductive Status." Biology of Reproduction 59 (5): 1195–99. http://www.ncbi.nlm.nih.gov/pubmed/9780327. [ Links ]
Delcroix, I, R Mauget, and J P Signoret. 1990. "Existence of Synchronization of Reproduction at the Level of the Social Group of the European Wild Boar (Sus Scrofa)." Journal of Reproduction and Fertility 89 (2): 613–17. http://www.ncbi.nlm.nih.gov/pubmed/2401987. [ Links ]
Delgadillo Sánchez, México, José Alberto, Flores Cabrera, José Alfredo, Véliz Deras, Francisco Gerardo, Delgadillo Sánchez, et al. 2003. "Control of Reproduction in Goats from Subtropical Mexico Using Photoperiodic Treatments and the Male Effect." Veterinaria México 34 (1): 69–79. http://www.redalyc.org/articulo.oa?id=42334107. [ Links ]
Edey, T N. 2017. "BODYWEIGHT AND OVULATION RATE IN SHEEP." Accessed June 24. http://www.asap.asn.au/livestocklibrary/1968/Edey68.PDF. [ Links ]
Elliott, J A. 1976. "Circadian Rhythms and Photoperiodic Time Measurement in Mammals." Federation Proceedings 35 (12): 2339–46. http://www.ncbi.nlm.nih.gov/pubmed/964387. [ Links ]
Eloranta, E, J Timisj?rvi, M Nieminen, V Ojutkangas, J Lepp?luoto, and O Vakkuri. 1992. "Seasonal and Daily Patterns in Melatonin Secretion in Female Reindeer and Their Calves." Endocrinology 130 (3): 1645–52. doi:10.1210/endo.130.3.1537312. [ Links ]
Evans, N P, T A Richter, D C Skinner, and J E Robinson. 2002. "Neuroendocrine Mechanisms Underlying the Effects of Progesterone on the Oestradiol-Induced GnRH/LH Surge." Reproduction (Cambridge, England) Supplement 59. Society for Reproduction and Fertility: 57–66. http://www.ncbi.nlm.nih.gov/pubmed/12698973.
Fernández-Baca, Saul. 1993. "Manipulation of Reproductive Functions in Male and Female New World Camelids." Animal Reproduction Science 33 (1–4): 307–23. doi:10.1016/0378-4320(93)90121-7. [ Links ]
Fitzgerald, B P, and C J McManus. 2000. "Photoperiodic versus Metabolic Signals as Determinants of Seasonal Anestrus in the Mare." Biology of Reproduction 63 (1): 335–40. http://www.ncbi.nlm.nih.gov/pubmed/10859276. [ Links ]
Foote, Robert H. 1996. "Review: Dairy Cattle Reproductive Physiology Research and Management?Past Progress and Future Prospects." Journal of Dairy Science 79 (6): 980–90. doi:10.3168/jds.S0022-0302(96)76449-4. [ Links ]
Forcada, F., J.A. Abecia, and I. Sierra. 1992. "Seasonal Changes in Oestrus Activity and Ovulation Rate in Rasa Aragonesa Ewes Maintained at Two Different Body Condition Levels." Small Ruminant Research 8 (4): 313–24. doi:10.1016/0921-4488(92)90212-M. [ Links ]
Franklin, Dr. Bill. 2017. "Contrasting Socioecologies of South America’s Wild Camelids: The Vicuña and the Guanaco." Accessed June 24. https://www.academia.edu/14795601/Contrasting_Socioecologies_of_South_Americas_Wild_Camelids_the_Vicuña_and_the_Guanaco.
Freeman, D A, and I Zucker. 2001. "Refractoriness to Melatonin Occurs Independently at Multiple Brain Sites in Siberian Hamsters." Proceedings of the National Academy of Sciences of the United States of America 98 (11). National Academy of Sciences: 6447–52. doi:10.1073/pnas.111140398. [ Links ]
Gedir, Jay V., James W. Cain, Paul R. Krausman, Jamison D. Allen, Glenn C. Duff, and John R. Morgart. 2016. "Potential Foraging Decisions by a Desert Ungulate to Balance Water and Nutrient Intake in a Water-Stressed Environment." Edited by Emmanuel Serrano Ferron. PLOS ONE 11 (2). University of Arizona Press: e0148795. doi:10.1371/journal.pone.0148795.
Ginther, O J. 1990. "Folliculogenesis during the Transitional Period and Early Ovulatory Season in Mares." Journal of Reproduction and Fertility 90 (1). Society for Reproduction and Fertility: 311–20. doi:10.1530/JRF.0.0900311. [ Links ]
Giwercman, Aleksander, and Yvonne Lundberg Giwercman. 2011. "Environmental Factors and Testicular Function." Best Practice & Research Clinical Endocrinology & Metabolism 25 (2): 391–402. doi:10.1016/j.beem.2010.09.011. [ Links ]
Gomes, W R, and N L VanDemark. 1974. "The Male Reproductive System." Annual Review of Physiology 36 (1). Annual Reviews 4139 El Camino Way, P.O. Box 10139, Palo Alto, CA 94303-0139, USA: 307–30. doi:10.1146/annurev.ph.36.030174.001515. [ Links ]
Gómez Brunet, A, A Gómez Brunet, B Malpaux, A Daveau, C Taragnat, and P Chemineau. 2002. "Genetic Variability in Melatonin Secretion Originates in the Number of Pinealocytes in Sheep." The Journal of Endocrinology 172 (2): 397–404. http://www.ncbi.nlm.nih.gov/pubmed/11834457. [ Links ]
Goodman2, Robert L, and Steven L Meyer. 2017. "Effects of Pentobarbital Anesthesia on Tonic Luteinizing Hormone Secretion in the Ewe: Evidence for Active Inhibition of Luteinizing Hormone in Anestrus’." Accessed June 24. https://oup.silverchair-cdn.com/oup/backfile/Content_public/Journal/biolreprod/30/2/10.1095_biolreprod30.2.374/1/biolreprod0374.pdf?Expires=1498424862&Signature=ExQLkNUqCd26Bx8uQ9BXM91NbtdmZmsxNMH0NIc6noldfhsrt~CLxsAz5ZrQf8y0759tjtlI83j3f8L3bSN1aCMyyjea0ST~IrANN2FfDsPF-530j1sDe0rNaqcVPXtF1smPgIlMrG-5EKDulzTN9ncHQDkwPLMoZLVcBfj7lYFBzaUMkYfvqG9NymeTlhgHXAJY2vPtZoGEEYolLpeucDEdh31rgfoLuji0CK2d2bBbWyJ4IEmoljkaivXYtQcZvQpEnB503jhKxpFcLCgq0vQLlH6Q3xCp~o5vhvk~oVXKde0CxIMIS1whVg3IZtn308Wnd0DwFJWLD-7PVNladw__&Key-Pair-Id=APKAIUCZBIA4LVPAVW3Q.
Guerin, M V, and X J Wang. 1994. "Environmental Temperature Has an Influence on Timing of the First Ovulation of Seasonal Estrus in the Mare." Theriogenology 42 (6): 1053–60. http://www.ncbi.nlm.nih.gov/pubmed/16727609. [ Links ]
Gustine, David, Perry Barboza, Layne Adams, Brad Griffith, Raymond Cameron, and Kenneth Whitten. 2017. "Advancing the Match-Mismatch Framework for Large Herbivores in the Arctic: Evaluating the Evidence for a Trophic Mismatch in Caribou." Edited by Marco Apollonio. PLOS ONE 12 (2): e0171807. doi:10.1371/journal.pone.0171807.
Hafez, E. S. E. 1952. "Studies on the Breeding Season and Reproduction of the Ewe Part I. The Breeding Season in Different Environments Part II. The Breeding Season in One Locality." The Journal of Agricultural Science 42 (3). Cambridge University Press: 189. doi:10.1017/S0021859600056896.
Hattar, S., H W Liao, M Takao, D M Berson, and K W Yau. 2002. "Melanopsin-Containing Retinal Ganglion Cells: Architecture, Projections, and Intrinsic Photosensitivity." Science 295 (5557): 1065–70. doi:10.1126/science.1069609. [ Links ]
Hazlerigg, David G., and Gerald A. Lincoln. 2011. "Hypothesis." Journal of Biological Rhythms 26 (6): 471–85. doi:10.1177/0748730411420812. [ Links ]
Hazlerigg, David, and Andrew Loudon. 2008. "New Insights into Ancient Seasonal Life Timers." Current Biology 18 (17): R795–804. doi:10.1016/j.cub.2008.07.040. [ Links ]
Henneke, D.R., G.D. Potter, and J.L. Kreider. 1984. "Body Condition during Pregnancy and Lactation and Reproductive Efficiency of Mares." Theriogenology 21 (6): 897–909. doi:10.1016/0093-691X(84)90383-2. [ Links ]
Henniawati, and I.C. Fletcher. 1986. "Reproduction in Indonesian Sheep and Goats at Two Levels of Nutrition." Animal Reproduction Science 12 (2): 77–84. doi:10.1016/0378-4320(86)90047-3. [ Links ]
Hut, R. A., and D. G. M. Beersma. 2011. "Evolution of Time-Keeping Mechanisms: Early Emergence and Adaptation to Photoperiod." Philosophical Transactions of the Royal Society B: Biological Sciences 366 (1574): 2141–54. doi:10.1098/rstb.2010.0409. [ Links ]
Kappers, J A. 1976. "The Mammalian Pineal Gland, a Survey." Acta Neurochirurgica 34 (1–4): 109–49. http://www.ncbi.nlm.nih.gov/pubmed/785963. [ Links ]
Keisler, Duane H, and Matthew C Lucy. 1996. "Perception and Interpretation of the Effects of Undernutrition on Reproduction." Journal of Animal Science 74 (suppl_3): 1. doi:10.2527/1996.74suppl_31x. [ Links ]
Koford, Carl B. 1957. "The Vicuna and the Puna." Ecological Monographs 27 (2). Ecological Society of America: 153–219. doi:10.2307/1948574. [ Links ]
Kubiak, J R, B H Crawford, E L Squires, R H Wrigley, and G M Ward. 1987. "The Influence of Energy Intake and Percentage of Body Fat on the Reproductive Performance of Nonpregnant Mares." Theriogenology 28 (5): 587–98. http://www.ncbi.nlm.nih.gov/pubmed/16726341. [ Links ]
Legan, S J, and F J Karsch. 1980. "Photoperiodic Control of Seasonal Breeding in Ewes: Modulation of the Negative Feedback Action of Estradiol." Biology of Reproduction 23 (5): 1061–68. http://www.ncbi.nlm.nih.gov/pubmed/6781542. [ Links ]
Lewy, A J, T A Wehr, F K Goodwin, D A Newsome, and S P Markey. 1980. "Light Suppresses Melatonin Secretion in Humans." Science (New York, N.Y.) 210 (4475): 1267–69. http://www.ncbi.nlm.nih.gov/pubmed/7434030. [ Links ]
Lincoln, G A, and R V Short. 1980. "Seasonal Breeding: Nature’s Contraceptive." Recent Progress in Hormone Research 36: 1–52. http://www.ncbi.nlm.nih.gov/pubmed/6774387.
Malpaux, B., C. Vigui?, D.C. Skinner, J.C. Thi?ry, J. Pelletier, and P. Chemineau. 1996. "Seasonal Breeding in Sheep: Mechanism of Action of Melatonin." Animal Reproduction Science 42 (1–4): 109–17. doi:10.1016/0378-4320(96)01505-9. [ Links ]
Malpaux, B, and F J Karsch. 1990. "A Role for Short Days in Sustaining Seasonal Reproductive Activity in the Ewe." Journal of Reproduction and Fertility 90 (2): 555–62. http://www.ncbi.nlm.nih.gov/pubmed/2250253. [ Links ]
Mani, A U, W A McKelvey, and E D Watson. 1992. "The Effects of Low Level of Feeding on Response to Synchronization of Estrus, Ovulation Rate and Embryo Loss in Goats." Theriogenology 38 (6): 1013–22. http://www.ncbi.nlm.nih.gov/pubmed/16727199. [ Links ]
McDaniel, J.B., J.L. Kreider, and D.M. Thrasher. 1979. "Influence of Artificial Light and Nutritional Supplement on the Onset of Breeding Season in Mares." Livestock Producers’ Day. http://agris.fao.org/agris-search/search.do?recordID=US201301392949.
Monecke, Stefanie, Dominique Sage-Ciocca, Franziska Wollnik, and Paul P?vet. 2013. "Photoperiod Can Entrain Circannual Rhythms in Pinealectomized European Hamsters." Journal of Biological Rhythms 28 (4): 278–90. doi:10.1177/0748730413498561. [ Links ]
Moore, Robert Y., Joan C. Speh, and J. Patrick Card. 1995. "The Retinohypothalamic Tract Originates from a Distinct Subset of Retinal Ganglion Cells." The Journal of Comparative Neurology 352 (3): 351–66. doi:10.1002/cne.903520304. [ Links ]
Nagy, P, D Guillaume, P Daels, F.J. Karsch, M. Quentin, C. Jamain, J.-P. Ravault, P. Rudas, and L. Solti. 2000. "Seasonality in Mares." Animal Reproduction Science 60–61 (July). Lea & Febiger, Philadelphia: 245–62. doi:10.1016/S0378-4320(00)00133-0. [ Links ]
Ogutu, Joseph O., Norman Owen-Smith, Hans-Peter Piepho, and Holly T. Dublin. 2015. "How Rainfall Variation Influences Reproductive Patterns of African Savanna Ungulates in an Equatorial Region Where Photoperiod Variation Is Absent." Edited by Mathew S. Crowther. PLOS ONE 10 (8): e0133744. doi:10.1371/journal.pone.0133744.
Ortavant, R, F Bocquier, J Pelletier, J P Ravault, J Thimonier, and P Volland-Nail. 1988. "Seasonality of Reproduction in Sheep and Its Control by Photoperiod." Australian Journal of Biological Sciences 41 (1): 69–85. http://www.ncbi.nlm.nih.gov/pubmed/3077741. [ Links ]
Ortavant, R, J Pelletier, J P Ravault, J Thimonier, and P Volland-Nail. 1985. "Photoperiod: Main Proximal and Distal Factor of the Circannual Cycle of Reproduction in Farm Mammals." Oxford Reviews of Reproductive Biology 7: 305–45. http://www.ncbi.nlm.nih.gov/pubmed/3936004. [ Links ]
Ovejero Aguilar, Ramiro J A, Graciela A Jahn, Mauricio Soto-Gamboa, Andrés J Novaro, and Pablo Carmanchahi. 2016. "The Ecology of Stress: Linking Life-History Traits with Physiological Control Mechanisms in Free-Living Guanacos." PeerJ 4 (November): e2640. doi:10.7717/peerj.2640.
Palmer, E., and D. Guillaume. 1992. "Photoperiodism in the Equine Species — What Is a Long Night?" Animal Reproduction Science 28 (1–4): 21–30. doi:10.1016/0378-4320(92)90087-T. [ Links ]
Palmer, E, and M.A Driancourt. 1983. "Some Interactions of Season of Foaling, Photoperiod and Ovarian Activity in the Equine." Livestock Production Science 10 (2): 197–210. doi:10.1016/0301-6226(83)90035-0. [ Links ]
Panda, S., Surendra K Nayak, Brice Campo, John R Walker, John B Hogenesch, and Tim Jegla. 2005. "Illumination of the Melanopsin Signaling Pathway." Science 307 (5709): 600–604. doi:10.1126/science.1105121. [ Links ]
Pelletier, J, and R Ortavant. 1975. "Photoperiodic Control of LH Release in the Ram. II. Light-Androgens Interaction." Acta Endocrinologica 78 (3): 442–50. http://www.ncbi.nlm.nih.gov/pubmed/1173013. [ Links ]
Peltier, M. R., G. Robinson, and D. C. Sharp. 1998. "Effects of Melatonin Implants in Pony Mares 2. Long-Term Effects." Theriogenology 49 (6): 1125–42. doi:10.1016/S0093-691X(98)00061-2. [ Links ]
Petterborg, L.J., B.A. Richardson, and R.J. Reiter. 1981. "Effect of Long or Short Photoperiod on Pineal Melatonin Content in the White-Footed Mouse." Life Sciences 29 (16): 1623–27. doi:10.1016/0024-3205(81)90063-1. [ Links ]
Pévet, P., B. Vivien-Roels, and M. Masson-Pévet. 1991. "Annual Changes in the Daily Pattern of Melatonin Synthesis and Release." In Role of Melatonin and Pineal Peptides in Neuroimmunomodulation, 147–57. Boston, MA: Springer US. doi:10.1007/978-1-4615-3756-4_15.
Pinedo, P.J., and A. De Vries. 2017. "Season of Conception Is Associated with Future Survival, Fertility, and Milk Yield of Holstein Cows." Journal of Dairy Science 100 (8): 6631–39. doi:10.3168/jds.2017-12662. [ Links ]
Plasse, D, A C Warnick, and M Koger. 1970. "Reproductive Behavior of Bos Indicus Females in a Subtropical Environment. IV. Length of Estrous Cycle, Duration of Estrus, Time of Ovulation, Fertilization and Embryo Survival in Grade Brahman Heifers." Journal of Animal Science 30 (1): 63–72. http://www.ncbi.nlm.nih.gov/pubmed/5436442. [ Links ]
Post, E., and M. C Forchhammer. 2008. "Climate Change Reduces Reproductive Success of an Arctic Herbivore through Trophic Mismatch." Philosophical Transactions of the Royal Society B: Biological Sciences 363 (1501): 2367–73. doi:10.1098/rstb.2007.2207. [ Links ]
Reiter, Russel J., Dun-Xian Tan, Lucien C. Manchester, Sergio D. Paredes, Juan C. Mayo, and Rosa M. Sainz. 2009a. "Melatonin and Reproduction Revisited." Biology of Reproduction 81 (3): 445–56. doi:10.1095/biolreprod.108.075655. [ Links ]
Reiter, Russel J, Dun-Xian Tan, Lucien C Manchester, Sergio D Paredes, Juan C Mayo, and Rosa M Sainz. 2009b. "Melatonin and Reproduction Revisited." Biology of Reproduction 81 (3): 445–56. doi:10.1095/biolreprod.108.075655. [ Links ]
Rhind, S.M, S.R McMillen, E Duff, D Hirst, and S Wright. 1998. "Seasonality of Meal Patterns and Hormonal Correlates in Red Deer." Physiology & Behavior 65 (2): 295–302. doi:10.1016/S0031-9384(98)00164-4. [ Links ]
Rhind, S M, M T Rae, and A N Brooks. 2001. "Effects of Nutrition and Environmental Factors on the Fetal Programming of the Reproductive Axis." Reproduction (Cambridge, England) 122 (2): 205–14. http://www.ncbi.nlm.nih.gov/pubmed/11467971. [ Links ]
Riveros, Jos? Luis, Bessie Urquieta, Cristian Bonacic, Bernd Hoffmann, Fernando Bas, and Gerhard Schuler. 2009. "Endocrine Changes during Pregnancy, Parturition and Post-Partum in Guanacos (Lama Guanicoe)." Animal Reproduction Science 116 (3–4): 318–25. doi:10.1016/j.anireprosci.2009.02.005. [ Links ]
Riveros, José Luis, Gerhard Schuler, Cristian Bonacic, Bernd Hoffmann, M. Graciela Chaves, and Bessie Urquieta. 2010. "Ovarian Follicular Dynamics and Hormonal Secretory Profiles in Guanacos (Lama Guanicoe)." Animal Reproduction Science 119 (1–2): 63–67. doi:10.1016/j.anireprosci.2009.11.005. [ Links ]
Rodríguez, Yusleiby, and Raquel Ponce De León. 2013. "Comportamiento Reproductivo de Novillas Cebú Lechero Cubano Y Mestizas de Cebú Lechero En La Empresa Pecuaria Genética " Los Naranjos "" Revista Cubana de Ciencia Agrícola 47 (2). http://www.redalyc.org/pdf/1930/193028751003.pdf.
ROLLAG, M.D., and G.D. NISWENDER. 1976. "Radioimmunoassay of Serum Concentrations of Melatonin in Sheep Exposed to Different Lighting Regimens." Endocrinology 98 (2). Oxford University Press: 482–89. doi:10.1210/endo-98-2-482. [ Links ]
Rutberg, A. T. 1984. "Birth Synchrony in American Bison (Bison Bison): Response to Predation or Season?" Journal of Mammalogy 65 (3). Oxford University Press: 418–23. doi:10.2307/1381088. [ Links ]
San Martin, F., F.C. Bryant, A. Valenzuela, D. Chauca, J. Esquerre, E. Candela, M. Nava, C. Villarroel, and A. Faura. 1989. "Nutrition of Domesticated South American Llamas and Alpacas." Small Ruminant Research 2 (3). O&B Books, Corvallis, OR: 191–216. doi:10.1016/0921-4488(89)90001-1. [ Links ]
Santiago-Moreno, J, A Gómez-Brunet, A Toledano-Díaz, R Picazo, A Gonzalez-Bulnes, and A López-Sebastián. 2006. "Seasonal Endocrine Changes and Breeding Activity in Mediterranean Wild Ruminants." Reproduction in Domestic Animals 41 (s2): 72–81. doi:10.1111/j.1439-0531.2006.00771.x. [ Links ]
Santiago-Moreno, J, A González-Bulnes, A Gómez Brunet, A del Campo, R Picazo, and A L López Sebastián. 2000. "Nocturnal Variation of Prolactin Secretion in the Mouflon (Ovis Gmelini Musimon) and Domestic Sheep (Ovis Aries): Seasonal Changes." Animal Reproduction Science 64 (3–4): 211–19. http://www.ncbi.nlm.nih.gov/pubmed/11121897. [ Links ]
Scaramuzzi, RJ, and GB Martin. 2008. "The Importance of Interactions Among Nutrition, Seasonality and Socio-Sexual Factors in the Development of Hormone-Free Methods for Controlling Fertility." Reproduction in Domestic Animals 43 (July): 129–36. doi:10.1111/j.1439-0531.2008.01152.x. [ Links ]
SCHMIDT, CHRISTIAN R. 1973. "Breeding Seasons and Notes on Some Other Aspects of Reproduction in Captive Camelids." International Zoo Yearbook 13 (1). Blackwell Publishing Ltd: 387–90. doi:10.1111/j.1748-1090.1973.tb02187.x. [ Links ]
Setchell, B.P., M.F. McDonald, S.N. McCutcheon, H.T. Blair, F. du Mesnil du Buisson, R. Ortavant, J. Pelletier, and J.P. Signoret. 1992. "Domestication and Reproduction." Animal Reproduction Science 28 (1–4). Hutchinson, London: 195–202. doi:10.1016/0378-4320(92)90106-N. [ Links ]
Sinclair, A. R. E., Simon A. R. Mduma, and Peter Arcese. 2000. "What Determines Phenology and Synchrony of Ungulate Breeding in Serengeti?" Ecology 81 (8). WileyEcological Society of America: 2100. doi:10.2307/177099.
Snyder, J.L., J.A. Clapper, A.J. Roberts, D.W. Sanson, D.L. Hamernik, and G.E. Moss. 1999. "Insulin-Like Growth Factor-I, Insulin-Like Growth Factor-Binding Proteins, and Gonadotropins in the Hypothalamic-Pituitary Axis and Serum of Nutrient-Restricted Ewes1." Biology of Reproduction 61 (1). McGraw Hill Book Company, New York: 219–24. doi:10.1095/biolreprod61.1.219. [ Links ]
Stokkan, Karl-Arne, Nicholas J. C. Tyler, and Russel J. Reiter. 1994. "The Pineal Gland Signals Autumn to Reindeer ( Rangifer Tarandus Tarandus ) Exposed to the Continuous Daylight of the Arctic Summer." Canadian Journal of Zoology 72 (5). NRC Research Press Ottawa, Canada : 904–9. doi:10.1139/z94-123. [ Links ]
Sumar, Julio B., R.J. Chapman, W.C. Foote, H. Kindahl, L.E. Edqvist, and L. Acosta. 1996. "Reproduction in Llamas and Alpacas." Animal Reproduction Science 42 (1–4). Corporacion Nacional Forestal e Instituto de la Patagonia, Punta Arenas, Chile: 405–15. doi:10.1016/0378-4320(96)01538-2. [ Links ]
Taberlet, Pierre, Eric Coissac, Johan Pansu, and Fran?ois Pompanon. 2011. "Conservation Genetics of Cattle, Sheep, and Goats." Comptes Rendus Biologies 334 (3): 247–54. doi:10.1016/j.crvi.2010.12.007. [ Links ]
Tamarkin, L, C. Baird, and O. Almeida. 1985. "Melatonin: A Coordinating Signal for Mammalian Reproduction?" Science 227 (4688): 714–20. doi:10.1126/science.3881822. [ Links ]
Tast, Anssi, Outi Halli, Susanna Ahlstrom, Hakan Andersson, Robert J. Love, and Olli A.T. Peltoniemi. 2001. "Seasonal Alterations in Circadian Melatonin Rhythms of the European Wild Boar and Domestic Gilt." Journal of Pineal Research 30 (1). Munksgaard International Publishers: 43–49. doi:10.1034/j.1600-079X.2001.300106.x. [ Links ]
Tephan Steinlechner, S. 2017. "Melatonin as a Chronobiotic: PROS and CONS." Accessed June 24. http://www.ane.pl/pdf/56045.pdf. [ Links ]
Thimonier, J, and A Sempere. 1989. "La Reproduction Chez Les Cervidés" 2 (1): 5–21. https://hal.archives-ouvertes.fr/hal-00895849/document.
TW, Knight, and Knight TW. 1985. "Are Rams Necessary for the Stimulation of Anoestrous Ewes with Oestrous Ewes?" Proceedings of the New Zealand Society of Animal Production 45 (January). http://www.sciquest.org.nz/node/39940.
Ungerfeld, Rodolfo, and Alejandro Bielli. 2003. "Seasonal and Social Factors Affecting Reproduction." Encyclopedia of Life Support Systems. Montevideo Uruguay: Encyclopedia of Life Support Systems (EOLSS), Developed under the Auspices of the UNESCO. https://www.researchgate.net/publication/262567464_Seasonal_and_social_factors_affecting_reproduction. [ Links ]
Villagómez Amezcua Manjarrez, México, Castillo Rojas, Villa Godoy, Román Ponce, and Vázquez Peláez. 2000. "Técnica Pecuaria En México." Técnica Pecuaria En México 38 (2): 89–103. http://www.redalyc.org/pdf/613/61338203.pdf. [ Links ]
Wade, George N., and Juli E. Jones. 2004. "Neuroendocrinology of Nutritional Infertility." American Journal of Physiology - Regulatory, Integrative and Comparative Physiology 287 (6). http://ajpregu.physiology.org/content/287/6/R1277.
Walkden-Brown, S.W., B.J. Restall, and Henniawati. 1993. "The Male Effect in the Australian Cashmere Goat. 3. Enhancement with Buck Nutrition and Use of Oestrous Females." Animal Reproduction Science 32 (1–2): 69–84. doi:10.1016/0378-4320(93)90058-Y. [ Links ]
Wehr, Thomas A. 1997. "Melatonin and Seasonal Rhythms." Journal of Biological Rhythms 12 (6). Sage PublicationsSage CA: Thousand Oaks, CA: 518–27. doi:10.1177/074873049701200605. [ Links ]
Wood, Shona, and Andrew Loudon. 2017. "The Pars Tuberalis: The Site of the Circannual Clock in Mammals?" General and Comparative Endocrinology, June. doi:10.1016/j.ygcen.2017.06.029.
Zerbe, Philipp, Marcus Clauss, Daryl Codron, Laurie Bingaman Lackey, Eberhard Rensch, J?rgen W. Streich, Jean-Michel Hatt, and Dennis W. H. M?ller. 2012. "Reproductive Seasonality in Captive Wild Ruminants: Implications for Biogeographical Adaptation, Photoperiodic Control, and Life History." Biological Reviews 87 (4): 965–90. doi:10.1111/j.1469-185X.2012.00238.x. [ Links ]
Zuckerman, S. 2009. "The Breeding Seasons of Mammals in Captivity." Proceedings of the Zoological Society of London 122 (3). Blackwell Publishing Ltd: 827–950. doi:10.1111/j.1096-3642.1952.tb00251.x. [ Links ]
Artículo recibido 27-06-2017
Artículo aceptado 20-09-2017
On line: 27-09-2017