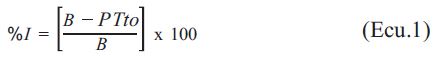Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Altoandinas
versión On-line ISSN 2313-2957
Rev. investig. Altoandin. vol.19 no.4 Puno oct./dic 2017
http://dx.doi.org/10.18271/ria.2017.312
ARTÍCULO DEL 4TO CONGRESO INTERNACIONAL DE INGENIERÍA AGROINDUSTRIAL
Efecto antimicrobiano del quitosano y cascara de naranja en el tratamiento de aguas residuales.
Antimicrobial effect of the quitosano and rind of orange in the treatment of waste water
Yesenia Campo Vera1*, Mónica Alexandra Delgado1, Yuly Roa1, Gustavo Mora1.
1 Grupo de Investigación para la Innovación Social, Agroindustrial, Tecnológica y Ambiental Araucana- GIISATA. Semillero de Investigación en Gestión y Saneamiento Ambiental. Centro de Gestión Agroindustrial de Arauca Dirección: Carrera 20 No. 28-163. Servicio Nacional de Aprendizaje–SENA. Colombia.
* Corresponding author (phone: +51-00-3102712135; e-mail: yesenia.campo.vera@gmail.com)
RESUMEN
El quitosano y sus derivados como agentes antimicrobianos naturales pueden aplicarse en agricultura, alimentos, biomédica, biotecnológica y farmacéutica. Su actividad antimicrobiana depende de muchos factores tales como su tamaño molecular, fuente, componentes asociados, pH, concentración y tipo de microorganismo. La cáscara de naranja es un biosorbente de naturaleza ecológica, de bajo costo y fácil disponibilidad. La investigación tiene como objetivo evaluar el efecto antimicrobiano de mezclas de quitosano y extracto acuoso de la cascara de naranja a diferentes concentraciones en el tratamiento de aguas residuales. El quitosano se obtuvo de forma comercial (Ch) de bajo peso molecular con un grado de desacetilación (DA) del 81,4%, y la cáscara de naranja se obtuvo a partir del secado al ambiente y posterior pulverización. En el ensayo, se aislaron e identificaron bacterias Gram negativas y Gram positivas de las muestras de agua residual que se tomaron en el emisario final de la planta de tratamiento PTAR del municipio de Saravena, (Colombia); y se determinó el % de inhibición a partir de pruebas de antibiograma. Los resultados mostraron que las bacterias Gram positivas son más sensibles que las Gram negativas a los tratamientos, la combinación de quitosano y extracto acuoso de cascara de naranja (50-50%) causo un incremento significativo en el % de inhibición. Demostrando que la cascara de naranja potencializa la actividad antibacteriana del quitosano y lo convierten en un agente eficiente para ser usado en el tratamiento de aguas residuales.
PALABRAS CLAVES: Antimicrobianos, aguas residuales, cascara de naranja, quitosano.
ABSTRACT
Chitosan and its derivatives as natural antimicrobial agents can be applied in agriculture, and in the food, biomedical, biotechnological and pharmaceutical industry. Its antimicrobial activity depends on many factors such as its molecular size, source, associated components, pH, concentration and the type of microorganism. Orange peels are a bio absorbent of ecological nature low-cost and easily found. The research aims to assess the antimicrobial effect of chitosan and aqueous extract or orange peels in different concentrations for the treatment of waste waters. The chitosan was obtained in its commercial presentation (Ch) of low molecular weight with a deacetylation (DA) degree of 81.4%, and the orange peels were treated by air-drying and later pulverization. During the essay, Gram positive and Gram negative bacteria were isolated and identified from the samples of waste water taken from the final emitter in the waste water treatment plant in the municipality of Saravena, Colombia; and the inhibition percentage was determined through antibiogram tests. Results showed that Gram positive bacteria are more sensitive to treatment than Gram negative bacteria. The combination of chitosan and aqueous extract of orange peels (at a 50%-50% ratio) caused a significant increase in the inhibition percentage, showing that orange peels bolster the antibacterial activity of chitosan and make it an efficient agent to be used in the treatment of waste waters.
KEYWORDS: Antimicrobial, waste water, orange peels, chitosan.
I. INTRODUCCIÓN
La escasez de suministro de agua y la baja calidad, junto con la falta de sistemas de saneamiento de aguas residuales eficientes en la depuración de la carga contaminante, sigue siendo en la actualidad un grave problema de salud pública en muchos países del mundo y en Colombia (Connor et al., 2017). El control de la contaminación de las aguas ha suscitado desde hace años un gran interés para la protección de la salud y del medio ambiente (Tchounwou et al., 2012). Una de las principales fuentes de contaminación de las aguas superficiales son los vertimientos de agua residual doméstica e industriales, proveniente de los sistemas de alcantarillados municipales (Nkansah et al., 2016). Los tratamientos de agua residuales comunes son de bajo costo de operación que busca principalmente la reducción de la carga orgánica contaminante (Connor et al., 2017).
Estas aguas tratadas posteriormente son incorporadas a cuerpos de aguas naturales (Ríos, quebradas, caños), siendo nuevamente fuente de captación para uso agrícola, pecuario y las plantas de tratamiento de agua potable Municipales, aguas abajo del vertimiento, razón por la que el control de vertidos ha centrado gran parte de las actuaciones legislativas de las administraciones competentes en esta materia hacia la disminución de la carga de microorganismos patógenos (Thebe y Mangore, 2012). Las técnicas convencionales para tratamiento de aguas residuales presentan dificultades al no lograr cumplir con los límites de vertido y pueden ocasionar efectos adversos sobre los organismos presentes en el ecosistema acuático, haciendo necesario la implementación de procesos alternos de depuración de aguas residuales; como lo es la utilización de material orgánico, implementando una tecnología limpia y amigable con el medio ambiente (Lizarazo y Orjuela, 2013; Clemente et al., 2013).
Para el tratamientos del agua, se han empleado diversos agentes coagulantes, como sales metálicas hidrolizables (cloruro férrico, sulfato de aluminio, policloruro de aluminio) y polímeros biodegradables con cargas definidas a través de su estructura; para reducir los niveles de contaminación. Estos polímeros se destacan por ser una alternativa amigable con el medio ambiente, debido a sus propiedades como alta solubilidad en agua, capacidad de regeneración y reutilización, adsorción, biodegradación, resistencia y fuerza mecánica (Malayoglu, 2017).
El quitosano es la forma desacetilada de quitina, un biopolímero que se puede obtener de diversos flujos de desechos y muestra actividad antimicrobiana contra diferentes hongos, bacterias gram positivas y gram negativas (Verlee et al., 2017). El quitosano se obtiene a partir de quitina, un biopolímero que se puede extraer de los crustáceos, hongos e insectos (Zou et al., 2016), se obtiene desacetilando quitina con NaOH al 30-60%; la actividad antimicrobiana aumenta, así como la solubilidad en medios ácidos (Verlee et al., 2017).
El quitosano es un copolímero al azar de D- glucosamina y N-acetil-D unidades de glucosamina. La relación entre estas dos unidades monoméricas, expresada como el grado de acetilación o desacetilación, y el peso molecular juegan un papel importante en la actividad antimicrobiana del quitosano y la solubilidad en medios acuosos (Verlee et al., 2017). Entre algunos de los mecanismos antibacterianos se destacan: 1). La interacción de la superficie iónica que resulta en la fuga de las células de la pared, la cual está mediada por las fuerzas electrostáticas entre los grupos de protonadas NH3+ y los residuos negativos. 2). La inhibición de la síntesis de ARNm y proteínas a través de la penetración de quitosano en los núcleos de los microorganismos; se supone que las moléculas de quitosano son capaces de atravesar la pared celular de las bacterias y llegar a la membrana plasmática. Y 3). La formación de una barrera externa para quelar metales y provocar la supresión de nutrientes esenciales para el crecimiento microbiano (Fernández et al., 2016).
En la última década, la cascara de naranja ha sido reportada como un excelente sustrato para varios productos de valor agregado, tales como aceites esenciales, pectina, antioxidantes naturales, antimicrobiano, etanol, ácidos orgánicos y oligosacáridos pectóticos (Mamma y Christakopoulos, 2014). La cáscara de naranja está compuesta principalmente de celulosa, pectina, hemi-celulosa, lignina, pigmentos de clorofila y otros hidrocarburos de bajo peso molecular que contienen muchos grupos funcionales hidroxilo lo que hace que sea un sorbente potencial para muchos contaminantes (Bhatnagar et al., 2015). Posee componentes bioactivos, que se considera que tienen un efecto beneficioso sobre la salud; especialmente en compuestos fenólicos y polifenólicos que exhiben actividades antimicrobianas y antioxidantes (Ahn et al., 2007; Benites et al., 2011). El objetivo de esta investigación fue evaluar el efecto quitosano y el extracto acuoso de la cascara de naranja como agentes antimicrobiano en el tratamiento de aguas residuales.
II. MATERIALES Y MÉTODOS
Localización. La investigación se llevó a cabo durante los meses de Junio a Julio de 2017, en el Laboratorio de la planta de tratamiento de aguas residuales de Empresa Comunitaria de Acueducto, Alcantarillado y Aseo Saravena, Arauca, Colombia, ubicada en una latitud norte entre 6° 46' y 7° 00' y una longitud este entre 71° 41' y 71° 06', a una altitud de 190 y 2600 msnm. La temperatura media diurna dentro del laboratorio fue de 27 ± 2 °C y una humedad relativa del 74%.
Caracterización del agua contaminada. Las muestras de agua contaminada fueron tomadas en diferentes puntos de captación del municipio de Saravena en Arauca-Colombia. Para el diseño experimental se recogió muestra suficiente para llevar a cabo un diseño completamente al azar de 3x3 correspondiente a 9 tratamientos. Las muestras se tomaron en el punto de vertimiento final del sistema de tratamiento de agua residual, llevado en la PTAR. Tomadas de acuerdo al instructivo del IDEAM. Los análisis se realizaron en el laboratorio SIAMA LTDA.N°: P171164 acreditado de Bucaramanga se realizaron las análisis microbiológicos de agua residual: Coliformes totales, fecales y Escherichia coli.
Preparación de soluciones de quitosano. El quitosano comercialmente disponible (Ch) de bajo peso molecular con un grado de desacetilación (DA) del 81,4% (50.000-190.000 Da) se adquirió de la empresa ALDRICH. El polvo de quitosano (1 g) se mezcló con 5 ml de solución de ácido acético al 1%, aforando a 100 mL con agua destilada con agitación constante por 1h a temperatura ambiente para obtener una solución de quitosano al 1% (p/v).
Obtención de los extracto acuoso de cascara de naranja. Se pesó 2 g de cáscara de naranja molidas y agregó 200 mL de agua a temperatura de ebullición, dejándola reposar por 3 minutos. Se filtró en caliente, obteniéndose soluciones al 1% que se almacenaron a temperatura de 0 a 4 °C en frascos ámbar hasta su uso.
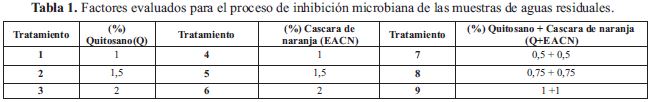
Planteamiento del diseño experimental. Se planteó un diseño experimental completo, aleatorio, de tres niveles (tabla 1), con el objeto de evaluar el efecto que tienen: el quitosano y el extracto acuoso de cáscara de naranja en el tratamiento de aguas residuales.
Aislamiento e Identificación Bacteriana. Las cepas provenientes de las muestras de agua se aislaron directamente de filtros de membrana en agar Chromocult (Merck), mientras que las cepas de sedimentos se aislaron de los tubos positivos de la prueba confirmatoria en caldo verde bilis brillante (Merck). De las muestras del agua se realizaron diluciones y siembras en medios selectivos y diferenciales: E. coli en Agar Mac Conkey, coliformes totales agar-lactosa-bilis-rojo violeta (ABRV) y coliformes fecales en Agar con Eosina y Azul de Metileno. Las colonias bacterianas desarrolladas se observó características macroscópicas, tales como: forma, color, borde, centro, superficie y elevación. La identificación se realizó mediante la aplicación de pruebas bioquímicas diferenciales convencionales, usando las tablas y claves del Bergey's Manual of Determinative Bacteriology (Camacho et al., 2009).
Prueba de sensibilidad. El efecto antimicrobiano sobre las diferentes cepas bacterianas se determinó mediante la técnicas de difusión en agar o antibiograma (Castañeda et al., 2009). Se preparó el agar Mueller-Hinton, de acuerdo con las instrucciones del fabricante (OXOID®), y se vertió en cajas de Petri de 150 mm dejando un espesor de 15 mm (aproximadamente 20 a 25 mililitros). Posteriormente, se sometió a prueba de esterilidad la cual consiste en la incubación por 24 horas a 37 °C. Una vez transcurrido este tiempo se verificó que no hubiera crecimiento de colonias en el medio, lo que significaba que se podía utilizar para la prueba. Se realizó una suspensión de las bacterias en solución salina al 0,85% (tubo 0,5 de la escala de Mac-Farland), lo cual es equivalente a inocular 1,5X108 Unidades Formadoras de Colonias (UFC)/ ml, y se procedió a la siembra en el medio Mueller- Hinton (Mantilla et al., 2010).
Se impregnaron los sensidiscos de papel Whatman N° 1 (Whatman International Ltd., England) estéril, de 7,25 mm de diámetro, por 15 min en los 9 tratamientos; se introdujeron 5 discos, 4 en la periferia y 1 en el centro y fueron incubados durante 24 h a 37 °C. Luego del periodo de incubación se midieron los halos con una regla milimetrada, los ensayos se realizaron por triplicado.
El porcentaje de inhibición fue determinado empleando la Ecuación 1:
Dónde: I es el porcentaje (%) de inhibición, P es el promedio del crecimiento en mm de cada tratamiento y B es el blanco absoluto (sin tratamiento). Se empleó como control, agua destilada estéril.
Análisis estadístico. Los resultados obtenidos fueron tratados estadísticamente significativa a una nivel de 95% (P <0.05), con el fin de discernir mejor los resultados del ANOVA se utilizó la prueba post hoc de Diferencias Mínimas Significativas (DMS), paquete de software estadístico SPSS versión 22.0.
III. RESULTADOS Y DISCUSIÓN
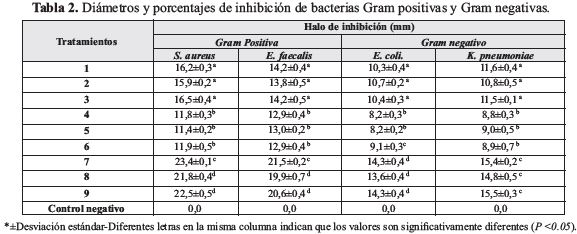
Se aislaron 15 cepas bacterianas de muestras de agua. El 90,0 % de las cepas aisladas fueron bacilos Gram negativos y el 10,0 % estreptococos Gram positivos. En las muestras de agua se identificaron 10 especies: Escherichia coli, Enterobacteraerogenes, E. cloacae, S. aureus, Enterococcus equinus, E. faecalis, K. pneumoniae, C. freundii, C. diversus, E. aerogenes. Las especies de mayor porcentaje de aislamiento fueron E. coli, seguida de E. faecalis, S. aureus y de K. pneumoniae.
En la tabla 2 se observa que las bacterias Gram positivas son más sensibles que las Gram negativas a los compuestos antimicrobianos del quitosano y los extractos acuosos de cascara de naranja. Debido posiblemente a las diferencias estructurales de las bacterias; la pared celular de las Gram negativas es más delgada y contiene una membrana externa con un alto porcentaje de lípidos, que protege la integridad de la pared celular (Ahn et al., 2007; Benites et al., 2011).
Los tratamiento de quitosano, cascara de naranja y su mezcla en sus diferentes concentraciones (1,0; 1,5 y 2,0%) presentaron diferencias significativas en sus halos de inhibición, mostrado que las bacterias son sensibles a los soluciones. Los tratamiento que combinaron quitosano y extracto acuoso de cascara de naranja en sus diferentes porcentajes presentaron mayores halos de inhibición, seguido del quitosano (tabla 2).
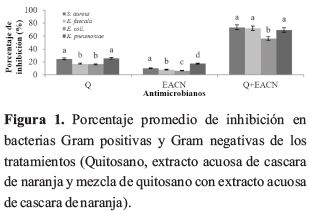
La figura 1 evidencia que los tratamientos que combinaron quitosano y extracto acuoso de cascara de naranja en sus diferentes porcentajes presentaron mayor % de inhibición. Debido probablemente a que el quitosano fue potencializado al combinarse con el extracto de cascara de naranja, aumentando su solubilidad y actividad antibacteriana en soluciones ácidas acuosas diluidas (pH <6,5), que pueden convertir unidades de glucosamina en forma soluble RNH3 + (Kumar et al., 2004; Qin et al., 2006).
Los tratamientos que se basaron en soluciones de quitosano en sus diferentes concentraciones mostraron una inhibición entre el 17 al 25 % en las bacterias estudiadas. El porcentaje de inhibición de los tratamientos dependen de la especie bacteriana y el peso molecular de quitosano (No et al., 2002). Las moléculas de quitosano positivamente cargadas interfieren con los residuos cargados negativamente en la superficie bacteriana, alterando la permeabilidad celular (Severino et al., 2015, Chien et al., 2015, Li et al., 2015).
Li et al., (2015) demostraron que el mecanismo antibacteriano del quitosano se debe a varios factores:
a) la interacciones de grupos NH3 + catiónicos con membranas celulares cargadas negativas que aumentan la permeabilidad de la membrana y la lisis celular; b) la interacción de los productos de la hidrólisis difundida con el ADN microbiano conduce a la inhibición de la síntesis de mRNA y de proteínas (Yuan et al., 2016); c) el quitosano inhibe el crecimiento microbiano por la quelación de nutrientes y metales esenciales (Yuan et al., 2016, Chien et al., 2015); d) el quitosano en la superficie de la célula puede formar una membrana polimérica que evita que los nutrientes ingresen (El-tahlawy et al., 2005) o actúa como una barrera contra el oxígeno, que pueden inhibir el crecimiento de bacterias aerobias (Yuan et al., 2016).
En la figura 1 se observa que los tratamientos de extracto acuoso de cascara en sus diferentes concentraciones (1,0; 1,5 y 2,0%) presentaron el menor porcentaje de inhibición (6 a 17 mm) con respecto a los de más tratamiento. Este comportamiento puede deberse al contenidos de polifenoles, en especial los del tipo esqueleto C6-C3- C6 (Flavonoides, flavonas, isoflavonas); que serían los responsables de la actividad antibacteriana encontrada en estos ensayos. Los polifenoles representan uno de los componentes abundantes en las cáscaras de naranja; estos compuestos tienen funciones de defensa en la planta, como agentes antimicrobianos, protección contra herbívoros y radiación UV (Ahn et al., 2007; Benites et al., 2011).
IV. CONCLUSIÓN
Los resultados mostraron que el quitosano, extracto acuoso de cascara de naranja y su combinación son efectivos en la inhibición de las cepas bacterianas estudiadas, observando que las Gram positivas son más sensibles que las Gram negativas a los tratamientos. La combinación de quitosano y extracto acuoso de cascara de naranja (50-50%) fue el tratamiento con mejor acción antimicrobiana, posiblemente porque la cascara de naranja aumenta la solubilidad al acidificar la solución, potencializando la actividad antibacteriana del quitosano. Demostrando que son agentes eficientes para ser usados en el tratamiento de aguas residuales.
REFERENCIAS BIBLIOGRÁFICAS
Ahn J, Kim Y, Seo E, Choi Y, Kim H. (20079. Antioxidant effect of natural plant extraets on the microencapsulated nigh oleic sunflower oil. J Food Engineering, 84: 327 -334. [ Links ]
Benites J, Díaz R, López J, Gajardo S, (2011). Actividad antioxidante y antibacteriana de seis cáscaras de frutos del oasis de Pica. Rev. BIOFARBO, 19(1): 1-7 [ Links ]
Bhatnagar, A., Sillanpa a, M., Witek-Krowiak, A., (2015). Agricultural waste peels as versatile biomass for water purification e a review. Chem. Eng. J., 270, 244e271 [ Links ]
Camacho, A., Giles, M., & Ortegón, A. (2009). Método para la determinación de bacterias coliformes, coliformes fecales y Escherichia coli por la técnica de diluciones en tubo múltiple (Número más Probable o NMP).
Castañeda, Y; Lopez, P.; Figueroa, Y.; Fuentes, J. (2009). Susceptibilidad a antibióticos de bacterias indicadoras de contaminación fecal aisladas de aguas y sedimentos marinos. Saber. 21 (1): 12-19. [ Links ]
Chien, R.-C., Yen, M.-T., & Mau, J.-L. (2015). Antimicrobial and antitumor activities of chitosan from shiitake stipes, compared to commercial chitosan from crab shells. Carbohydrate Polymers . doi:10.1016/j.carbpol.2015.11.061.
Clemente, A. R., Arrieta, E. L. C., & Mesa, G. A. P. (2013). Procesos de tratamiento de aguas residuales para la eliminación de contaminantes orgánicos emergentes/Processos de tratamento de águas residuárias para a remoção de contaminantes orgânicos emergentes. Revista Ambiente & Água, 8(3), 93. [ Links ]
Connor, R., Renata, A., Ortigara, C., Koncagül, E., Uhlenbrook, S., Lamizana-Diallo, B. M., & Hendry, S. (2017). The United Nations World Water Development Report 2017. Wastewater: The Untapped Resource. The United Nations World Water Development Report. [ Links ]
El-tahlawy, K. F., El-bendary, M. A., Elhendawy, A. G., & Hudson, S. M. (2005). The antimicrobial activity of cotton fabrics treated with different crosslinking agents and chitosan. Carbohydrate Polymers, 60, 421-430.
Fernández de Castro, L. Mengíbar, M. Sánchez, A. Arroyo, L. Villarán, M.C. Díaz de Apodaca, E. Heras, A. (2016). Films of chitosan and chitosan-oligosaccharide neutralized and thermally treated: Effects on its antibacterial and other activities, LWT-Food Sci. Technol. 73: 368-374. [ Links ]
Kumar, M. N. V. R., Muzzarelli, R. A. A., Muzzarelli, C., Sashiwa, H., & Domb, A. J. (2004). Chitosan chemistry and pharmaceutical perspectives. Chemical Reviews, 104, 6017-6084. [ Links ]
Li, Z., Yang, F., Yang, R. (2015). Synthesis and characterization of chitosan derivatives with dualantibacterial functional groups. International Journal of Biological Macromolecules, 75, 378–387. [ Links ]
Lizarazo Becerra, J. M., & Orjuela Gutiérrez, M. I. (2013). Sistemas de plantas de tratamiento de aguas residuales en Colombia (Doctoral dissertation, Universidad Nacional de Colombia). [ Links ]
Malayoglu, U. (2017). WITHDRAWN: Removal of heavy metals by biopolymer (chitosan)/nanoclay composites. [ Links ]
Mamma, D., Christakopoulos, P., (2014). Biotransformation of Citrus By-Products into Value Added Products. Waste and Biomass Valorization 5, 529–549. [ Links ]
Mantilla, J., Pulido, M., & Jaime, J. (2010). Prueba de sensibilidad antimicrobiana de cepas de Salmonella grupo D (móviles e inmóviles) aisladas de ponedoras comerciales en Colombia. Revista de la Facultad de Medicina Veterinaria y de Zootecnia, 57(3), 159. [ Links ]
No, H. K., Park, N. Y., Lee, S. H., & Meyers, S. P. (2002). Antibacterial activity of chitosans and chitosan oligomers with different molecular weights. International Journal of Food Microbiology, 74, 65-72.
Qin, C., Li, H., Xiao, Q., Liu, Y., Zhu, J., & Du, Y. (2006). Water-solubility of chitosan and its antimicrobial activity. Carbohydrate Polymers, 63, 367-374. [ Links ]
Severino, R., Ferrari, G., Vu, K. D., Donsì, F., Salmieri, S., & Lacroix, M. (2015). Antimicrobial effects of modified chitosan based coating containing nanoemulsion of essential oils, modified atmosphere packaging and gamma irradiation against Escherichia coli O157:H7 and Salmonella Typhimurium on green beans. Food Control, 50, 215-222. [ Links ]
Tchounwou, P. B., Yedjou, C. G., Patlolla, A. K., & Sutton, D. J. (2012). Heavy metal toxicity and the environment. In Molecular, clinical and environmental toxicology (pp. 133-164). Springer Basel. [ Links ]
Thebe, T. A., & Mangore, E. N. (2012). Wastewater production, treatment, and use in Zimbabwe. Department of Civil and Water Engineering, National University of Science and Technology, Bulawayo. [ Links ]
Verlee, A.; Mincke, S.; Stevens, C. V. (2017). Recent Developments in Antibacterial and Antifungal Chitosan and Its Derivatives. Carbohydr. Polym., 164, 268–283 DOI:10.1016/j.carbpol.2017.02.001. [ Links ]
Yuan, G., Lv, H., Tang, W., Zhang, X., & Sun, H. (2016). Effect of chitosan coating combined with pomegranate peel extract on the quality of Pacific white shrimp during iced storage. Food Control, 59, 818-823. [ Links ]
Zou P, Yang X, Wang J, Li Y, Yu H, Zhang Y, (2016). Advances in characterisation and biological activities of chitosan and chitosan oligosaccharides. Food Chem.; 190: 1174–81 [ Links ]
Artículo recibido 13/07/2017
Artículo aceptado 28/08/2017
On line: 25/10/2017