Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Altoandinas
versão On-line ISSN 2313-2957
Rev. investig. Altoandin. vol.20 no.1 Puno jan./mar. 2018
http://dx.doi.org/10.18271/ria.2018.327
ARTÍCULO ORIGINAL
Cepas de Trichoderma con capacidad endofitica sobre el control del mildiu (Peronospora variabilis Gäum.) y mejora del rendimiento de quinua
Trichoderma strains with endophytic capacity on the control of the mildew (Peronospora variabilis Gäum) and improve quinoa yield
Betsabe Leon Ttacca1; Nora Ortiz Calcina2; Condori Ticona Norma2; Chura Yupanqui Ernesto1
1 Facultad de Ciencias Agrarias - Escuela profesional de Ingeniería Agronómica de la Universidad Nacional del Altiplano de Puno Perú
2 Investigador independe egresadas de la Facultad de Ciencias Agrarias de la Universidad Nacional del Altiplano de Puno Perú
1 Autor para correspondencia: betsalet@yahoo.es.
RESUMEN
El mildiu es la enfermedad más importante que afecta a la quinua (Chenopodium quinoa Willd.) en el altiplano peruano, ocasionado por el pseudohongo Peronospora variabilis Gäum., causando una reducción en su rendimiento de hasta 99%. Con la finalidad de evaluar el efecto de cepas de Trichoderma sp con capacidad endofitica en el control del mildiu y mejora del rendimiento de la quinua var. Salcedo INIA, se peletizaron semillas (1x106 ufc. semilla-1) e infestaron el sustrato con esporas de 10 cepas de Trichoderma para determinar el porcentaje de colonización endofitica en plantas de quinua de 30 y 60 días de edad en condiciones controladas; se realizaron cuatro aplicaciones foliares (1x107 ufc.ml-1) y evaluaciones de severidad para determinar el área bajo la curva del progreso de la enfermedad (AUDPC) y rendimiento de grano bajo condiciones de campo. Todas las cepas lograron colonizar diferentes partes de la planta considerándose así endófitos de quinua. El mayor porcentaje de colonización (34.24 %) se dio con la infestación del sustrato, siendo la cepa T10 (60%) quien logro la mayor colonización seguido de T3 (56.67%) y T2 (43.33%) a los 60 días de evaluación. Los tratamientos que recibieron aplicaciones con las cepas T1, T3 y T2 fueron los menos afectados con el mildiu, con valores de AUDPC de 615.7, 706.8 y 759 respectivamente y presentaron los valores más altos en el rendimiento de grano (3127.30, 3029.12 y 2866.57 kg. ha-1 respectivamente) en comparación al Testigo con AUDPC de 1670.5 y rendimiento 1141.27 kg. ha-1.
PALABRAS CLAVES: Biocontrol, endófitos, pseudohongo, Chenopodium quinoa, rendimiento.
ABSTRACT
Downy mildew is the most important disease that affects quinoa (Chenopodium quinoa Willd.) in the Peruvian altiplano, it’s caused by pseudo fungi Peronospora variabilis Gäum. It causes yield reductions up to 99%. With the purpose of evaluating the effect of Trichoderma sp strains with endophytic capacity in the control of the mildew and improve quinoa yield var. Salcedo INIA, the seeds were fully covered (1x106 ufc. seed-1) and substrate was infested with spores of 10 Trichoderma strains to determine the percentage of endophytic colonization in quinoa plants at 30 and 60 days age under controlled conditions;four leaf applications (1x107 ufc.ml-1) and severity evaluations were also performed to determine the area under the disease progress curve (AUDPC) and grain yield under field conditions. All the strains managed to colonize different parts of the plant confirming to be endophytes of quinoa. The highest percentage of infestation (34.24 %) was achieved inoculating the substrate with the strain T10 which level of colonization reached 60%, followed by T3 with 56.67% and T2 with 43.33%. The scoring after 60 days showed that plants treated with strains T1, T3 and T2 were the least affected by downy mildew with values of 615.7, 706.8 and 759 for AUDPC, respectively. They also displayed the highest values for grain yield 3127.30, 3029.12 and 2866.57 kg. ha-1, respectively, in comparison with the control which AUDPC and yield were 1670.5 and 1141.27 kg. ha-1, respectively.
KEYWORDS: Biocontrol, endophytes, pseudo-fungi, Chenopodium quinoa, yield.
INTRODUCCIÓN
En el Perú, la región Puno registra el volumen de producción más elevado de los últimos tiempos (38,2 mil toneladas) y es considerada como la primera región con mayor producción nacional de grano de quinua (Chenopodium quinoa Willd.) mayormente orgánica, sin el uso de insumos químicos en su cultivo, es reconocido en los mercados, los precios pagados son siempre mayores que la quinua convencional, aunque los rendimientos aún son considerados bajos (Dirección General De Políticas Agrarias, 2017), debido a los riesgos climáticos y biológicos.
La quinua es atacada por una variedad de patógenos, que causan varias enfermedades como mohos, chupaderas, tizón, mosaico, etc.; siendo, el mildiu la enfermedad más severa de la quinua causado por Peronospora variabilis, ocasionando la reducción del rendimiento de 33 a 58%, (Danielsen & Ames, 2000; Danielsen, Bonifacio, & Ames, 2003; Zurita-Silva, Fuentes, Zamora, Jacobsen, & Schwember, 2014), incluso en los cultivares más resistentes y hasta un 99% en los cultivares susceptibles (Danielsen & Munk, 2004; Kumar, Bhargava, Shukla, Singh, & Ohri, 2006), debido a las limitadas estrategias de control de enfermedades dentro de una producción orgánica en la Región Puno. Siendo una alternativa el control biológico, con el uso de cepas de Trichoderma sp con capacidad endofitica, estos endófitos son capaces de colonizar los tejidos de las plantas sin causar síntomas visibles e inducir la producción de compuestos relacionados con la defensa y algunos genes implicados en respuestas de defensa de las plantas a factores bióticos y abióticos (Bae et al., 2009; Bailey et al., 2008; De Souza et al., 2008; Hanson & Howell, 2004).
Entre los principales endófitos como agentes de control biológico, existe un grupo de hongos del género Trichoderma sp, considerados antagonistas naturales de fitopatógenos y son ampliamente utilizados en la agricultura, poseen un gran potencial de biocontrol a plagas y enfermedades, y pueden contribuir al mejoramiento general de las plantas (Guédez, Cañizález, Castillo, & Olivar, 2009; Harman, 2006; López-Ferrer, Brito-Vega, López-Morales, Salaya-Domínguez, & Gómez-Méndez, 2017; Toghueo et al., 2016; Tuesta-Pinedo et al., 2017). Asimismo, este antagonista induce resistencia sistémica o localizada, el aumento de crecimiento y la absorción de nutrientes de la planta, desactivación de enzimas del patógeno, compatibilidad con agroquímicos, entre otros; siendo el micoparasitismo, antibiosis y competencia por espacio y nutrientes los principales mecanismos de acción de este hongo (Martínez, Infante, & Reyes, 2013). Inducción de defensa de plantas y Micoparasitismo son considerados como los mecanismos más importantes de control biológico (Mukherjee et al., 2012). Esta situación condujo la realización del presente trabajo de investigación con los siguientes objetivos: Determinar la capacidad endófita de cepas de Trichoderma sp. en plantas de quinua (Chenopodium quinoa Willd.) y evaluar el efecto de cepas de Trichoderma sp en el control del mildiu (Peronospora variabilis) y mejora del rendimiento de la quinua var. Salcedo INIA,
MATERIALES Y MÉTODOS
Producción de cepas de Trichoderma sp
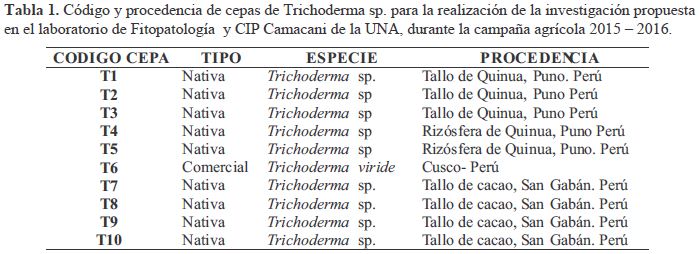
Las cepas de Trichoderma sp que se utilizaron para este primer ensayo fueron proporcionadas por la Escuela profesional de Ingeniería Agronómica de la Universidad Nacional del Altiplano (UNA) Puno - Perú (Tabla1), nueve de las cepas fueron nativas, aisladas de tallos de plantas de quinua y cacao, y del suelo rizosferico de quinua. A partir de cultivos jóvenes se procedió a realizar repiques de cada cepa en medio PSA (Papa Sacarosa Agar) y fueron incubados a 25°C bajo luz artificial durante una semana, con la finalidad de inducir la producción de estructuras de reproducción.
Colonización endofitica de Trichoderma sp. en quinua (Chenopodium quinoa Willd.)
Para la colonización de plantas de quinua se emplearon 10 cepas de Trichoderma sp, se realizaron aplicaciones de las cepas mediante dos métodos de inoculación: Método 1 (Peletización de semillas con conidias de Trichoderma sp), consistió en cubrir las semillas desinfestadas con conidias de Trichoderma sp (1x 10 6 ufc. semilla-1), para 1 g de semillas se aplicó 1.5 ml de suspensión de conidias (2x108 ufc.cc-1) y 0.5 ml de melaza esterilizada, la mezcla se realizó en viales de 2 ml, para el caso del testigo se realizó la mezcla de ADE y melaza, luego fueron transferidas a placas petri para su secado por 24 horas, se realizó la siembra de tres semillas peletizadas por cada maceta conteniendo 200 g de sustrato estéril a capacidad de campo a una concentración de 2:1:1 (Suelo agrícola, compost y arena). Para el Método 2 (Infestación del sustrato suelo con conidias de Trichoderma sp vía drench), se realizó la aplicación de Trichoderma sp (1x107ufc.g suelo-1) al suelo mediante el método via drench con 30 ml de suspensión de conidias en cada maceta con 200g de sustrato estéril, posteriormente, se sembraron tres semillas desinfestadas por cada maceta. Se dejó en incubación en el laboratorio de Fitopatología bajo luz artificial a una temperatura de 12 °C, Humedad Relativa de 40% por un periodo de 60 días para ambos métodos. Para determinación de la colonización de Trichoderma sp en plántulas de quinua, se realizó el re-aislamiento de Trichoderma sp en medio Corn meal dextrosa agar (CMDA) de secciones (raíz principal media, punta de raíz, Hipocotilo, Epicotilo y hojas) de plántulas de quinua colonizadas con las cepas de Trichoderma sp a los 30 y 60 días de edad según la metodología descrita por Bailey et al. (2008). Estas placas fueron incubadas a 25 °C por cinco días, y se registró como positivo (1) o negativo (0) para la colonización de Trichoderma sp.
Capacidad de biocontrol decepas de Trichoderma sp. endofitos hacia Peronospora variabilis Gaüm patogeno de Chenopodium quinoa Willd.
El experimento fue conducido en una parcela experimental del CIP Camacani, durante la campaña agrícola 2015 (octubre) – 2016 (mayo) en 11 parcelas por bloque, 3 bloques, 3 repeticiones (parcelas) por tratamiento, 2.4 m el ancho de parcela, 1.2 m de distancia entre parcelas, 5 surcos por parcela con un distanciamiento de 0,60 m entre surcos, 5 m de longitud de surcos y el área efectiva del experimento de 889.2 m2. El total de tratamientos empleados fueron 11, los 10 primeros corresponden a la aplicación de cepas de Trichoderma sp y el último tratamiento testigo sin aplicación (T11)
Para las aplicaciones, previamente en el laboratorio de fitopatología de la EPIA –UNA, se propagaron las cepas de Trichoderma sp endófito en sustrato arroz, siendo la primera aplicación el día de la siembra en semillas (peletizadas a una concentración de 1x106 ufc. semilla-1) y abono (1x107 ufc. g de estiércol-1), y cuatro aplicaciones a nivel foliar (1 x 107 ufc/cc) en cuatro momentos críticos del desarrollo fenológico del cultivo: durante la ramificación, panojamiento, floración y grano lechoso.
Se realizaron cuatro evaluaciones de severidad de la enfermedad durante la campaña agrícola, la primera evaluación se realizó a los 30 días después de la segunda aplicación de Trichoderma sp (100 días después de la siembra), la segunda evaluación a los 15 días después de la tercera aplicación, la tercera evaluación a los 15 días después de la cuarta aplicación y la cuarta evaluación a los 10 días después de la última aplicación de Trichoderma sp. Para cada evaluación, se escogió al azar 10 plantas de los tres surcos céntricos por parcela y de cada planta se escogió 3 hojas al azar, una de cada tercio (superior, medio e inferior) en donde se evaluaron el porcentaje de área afectada de cada hoja usando una escala en base al porcentaje de área afectada por la enfermedad según la escala de evaluación propuesta por Danielsen and Ames (2000), se calculó el valor del área bajo la curva de progreso de la enfermedad, (AUDPC), en base a mediciones de severidad.
DISEÑO Y ANÁLISIS ESTADÍSTICO
Para determinar la colonización de Trichoderma sp en plántulas de quinua se empleó el diseño completamente al azar (DCA) con arreglo factorial (2x2x10) con tres repeticiones, dos métodos de inoculación (peletizacion de semilla e infestación del suelo), dos fechas de evaluación (30 y 60 días) y 10 cepas de Trichoderma sp. Para evaluar la capacidad de biocontrol de cepas de Trichoderma sp se empleó un diseño de Bloque completamente al azar con tres repeticiones. Los datos expresados en porcentaje fueron transformados angularmente (arco seno √X) y los datos de AUDPC a raíz cuadrada, con dicha transformación se confirió la normalidad y homogeneidad de varianzas como lo recomendado por Montgomery (2008) y en consecuencia estos fueron procesados en un software estadístico InfoStat, versión 2008 (Di Rienzo et al ., 2008) para realizar el análisis de varianza (ANDEVA) y para las diferencias de medias se aplicó la prueba de contraste de Tukey, con un nivel de significancia de 0.05%.
RESULTADOS Y DISCUSIÓN
Capacidad endófita decepas de Trichoderma sp en plantas de Chenopodium quinoa Willd.
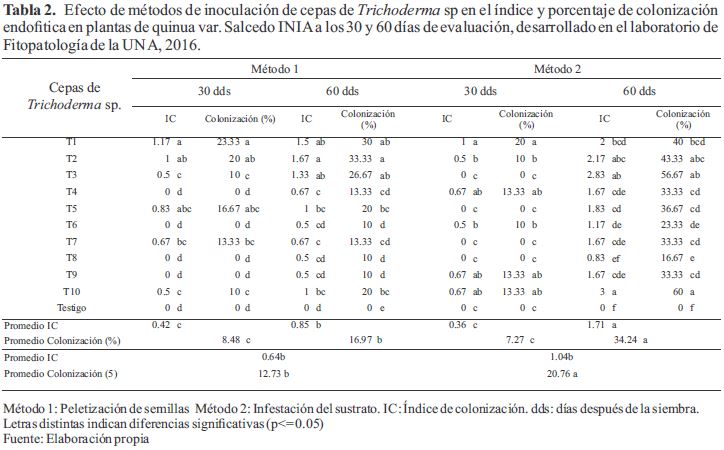
Los análisis de varianza (ANDEVA) del índice y colonización endofítica de cepas de Trichoderma sp en plantas de quinua variedad salcedo INIA, indican que los efectos de los factores Métodos de inoculación, Fecha de evaluación y Cepas de Trichoderma sp son significativos (p≤0,05). La Tabla 2 muestra que el método 2 (infestación del sustrato con cepas de Trichoderma sp) presento el mayor índice (1.04) y porcentaje de colonización endofitica (20.76 %) a diferencia del método 1 (semillas peletizadas con cepas de Trichoderma sp) que presento el menor índice (0.64) y porcentaje de colonización (12.73 %). Por otro lado, se observa que a los 30 días de evaluación la colonización fue menor en ambos métodos de inoculación, siendo el método 1 con mayor colonización (8.48 %) a diferencia del método 2 (7.27%); sin embargo, a los 60 días la colonización fue mayor, siendo el método 2 con mayor colonización (34.24 %) a diferencia del método 1 (16.97%). Siendo la cepa T10 quien logro la mayor colonización seguido de T3 y T2, mientras que la cepa T8 presento la menor colonización en plantas de quinua de 60 días de edad.
De acuerdo a los resultados en este estudio, todas las cepas de Trichoderma fueron reaisladas de segmentos de tejidos pantas de quinua, lo cual indica que son hongos endófitos de quinua, debido a lo mencionado por Carroll (1988) que estos microorganismos viven en asociación con las plantas dentro de sus tejidos en los espacios intercelulares e intracelulares, absorbiendo nutrientes de ella en forma asintomática. De manera semejante, Stone, Bacon, and White (2000) mencionan que los hongos endófitos viven en los espacios intercelulares y dentro de la célula del huésped planta sin causar daño aparente. Igualmente, concuerda con lo reportado por Arnold et al. (2003), mencionan que las plantas colonizadas por Trichoderma sp crecieron asintomáticamente. Como tal, las cepas de Trichoderma sp han mostrado interés
en el campo de la fitopatología y se consideran como agentes de control biológico que tienen ventajas específicas sobre los fungicidas sintéticos, incluyendo menos efectos ambientales, eficacia contra patógenos resistentes a fungicidas y menor probabilidad de desarrollo de resistencia (Gao, Dai, & Liu, 2010; Toghueo et al., 2016). De igual modo, en otros estudios se aislaron hongos endófitos de plántulas de Theobroma gileri previamente inoculadas, corroborado así la capacidad endofítica (Evans, Holmes, & Thomas, 2003). Lo mismo sucedió en plántulas de cacao que fueron inoculadas con especies de Trichoderma sp endófito y todos las cepas fueron capaces de colonizar partes aéreas de la plántulas (Arévalo, Canto, Leon, Meinhardt, & Cayotopa, 2010; Bailey et al., 2008; Bailey et al., 2006). De la misma forma en estudios realizados por Bailey et al. (2008), encontraron de 10 cepas de hongos endófitos, cuatro cepas DIS 110a (T. harzianum), DIS 219b (T. hamatum), DIS 219f (T. harzianum) y TA (T. asperellum) fueron los que colonizaron mayor de 50 % los tejidos de cacao en todos los métodos de inoculación.
Asimismo, en este estudio, en ambos métodos se observa que el índice y porcentaje de colonización fue menor a los 30 días de evaluación incrementándose a los 60 días de evaluación. Estos resultados estuvieron de acuerdo con los hallazgos de Arnold et al. (2003), donde indican que partes viejas de la planta puede albergar más endófitos que los más jóvenes, la edad de la planta y el tiempo de exposición del incremento del inóculo tienen un efecto sobre la diversidad y número de endófitos en sus tejidos. Igualmente la incidencia de hongos endófitos se incrementa a medida que las hojas o las semillas crecen (Gallery, Dalling, & Arnold, 2007).
Por su parte, Bailey et al. (2008) señalan que un índice de colonización mayor a cero indica que la cepa estuvo viviendo dentro del tejido de la planta y es un endófito, lo cual indicaría que todas cepas estudiadas son endófitos de quinua, estos índices se logró con el método 2. Estas cepas de Trichoderma sp estudiadas lograron colonizar diferentes partes de la planta ya que fueron recuperadas de diferentes fragmentos de la misma planta, lo cual indica que infectaron sistémicamente los espacios intercelulares de las raíces, tallos y hojas de la quinua, considerándose así endófitos sistémicos, como lo mencionan Stone et al. (2000).
En otros estudios, varias especies de endófitos fueron recuperados de diferentes fragmentos de la planta (raíces, hojas o ramas), mientras que otros pueden infectar a varias de estas secciones (Bacon & Hinton, 1996; Bailey et al., 2006; Carroll, 1988; De Souza et al., 2008), lo que sucedió con las cepas estudiadas que colonizaron diferentes tejidos de plantas de quinua a los 30 y 60 días de evaluación.
Capacidad de biocontrol decepas de Trichoderma sp. endofitos hacia Peronospora variabilis patogeno de Chenopodium quinoa Willd.
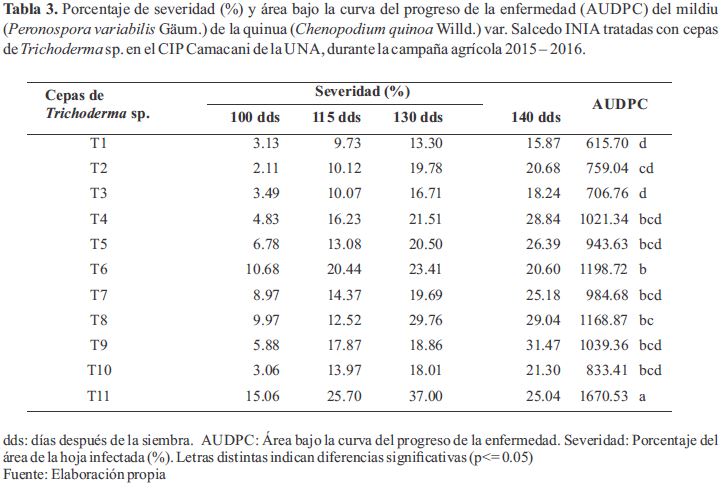
El análisis de varianza (ANDEVA) del Área bajo la curva del progreso de la enfermedad (AUDPC) del mildiu de la quinua (Peronospora variabilis Gäum.) mostró una alta significancia (Pr<0.05) para tratamientos (cepas) con un C.V. de 9.77% y un R2 de 0.73. Los valores de AUDPC fueron significativamente menores en los todos los tratamientos que recibieron aplicaciones de Trichoderma sp que el testigo (T11), siendo el más afectado con el valor más alto de AUDPC (1670.5) (Tabla 3). Asimismo, los tratamientos con aplicaciones de Trichoderma sp T6 y T8 fueron los que presentaron los valores altos de AUDPC con 1198.7 y 1168.9 respectivamente; sin embargo, el tratamiento menos afectado fue el T1 seguido de los tratamientos T3 y T2 con valores menores de AUDPC de 615.7, 706.8 y 759 respectivamente
También, los valores de severidad del mildiu de la quinua de todos los tratamientos que recibieron aplicaciones de Trichoderma fueron inferiores al testigo hasta los 130 días después de la siembra (tercera evaluación), mientras que en la última evaluación, a los 144 dds, en ocho tratamientos siguió incrementando la severidad, por el contrario en los tratamientos T11 (testigo), T6 y T8 redujeron los valores de severidad. Se observó en las plantas más afectadas por la enfermedad (testigo), el patógeno ocasionó defoliación y es posible que estas hojas no fueron seleccionadas para la evaluación que probablemente presentarían 100 % de severidad y de modo que presentaron bajos valores de severidad. Igualmente, en todos los tratamientos hubo un ligero incremento de severidad por que las condiciones medioambientales no eran favorables para el desarrollo de la enfermedad en el mes de marzo, debido a que fue un mes de características secas, es decir con precipitaciones de 26.80 mm por debajo de su promedio normal de diez años (131.01mm).
Estas características deficitarias de precipitación en el mes de marzo no fueron favorables para el desarrollo de la enfermedad debido a que las esporas se deshidratan y la esporulación desaparece (Saravia, Plata, & Gandarillas, 2014); puesto que, Kumar et al. (2006) mencionan que los factores determinantes para que el crecimiento del patógeno y desarrollo de la enfermedad son temperaturas frescas (23 °C) y humedad relativa (mayor 90 %) lo cual no se presentó en el mes de marzo e hizo que la severidad sea menor y en algunos tratamientos que recibieron el control se detuvo la enfermedad con ligeros incrementos. Por el contrario, los incrementos de severidad desde la primera evaluación hasta la tercera evaluación, se registró en el mes de febrero e inicios del mes de marzo, se debió a que las condiciones ambientales fueron favorables para el desarrollo de la enfermedad, en donde se registró precipitaciones durante todo el mes e hizo que la enfermedad se disemine y se desarrolle el patógeno.
Los tratamientos que fueron aplicados con las cepas T1, T2 y T3, resultaron ser los menos afectados con la enfermedad, presentaron un lento aumento y posterior disminución de la severidad en el tiempo, puede deberse a la expansión más rápida de las hojas que al desarrollo de síntomas (Danielsen, Mercado, Ames, & Munk, 2004). Además, se observó en estos tratamientos plantas bien desarrolladas con buen follaje, probablemente las cepas de Trichoderma actuaron como promotores de crecimiento (Martínez et al., 2013). Igualmente estos resultados concuerdan con Plata and Callizaya (2013), quienes reportaron dos grupos de Trichoderma, un grupo de cuatro cepas de Trichoderma inhibieron el desarrollo del mildiu y promovieron el desarrollo de las plantas de quinua, y un segundo grupo solo controlaron la enfermedad en mayor proporción.
Desde el punto de vista del control biológico, se demostró que todas las cepas de Trichoderma spaisladas de quinua resultaron ser endófitos, capaces de reducir la severidad del mildiu (Peronospora variabilis Gäum.). No existen reportes sobre el control del mildiu en quinua con el uso de hongos endófitos; sin embargo existen estudios para el control de otros patógenos de importancia en la agricultura, siendo el estudio más impactante en especies tropicales, en Theobroma cacao L., la inoculación con endofitos redujo significativamente la necrosis foliar y la mortalidad causada por Phytophthora palmivora (Arnold et al., 2003). Igualmente, se encontraron hongos endófitos mostrando antagonismo In vitro mediante pruebas de antibiosis y micoparasitismo contra Moniliophthora roreri (moniliasis), Phytophthora palmivora (pudrición parda) y Moniliophthora perniciosa (escoba de bruja), inhibieron significativamente el crecimiento micelial de los patógenos (Leon, Rojas, Rodriguez, Arévalo, & Márquez, 2010; Mejía et al., 2008).
Por lo tanto, la reducción de la severidad podría atribuirse a un efecto directo del endófito sobre la propagación de Peronospora variabilis Gäum. y varios mecanismos podrían ser responsable de esa reducción. Se ha reportado de que los agentes de control biológico pueden producir sustancias que atacan directamente a los patógenos o que inducen la resistencia sistémica, lo que a su vez reduce la incidencia de patógenos en el huésped de la planta (Gao et al., 2010).
El efecto directo de las cepas de Trichoderma spp sobre el patógeno se debió a las aplicaciones foliares que se realizaron a razón de 1 x 10 7 ufc. ml-1 que fue adecuada sobre el control de la enfermedad reduciendo la severidad. Es posible que estas cepas proliferaron y supervivieron en las plantas durante un período prolongado después de la aplicación, principalmente en tejidos que suelen ser propensos a infección por el patógeno objetivo, lo cual concuerda con los hallazgos de otros investigadores que aplicaron la cepa endófito Trichoderma martiale ALF 247 para el control de Phytophthora palmivora en concentraciones que oscilaban entre 1 x 104 y 5 x 107 conidios por mililitro, la severidad de la enfermedad disminuyó proporcionalmente y han demostrado que la cepa es un endofito que coloniza toda la planta después de la aplicación (Hanada, Pomella, Soberanis, Loguercio, & Pereira, 2009).
Igualmente las aplicaciones que se realizaron en cuatro momentos críticos del desarrollo fenológico del cultivo (durante la ramificación, panojamiento, floración y grano lechoso) fue ideal para mantener las poblaciones de Trichoderma sp sobre la superficie de la planta, colonice y ejerza sus mecanismos de acción sobre el patógeno. Es probable que estos endófitos parasitaron las hifas del patógeno por diversos medios como enrollamiento, penetración a las hifas de los agentes patógenos y secretaron enzimas para descomponer la pared celular del patógeno conforme a lo reportado por Harman (2006) y Martínez et al. (2013). Así por ejemplo, Trichoderma sp son capaces de parasitar las hifas del patógeno de las plantas Rhizoctonia solani y muchas de estas observaciones están relacionadas con control biológico (Grosch, Scherwinski, Lottmann, & Berg, 2006). De manera semejante, Macagnan, Romeiro, and Pomella (2008) señalan que cuando los endófitos colonizan la superficie de la planta, ellos producen enzimas para hidrolizar paredes celulares de la planta. Como resultado, estas enzimas también tienen la función de suprimir directamente las actividades del patógeno de la planta y tienen la capacidad de degradar las paredes de la célula de los hongos y Oomycetes.
A su vez, las aplicaciones que se realizaron a nivel de semilla tuvo un efecto positivo en el control del inóculo primario de Peronospora variabilis Gäum., debido a que en la superficie de las semillas se encuentran las oosporas, estructuras de reproducción sexual, que es fuente de inóculo para dar inicio a la enfermedad (Danielsen & Ames, 2000; Danielsen et al., 2003; Danielsen et al., 2004) y al peletizar las semillas con las cepas de Trichoderma sp es probable que estos endófitos tuvieron efecto directo sobre el patógeno utilizando uno o varios mecanismos de acción para reducir las poblaciones de oosporas y se puedo observar plantas sanas hasta los 90 días después de la siembra a diferencia del control en donde no se aplicó estos hongos en la superficie de las semillas. Ya que, existen reportes en donde indican los efectos beneficiosos que tienen algunas especies de Trichoderma viride, Trichoderma harzianum y Trichoderma pseudokoningii, en la reducción de la incidencia de patógenos fúngicos transmitidos por semillas (Mukhtar, 2008). Además, otros estudios han confirmado la mejora de la germinación de las semillas, así como el aumento de la frecuencia de plantas sanas y el aumento del rendimiento con aplicaciones de T. harzianum y T. viride (Toghueo et al., 2016). Investigaciones demuestran que especies de T. virens y T. harzianum resultaron tener efecto antagónico de M. roreri, Phytophthora spp., yM. perniciosa en sistemas agroforestales-cacaotales (Theobroma cacao L.) (López-Ferrer et al., 2017)
Efecto decepas de Trichoderma sp. endofitos en el rendimiento de Chenopodium quinoa Willd.
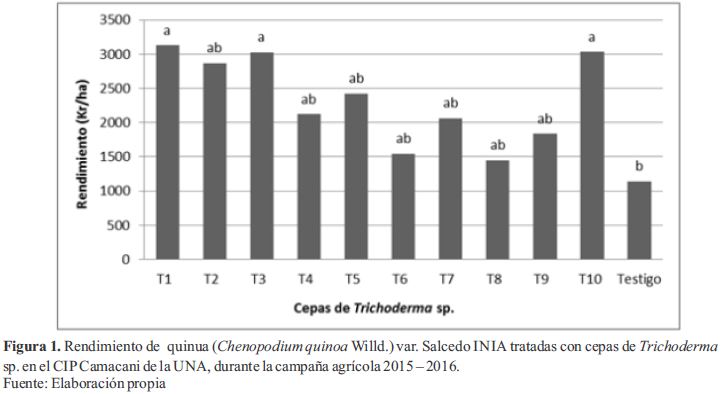
El análisis de varianza (ANDEVA) del rendimiento de grano de Chenopodium quinoa Willd mostró significancia (Pr<0.05) para las cepas de Trichoderma sp con un C.V. de 13.51 % y un R2 de 0.89. Estando el rendimiento de todos los tratamientos que recibieron aplicaciones de Trichoderma sp significativamente mayores al testigo (1141.27 kg.ha-1) con valores comprendidos entre 1445.34 kg.ha-1 a 3127.3 kg.ha-1, siendo los tratamientos con las cepas T1 (3127.3 kg.ha-1), T3 (3029.12 kg.ha-1) y T10 (3032.54 kg.ha-1 ) con mayor rendimiento (Figura 1).
Existen reportes donde indican que de 30 cepas de Trichoderma seis inhibieron la enfermedad y a su vez mejoraron el crecimiento de las plantas (Plata et al., 2013) lo cual concuerda con los resultados de esta investigación. Puesto que los efectos de cepas de Trichoderma sp sobre el crecimiento y desarrollo de las plantas tienen implicaciones económicas importantes, así como mejorar el vigor de las plantas para superar las tensiones bióticas y / o abióticas (Toghueo et al, 2016). Por lo tanto, el uso de estas cepas en la mejora y protección del crecimiento de las plantas es de importancia en el sistema de agricultura sostenible, ya que los fertilizantes químicos y los pesticidas no son económicos a largo plazo debido a su costo y a la contaminación ambiental. La promoción del crecimiento de las plantas se observa a menudo en respuesta a la colonización de Trichoderma sp (Harman, 2006; Rinu et al., 2014). Es probable que las cepas de Trichoderma endofito cree condiciones de crecimiento más favorables que conduzcan a un mejor crecimiento de la planta. (Toghueo et al., 2016) Los resultados estuvieron de acuerdo con los hallazgos de otros investigadores que sugirieron que además de su capacidad de biocontrol, algunas especies de Trichoderma spp son capaces de promover el crecimiento de las plantas (Hoyos-Carvajal et al ., 2009). De igual modo, muchos estudios demostraron que plantas infectadas con endófitos obtienen promoción del crecimiento, la resistencia a la estrés por sequía y la tolerancia a la condiciones inadecuadas del suelo (Malinowski et al., 2004). Así por ejemplo, semillas tratadas con la cepa T22 de T. harzianum, respondieron positivamente y hubo un aumento de rendimiento (Harman, 2006); aplicaciones de Trichoderma endófito con fertilizantes orgánicos e inorgánicos en plantaciones de cacao obtuvieron incrementos porcentuales positivos en el rendimiento con respecto al control absoluto (Tuesta-Pinedo et al., 2017). Lu et al., (2000) señalan que la mejora del crecimiento de la planta puede estar influenciada por compuestos como fitohormonas producidas por hongos endófitos como el ácido indolacético (IAA) y sus análogos. Además, la producción de algunos ácidos orgánicos tales como los ácidos glucónico cítrico y / o fumárico (Vinale et al., 2008) reduce el pH del suelo, dando como resultado la solubilización de fosfatos. (Toghueo et al., 2016).
CONCLUSIONES
-
Se logró la mayor colonización endofitica de cepas de Trichoderma en quinua con el método de infestación del sustrato; siendo las cepas T10, T3 y T2 con mayor colonización en plantas de quinua a los 60 días de evaluación.
-
Los valores de AUDPC fueron significativamente menores en los todos los tratamientos que recibieron aplicaciones de Trichoderma sp que el testigo (AUDPC = 1670.5), siendo los tratamientos con las cepas T1, T3 y T2 menos afectados con valores de AUDPC de 615.7, 706.8 y 759 respectivamente en comparación a los tratamientos con las cepas T6 (AUDPC = 1198.7) y T8 (AUDPC = 1168.9) que fueron los que presentaron los valores altos de AUDPC. Similar tendencia ocurrió en el rendimiento (3127.30, 3029.12 y 2866.57 kg. ha-1 respectivamente) en comparación al Testigo con 1141.27 kg. ha-1respectivamente.
REFERENCIAS BIBLIOGRÁFICAS
Arévalo, E., Canto, M., Leon, B., Meinhardt, L., & Cayotopa, J. (2010). Colonización de plántulas de Theobroma cacao por aislamientos de Trichoderma endófitos con potencial de control biológico. Paper presented at the XXI Congreso Peruano de Fitopatología., Tarapoto, Perú [ Links ].
Arnold, A. E., Mejía, L. C., Kyllo, D., Rojas, E. I., Maynard, Z., Robbins, N., & Herre, E. A. (2003). Fungal endophytes limit pathogen damage in a tropical tree. Proc Natl Acad Sci U S A, 100(26), 15649-15654. [ Links ]
Bacon, C. W., & Hinton, D. M. (1996). Symptomless endophytic colonization of maize by Fusarium moniliforme. Canadian Journal of Botany, 74(8), 1195-1202. doi: 10.1139/b96-144 [ Links ]
Bae, H., Sicher, R. C., Kim, M. S., Kim, S.-H., Strem, M. D., Melnick, R. L., & Bailey, B. A. (2009). The beneficial endophyte Trichoderma hamatum isolate DIS 219b promotes growth and delays the onset of the drought response in Theobroma cacao. Journal of Experimental Botany, 60(11), 3279-3295. doi: 10.1093/jxb/erp165 [ Links ]
Bailey, B. A., Bae, H., Strem, M. D., Crozier, J., Thomas, S. E., Samuels, G. J., Holmes, K. A. (2008). Antibiosis, mycoparasitism, and colonization success for endophytic Trichoderma isolates with biological control potential in Theobroma cacao. Biological Control, 46(1), 24-35. doi:http://dx.doi.org/10.1016/j.biocontrol.2008.01.003 [ Links ]
Bailey, B. A., Bae, H., Strem, M. D., Roberts, D. P., Thomas, S. E., Crozier, J., . . . Holmes, K. A. (2006). Fungal and plant gene expression during the colonization of cacao seedlings by endophytic isolates of four Trichoderma species. Planta, 224(6), 1449-1464. doi: 10.1007/s00425-006-0314-0 [ Links ]
Carroll, G. (1988). Fungal Endophytes In Stems And Leaves - From Latent Pathogen To Mutualistic Symbiont. Ecology, 69(1), 2-9. doi: 10.2307/1943154 [ Links ]
Danielsen, S., & Ames, T. (2000). El mildiu (Peronospora farinosa) de la quinua (Chenopodium quinoa) en la zona andina. (Vol. I). LIMA-PERU: Centro Internacional de la Papa (CIP). [ Links ]
Danielsen, S., Bonifacio, A., & Ames, T. (2003). Diseases of quinoa (Chenopodhim quinoa). Food Reviews International, 19(1-2), 43-59. doi: 10.1081/FRI-120018867 [ Links ]
Danielsen, S., Mercado, V. H., Ames, T., & Munk, L. (2004). Seed transmission of downy mildew (Peronospora farinosa f.sp. chenopodii) in quinoa and effect of relative humidity on seedling infection. Seed Science and Technology, 32(1), 91-98. [ Links ]
Danielsen, S., & Munk, L. (2004). Evaluation of disease assessment methods in quinoa for their ability to predict yield loss caused by downy mildew. Crop Protection, 23(3), 219-228. doi: 10.1016/j.cropro.2003.08.010 [ Links ]
De Souza, J. T., Bailey, B. A., Pomella, A. W. V., Erbe, E. F., Murphy, C. A., Bae, H., & Hebbar, P. K. (2008). Colonization of cacao seedlings by Trichoderma stromaticum, a mycoparasite of the witches’ broom pathogen, and its influence on plant growth and resistance. Biological Control, 46(1), 36-45. doi: http://dx.doi.org/10.1016/j.biocontrol.2008.01.010
Dirección General De Políticas Agrarias. (2017). La Quinua: Producción y Comercio del Perú (D.-. MINAGRI, Trans.). In C. A. Romero (Ed.), Boletin: Perfil tecnico (DGPA - MINAGRI ed., Vol. 2, pp. 8). Lima - Perú MINISTERIO DE AGRICULTURA Y RIEGO. [ Links ]
Evans, H. C., Holmes, K. A., & Thomas, S. E. (2003). Endophytes and mycoparasites associated with an indigenous forest tree, Theobroma gileri, in Ecuador and a preliminary assessment of their potential as biocontrol agents of cocoa diseases. Mycological Progress, 2(2), 149-160. [ Links ]
Gallery, R. E., Dalling, J. W., & Arnold, A. E. (2007). Diversity, host affinity, and distribution of seed‐infecting fungi: a case study with cecropia. Ecology, 88(3), 582-588. [ Links ]
Gao, F.-k., Dai, C.-C., & Liu, X.-Z. (2010). Mechanisms of fungal endophytes in plant protection against pathogens. African Journal of Microbiology Research, 4(13), 1346-1351. [ Links ]
Grosch, R., Scherwinski, K., Lottmann, J., & Berg, G. (2006). Fungal antagonists of the plant pathogen Rhizoctonia solani: selection, control efficacy and influence on the indigenous microbial community. Mycological Research, 110(12), 1464-1474. [ Links ]
Guédez, C., Cañizález, L., Castillo, C., & Olivar, R. (2009). Efecto antagónico de Trichoderma harzianum sobre algunos hongos patógenos postcosecha de la fresa (Fragaria spp). Revista de la Sociedad Venezolana de Microbiología, 29, 34-38. [ Links ]
Hanada, R. E., Pomella, A. W. V., Soberanis, W., Loguercio, L. L., & Pereira, J. O. (2009). Biocontrol potential of Trichoderma martiale against the black-pod disease (Phytophthora palmivora) of cacao. Biological Control, 50(2), 143-149. doi: http://dx.doi.org/10.1016/j.biocontrol.2009.04.005 [ Links ]
Hanson, L. E., & Howell, C. R. (2004). Elicitors of Plant Defense Responses from Biocontrol Strains of Trichoderma viren. Phytopathology, 94(2), 171-176. doi: 10.1094/PHYTO.2004.94.2.171 [ Links ]
Harman, G. E. (2006). Overview of Mechanisms and Uses of Trichoderma spp. Phytopathology, 96(2), 190-194. doi: 10.1094/PHYTO-96-0190 [ Links ]
Kumar, A., Bhargava, A., Shukla, S., Singh, H. B., & Ohri, D. (2006). Screening of exotic Chenopodium quinoa accessions for downy mildew resistance under mid-eastern conditions of India. Crop Protection, 25(8), 879-889. doi: 10.1016/j.cropro.2005.11.012 [ Links ]
Leon, B., Rojas, M., Rodriguez, G., Arévalo, E., & Márquez, K. (2010). Antibiosis y micoparasitismo a los principales patógenos de cacao (Theobroma cacao) por hongos endófitos. Paper presented at the XXI Congreso Peruano de Fitopatología., Tarapoto, Perú [ Links ].
López-Ferrer, U. d. C., Brito-Vega, H., López-Morales, D., Salaya-Domínguez, J. M., & Gómez-Méndez, E. (2017). Papel de Trichoderma en los sistemas agroforestales-cacaotal como un agente antagónico. Tropical and Subtropical Agroecosystems, 20(1), 91-100. [ Links ]
Macagnan, D., Romeiro, R. d. S., & Pomella, A. W. (2008). Production of lytic enzymes and siderophores, and inhibition of germination of basidiospores of Moniliophthora (ex Crinipellis) perniciosa by phylloplane actinomycetes. Biological Control, 47(3), 309-314. [ Links ]
Martínez, B., Infante, D., & Reyes, Y. (2013). Trichoderma spp. y su función en el control de plagas en los cultivos. Revista de Protección Vegetal, 28, 1-11. [ Links ]
Mejía, L. C., Rojas, E. I., Maynard, Z., Bael, S. V., Arnold, A. E., Hebbar, P., . . . Herre, E. A. (2008). Endophytic fungi as biocontrol agents of Theobroma cacao pathogens. Biological Control, 46(1), 4-14. doi: http://dx.doi.org/10.1016/j.biocontrol.2008.01.012 [ Links ]
Montgomery, D. C. (2008). Design and analysis of experiments (7th ed.): John Wiley & Sons. [ Links ]
Mukherjee, M., Mukherjee, P., Horwitz, B., Zachow, C., Berg, G., & Zeilinger, S. (2012). Trichoderma–Plant–Pathogen Interactions: Advances in Genetics of Biological Control. Indian Journal of Microbiology, 52(4), 522-529. doi: 10.1007/s12088-012-0308-5 [ Links ]
Mukhtar, I. (2008). Influence of Trichoderma species on seed germination in okra. Mycopath, 6(1&2), 47-50. [ Links ]
Plata, G., & Callizaya, J. J. (2013). Control biológico del mildiu de la quinua utilizando diferentes aislamientos de Trichoderma sp. Paper presented at the Congreso Científico de la Quinua. La Paz (Bolivia). 14-15 Jun. 2013., Bolivia. [ Links ]
Saravia, R., Plata, G., & Gandarillas, A. (2014). Plagas y enefermedades del cultivo de quinua. Cochabamba, BO.: Fundacion PROINPA. [ Links ]
Stone, J. K., Bacon, C. W., & White, J. (2000). An overview of endophytic microbes: endophytism defined. Microbial endophytes, 3, 29-33. [ Links ]
Toghueo, R. M. K., Eke, P., Zabalgogeazcoa, Í., de Aldana, B. R. V., Nana, L. W., & Boyom, F. F. (2016). Biocontrol and growth enhancement potential of two endophytic Trichoderma spp. from Terminalia catappa against the causative agent of Common Bean Root Rot (Fusarium solani). Biological Control, 96, 8-20. doi: http://dx.doi.org/10.1016/j.biocontrol.2016.01.008 [ Links ]
Tuesta-Pinedo, Á. L., Trigozo-Bartra, E., Cayotopa-Torres, J. J., Arévalo-Gardini, E., Arévalo-Hernández, C. O., Zúñiga-Cernadez, L. B., & Leon-Ttacca, B. (2017). Optimización de la fertilización orgánica e inorgánica del cacao (Theobroma cacao L.) con la inclusión de Trichoderma endófito y Micorrizas arbusculares. Revista Tecnología en Marcha, 30, 67-78. [ Links ]
Zurita-Silva, A., Fuentes, F., Zamora, P., Jacobsen, S., & Schwember, A. (2014). Breeding quinoa (Chenopodium quinoa Willd.): potential and perspectives. Molecular Breeding, 34(1), 13-30. [ Links ]
Recibido: 15/09/2017
Aceptado: 28/12/2017
On line: 08/01/2018