Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Investigaciones Altoandinas
On-line version ISSN 2313-2957
Rev. investig. Altoandin. vol.20 no.1 Puno Jan./Mar 2018
http://dx.doi.org/10.18271/ria.2018.330
ARTÍCULO ORIGINAL
Optimización de la temperatura de secado y presión de vacío en la decoloración y composición del aceite crudo de pescado
Optimization of drying temperature and vacuum pressure on the decoloration and composition crude fish oil
Lourdes Esquivel-Paredes1, Ashley Campos-Grijalva2, Williams Esteward Castillo-Martínez3
1 Dirección de Investigación de la Universidad César Vallejo - Chimbote Ancash Perú
2 Facultad de Ingeniería - Escuela de Ingeniería Agroindustrial de la Universidad Nacional del Santa - Chimbote Ancash Perú
3 Facultad de Ingeniería - Escuela de Ingeniería Agroindustrial de la Universidad Nacional del Santa - Chimbote Ancash Perú.
1 Autor para correspondencia: lesquivel@ucv.edu.pe
RESUMEN
El presente estudio tuvo como objetivo determinar los parámetros óptimos de decoloración de aceite crudo para obtener un aceite semirrefinado de pescado de calidad aceptable; se utilizó la metodología de superficie de respuesta, considerando un diseño central compuesto con 2 factores presión de vacío (0.13-0.7 bar) y temperatura de secado (96-124°C); teniendo como variables dependientes el porcentaje de ácidos grasos libres (%AGL) y color del aceite, parámetros decisivos en la aceptación de lotes del producto en la industria. Así mismo se caracterizó fisicoquímicamente la materia prima y producto terminado óptimo, el cual fue obtenido bajo las condiciones de operación: temperatura de secado de 110°C y 0.13 bar de vacío. El producto terminado indicó un porcentaje de ácidos grasos libres de 0.27 ± 0.01% y color CieLab con coordenadas L: 48,69 ± 0.88, a: -4,28 ± 0,26 y b: 35,03 ± 0,85, el cual es equivalente a color 6 -7 en escala Gardner, cumpliendo así con las especificaciones industriales.
PALABRAS CLAVE:decoloración, aceite crudo, ácidos grasos libres, color.
ABSTRACT
The objective of this study was to determine the optimal parameters of decolorization of crude oil to obtain a semi-refined fish oil of acceptable quality; response surface methodology was used, considering a central composite design with two factors: Vacuum pressure (0.13-0.7 bar) and drying temperature (96-124°C); having as dependent variables the percentage of free fatty acids (% AGL) and color of the oil. The raw material and the optimum finished product were characterized physico-chemically, which was obtained under the operating conditions: drying temperature of 110 ° C and 0.13 bar vacuum. The finished product indicated a percentage of free fatty acids of 0.27 ± 0.01% and CieLab colour with coordinates L: 48.69 ± 0.88, a: -4.28 ± 0.26 and b: 35.03 ± 0.85, which Is equivalent to color 6 -7 in Gardner scale, compliance with the industrial specifications.
KEYWORDS: decoloration, crude oil, free fatty acids, colour.
INTRODUCCIÓN
El aceite de pescado representa aproximadamente el 2% del consumo mundial de grasas y aceites, es subproducto del procesamiento de la harina de pescado, de composición variada ya que depende de otras características como variedad y tamaño, especies más pequeñas como anchoas, sardinas, arenque y anguilas presentan un contenido de grasa relativamente alto y representando la materia prima para la industria del aceite de pescado. El aceite de pescado ha desempeñado un papel importante en la dieta humana, y actualmente, la demanda de aceite de pescado sigue creciendo debido a sus propiedades medicinales (Rizliya y Mendis 2014).
Los aceites de pescado son fuentes de ácidos grasos poliinsaturados, que pertenecen a la familia omega 3, como el ácido docosahexaenoico (DHA) y ácido eicosapentaenoico (EPA); aceites esenciales en la dieta humana importantes por sus beneficios en la salud ampliamente demostrados (Harris, Mozaffarian, Kris-Etherton, Rudel y Engler, 2009). Sin embargo, el aceite crudo contiene impurezas y compuestos indeseables (ácidos grasos libres, fosfolípidos y compuestos volátiles) que afectan adversamente la estabilidad del producto; ello requiere un proceso de refinación para garantizar la calidad de los aceites para el consumo humano (Vaisali, Charanyaa, Belur y Regupathi, 2015).
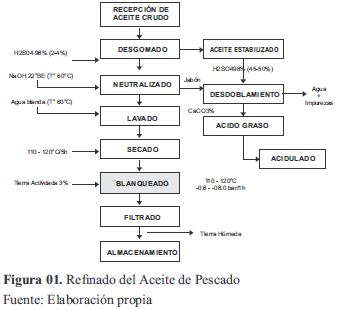
Tradicionalmente, el refinado químico se emplea para mejorar las características de los aceites de pescado, que pueden incluir desgomado, neutralización, lavado, blanqueo (blanqueamiento y filtración) y desodorización (Menegazzo, Petenuci y Fonseca, 2014). El primer paso es el desgomado para eliminar fosfolípidos; seguido se neutralizan los Acido Grasos libre (AGL) con hidróxido de sodio (NaOH) para producir un jabón eliminado luego con el resto de fosfolípidos por centrifugación, los pigmentos adsorbidos son eliminados por las arcillas de blanqueo activadas con ácido. Por último, el aceite se destila a vapor de alta vacío para retirar de él trazas de ácidos grasos libres, aldehídos, cetonas y otros compuestos volátiles. (Tokuṣoḡlu, 2008).
La desodorización es un paso crítico durante la refinación; emplea altas temperaturas, que posiblemente desencadenen la degradación de los ácidos grasos de cadena larga. Por lo tanto, el control de la temperatura es imprescindible durante la desodorización de los aceites de pescado para prevenir el deterioro (Fournier, Destaillats, Juaneda, Dionisi, Lambelet, Sébédio y Bredeaux, 2007). Dado que el aceite crudo de pescado contiene los mismos tipos de compuestos o impurezas presentes en otros aceites y grasas brutas destinados a usos comestibles, estas sustancias pueden ser removidas por los mismos procesos que se utilizan para los aceites vegetales.
En la purificación de aceites animales y vegetales la etapa de blanqueamiento, generalmente, emplea agentes adsorbentes. Este proceso puede ser físico o químico y consiste en la adhesión de las moléculas que dan coloración intensa al aceite en una superficie sólida denominada adsorbente (Souza, 2011). El blanqueo o decoloración por adsorción, con alta actividad superficial a través de la aplicación de tierras blanqueantes o carbón activado retienen las sustancias colorantes; otro tipo de blanqueo, es mediante calor y es efectivo en carotenoides aplicado a gran escala en combinación con el blanqueo por adsorción y el proceso de desodorización (Gonzalez-Tovar, Noriega-Rodríguez, Ortega-García, Gámez-Meza & Medina-Juárez, (2005). Tiene por objetivo remover del aceite neutralizado: pigmentación, productos de oxidación, fosfátidos residuales, rastros de metales y jabones residuales. El aceite blanqueado es muy susceptible a la oxidación debido a la pérdida de sus componentes iniciales, siendo aplicable desodorización o hidrogenación para reducir los compuestos indeseables a la calidad del aceite (Menegazzo, 2012).
El objetivo del trabajo de investigación fue optimizar la temperatura de secado y presión de vacío en la decoloración y composición del aceite crudo de pescado.
MATERIALES Y MÉTODOS
Se empleó aceite crudo de pescado adquirido de Tambo de Mora (Ancash-Perú). Para la caracterización los equipos empleados fueron: Estufa POL-EKO, Colorímetro Escala Gardner, Termómetro digital (0 – 150ºC), Equipo de baño de agua - Modelo: BW-20G, Centrífuga Sigma 4 – 16 KS/ DIGICEN 21R, Colorímetro Konica Minolta CR – 400, Espectrofotómetro UV-VIS (T-80 doble as), Cromatógrafo de gases (Perkin Elmer - Clarus 400GC), Balanza analítica (MS204S/01). La fase experimental siguió el proceso detallado en la Figura 01, a cada tratamiento se realizó 03 repeticiones.
Para determinar las propiedades fisicoquímicas del aceite se realizó los siguientes análisis: a) Porcentaje de ácidos grasos libres (%AGL): Se aplicó el método indicado en la NTP 209.005:1968 (revisada el 2011). Pesar la muestra correspondiente. Agregar alcohol neutralizado con solución de NaOH 0.25N, 0.1 N. Calentar, homogenizar y titular agitando vigorosamente con solución de NaOH 0.25N, 0.1 N. % AGL= Gasto (mL) * Factor/Peso muestra (g). b) Color escala Gardner bajo el método indicado en la NTP 312.011:1985 (revisada el 2015). c) Color por el método CIElab, según la norma UNE 72031/1983. d) Impurezas y humedad, según el método declarado por la ISO 662:2016 y ISO 663:2017. e) Índice de anisidina (IA), siguiendo el método ISO 6885:2012. Se pesó aproximadamente 0.5 g de muestra previamente calentada y filtrada, en una fiola de 25 ml; enrasar hasta 25 ml con N-Hexano y homogenizar. Adicionar en dos tubos de ensayo 5 ml de la solución, a uno de ellos adicionar 1 ml de ácido cético glacial y al otro la solución de p-anisidina (0.25gp-anisidina/ 100ml solución), agitar por 1 minuto exacto y dejar en reposo en oscuridad por 8 minutos, leer las absorbancias a 350 nm, posteriormente reemplazarlos en la siguiente fórmula: I.A. = 100*25*1.2*0.01*(Abs2-Abs1-Abs0)/peso muestra (g). Donde: Abs0= absorbancia 5 ml de N-hexano y 1 ml de solución de p-anisidina (blanco), Abs1= absorbancia de la solución con la muestra con solución de p-anisidina. Abs2= absorbancia de la solución con la muestra con ácido acético. f) Índice de saponificación (IS), AOCS Cd 3-25., 2003. g) Índice de yodo (IY), bajo la NTP 209.008:1968. h) Índice de peróxidos (IP): NTP 209.006:1968. Se pesó aproximadamente 1 g de muestra sin impurezas y adicionó 10 mL de cloroformo, 15 mL de ácido acético glacial y 1 mL de solución de KI saturada, agitó por un minuto exacto y dejó reposar por 5 minutos en la oscuridad, posteriormente agregar 75 mL de agua destilada y tituló con solución de tiosulfato de sodio a 0.01 N, adicionó solución de almidón al 1% y finalmente tituló hasta viraje de color. I.P. = 1000*0.01*(gasto - blanco) / peso muestra (g). i) Perfil de ácidos grasos (PAG): AOCS Ce 1b-89:2009. Fatty Acid Composition of Marine Oils by GLC. j) Densidad: CODEX STAN 210.1999. Densidad relativa = (W3 - W1) / (W2 – W1). Donde: W1= peso del picnómetro vacío, W2= peso del picnómetro con agua, W3= peso del picnómetro con la muestra.
Diseño experimental
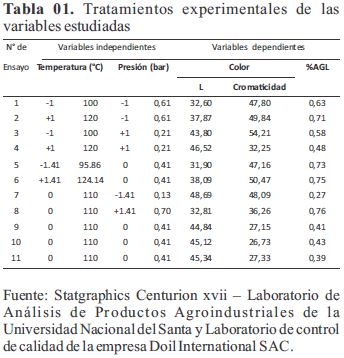
La metodología de superficie de respuesta (RSM) involucra la aplicación de técnicas matemáticas y estadísticas con el objetivo de ajustar a una ecuación polinomial los datos experimentales, con el objetivo de hacer predicciones estadísticas (Rodríguez, 2014). En esta investigación se aplicó el diseño compuesto central rotacional (DCCR) con 4(2k) puntos exponenciales + 4(2k) puntos axiales y 3(t) repeticiones en el punto central, para un total de 11 ensayos experimentales, donde k=2 es el número de variables independientes (temperatura de secado y presión de vacío). En la se muestran los valores máximos, mínimos y medios de las variables estudiadas.
RESULTADOS Y DISCUSIÓN
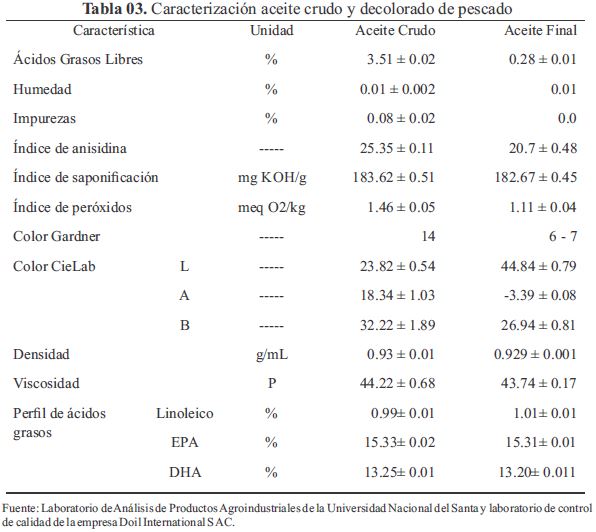
La caracterización fisicoquímica del aceite crudo de pescado mostró un IS de 183.62 ± 0.51 mg de KOH/g (Tabla 03) muy similar al obtenido en los aceites crudos de cabezas de atún 164.21mg de KOH/g, Tilapia de 194.96 mg de KOH/g y Bagre de 212.30 mg de KOH/g (Oliveira, Minozzo, Licodiedoff y Waszczynskyj, 2016).
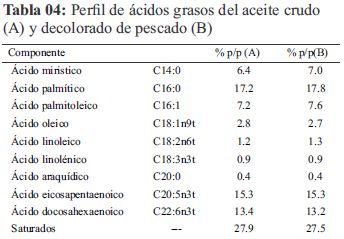
Zuidam y Nedovic' (2010) afirman que el EPA Y DHA son ácidos grasos poliinsaturados presentes en fuentes marinas dentro del rango de 20-40% del contenido de la grasa y en algas cerca del 40% del contenido de la grasa. Del mismo modo Salas-Maldonado, Ayala-Galdós, y Albrecht-Ruiz, (2002). encontró que la sumatoria de los ácidos grasos EPA + DHA en aceite de pescado fluctúan alrededor del 25.5 y 37.4% a lo largo del año, la suma de los valores obtenidos de EPA y DHA es 29.3 % (Tabla 04), están dentro del rango reportado.
Modelación y optimización: La Tabla 01 presenta los tratamientos experimentales para cada variable respuesta.
Brooks, Berbesi, y Hodgson (sf) indica que la temperatura de secado debe ser la adecuada para eliminar el exceso de humedad, la arcilla de blanqueo tiene una atracción / afinidad por compuestos polares como el agua; en presencia de un exceso de humedad, por encima del punto de saturación del agua con el agua libre presente en el aceite (<0,15% en peso), las temperaturas bajas (<20 ° C por encima del punto de fusión) y la falta de un buen vacío, la eficiencia del blanqueo puede y lo más probable disminuirá debido al efecto de apagado de agua en la estructura de agregados de las partículas de arcilla cuando el agua está en exceso. Si se disminuye la concentración de agua en el aceite por debajo del punto de saturación (en algún lugar entre 0,06% y 0,1%, dependiendo de la temperatura y el nivel de contaminantes), el agua se disuelve completamente en el aceite y es menos probable que cause ese efecto, es por ello que a bajas temperaturas de secado no se obtiene eficiencia en el blanqueado ya que existe reacción con el agua aún presente.
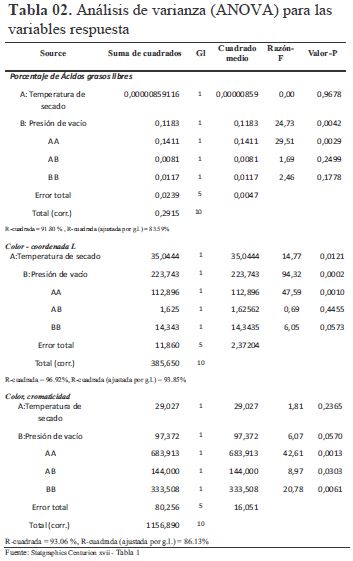
La validez del modelo de % AGL del producto terminado se puede corroborar por el análisis del coeficiente de determinación (R2), valor de R2 =91.80 %; con un R2 ajustado = 83.59 % (Tabla 02), según Gutiérrez y De la Vera (2004) indican que modelos adecuados son aquellos que presentan R² ajustado mayores a 70 % .Del ANOVA se determinó que la presión de vacío es estadísticamente significativo para el %AGL del aceite decolorado al presentar un p-valor menor a 0.05 (p-valor de tabla al 95% de confiabilidad).
A menos presión absoluta 0.13 bar (-0.88 bar de vacío), es decir mayor vacío, el %AGL es menor 0.27 %AGL, mientras para la temperatura se obtiene el menor %AGL a 110 °C y valores mayores a temperaturas inferiores y superiores a esta. El modelo matemático para el %AGL: %AGL = 20,489 - 0,357*T - 2,802*P + 0,002*T^2 + 0,023*T*P + 1,14*P^2 Donde: T= temperatura de secado, P= presión de vacío.
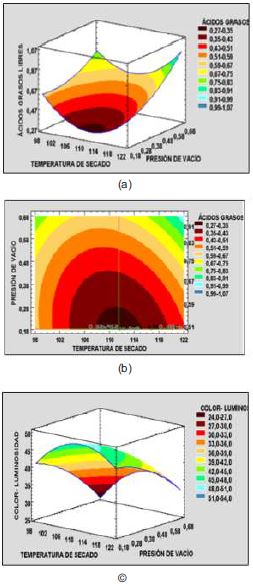
La Figura 02 (a y b) evidencia que a medida la presión absoluta disminuye así también sucede con el %AGL, como consecuencia del aumento de la presión de vacío y el efecto de la temperatura es menor. La eficiencia del blanqueo mejora cuando la presión de funcionamiento en el blanqueador se ejecuta entre 50 a 125 mm de Hg (absolutos); esta presión reducida también minimiza la interacción del aceite y el aire, que resulta en bajos índices de peróxidos, los valores de anisidina, y el color del aceite decolorado; otros autores señalan diferentes presiones de vacío como Torres, Angulo, Oliart y Medina (2009), 26.7x102Pa. El incremento de la temperatura permite acelerar los procesos químicos, ocasionando que una grasa o aceite calentados se degraden con rapidez, sobre todo en presencia de residuos que potencian las reacciones de alteración actuando como catalizadores. Una de las principales alteraciones es la hidrólisis que provoca la ruptura del enlace éster de los triglicéridos, lo que conlleva a un aumento de AGL tal como sostiene Lercker y Carrasco (2007). La hidrólisis de las sustancias grasas produce la liberación de ácidos grasos, los AGL aceleran la degradación oxidativa debido a la acción de los grupos carboxílicos sobre los hidroperóxidos de los ácidos grasos. La acidez acorta en tiempo de conservación del aceite por el efecto hidrolítico promotor de la acción oxidante (Lercker y Carrasco, 2007).
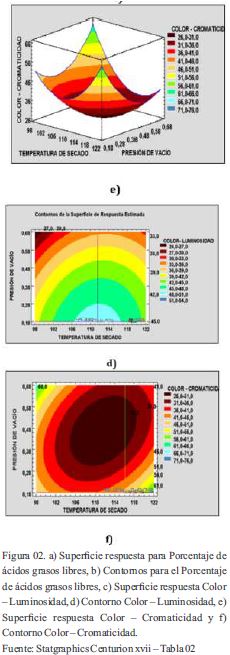
Modelos matemáticos y superficie respuesta para color:
La variable color se analizó en base a las tres coordenadas obtenidas por el método CieLab, coordenada L (luminosidad) y la cromaticidad (tono), a partir de la siguiente fórmula: C= (a2 + b2)1/2
El modelo encontrado Color-Luminosidad presenta un coeficiente de determinación de 96.92 % y un R2 ajustado de 93.85% lo cual indica que el modelo representa el proceso, se observa la significancia sobre la luminosidad de la presión de vacío y la temperatura de secado. La luminosidad haciende a menores valores de presión absoluta y temperaturas superiores a 100 °C pero menores de 120°C (Tabla 02). Brooks et al (sf) indica que la temperatura afecta la viscosidad del aceite y la cinética de adsorción. La viscosidad del aceite disminuye con el aumento de temperatura que resulta en una mejor dispersión de las partículas de tierra de blanqueo, la mejora de arcilla / interacciones de aceite, y menos resistencia al flujo. La aplicación de una temperatura más alta que beneficia la eliminación de color y las tasas de filtración, sin embargo, dependen del tipo y calidad del aceite, a su vez puede empeorar el color del aceite y su estabilidad a la oxidación, lo cual se puede notar a temperaturas de 124.14 °C se obtiene un color más oscuro que a temperaturas inferiores. Silva, Pinto, Carrola y Paiva-Martins (2010) indica que, mediante el aumento de la concentración de oxígeno, la formación de radicales peroxilo secundarias se vuelve importante, lo que resulta en la pérdida de comportamiento antioxidante, la cual es una de las razones por la que a bajas presiones de vacío (0.70 y 0.61 bar abs.) resulta un producto más oxidado mostrando un color oscuro. Según Silva et al. (2010), la temperatura afecta la capacidad de adsorción de los adsorbentes. Por lo tanto, pueden proporcionar isotermas de la relación entre la cantidad de un soluto adsorbido, la mayor absorción de los carotenos es a altas temperaturas entre 105 – 115 °C.
El modelo matemático para el color-luminosidad: L= -500,428 + 9,915*T - 28,833*P - 0,045*T^2 + 0,319*T*P - 39,843*P^2 Donde: L= Luminosidad del producto terminado, T= temperatura de secado, P= presión de vacío, el modelo presenta un coeficiente de determinación de 93.06%y un R2 ajustado de 86.13 %, la interacción de la temperatura de secado y presión de vacío ejercen significancia (Tabla 02).
Los efectos de la temperatura de secado y la presión de vacío en la cromaticidad es notable, a medida se acercan a sus niveles extremos la cromaticidad tiende a ser más alta, lo cual se traduce en un color más vívido (más saturado). En los niveles de los puntos centrales (110°C y 0.41 bar) la cromaticidad es más baja, la luminosidad es mayor obteniéndose un color amarillo más oscuro. Las especificaciones industriales señalan un color Gardner de 6-7 para el producto terminado, el cual solo se obtiene, a temperatura de secado y presión de vacío de 100°C y 0.13 bar (ensayo 7). Las coordenadas fueron de 48.69 para la luminosidad y 48,09 para cromaticidad, lo que se traduce en un color de tono amarillo claro.
El modelo matemático para el color-cromacidad: C = 1283,79 - 23,172*T + 155,015*P + 0,110*T2 - 3,0*T*P + 192,124*P2 Donde: C= cromaticidad, T= temperatura de secado, P= presión de vacío
La cromaticidad (tono de amarillo) (Figura 02 e,f) que se logró obtener es de 48 alcanzando los valores de 6-7 en la escala Gardner, logrado con la temperatura de secado de 110°C y 0,13 bar absoluta de presión de vacío. Los pigmentos en los aceites de pescado comerciales son principalmente de la familia de los carotenoides que son responsables de la coloración a amarillo. Los carotenoides son responsables de la mayor parte del color del aceite de pescado. Silva et al (2010) señala que el ambiente polar que forman las tierras activadas permite que los cationes de carotenoides (formados a partir de la reacción con radicales de alcoxil y alquil obtenidos por descomposición de peróxidos por la tierra activada) se unan a la superficie aniónica de la arcilla.
La caracterización del producto final (aceite decolorado) (Tabla 03), muestra valores disminuidos para el IP e IN. El primero se redujo de 1.46± 0.05 a 1.11±0.04 mientras que el segundo de 25.35 ± 0.11 a 20.7 ± 0.48 en comparación al aceite crudo muestreado. Gonzalez-Tovar, Noriega-Rodríguez, Ortega-García, Gámez-Meza & Medina-Juárez, (2005) señala que las tierras de blanqueo actúan como absorbentes de pigmentos y como catalizadores de los peróxidos a compuestos secundarios de oxidación (aldehídos y cetonas), aunque esta última reacción es más lenta, ocurriendo incluso cuando la absorción de pigmentos ya no es significativa. Según Egbuna y Omotioma (2013) posterior al blanqueo los IP y IA decrecen y este decrecimiento es proporcional a la temperatura de operación empleada. Silva et al. (2010) indica que con el empleo de tierras activadas el índice de peróxidos puede llegar a cero y reducir significativamente el índice de anisidina. Para obtener el aceite semirrefinado (decolorado) el aceite crudo pasa por un proceso de neutralización, donde el % AGL es llevada a menos de 0.1 %, sin embargo al mezclarse con la tierra activada este valor se incrementa debido a la acidez inherente de su superficie o a su efecto catalítico formando ácidos grasos libres (Silva et al, 2010). Brooks et al (sf) señala que la humedad del producto que sale del filtro como producto terminado es un buen indicador de las condiciones de operación. La humedad de 0.01% refleja las condiciones óptimas en que se obtuvo el producto, temperatura de secado de 110°C y presión de vacío de -0.88 bar.
En la Tabla 04 se observa el perfil de ácidos grasos dejando notar un aumento en el porcentaje de ácido linoleico y un decrecimiento leve para el caso del ácido eicosapentaenoico y ácido docosahexaenoico en comparación al aceite crudo muestreado, Tokuṣoḡlu (2008) explica que como consecuencia del procesamiento del aceite los niveles de CLA (ácido linoleico conjugado) incrementan, de igual forma para los otros ácidos polinsaturados, teniendo un efecto contrario en los monoinsaturados.
CONCLUSIÓN:
La aplicación de metodología de superficie respuesta con un diseño compuesto central rotacional permitió obtener los valores óptimos de temperatura de secado de 110°C y 0.13 bar de presión. El producto terminado indicó un porcentaje de ácidos grasos libres de 0.27 ± 0.01% y color CieLab con coordenadas L: 48,69 ± 0.88, a: -4,28 ± 0,26 y b: 35,03 ± 0,85, el cual es equivalente a color 6 -7 en escala Gardner, cumpliendo así con las especificaciones industriales.
REFERENCIAS BIBLIOGRÁFICAS.
AOCS Cd 3-25. (2003). Official Method Saponification Value, Sampling and Analysis of Commercial Fats and Oils. Illinois. USA: Copyright The American Oils Chemist’s Society. Urbana.
AOCS Ce 1b-89 (2009). Marine Oil - Fatty Acid Composition by GLC. 6th edition. AOCS Press Champaigh IL. [ Links ]
Bartolomeu, D. (2015). Extração, refino e caracterização de óleo de coproduto de atum-galha-amarela (thunnus albacares) rico em ácidos graxos poli-insaturados. (Tesis doctorado, Universidade Federal do Paraná. Curitiba. Brasil). Recuperada de http://acervodigital.ufpr.br/bitstream/handle/1884/41349/R%20-%20T%20-%20DAYSE%20ALINE%20SILVA%20BARTOLOMEU%20DE%20OLIVEIRA.pdf?sequence=2&isAllowed=y [ Links ]
Brooks, D., Berbesi, R. and Hodgson, A. sf. Optimization of Bleaching Process - AOCS Lipid Library. [online] Lipidlibrary.aocs.org. Available at: http://lipidlibrary.aocs.org/OilsFats/content.cfm?ItemNumber=40321. [ Links ]
CODEX STAN 210. (1999). Codex Standard for Named Vegetable Oils. Food and Agriculture Organization of the United Nations. Roma determinación del índice de yodo. Método Wijs. [ Links ]
Egbuna S.O.; and Omotioma M. (2013). Beneficiation of Local Clay to Improve Its Performance in Adsorption of Carotene Pigments and Volatiles in the Bleaching of Palm oil, IJESI Vol. 2 issue 12, Pp 12-28. [ Links ]
Fournier, V., Destaillats, F., Juaneda, P., Dionisi, F., Lambelet, F., Sébédio, J.-L., & Bredeaux, O. (2007). Degradation products formed from long-chain PUFA during deodorization of fish oil. Lipid Technology, 19(1), 9–11. [ Links ]
Gonzalez-Tovar, L.; Noriega-Rodríguez, J.; Ortega-García, J.; Gámez-Meza, N. & Medina-Juárez, L. (2005). Cinética de adsorción de pigmentos, peróxidos y tocoferoles durante el proceso de blanqueo del aceite de soja. Grasas y Aceites. 56(4): 324-327. [ Links ]
Gutierrez, H.; De La Vera. (2004). Análisis y diseño de experimentos. México: Mc Graw-Hill. Interamericana Editores. [ Links ]
Harris, W. S., Mozaffarian, D., Rimm, E., Kris-Etherton, P., Rudel, L. L., Appel, L. J., Engler, M. M., et al. (2009). Omega-6 fatty acids and risk for cardiovascular disease. Circulation, 119, 902–907. [ Links ]
Lercker, G.; Carrasco P. (2007). Evaluation of the Influence of Thermal Oxidation on the Phenolic Composition and on the Antioxidant Activity of Extra-Virgin Olive Oils. J. Agric. Food Chem., 55 (12)
Menegazzo, M. L., Petenuci, M. E., & Fonseca, G. G. (2014). Production and characterization of crude and refined oils obtained from the co-products of Nile tilapia and hybrid sorubim processing. Food Chemistry, 157, 100–104. [ Links ]
Menegazzo, M. (2012). Produção e caracterização de biodiesel obtido via Rota etílica a partir de óleo bruto de resíduos de Pescado. (Tesis maestría, Universidade Federal da Grande Dourados. Brasil). Recuperada de http://files.ufgd.edu.br/arquivos/arquivos/78/MESTRADO-DOUTORADO-CIENCIA-TECNOLOGIA-AMBIENTAL/49.%20%E2%80%9CProdu%C3%A7%C3%A3o%20e%20Caracteriza%C3%A7%C3%A3o%20de%20Biodiesel%20Obtido%20Via%20Rota%20Et%C3%ADlica%20%C3%A0%20Partir%20de%20%C3%93leo%20Bruto%20de%20Res%C3%ADduos%20de%20Pescado%E2%80%9D.pdf [ Links ]
Method ISO 662. (2016). Animal and vegetable fats and oils. Determination of moisture and volatile matter content. Fifth edition. Recuperada de https://www.iso.org/obp/ui/#iso:std:iso:662:ed-3:v1:en [ Links ]
Method ISO 663. (2017). Animal and vegetable fats and oils. Determination of insoluble impurities content. Fifth edition. Recuperada de https://www.iso.org/obp/ui/#iso:std:iso:663:ed-5:v1:en [ Links ]
Method ISO 6885. (2012). Animal vegetables fats and oils - Determination of anisidine value. Reviewed. Quality and Standards Authority of Ethiopia (QSAE). Recuperada de https://archive.org/details/et.iso.6885.2012. [ Links ]
Método UNE 72031. (1983). Magnitudes colorimétricas. Recuperada de http://www.aenor.es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0006977#.Wl7ac6jiZPZ [ Links ]
Morais, M.; Pinto, L.; Ortiz, S.; Crexi, V.; Silva, R.; Silva, J. (2001). Estudo do processo de refino do óleo de pescado. Revista Instituto Adolfo Lutz. v. 60, n.1, p. 23-33. [ Links ]
NTP 209.005. (1968) (revisada el 2011). Aceites y grasas comestibles. Método para la determinación de la acidez libre. Primera edición. Instituto Nacional de Defensa de la Competencia y de la protección de la propiedad intelectual. Peru. [ Links ]
NTP 209.006 (1968) (revisada el 2011). Aceites y grasas comestibles. Método de determinación del índice de peróxido. Primera edición. Instituto Nacional de Defensa de la Competencia y de la protección de la propiedad intelectual. Perú [ Links ].
NTP 209.008. (1968) (revisada el 2012). Aceites y grasas comestibles. Método de Determinación de índice de yodo por el método Wijs. Primera edición. Instituto Nacional de Defensa de la Competencia y de la protección de la propiedad intelectual. Perú [ Links ].
NTP 312.011. (1985) (revisada el 2015). Aceites marinos. Determinación del color en la escala Gardner. Primera edición. Instituto Nacional de Defensa de la Competencia y de la protección de la propiedad intelectual. Perú [ Links ].
Oliveira, D.; Minozzo, M.; Licodiedoff, S.; Waszczynskyj, N. (2016). Physicochemical and sensory characterization of refined and deodorized tuna (Thunnus albacares) by-product oil obtained by enzymatic hydrolysis. Food Chem., 207, 187–194 [ Links ]
Rizliya V, Mendis E. (2014). Biological, physical, and chemical properties of fish oil andindustrial applications. In: Kim, S.-K. (Ed.), Seafood Processing By-Products: Trendsand Applications. Springer Science+Business Media, New York. [ Links ]
Rodríguez-Rodríguez, J., & Amaya-Guerra, C., & Caballero-Mata, P., & Alanís-Guzmán, M., & Aguilera-González, C., & Báez-González, J., & Moreno Limón, S., & Núñez-González, A. (2014). Optimización de un método para determinación de fitoesteroles y escualeno en ácidos grasos destilados usando la metodología de superficie de respuesta y su validación. Revista Mexicana de Ciencias Farmacéuticas,45(4)
Salas-Maldonado, A., & Ayala-Galdós, M., & Albrecht-Ruiz, M. (2002). Contenido de EPA Y DHA en aceite crudo de pescado producido en el Perú durante el periodo 1996-2000. Ciencia y Tecnología Alimentaria, 3 (5), 283-287. [ Links ]
Silva L.; Pinto J.; Carrola J.; Paiva-Martins, F. (2010). Oxidative stability of olive oil after food processing and comparison with other vegetable oils, In Food Chemistry, Volume 121, Issue 4, pp 1177-1187 [ Links ]
Souza, C.; Bariccatti, R.; Simões, M; Silva de Oliveira, J. (2011). Estudo do branqueamento de óleo de peixe utilizando-se a bentonita sódica através de planejamento fatorial 24. Semina: Ciências Exatas e Tecnológicas, Londrina, v. 32, n. 1, p. 107-114. [ Links ]
Tokuṣoḡlu, Ö. (2008). Conjugated linoleic acid (CLA). Cis 9, trans 11 and trans 10, cis 12 isomer detection in crude and refined corn oils by capillary GC. Grasas Aceites, 59: 146-151. [ Links ]
Torres-González M.; Angulo-Guerrero, O.; Oliart-Ros, R. & Medina-Juárez L. (2009). Efecto de la refinación física sobre la calidad química y sensorial del aceite de coco. Grasas y aceites, 60 (1)
Vaisali, C., Charanyaa, S., Belur, D. P., & Regupathi, I. (2015). Refining of edible oils: a critical appraisal of current and potential technologies. International Journal of Food Science and Technology, 50, 13–23. [ Links ]
Zuidam, N., Nedovic' V. (2010). Encapsulation Technologies for Active Food Ingredients and Food Processing. New York: Springer Science. [ Links ]
Recibido: 29/09/2017
Aceptado: 30/12/2017
On line: 08/01/2018