Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Altoandinas
versión On-line ISSN 2313-2957
Rev. investig. Altoandin. vol.20 no.2 Puno mayo/jun. 2018
http://dx.doi.org/10.18271/ria.2018.361
ARTÍCULO ORIGINAL
Propagación in vitro de Cinchona officinalis L a partir de semillas
In vitro propagation of Cinchona officinalis L from seeds
Nelson Ramiro Lima Jiménez1; José Antonio Moreno Serrano1,2*; Víctor Hugo Eras Guamán1; Julia Minchala Patiño1; Darlin González Zaruma1; Magaly Yaguana Arévalo1; Cristian Valarezo Ortega1.
1 Carrera de Ingeniería Agronómica y de Recursos Naturales Renovables de la Universidad Nacional de Loja -Ecuador.
2* Departamento de Biotecnología y Biología Vegetal de la Universidad Politécnica de Madrid, E.T.S.
* Autor para correspondencia: josemoreno796@gmail.com Address and Postal Code: Ciudad Universitaria s/n, Madrid. España; CP: 28040, Phone: 6338139060
RESUMEN
La micropropagación vegetal es una herramienta útil para la conservación de especies forestales amenazadas mediante la utilización de técnicas de cultivo in vitro. El principal objetivo fue: estudiar la propagación in vitro de Cinchona officinalis L a partir de semillas. Se aplicó NaOCl a diferentes concentraciones y tiempos de inmersión para la desinfección de semillas, el medio de cultivo MS (Murashige y Skoog) fue suplementado con AG3 para la germinación de semillas y para la fase de multiplicación in vitro fue usada la combinación de auxina y citoquininas en diferentes concentraciones. Los tratamientos con NaOCl al 50 % durante 5, 10 y 15 min fueron los que obtuvieron menor porcentaje de contaminación; el mayor porcentaje de germinación en las semillas se obtuvo con 1 mg/l de AG3 y los mejores resultados en multiplicación in vitro se obtuvo con la combinación de 0.2 ANA + 2.0 BAP. Se generaron protocolos de propagación in vitro en la especie Cinchona officinalis L con la finalidad de emprender programas de conservación y recuperar ecosistemas forestales nativos de la región sur del Ecuador.
PALABRAS CLAVE: C. officinalis, in vitro, desinfección, germinación, multiplicación.
ABTRACT
Plant micropropagation is a useful tool for the conservation of threatened forest species with the use of in vitro culture techniques. The main objective was to study the in vitro propagation of Cinchona officinalis L from seeds. NaOCl was applied at different concentrations and immersion times for seed disinfection, medium MS (Murashige and Skoog) was supplemented with GA3 for seed germination and for in vitro multiplication phase was used the combination of auxin and cytokinins in different concentrations. The treatments with NaOCl at 50 % for 5, 10 and 15 min were those that obtained the lowest percentage of contamination; the highest percentage of germination in the seeds was obtained with 1 mg/l of GA3 and the best results in vitro multiplication were obtained with the combination of 0.2 NAA + 2.0 BAP. In vitro propagation protocols were generated in the species Cinchona officinalis L with the purpose of undertaking conservation programs and recovering native forest ecosystems of the southern region of Ecuador.
KEY WORDS: C. officinalis, in vitro, disinfection, germination, multiplication.
INTRODUCCIÓN
El género Cinchona conocido como "cascarilla o árbol de quina" está conformado por 23 especies de la familia Rubiaceae, generalmente son arboles de tamaño mediano a pequeño o arbustos con corteza amarga, se distribuyen a lo largo de la zona tropical y ecuatorial de la cordillera de los Andes desde los 10° de latitud norte hasta los 20° de latitud sur, desde Venezuela a Bolivia siguiendo los bosques nublados andinos de mayor humedad ambiental y tienen preferencia por los lugares más escarpados y de fuerte pendiente (Madsen, 2002).
Según Garmendia (2005), los quinos del Ecuador se encuentran en las entradas naturales del callejón interandino, como San Gabriel en la provincia del Carchi, Aloag en la provincia de Pichincha, el Valle de Pastaza en la provincia de Tungurahua, etc. Cinchona officinalis es endémica del valle de Loja, ha sido una especie muy representativa para esta provincia, por su valor medicinal, cultural e histórico, razón por la cual esta especie fue nombrada como el Árbol Nacional del Ecuador, lo que representa un hecho de trascendental importancia para la provincia de Loja, ya que la especie fue descubierta en esta región (Anda, 2002).
En los bosques de la provincia de Loja se explotó la cascarilla hasta el siglo XIX, debido a sus propiedades medicinales (Jaramillo & Carrera, 2008) y a sus metabolitos secundarios (alcaloides) encontrados en su corteza (Nieto, 2000), se caracteriza principalmente por su contenido de quinina; sustancia que se utilizó durante siglos para curar la malaria (Garmendia, 2005), cuando se consiguió la síntesis de la cloroquinina sintética, se empezó a utilizar como fármaco, desplazando a la quinina (Garmendia, 2005). Pese a esto la cascarilla tiene un nuevo uso en el mercado como gin tonic; la quinina da el sabor amargo a este tónico que ha conquistado el mercado de bebidas gaseosas, especialmente en Europa y Estados Unidos (Ulloa, 2006; Legffngwell, 2003).
Tradicionalmente el género Cinchona ha sido utilizado con fines medicinales (Vallejo, 1998), además del uso antropogénico y la expansión agrícola (Cuvi, 2009), han causado una sobreexplotación de la misma (Ríos, De la Cruz, & Mora, 2008) y la baja tasa de germinación y regeneración de la especie en condiciones naturales (Espinosa & Rios, 2014), han incidido ya que en la actualidad no es fácil encontrar poblaciones de cascarilla en ecosistemas forestales (Buddenhagen et al., 2004). Ha pasado a formar parte de la lista de especies promisorias del Ecuador, en vías de extinción (Ríos, De la Cruz, & Mora, 2008). Últimamente quedan pequeños relictos boscosos en zonas inaccesibles; el futuro de esta especie en Ecuador es incierto, ya que el país posee la mayor tasa de deforestación de la región (FAO, 2010) y son urgentes los esfuerzos para la conservación eficiente de esta especie.
Al ser el cultivo in vitro una estrategia de conservación de especies amenazadas, por permitir la multiplicación masiva de plantas (Bhojwani & Santu, 2013) y teniendo en cuenta que los especímenes de C. officinalis son esporádicos en su ambiente natural, la perdida rápida de viabilidad de las semillas, la recalcitrancia en la conservación de las semillas por largos periodos de tiempo, la escasa regeneración natural, la importancia creciente por sus propiedades farmacológicas, entre otros factores, resalta la necesidad de realizar estudios alternativos que permitan la protección y difusión de la especie, bajo esta perspectiva y con el ánimo de contribuir al conocimiento para la conservación de la especie.
MATERIALES Y MÉTODOS
Germinación y desinfección in vitro de semillas de C.officinalis
Las semillas se seleccionaron en grupos de 30 para facilitar su manipulación debido a su tamaño pequeño, la desinfección de las semillas de C. officinalis se realizó en la cámara de flujo laminar donde se aplicó alcohol etílico al 70 % durante 1 min y se enjuagó con agua destilada estéril, seguidamente se colocaron en hipoclorito de sodio (NaOCl) en tres concentraciones (15, 25 y 50 %) y tres tiempos de inmersión (5, 10 y 15 min). Una vez realizado el proceso de desinfección de las semillas, se procedió a la siembra in vitro de semillas, se utilizó el medio de cultivo MS (Murashige y Skoog, 1962), suplementado con vitaminas (1 mg/l de tiamina y 100 mg/l de m-inositol), sacarosa como fuente de carbohidratos al 2 %, agar 0.6 % como agente gelificante y ácido giberélico (AG3) en dos concentraciones (0.5 y 1.0 mg/l), se sembraron dos semillas por cada tubo de ensayo a temperatura de 23 ± 2 °C y un fotoperiodo de 16-8 horas, luz-oscuridad.
Multiplicación in vitro de explantes de C.officinalis
Se seleccionaron los ápices caulinares y segmentos nodales de las plantulas germinas in vitro, se sembraron en un medio de cultivo basal estuvo constituido por las sales minerales MS (Murashige y Skoog, 1962), suplementado con vitaminas (1 mg/l de tiamina y 100 mg/l de m-inositol), sacarosa como fuente de carbohidratos al 2 %, agar 0.6 % como agente gelificante y se adicionó la interacción de tres hormonas: ácido naftalenoacético (0.2 mg/l), 6-bencil-aminopurina (0.2 y 2.0 mg/l) y kinetina (0.2 y 2.0 mg/l). El pH de los medios de cultivo se ajustó a 5.8 ± 0.2 con NaOH 1N; se sembraron 2 explantes/vial, a temperatura de 23 ± 2 °C y un fotoperiodo de 16-8 horas, luz-oscuridad.
Análisis estadístico de los datos
Se utilizó el software Info Stat (Di Rienzo et al., 2009). Se realizó un análisis de varianza (ANOVA), estableciendo diferencias significativas con el test de LSD Fisher a un nivel de significancia de 0.05 en cada uno de los ensayos realizados.
RESULTADOS
Germinación y desinfección in vitro de semillas de C.officinalis
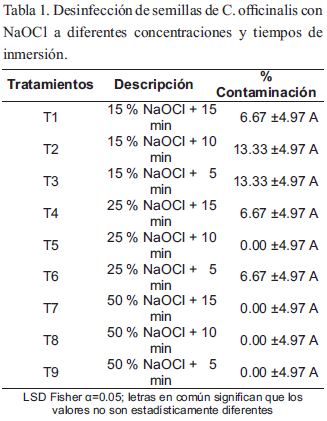
Con respecto a la variable de % de contaminación, no se encontraron diferencias significativas entre los tratamientos (p= 0.3276), el T2 (15 % de NaOCl + 10 min de inmersión) y el T3 (15 % de NaOCl + 15 min de inmersión) presentan el valor más alto (13.33 ± 4.97), en comparación del T1 (15 % de NaOCl+ 5 min de inmersión), T4 (25 % de NaOCl + 5 min de inmersión) y el T6 (25 % de NaOCl + 15 min de inmersión) que presentaron valores de (6.67 ± 4.97) de contaminación provocada por hongos y bacterias. En el caso de los tratamientos T5 (25 % de NaOCl + 10 min de inmersión), T7 (50 % de NaOCl + 5 min de inmersión), T8 (50 % de NaOCl +10 min de inmersión) y T9 (50 % de NaOCl + 15 min de inmersión) no registró contaminación. La contaminación se presentó en el día 5 y se estabilizó en el día 15 de siembra de las semillas de C. officinalis (Tabla 1; Figura 1).
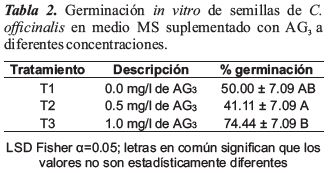
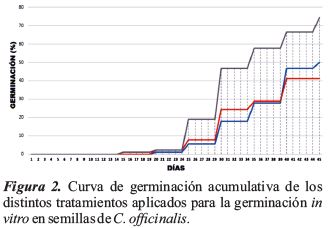
Los resultados de la variable germinación, presentaron diferencias significativas entre los tratamientos (p = 0.0379). El T2 (0.5 mg/l AG3) presenta el valor más bajo (41.11 ± 7.09), el T1 (0.0 mg/l AG3) tiene un valor de (50.00 ± 7.09), en comparación con el T3 (1.0 mg/l AG3) que presentó los valores más altos (74.44 ± 7.09) en porcentaje de germinación (Tabla 2). La germinación se inició a los 15 días y se estabilizó a los 45 días después de la siembra (Figuras 2 y 3).
Multiplicación in vitro de explantes de C.officinalis
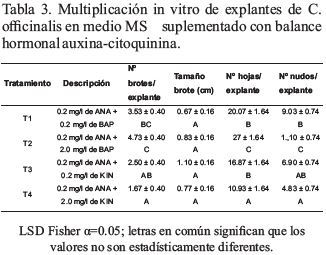
En la variable tamaño del brote no se encontraron diferencias significativas (p=0.3337); sin embargo, si se encontraron diferencias significativas entre tratamientos para las variables: número de brotes/explante (p = 0.0035), número hojas/explante (p = 0.0008) y número de nudos/explante (p = 0.0007). El T2 (0.2 mg/l de ANA + 2.0 mg/l de BAP) fue el tratamiento con los mejores resultados en la formación de brotes, nudos y hojas, con un número promedio de (4.73, 27.00 y 12.10) respectivamente por explante en C. officinalis (Tabla 3; Figura 4).
DISCUSIÓN
Germinación y desinfección in vitro de semillas de C. officinalis
La contaminación microbiana es uno de los problemas más graves en la micropropagación de especies vegetales, a nivel mundial produce cuantiosas pérdidas de material vegetal (George, 1993). Los contaminantes más frecuentes en condiciones in vitro son los hongos, las bacterias y levaduras, denominados "vitropatógenos" (Leifert, et al., 1994).
Se observó, que el NaOCl en altas concentraciones y diferentes tiempos de inmersión disminuyen la contaminación de las semillas; observándose en el T7 (50 % de NaOCl durante 5 min de inmersión), T8 (50 % de NaOCl durante 10 min de inmersión) y T9 (50 % de NaOCl durante 15 min de inmersión), los cuales presentan 0 % de contaminación, resultados similares a los de Conde (2015); donde manifiesta que utilizando concentraciones de 50 % de NaOCl se disminuye el porcentaje de contaminación. Por el contrario, los tratamientos que tuvieron bajas concentraciones de NaOCl presentaron niveles altos de contaminación como se puede observar en los tratamientos: T2 y T3 que alcanzaron un porcentaje de 13.33 % de contaminación los cuales tenían una concentración de 15 % de NaOCl.
La contaminación se observó a partir de los 5 días y se estabilizó a los 15 días de siembra. Por tal razón, si se aumenta la concentración de NaOCl se disminuye el porcentaje de contaminación, de manera que se evita la pérdida de cuantiosas cantidades de material vegetal provocada por hongos y bacterias en cultivo in vitro. Otros autores en otras especies vegetales reportan el uso de NaOCl para obtener plántulas en condiciones fitosanitarias apropiadas para trabajos de cultivo in vitro, previniendo y controlando la contaminación microbiana que constituye uno de los problemas más graves en la micropropagación de especies leñosas (Guerrero, Basantez, Gómez-Kosky, & Caraballoso, 2016; García, Mesa, & Ocampo, 2015; Luna, Bogado, Ayala, Bravo, & Sansberro, 2016; Billard, Dalzotto, & Lallana, 2014)
Las hormonas desempeñan un papel muy importante en la fisiología de las semillas, así el AG3 mejora la velocidad de germinación, el porcentaje de germinación y apoya al crecimiento inicial de las plántulas (Hartmann & Kester, 1997). En este estudio se aplicó distintas concentraciones de AG3, el tratamiento T3 con una concentración de 1 mg/l AG3 obtuvo el valor más alto de 74.44 % de germinación, que coincide con lo manifestado por Armijos-González y Pérez (2016) en ensayos de germinación en presencia de fenoles mostraron porcentajes de germinación en C. pubescens de 53.5 % y C. officinalis de 56.6 % y con el uso de fotoperiodo incrementaron los porcentajes de germinación en C. pubescens al 90.0 % y C. officinalis al 86.7 %. Anacafe (2004), en estudios realizados en C. officinalis utilizando concentraciones de 1.0 y 2.0 mg/l de AG3 obteniendo un 88.67 y 83.33 % de germinación respectivamente. Armijos y Pérez (2011), en ensayos de germinación en Cinchona officinalis, Cinchona pubescens y Cinchona sp, también obtuvieron un porcentaje promedio alto de germinación en las tres especies, en un tiempo de evaluación de 90 días un 90 % de semillas germinadas.
Por el contrario, Ruíz, de Chico, y Ruíz, (2014), en estudios con C. pubescens aplicando una concentración de 1000 mg/l AG3 obtiene valores bajos de 33.34 % de germinación, lo que difiere con los resultados obtenidos en la presente investigación. Zurita et al., (2014), manifiesta que se debe utilizar bajas concentraciones de AG3 (1 mg/l), debido a que induce a la germinación de las semillas y en altas concentraciones inhibe la germinación. Otros autores utilizando métodos de germinación convencionales obtuvieron porcentajes de germinación similares o superiores comparados con los de cultivo in vitro; Gonzaga et al., (2012), quienes en un estudio realizado en el bosque protector "El Bosque" en San Pedro de Vilcabamba, mencionan que las semillas de C. officinalis alcanzaron un porcentaje de germinación del 73.5 %; Apolo (2012) menciona también que la germinación de las semillas de C. pubescens procedentes de Loja y Galápagos a nivel de laboratorio, sobrepasan el 80 % de germinación; así también, Herrera (2016) manifiesta, que obtuvo un porcentaje de germinación de C. officinalis del 73.5 %.
Con respecto a los días de germinación, se presentó a los 15 días y se estabilizó a los 45 días de haber sido inoculadas las semillas, estos resultados son similares a los obtenidos por Jäger (2011), afirmando que las semillas de C. pubescens germinan entre 10 a 40 días utilizando la misma cantidad de AG3; López-Encina y González-Padilla (1996), señalan que la germinación in vitro tiene ventajas, puede aumentar la tasa de germinación, reducir el tiempo y homogenizar la germinación gracias al fitorregulador de crecimiento de acción hormonal (AG3) que estimula la germinación de las semillas. Diferentes estudios en otras especies han mostrado también, que la aplicación de ácido giberélico promueve la germinación al actuar sobre el balance hormonal que desencadena el proceso de germinación (Lindo, La Torre, & Luján, 2017; López-Elías, 2017; Ruiz, López & Herrera, 2017; Prado-Urbina et al., 2015)
Multiplicaciónin vitro de explantes de C.officinalis
Con la combinación hormonal (auxinas-citoquininas) de 0.2 mg/l de ANA + 2.0 mg/l de BAP aplicado en el T2, se logró obtener los mejores resultados en formación de brotes, nudos y hojas con un número promedio de 4.73, 27.00 y 12.10 respectivamente por explante, resultados que son lo corroborados por Armijos-González y Pérez (2016) en C. officinalis con 3.0 IBA + 5.0 BAP obtuvieron 4.3 brotes/explante; también Quichimbo (2012), en estudios en Cedrela montana, quien manifiesta que utilizando 2.0 mg/l de BAP sin combinación con ANA obtuvo un promedio de 3 brotes por cada explante; Daquinta (2003), asegura que a medida que aumenta la concentración de BAP se alcanza mejores niveles de brotación en especies forestales.
En otro estudio realizado por Santos (2011) en C. officinalis, en un medio de cultivo MS sin ningún tipo de hormonas, obtuvo brotes con tamaños de 1.01 cm y un total de 4.1 brotes por cada explante, resultados que concuerdan con los obtenidos en la presente investigación, sin embargo Santos obtuvo esos resultados a los 90 días, en la presente investigación se adicionó al medio de cultivo una combinación hormonal en el T2 de (0.2 de ANA y 2.0 de BAP) la que permitió tener los mismos resultados pero en 45 días. Se podría afirmar que ANA promueve la división celular estimulando el crecimiento vegetativo de los explantes y el BAP provoca la formación de nuevos brotes, permitiendo así la aparición de nudos y a su vez nuevas hojas.
Los resultados observados también guardan similitud con los descritos por diferentes autores durante la propagación in vitro de otras especies arbóreas como Tectona grandis L., Pithecellobium dulce (Roxb.) y Caesalpinia spinosa (Mol.) O. Kuntz. Los autores refieren que con el empleo de un medio de cultivo compuesto por las sales MS y 1.0 mg L-1 de BAP obtienen un porcentaje de brotes establecidos in vitro de 90 % en Tectona (Jiménez-Tello, 2008), 80 % en Pithecellobium (Goyal, Kachhwaha, & Kothari, 2012) y 90 % en Caesalpinia (Núñez, Quiala, de Feria, Mestanza, & Teanga, 2013)
Los resultados obtenidos en el presente estudio son de relevancia para el género Cinchona, se logró obtener un 0 % de contaminación por hongos y bacterias endógenas que permanecen latentes en la semillas de la especie, una alta tasa de germinación y de formación de brotes, nudos y hojas en la fase de multiplicación in vitro de explantes (ápices caulinares y segmentos nodales); resultados que demuestran que la técnica de cultivo in vitro puede ser utilizada para generar protocolos de micropropagación en la especie C. officinalis, para la recuperación y conservación de la especie, así como modelo para otras especies forestales de la familia Rubiaceae.
Agradecimientos
Autoridades de la Universidad Nacional de Loja, y al equipo técnico del proyecto de investigación; "Identificación y descripción del estado actual de Cinchona officinalis L, en la provincia de Loja y generación de protocolos para la propagación in vivo e in vitro", por el apoyo técnico brindado para la ejecución de la presente investigación.
REFERENCIAS BIBLIOGRÁFICAS
Acosta-Solís, M. (1946) Cinchonas del Ecuador. Editorial Ecuador, Quito, 271 p. [ Links ]
Anda, A. 2002. La Cascarilla. Ed. Universidad Técnica Particular de Loja, Loja -Ecuador. 192 p. [ Links ]
ANACAFE (Asociación Nacional del café). 2004. Cultivo de Quina: Programa de diversificación de ingresos en la empresa cafetalera. [ Links ]
Andersson, L., & Taylor, C. (1994). Rubiaceae: Cinchonea-Coptosapeltea flora of Ecuador. En G. Harling, & L. Andersson, Flora of Ecuador (pp. 62:1-319). Quito: University of Gothenburg Riks museum; Pontificia Universidad Católica del Ecuador. [ Links ]
Apolo, M. 2012. Germinación en Laboratorio e influencia de los hongos micorrízicos y la aplicación de nutrientes en el crecimiento de dos procedencias de Cinchona pubescens, a nivel de invernadero. Tesis de grado previa a la obtención de título de ingeniero forestal. Loja. Ecuador. 78 p. Retrieved from http://dspace.unl.edu.ec/handle/123456789/5340 [ Links ]
Armijos, R., & Pérez, C. (2011). Germinación y multiplicación in vitro en Cinchona pubescens Vahl y Cinchona officinalis Linneo. Loja, Ecuador: Universidad Técnica Particular de Loja, Universidad Politécnica de Madrid. [ Links ]
Armijos-González, R., & Pérez, C. (2016). In vitro germination and shoot proliferation of the threatened species Cinchona officinalis L., (Rubiaceae). Journal of Forestry Research, 27(6), 1229-1236. doi: 10.1007/s11676-016-0272-8 [ Links ]
Bhojwani, S., & Santu, P. (2013). Plant tissue culture: an introductory test. Springer. Retrieved from https://link.springer.com/book/10.1007%2F978-81-322-1026-9 [ Links ]
Billard, C. E., Dalzotto, C. A., & Lallana, V. H. (2014). Desinfección y siembra asimbiótica de semillas de dos especies y una variedad de orquídeas del género Oncidium. Polibotánica, (38), 145-157. Retrieved from http://www.scielo.org.mx/scielo.php?pid=S1405-27682014000200008&script=sci_arttext [ Links ]
Buddenhagen, C., Renteria, J., Gardener, M., Wilkinson, S., Soria, M., Yanez, P., Tye, A., Valle, R. 2004. Control of a highly invasive tree Cinchona, in Galápagos. Weed technonolgy 18: 1194-1202. [ Links ]
Conde, V. (2015). Biotechnological processes for the in vitro proliferation and rooting of "hualtaco" Loxopterygium huasango spruce ex engl., From the dry forest of the province of Loja. Ecuador: Universidad Nacional de Loja. [ Links ]
Cuvi, N. (2009). Ciencia e imperialismo en América Latina: La Misión de Cinchona y las estaciones agrícolas cooperativas. Barcelona: Universidad Autónoma de Barcelona Departamento de Filosofía. Retrieved from https://ddd.uab.cat/reco rd/63857 [ Links ]
Daquinta, M., Rodríguez, L., Ramos, L., & Capote, R. (2003). Biotechnology management of species and bamboos in Cuba. XII Woorld Forestry. Québec, Canada. [ Links ]
Di Rienzo, J. A., Casanoves, F., Balzarini, M. G., Gonzalez, L., Tablada, M., & Robledo, C. W. (2010). InfoStat versión. Argentina.: Grupo InfoStat, FCA. Universidad Nacional de Córdoba. [ Links ]
Espinosa, C., & Ríos, G. (2014). Patrones de crecimiento de Cinchona officinalis in vitro y ex vitro; respuestas de plántulas micropropagadas y de semillas. Revista Ecuatoriana de Medicina y Ciencias Biológicas, 35 (1,2), 73-82. [ Links ]
FAO. (2010). Evaluación de los recursos forestales mundiales 2010. Roma: FAO. Retrieved from http://www.fao.org/docrep/013/i1757s/i1757s.pdf [ Links ]
García Lozano, D. L., Mesa López, N., & Ocampo Guerrero, M. L. (2015). Standardization of the disinfection protocol for the micropropagation of Aspidosperma polyneuron. Revista Colombiana de Biotecnología, 17(2), 76-84. doi: 10.15446/rev.colomb.biote.v17n2.54277 [ Links ]
Garmendia, A. (2005). El Àrbol de la Quina (Cinchona sp) (1a. ed.). Ecuador: Universidad Tècnica Particular de Loja. [ Links ]
George, E. (1993). Plant propagation by tissue culture. Ed. Exegeties Ltd. 143 p. [ Links ]
Goyal, P., Kachhwaha, S., & Kothari, S. L. (2012). Micropropagation of Pithecellobium dulce (Roxb.) Bentha multipurpose leguminous tree and assessment of genetic fidelity of micropropagated plants using molecular markers. Physiology and Molecular Biology of Plants, 18(2), 169-176. doi: 10.1007/s12298-012-0112-z [ Links ]
Guerrero, M. J., Basantez, K., Gómez-Kosky, R., & Caraballoso, I. B. (2016). Establecimiento in vitro de brotes de Vasconcellea x helbornii (Badillo) Badillo. Biotecnología Vegetal, 16(2).
Gonzaga, L., & Moncayo, M. (2012). Fenología, producción de hojarasca y ensayos de germinación de las principales especies nativas del bosque protector "el bosque" parroquia San Pedro de Vilcabamba. Tesis: Facultad Forestal. Loja, Ecuador: Universsidad Nacional de Loja. Retrieved from http://dspace.unl.edu.ec/handle/ 123456789/5339 [ Links ]
Hartman, H., Kester, D. 1997. Propagación de Plantas. México D.F. Compañía Editorial Continental, S.A. de C.V. 760 p. [ Links ]
Herrera, C. (2016). Evaluación de fuentes semilleras de especies forestales nativas, como apoyo a programas y políticas de reforestación de la provincia de Loja. Tesis: Master en Desarrollo Rural. Loja, Ecuador: Universidad Naciional de Loja. Retrieved from http://dspace.unl.edu.ec/handle/123456789/9919 [ Links ]
Jäer, H. (2014). Cinchona pubescens. En Enzyklopädie der Holzgewächse. Weinheim, Alemania: Wiley VCH. [ Links ]
Jaramillo, J., & Carrera, D. 2008. Una aproximación CTS al análisis de la industria. Retrieved from http://www.utpl.edu.ec/jorgeluisjaramillo/wp-content/uploads/20 08/08/jorgeluis-la-industria-de-la-cascarilla-junio-2008-blog.pdf [ Links ]
Jiménez-Tello, M. V. (2008) Propagación in vitro de Tectona grandis L. a partir de ápices de brotes axilares de plantas de origen epicórmico. Tesis de Maestría, Instituto de Biotecnología de Las Plantas Universidad Central Marta Abreu de Las Villas, Santa Clara, Cuba. [ Links ]
Leifert, C., Morris, C. E., & Waites, W. M. (1994). Ecology of microbial saprophytes and pathogens in tissue culture and field-grown plants: reasons for contamination problems in vitro. Critical reviews in plant sciences, 13(2), 139-183. doi: 10.1080/07352689409701912 [ Links ]
Leffingwell, J. C. (2003). Chirality & bioactivity I.: pharmacology. Leffingwell Reports, 3(1), 1-27. Retrieved from http://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.731.5594&rep=rep1&type=pdf [ Links ]
López, E., & González, P. 1996. A propósito de semillas. Enc. En la Biol. Ltd. 143 p. [ Links ]
Lindo-Angulo, T., La Torre-Acuy, M. I., & Luján-Roca, D. Á. (2017). Efecto de la temperatura y el ácido giberélico en la germinación de semillas de caesalpinia spinosa (tara). The Biologist, 15(1). Retrieved from http://revistas.unfv.edu.pe/i ndex.php/rtb/article/view/143
López-Elías, J., Jiménez-León, J., Huez-López, M. A., Dávila-Loreto, J. A., Ávila-Machado, E., & Robles-Zepeda, R. E. (2017). Germinación de semillas de Asclepias subulata en condiciones de casa sombra utilizando ácido giberélico. European Scientific Journal, ESJ, 13(15). Retrieved from http://eujournal.org/ind ex.php/esj/article/view/9354
Luna, C. V., Bogado, F. A., Ayala, P. G., Bravo, C. D. V., & Sansberro, P. A. (2016). Uso de distintos desinfectantes superficiales para el establecimiento in vitro de segmentos nodales de Grevillea robusta. Revista de Investigaciones de la Facultad de Ciencias Agrarias-UNR, (27), 011-016. Retrieved from http://www.cienciasagronomicas.unr.edu.ar/journal/index.php/agronom/article/view/116 [ Links ]
Madsen, J. (2002). Historia cultural de la cascarilla de Loja. En Z. M. Aguirre, Botánica Austroecuatoriana: estudios sobre los recursos vegetales en las provincias de El Oro, Loja y Zamora Chinchipe (pp. 385-399). Quito: Ediciones AbyaYala. Retrieved from http://repositorio.educacionsuperior.gob.ec/handle/28000/3657 [ Links ]
Murashige, T. S. (1962). A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum, (15), 473-497. doi: 10.1111/j.1399-3054.1962.tb08052.x [ Links ]
Nieto, M. (2000). Remedios para el imperio: Historia Natural y la apropiación del nuevo mundo. Bogota, Colombia: ICAH. [ Links ]
Núñez, J. E. N., Quiala, E., de Feria, M., Mestanza, S., & Teanga, S. (2017). Propagación in vitro de Caesalpinia spinosa (Mol.) O. Kuntz a partir de yemas axilares de árboles plus seleccionados. Biotecnología Vegetal, 17(2). Retrieved from https://revista.ibp.co.cu/index.php/BV/article/view/543
Prado-Urbina, G., Lagunes-Espinoza, L. D. C., García-López, E., Bautista-Muñoz, C. D. C., Camacho-Chiu, W., Mirafuentes, F., & Aguilar-Rincón, V. H. (2015). Germinación de semillas de chiles silvestres en respuesta a tratamientos pre-germinativos. Ecosistemas y recursos agropecuarios, 2(5), 139-149. Retrieved from http://www.scielo.org.mx/scielo.php?pid=S2007-90282015000200002&script=sci_arttext&tlng=en [ Links ]
Quichimbo, D., & Del Cisne, G. (2012). Procesos morfogénicos in vitro de cedro (Cedrela montana Moritz ex Turcz.) inducidos, a partir de semillas, para propagación y conservación de germoplasma. Tesis Forestal. Universidad Nacional de Loja. Retrieved from http://dspace.unl.edu.ec/handle/123456789/5343 [ Links ]
Ríos, M., De la Cruz, R., & Mora, A. (2008). Conocimiento tradicional y plantas útiles del Ecuador: saberes y prácticas. Editorial Abya Yala. https://books.google.es/books?hl=es&lr=&id=HZU_zQ0H3jMC&oi=fnd&pg=PA3&dq=Rios,+M.+2008.+Plantas+utiles+del+ecuador:+uso+y+abuso.+En+M.+Rios.+R,+de+la+Cruz+y+A,+Mora,+Conocimientos+y+tradiciones+de+las+plantas+%C3%B9tiles+del+Ecuador:+Saberes+y+Pr%C3%A0cticas+(Abya+Yala+ed.).+Quito.+Ecuador.&ots=if11fVhOKx&sig=PLjp0TMLCUMh4B0p_0ueohFsy0#v=onepage&q&f=false [ Links ]
Ruíz, J. C., de Chico, L. C. R., & Ruíz, J. C. (2014). Efecto del ácido giberélico, nitrato de potasio y agua de coco en la germinación de semillas de quina, Cinchona pubescens. Revista REBIOLEST, 2(1), 5-15. Retrieved from http://revistas.unitru.edu.pe/index.p hp/ECCBB/article/view/637 [ Links ]
Ruiz, G. B., López, R. A., & Herrera, J. (2017). Efecto de tratamientos físicos y químicos sobre la germinación y almacenamiento de semillas de Bactris guineensis (L.) HE Moore, Costa Rica. Revista Forestal Mesoamericana Kurú, 14(35), 45-54 [ Links ]
Santos, A., & Armijos, R. (2011). Modificación de nutrientes y agentes osmóticos sobre la alimentación del crecimiento In vitro de Cinchona officinalis, L. como herramienta de conservación. Instituto de Ecología-Unidad de Fisiología Vegetal. Universidad Técnica Particular de Loja. Ecuador. [ Links ]
Ulloa, C. (2006). Aromas y sabores andinos. Botánica económica de los Andes Centrales. La Paz: Universidad Mayor de San Andrés, 313-328. Retrieved from http://www.mobot.org/mobot/research/curators/pdf/Aromas.pdf [ Links ]
Vallejo, A. (1998). Conservación. ¿Gasto o inversión?. Ecuador, Terra Incógnita. Revista Ecológica, 1, 4.
Zurita-Valencia, W., Gómez-Cruz, J. E., Atrián-Mendoza, E., Hernández-García, A., Granados-García, M. E., García-Magaña, J. J. & Sánchez-Vargas, N. M. (2014). Establecimiento de un método eficiente de germinación in vitro y micropropagación del cirimo (Tilia mexicana Schlecht.)(Tiliaceae). Polibotánica, (38), 129-144. Retrieved from http://www.scielo.org.mx/scielo.php?pid=S140527682014000200007&script=sci_arttext&tlng=pt [ Links ]
Artículo recibido: 13/09/2017
Artículo aceptado: 22/03/2018
On line: 27/04/2018