Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de Investigaciones Altoandinas
versão On-line ISSN 2313-2957
Rev. investig. Altoandin. vol.20 no.4 Puno out./dic. 2018
http://dx.doi.org/10.18271/ria.2018.417
ARTÍCULO ORIGINAL
Efecto del ácido naftalenacético y 6-bencilaminopurina en la inducción de callos embriogénicos en anteras de Carica papaya L. variedad criolla
Effect of naftalenacetic acid and 6-bencilaminopurine in the induction of embriogenic calllus of Carica papaya L. var. criolla
Julio Chico-Ruiz 1*, Osmar Gonzales-Zavaleta2
1 Laboratorio de Fisiología y Cultivo de Tejidos Vegetales. Universidad Nacional de Trujillo-Perú
2 Laboratorio de Fisiología y Cultivo de Tejidos Vegetales. Universidad Nacional de Trujillo-Perú
* Autor para correspondencia, e-mail: jchico22@gmail.com
RESUMEN
El papayo (Carica papaya L.), Caricaceae, es un cultivo importante por su alto valor nutricional y sus aplicaciones medicinales e industriales, sin embargo, este cultivo tiene problemas de plagas y enfermedades por lo cual hacen falta investigaciones para obtener variedades mejoradas de papaya. Una alternativa es el cultivo de anteras para lo cual es necesario conocer su competencia con la inducción de callos; con lo planteado el objetivo de esta experiencia fue determinar el efecto del ácido naftalenacético y 6-bencilaminopurina en la inducción de callos embriogénicos en anteras de C. papaya L. variedad criolla. Los pimpollos obtenidos fueron medidos y agrupados según su longitud, para determinar el estado de desarrollo del grano de polen y se confirmó el estado de microspora con la coloración de carmín acético y HCl. Luego los explantes fueron sometidos a un pretratamiento en frío (6°C) por 4 días, luego se sembraron en el medio Murashige & Skoog, que contenía sacarosa (3%), fitagel (0.5%), pH de 6.0 y combinaciones de ANA y BAP a concentraciones de ppm. La evaluación se realizó durante 4 meses, el tratamiento T4 (ANA 1 y BAP 0.5) fue el mejor para el porcentaje de anteras con callos (hasta un 40%), en cuanto a microsporas inducidas el mejor fue T5 (ANA 1 y BAP 1) con el 2.9%. El tamaño de las anteras aumentó y el color de las mismas cambió de amarillo a marrón. Durante el proceso de inducción no se observaron embriones, pero si desdiferenciación del tejido (meristemoides).
PALABRAS CLAVES: Carica papaya, anteras, microsporas, ácido naftalenacético (ANA) y 6- bencilaminopurina (BAP).
ABSTRACT
The papaya (Carica papaya L.), Caricaceae, is an important crop for its high nutritional value and its medicinal and industrial applications, however, this crop has problems of pests and diseases, which requires research to obtain improved varieties of papaya. An alternative is the cultivation of anthers for which it is necessary to know their competence with the induction of calluses; with the stated objective of this experience was to determine the effect of naphthaleneacetic acid and 6-benzylaminopurine in the induction of embryogenic calluses in anthers of C. papaya L. var. criolla. The obtained buds were measured and grouped according to their length, to determine the state of development of the pollen grain and the microspore state was confirmed with the coloring of acetic carmine and HCl. Then the explants were subjected to a cold pretreatment (6 ° C) for 4 days, then they were seeded in the Murashige & Skoog medium, which contained sucrose (3%), phytagel (0.5%), pH 6.0 and combinations of ANA and BAP at ppm concentrations. The evaluation was performed during 4 months, the treatment T4 (ANA 1 and BAP 0.5) was the best for the percentage of anthers with calluses (up to 40%), as for microspores induced the best was T5 (ANA 1 and BAP 1) with 2.9%. The size of the anthers increased and the color of the anthers changed from yellow to brown. During the induction process, embryos were not observed, but tissue dedifferentiation (meristemoids) was observed.
KEYWORDS: Carica papaya, anthers, microspores, naphthaleneacetic acid (ANA) and 6-benzylaminopurine (BAP).
INTRODUCCIÓN
Carica papaya Linn (Caricaceae) es nativa de América tropical y es reconocida por su tallo frágil, no ramificado, que produce abundante latex, y en la parte apical presenta numerosas hojas. Tiene un rápido crecimiento que puede llegar hasta 20 metros de alto. Es importante por su valor nutricional y aplicaciones medicinales e industriales.
Tradicionalmente las hojas han sido y son utilizadas en un amplio rango de dolencias, como malaria, dengue, ictericia y actividad antiviral. Las hojas jóvenes son ricas en flavonoides (miricetina), alcaloides (carpaina, pseudocarpaina, dehidrocarpaina), compuestos fenólicos (ácido ferúlico, cafeíco y cloroigénico), compuestos cinogenéticos (bencilglucosinolato) (Gyauchand et al., 2015; Navarro et al., 2016; Yogiraj et al., 2014). Sin embargo, su cultivo tiene que afrontar una serie de problemas en su producción que se ve limitado por el virus de la mancha anular de la papaya (PRSV); además la fragilidad y la naturaleza perecedera de la fruta limitan la exportación a gran escala. También los métodos convencionales que se usan para propagarla, ya sea por semillas, injertos y estacas suelen ser tediosos e imprácticos a gran escala debido a una variación considerable en la susceptibilidad a las enfermedades, calidad y rendimiento de la fruta (Gyauchand et al., 2015).
La androgénesis es la producción de plantas haploides a partir del cultivo de anteras o de microsporas aisladas. En condiciones apropiadas el grano de polen puede desarrollar en callo o en un embrioide. El callo puede ser inducido a dar origen a un embrioide en un medio de cultivo favorable. Los embrioides desarrollarán en plantas sin embargo la fertilidad del regenerante y el número de plantas verdes puede impactar en las líneas doble haploides producidas. El término haploide es usado para describir a una planta que tiene un juego de cromosomas (n) y doble haploide (DH) describe a una planta haploide en el cual el número de cromosomas ha sido doblado (2n) (Humphreys y Knox, 2015). Los haploides ocurren espontáneamente o pueden ser inducidos por métodos in vivo (hibridación inter o intra específica, haploidización mediado por centrómero) o in vitro (cultivo de gametofitos inmaduros masculinos o femeninos) (Makowska et al., 2017).
Varios investigadores han adoptado el cultivo de anteras por el elevado número de granos de polen dentro de cada antera que teóricamente produce plantas DH. Además, el cultivo de anteras es reportado como el mejor costo- efectivo en relación para el método de cruzamiento intergenérico para la producción de plantas doble haploides a gran escala. (Humphreys y Knox, 2015; Dewivedi et al., 2015).
El estado de desarrollo de la antera tiene fuerte influencia en la eficiencia de inducción de haploides. Esta debe ser cosechada saludablemente, la planta no debe estar estresada, debe estar en óptimas condiciones de temperatura, intensidad luminosa, fotoperiodo, nutrición y agua. También el estado de desarrollo de la microspora en el momento de iniciar el cultivo es importante porque influencia en la totipotencia de la microspora durante la androgénesis in vitro (Dewivedi et al., 2015; Humphreys y Knox, 2015).
El pretratamiento del explante antes de iniciar el cultivo es beneficioso para mejorar la eficiencia deDH en muchos cultivos para detener a la microspora en su vía gametofítica. Su desarrollo que se orienta hacia la embriogénesis promueve la división celular seguida por la formación de estructuras multicelulares y finalmente, las estructuras embrionarias son liberadas por la pared de la exina. La mayoría de los pre-tratamientos incluye la temperatura, sacarosa y medio ayuno sin nitrógeno y estrés osmótico, lo cual difiere entre especies. Dependiendo de las especies y los genotipos, el estrés por temperatura puede ser aplicado para someter toda la inflorescencia o botones florales excisados o anteras excisadas con bajas o altas temperaturas por varias horas o días (Parra, 2015).
Los constituyentes del medio basal y las combinaciones de los reguladores del crecimiento son importantes en la inducción de haploides. El tipo y concentración de auxinas determina la vía del desarrollo de la microspora, con 2,4-D induce formación de callos, mientras que AIA y ANA promueven directa embriogénesis. Particularmente importante en los cultivos in vitro, es la acción concertada de auxinas y citoquininas orientados al control y división celular además de la morfogénesis. Usualmente antagónicas pero sus efectos son modulados por el genoma de la planta y el tejido específico (Zur et al., 2015).
Concentraciones elevadas de auxina (5-10 mgl-1) de 2,4-D, estimula la iniciación de la embriogénesis de la microspora de algunas especies recalcitrantes, como en yuca (Perera et al., 2014). Ello ha sugerido que el 2,4-D no es solo una auxina análoga, sino que a altas concentraciones es un factor de estrés que orienta a la vía embriogénica a la célula en desarrollo. Esto sugiere que los niveles endógenos y el aplicado puede ser crucial para la producción y calidad de los embriones derivados de la microspora.
Aporte de investigaciones sobre el tema, tenemos el de Kalam et al., (2013) que trabajaron con tres especies de Carica (C. papaya, C. cauliflora, C. goudotiana) en las cuales ensayaron diferentes medios de cultivo y el tamaño del pimpollo floral para inducir callos y regenerar plantas haploides. Utilizaron 2.0 mg/l de ANA, 1.0 mg/l de BAP y 60 g/l de sacarosa. Las tres especies manifestaron altos porcentajes de callos, solo C. goudotiana mostró callos embriogénicos y regeneración de planta haploide. Gyuanchand et al. (2015) informaron de una tasa de inducción de embriones de hasta 8% en anteras cultivadas en medio agar con 0,1 mg/L de BA y 0,1 mg/L de NAA, después de ser pretratadas en MS liquido suplementado con 2% de sacarosa durante siete días a 35 °C. Al final los pretratamientos con altas temperaturas 25 y 35 °C son los más adecuados para la inducción de embriones en papaya. Hazarika y Chatuverdi (2013), trabajaron con ovarios no fertilizados de Camelia sinensis y lograron establecer un callo desdiferenciado de origen haploide. Obtuvieron el mayor número de callos a 8.5 μM BA y 4.5 μM 2,4-D con 33°C por 10 días en la oscuridad, y encontraron que la mayoría de células fueron haploides. Ibrahim et al., (2015) realizaron experiencias con óvulos de Hibiscus cannabinus L., para producir haploides. Utilizó ANA, BAP, 2iP y TDZ encontrando alta producción de callos (98%) si los óvulos provenían de pimpollos florales de 22-24 mm de longitud y tratados con 3 ppm de ANA y 3 ppm de 2iP. Kouakou et al., (2015) evaluó el potencial androgénico de las anteras de Lagenaria siceraria con un pretratamiento de 0, 1, 2, 4,6 y 7 días a 4º C. Obtuvieron un 79% de callos cuando las anteras estuvieron uno y dos días a 4º C.
El contar con metodologías que nos permitan obtener plantas haploides a través del cultivo de anteras, no solo en papaya sino también en otras especies, es de vital importancia, pero antes se debe comenzar a conocer las características morfológicas e histológicas que presenta un callo, lo cual es frecuente al iniciar los cultivo in vitro de anteras. Con lo expuesto el objetivo de este trabajo fue determinar el efecto del ácido naftalenacético y el 6- bencilaminopurina, a distintas concentraciones, en la inducción de callos a partir de anteras de C. papaya L. variedad criolla.
MATERIALES Y MÉTODOS
Material vegetal
Los botones florales fueron colectados de plantas de C. papaya L. (variedad criolla) cultivadas en el campo experimental de Fisiología Vegetal de la Facultad de Ciencias Biológicas de la Universidad Nacional de Trujillo.
Determinación del tamaño adecuado de primordio
Se colectaron botones florales con longitudes variables, con la finalidad de tener anteras con granos de polen en diferentes estados de desarrollo. Estos se clasificaron en 4 grupos de acuerdo a su tamaño: de 1 a 3 mm; de 4 a 5 mm, de 6 a 8 mm; de 9 a 11 mm; y de 12 a 14 mm. A cada uno de estos grupos se le realizó la disección (separación de las anteras del conectivo), tinción con orceína acética y posterior observación al microscopio para determinar las etapas de desarrollo del grano de polen. Se seleccionó el grupo de primordios que contenían anteras con una población alta de microsporas en estado uninucleada.
Cultivo in vitro de las anteras
Para la experiencia se utilizaron primordios de 6-8 mm de longitud (Fig. 1a). Durante la fase de pretratamiento, los botones florales fueron cubiertos en papel aluminio y colocados a una temperatura de 6 °C durante 4 días.
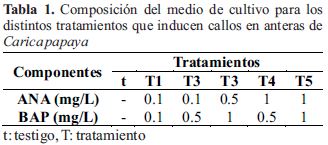
Posteriormente los primordios fueron desinfestados en alcohol al 70% durante 30 segundos y en una solución de hipoclorito de sodio al 1.5% por 10 minutos y enjuagados varias veces en agua destilada estéril. Luego se retiraron las hojas florales para exponer las anteras, extraídas éstas se colocaron en medio MS (Murashige & Skoog, 1964), con 1% de fitagel y 3.0% de sacarosa y suplementado con ácido naftalenacético (ANA) y 6-bencilaminopurina (BAP) a distintas concentraciones para cada tratamiento (Tabla 1). Previamente el pH del medio se ajustó a 6.0 con NaOH/HCl 1,0 N antes de añadir el gelificante. Después de autoclavar a 1.2 Kg/cm2 y 120 °C durante 15 minutos, los medios se vertieron en placas Petri de 5.5 cm de diámetro, conteniendo cada uno 8 ml de medio de cultivo. El número de anteras por placa fue de 15 y se incubaron durante 4 meses a 25 ± 2 °C con un fotoperiodo de (16:8). Se realizó un recambio de medio de cultivo a los 2 meses (Fig. 1b).
Diseño experimental
Se utilizó un diseño completamente al azar. Para establecer el efecto de los reguladores de crecimiento sobre las anteras, se formularon 5 tratamientos y un grupo testigo (t) cada uno con tres repeticiones y cada una de ellas con 15 unidades muestrales (Tabla 1).
Evaluación
Se evaluó cada 10 días el número de anteras que formaron callos (%), y el color y la forma que iban presentando durante la experiencia. También se evaluó el número de microsporas inducidas por antera, con cambios en su morfología. Para este caso, de cada antera, se hizo un preparado en fresco y se observó al microscopio (10 x) contando en cuatro campos panorámicos utilizando la cámara de Neubabuer. De cada campo se obtuvo el número de microsporas totales y microsporas inducidas, aplicando la siguiente fórmula:
Análisis histológico
Se tomaron dos explantes de cada repetición para el análisis histológico. Estos fueron fijados en solución AFA (40% de formaldehido-10 ml-/ácido acético glacial-3ml-/ 50% etanol -87 ml). Las muestras fueron posteriormente deshidratadas en una serie de alcoholes (de 30% a 100%) y luego embebidas en parafilm. Los cortes transversales se hicieron con un micrótomo (el grosor y el ángulo de la cuchilla fueron 7µm y 11º respectivamente). Finalmente ellas fueron coloreadas con safranina (1 hora) y cristal violeta (2 minutos), y luego fotografiadas con ayuda de un microscopio Olympus que tenía acoplado una cámara digital.
Análisis estadístico
Los datos fueron analizados mediante el programa SPSS v. 24. Se realizó una ANAVA y una comparación de medias de Tukey para encontrar diferencias significativas entre los porcentajes de anteras con callos y entre los porcentajes de microsporas inducidas por antera.
RESULTADOS
Anteras con callos
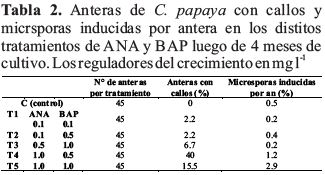
Después de 4 meses de cultivo, los tratamientos que produjeron mostraron un mayor porcentaje de formación de callos por anteras fueron el T4 y T5 con un 40% y 15.5% respectivamente (Tabla 2); con la prueba de ANAVA y TUKEY se determinó la diferencia significativa entre estos dos tratamientos respecto a los demás, y que también existe diferencia significativa entre el T4 y T5; sin embargo, no existe diferencia significativa entre los tratamientos T5 y T3 con un nivel de confianza del 95%. Esto quiere decir que de todos los tratamientos T4 (1 µg/ml ANA/ 0.5 µg/ml BAP) fue el que tiene el mayor porcentaje de inducción de callos.
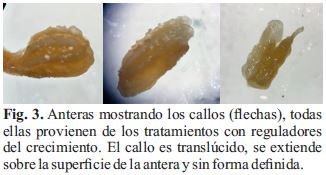
En las anteras tratadas hubo un cambio con respecto a las no tratadas (Fig. 2), se observó un cambio en su morfología (mayor tamaño y bordes irregulares en toda su superficie) y color variando de amarrillo (normal) a marrón. Los callos de forma irregular y translúcido, fueron notorios en el tratamiento 4 (Fig. 3).
Microsporas inducidas por antera
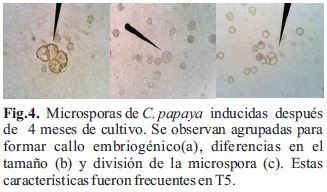
El tratamiento que mostró mayor porcentaje de microsporas inducidas por antera fue el T5 (1 µg/ml ANA/ 1 µg/ml BAP) con un 2.9% (Tabla 2) y fue el único con diferencias significativas respecto a todos los demás tratamientos (p<0,05) con un nivel de confianza del 95%. Las microsporas inducidas eran más grande que las microsporas normales (Fig. 4b), algunas de ellas se agrupaban para formar el callo (Fig. 4a) y otras presentaban un estado de división (Fig. 4c).
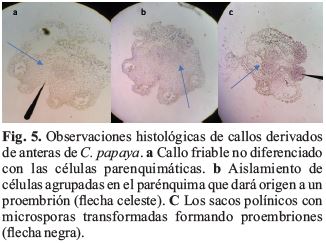
Desarrollo de meristemoides
En los cortes histológicos se pudo observar cambios en los tejidos de anteras procedentes de T1 y T4 (Fig. 5). La característica es: la mayoría de células son grandes y desordenadas, la presencia de células pequeñas (en la zona del conectivo) intensamente coloreadas y agrupadas que dan origen a los meristemoides y futuro embrión.
DISCUSIÓN
Encontramos que los reguladores del crecimiento, el estado de la microspora y las condiciones del shock térmico son importantes para la respuesta androgénica además que fueron los determinantes no solo para formación de callos sino también para la formación de nuevos tejidos en el callo. Por ejemplo, el grosor de la pared en la antera también influencia en la embriogénesis, las anteras jóvenes son más sensibles. Si las paredes son gruesas pueden retrasar la difusión o los factores inductores hacia el lóculo de la antera, reduciendo su efecto sobre las microsporas inducibles, también el estandarizar el tamaño del pimpollo floral es un paso crítico y es altamente genotipo-específico. (Dewivedi et al., 2015), o que el tejido de la antera provea nutrientes y protección contra el estrés (Soriano y Boutilier, 2013). Sin embargo, en el cultivo de anteras, las células somáticas son diploides y pueden desdiferenciarse y dividirse formando unas plántulas o callo diploide no deseado.
Se realizó un pretratamiento de las anteras de C. papaya a 6°C, la cual es muy crucial en esta técnica, pues solo los agentes físico-químicos estresantes desencadenarán la reprogramación de las microsporas; Golabadi et al. (2017) sugieren que cualquier estrés induce una señal de respuesta en la planta, la cual va a depender de la selección del genotipo con capacidad embriogénica. Además, el estrés abiótico frecuente, aparte de otros, es la temperatura la cual causa un shock térmico. En respuesta al tratamiento del estrés, existen varias hipótesis para explicar los cambios que sufren las microsporas por ejemplo Abdalla (2016) propone cambios en la expresión génica y en la organización de la estructura celular de la microspora que afecta el núcleo y el citoplasma, durante el pretratamiento; Golabadi et al. (2017) reporta que a bajas temperaturas después de la mitosis causa una rotura de los microtúbulos de las microsporas lo que determina una división asimétrica del núcleo. Parra (2015) describen que al aplicar temperaturas bajas causa interrupción en el desarrollo de la célula vegetativa, así la división estimulada causa la inducción de androgénesis en el cultivo de anteras.
Sobre los callos obtenidos, el mayor porcentaje de inducción lo encontramos en T4 y T5, (Tabla 2). Es probable que los callos se hayan formado a partir de las microsporas que se observan al interior de las tecas según la Fig. 5c o de la formación de meristemoides y alteraciones del tejido (Fig. 5 a, b, c, d). Rivas-Sendra et al., (2015) a las cinco semanas encontró en anteras de S. melongena dos tipos de callos. El primero de tipo compacto, no friable y de color verde, no organogénico, luego se necrosa y muere. El segundo tipo, que es el que observamos en anteras de C. papaya, era translúcido, espongoso y masa friable, organogénico de la cual emergieron hojas. Kurtar et al., (2018) trabajando con dos especies de Cucurbita reporta que los callos de color verde que obtuvo son altamente productivos en la iniciación de las plantas. Entonces el color del callo para regenerar una planta va a depender de la especie y reguladores del crecimiento utilizadas, porque las anteras con callos embriogénicos de papaya fueron marrones.
Las microsporas inducidas en T5 (Fig. 4 a, b, c) presentaban cambios que se observan en muchos trabajos donde se inducen embriogénesis a partir de microsporas (Soriano et al., 2013) y con pre tratamiento a temperaturas de 4º C ( Kouakou et al., 2015) como aumento de tamaño, otras empezaban un proceso de división y se encontraban cubiertas aún por una capa de exina y otras se agrupaban linealmente formando embriones tipo suspensor; al hacer una tinción fluorescente con DAPI observaron la presencia de varios núcleos en dichos pro-embriones. Perera et al., (2014) trabajando con anteras y microsporas de Manihot esculenta coinciden con nuestras observaciones (Fig. 5). Ellos reportan que la pared celular de la antera, epidermis, endotecio y capa media se alargaban y el tapete se degeneraba. En cambio, el tejido conectivo de la antera presentaba pequeñas células meristemáticas con núcleo intensamente coloreados. Dos diferentes estructuras multicelulares se observaron, la primera es el incremento del diámetro de la microspora inducida sobre la microspora no inducida y la segunda es la división simétrica del núcleo.
Entonces el genotipo de las plantas donadoras determina la eficiencia in vivo o in vitro de la producción de haploides. Esta respuesta varía no solo entre especies sino dentro de las especies, con pocos genotipos con gran respuesta mientras que otros son recalcitrantes. La interacción genotipo y tamaño del brote y el genotipo por condiciones de crecimiento del donador impactan en la eficiencia de la producción de haploides. La mayoría de las especies, con pocas excepciones, son recalcitrantes para la androgénesis, la cual es controlado por genes específicos del polen (Kurtar et al., 2018).
CONCLUSIONES
Podemos afirmar que el estrés a 5º C es clave para inducir cambios en las anteras de C. papaya, además las combinaciones ANA-BAP inducen callos como también transforman a las microsporas y se observan en alto porcentaje en los tratamientos T4 y T5 respectivamente. Con esta experiencia es posible obtener plantas haploides y poder promover el mejoramiento de este cultivo.
Agradecimientos: Al prof. Róger Veneros Terrones, profesor de Fisiología Vegetal-Facultad de Ciencias Biológicas, por habernos brindado el material vegetal y el apoyo técnico para la ejecución de la presente investigación.
REFERENCIAS BIBLIOGRÁFICAS
Abdalla, A. (2016). Factores clave implicados en la embriogénesis de microsporas inducida por estrés en cebada y colza: metilación del DNA, proteínas de arabinogalactanos y auxina. (Tesis Doctoral). Madrid: Universidad Complutense de Madrid. Disponible en: https://core.ac.uk/download/pdf/42950138.pdf (Tomado el 06 de Agosto de 2018) [ Links ]
Dwivedi, S., Britt, A., Tripathi, L., Sharma, S., Upadhyaya, H. y Ortiz, R. (2015). Haploids: Constraints and opportunities in plant breeding. Biotechnology Advances 33: 812-829. doi: http://dx.doi.org/10.1016/j.biotechadv.2015.07.001 [ Links ]
Golabadi, M., Ghanbari, Y., Keighobadi, K. y Ercisli, S. (2017). Embryo and callus induction by different factors in ovary culture of cucumber. Journal of Applied Botany and Food Quality 90, 68 – 75. doi:10.5073/JABFQ.2017.090.010 [ Links ]
Gyauchand, K., Kumar, S., Sagar, S., Kumar, V. y Kumar, M. (2015). In-vitro androgenesis in papaya (Carica papaya L.) cv. Pusa Nanha. Journal of Applied and Natur al Science, 7(1): 273-278. doi: https://doi.org/10.31018/jans.v7i1.601 [ Links ]
Hazarika, R. y Chatuverdi, R. (2013). Establishment of dedifferentiated callus of haploid origin from unfertilized ovaries of tea (Camellia sinensis (L.) O.Kuntze) as a potential source of total phenolics and antioxidant activity. In vitro Cell. Dev.Biol-Plant 49:60-69 doi:10.1007/s11627-013-9490-3 [ Links ]
Humphreys, D. y Knox, R. (2015). Doubled Haploid Breeeding in Cereals. En Al-Khayra et al. (eds), Advances in Plant Breeding Strategies: Breeding Strategies: Breeding, Biotechnology and Molecular Tools, doi: 10.1007/978-3-319- 22521-0_9
Ibrahim, A., Kayat, F., Susanto, O., Ariffullah, M. y Kashiani, P. (2015). Callus induction from ovulos of kenaf (Hibiscus cannabinus L.) Biotechnoloy 14(2):72-78. doi: 10.3923/biotech.2015.72.78 [ Links ]
Kalam, M., Golam, M. y Amin, L. 2013. Effects of different culture media and flower bud size on haploid plant production through anther culture of three Carica species. Journal of Food, Agriculture & Environment 11(2): 296- 300. doi: https://doi.org/10.1234/4.2013.4268 [ Links ]
Kiszczak, W., Kowalska, V., Kapuscinska, A., Burian, M. y Gorecka, K. (2015). Effect of low temperature on in vitro androgenesis of carrot (Daucus carota L.). In Vitro Cell.Dev.Biol.-Plant 5(2): 135-142 doi:10.1007/s11627- 015-9665-1Kouakou Laurent [ Links ]
Kouakou, K., Doubi, T., Koffi, K., Kouassi, K., Kouakou, T., Baudoin, J. y Zoro I. (2015). Androgenic potential and anther in vitro culture of Lagenaria siceraria (Molina) Standl an edible-seed cucurbit. Int. J. Biol. Chem. Sci. 9(4): 1779-1789. doi : http://dx.doi.org/10.4314/ijbcs.v9i4.4 [ Links ]
Kurtar, E., Balkaya, A. y Ozbakir, M. (2018). Production of Callus Mediated Gynogenic Haploids in Winter Squash (Cucurbita maxima Duch.) and Pumpkin (Cucurbita moschata Duch.). Czech J. Genet. Plant Breed., 54(1): 9–16. doi: 10.17221/30/2017-CJGPB [ Links ]
Makowska, K., Oleszczuk, S. y Zimny, J. (2017). The Effect of Copper on Plant Regeneration in Barley Microspore Culture. Czech J. Genet. Plant Breed., 53(1): 17–2 doi: 10.17221/82/2016-CJGPB [ Links ]
Murashige, T y Skoog, F. (1962). A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures". Physiologia Plantarum. 15(3): 473 497. doi:10.1111/j.1399-3054.1962.tb08052.x. [ Links ]
Navarro, A., Rojas, E., Lazcano, M. y Vera, O. (2016). Propiedades funcionales de semillas de papaya (Carica papaya L.). Revista de Ciencias de la Salud. 3(7): 48-57. Disponible en: www.ecorfan.org/Bolivia (Tomado el 06 de Agosto de 2018) [ Links ]
Parra, V. (2015). Aspectos básicos y aplicados de la inducción de embriogénesis en microsporas de pimiento y colza. (Tesis Doctoral). Valencia: Universitat Politècnica de València. Disponible en: http://hdl.handle.net/10251/48518 (Tomado el 06 de Agosto de 2018) [ Links ]
Perera, P., Ordoñez, C., Lopez-Lavalle, L. y Dedicova, B. (2014). A milestone in the doubled haploid pathway of cassava. Protoplasma 251:233-246 doi: 10.1007/s00709-013-0543-6 [ Links ]
Rivas-Sendra, A., Corral-Martínez, P., Camacho-Fernández, C. y Seguí-Simarro, J. (2015). Improved regeneration of eggplant doubled haploids from microspore-derived calli through organogenesis. Plant Cell Tissue Organ Cult 122:759-765 doi 10.1007/s11240-015-0791-6 [ Links ]
Soriano, M., Li, H. y Boutillier, K. (2013). Microspore embryogenesis: establishment of embryo identity and pattern in culture. Plant Reprod, 26: 181-196. doi 10.1007/s00497-013-0226-7 [ Links ]
Yogiraj, V., Goyal P., Chauhan,C., Goyal, A. y Vyas, B. 2014. Carica papaya Linn: An Overview. International Journal of Herbal Medicine 2014; 2 (5): 01-08. Disponible en: www.florajournal.com (Tomado el 06 de Agosto de 2018) [ Links ]
Zur,I., Dubas, E., Krzewska, M y Janowiak, F. (2016). Current insights into hormonal regulation of microspore embryogenesis. En Seguí-Simarro, J., ed. (2016). Doubled haploidy In model and recalcitrant species. Lausanne: Frontiers Media. 6(1), 624 doi; 10.3389/978-2-88919-783-5 [ Links ]
Artículo recibido: 17-05-2018
Artículo aceptado: 30-09-2018
On line: 29-10-2018