Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Altoandinas
versión On-line ISSN 2313-2957
Rev. investig. Altoandin. vol.20 no.4 Puno oct./dic. 2018
http://dx.doi.org/10.18271/ria.2018.418
ARTÍCULO ORIGINAL
Crio-Tomografía de rayos X (Cryo-XT) de fábricas virales en células infectadas con virus vaccinia
Cryo-X-ray Tomography (Cryo-XT) of viral factories in cells infected with vaccinia virus
Jose Antonio Moreno-Serrano1*, Tulio F. Solano Castillo2
1 Facultad de Veterinaria de la Universidad Complutense de Madrid España
2 Área Agropecuaria y de Recursos Naturales Renovables de la Universidad Nacional de Loja España
*Autor para correspondencia, e-mail: josemoreno796@gmail.com
RESUMEN
El VV (virus vaccinia) es uno de los virus más complejos, con un tamaño superior a 300 nm y más de 100 proteínas estructurales. Su montaje implica interacciones secuenciales y reordenamientos importantes de sus componentes estructurales.
Se infectaron las células BSC40 y luego se seleccionaron mediante microscopía de fluorescencia de luz y posteriormente se formaron imágenes en el microscopio de rayos X en condiciones criogénicas. Se utilizaron series de inclinación tomográfica de imágenes de rayos X para producir reconstrucciones tridimensionales que muestran diferentes organelos celulares (núcleos, mitocondrias, RE), junto con otros dos tipos de partículas virales relacionadas con diferentes etapas de maduración del virus vaccinia (IV) inmaduros y (MV) partículas maduras; los ensayos con witaferina mostraron enlaces con actina, que impide la polimerización y el alargamiento de los filamentos; causando viriones mal empaquetados o aberrantes, que inhibe la progresión de la infección viral. Los hallazgos demuestran que la cryo-tomografía de rayos X, es una poderosa herramienta para recolectar información estructural tridimensional a partir de células enteras congeladas, no fijadas y sin manchas con resolución suficiente para detectar diferentes partículas de virus que exhiben distintos niveles de maduración.
PALABRAS CLAVES: virus vaccinia, cryo-tomografía de rayos X, fábrica viral, filamentos de actina.
ABSTRACT
VV (vaccinia virus) is one of the most complex viruses, with a size greater than 300 nm and more than 100 structural proteins. Its assembly involves sequential interactions and important rearrangements of its structural components.
The BSC40 cells were infected and then selected by light fluorescence microscopy and subsequently imaged under the X-ray microscope under cryogenic conditions. Tomographic tilt series of X-ray images were used to produce three-dimensional reconstructions showing different cellular organelles (nuclei, mitochondria, RE), together with two other types of viral particles related to different stages of immature vaccinia (IV) maturation and (MV) mature particles; tests with witaferin showed links with actin, which prevents polymerization and elongation of the filaments; causing poorly packaged or aberrant virions, which inhibits the progression of the viral infection. The findings demonstrate that X-ray cryo-tomography is a powerful tool to collect three-dimensional structural information from frozen whole cells, unfixed and without spots with sufficient resolution to detect different virus particles that exhibit different levels of maturation.
KEYWORDS: Vaccinia virus, cryo-X-ray tomography, viral factory, actin filaments.
INTRODUCCIÓN
La caracterización de las relaciones complejas establecidas entre virus y células ha proporcionado tradicionalmente herramientas únicas para estudiar el ciclo de vida del virus y, simultáneamente, aspectos particulares de los sistemas celulares utilizados por los virus. El virus vaccinia es bien conocido como un vector de expresión muy útil y ahora se usa para diseñar nuevas vacunas contra varios patógenos (Liu & Moss, 2018; Moss, 1996). Al mismo tiempo, virus vaccinia se ha convertido en el foco de los biólogos celulares debido a las complejas interacciones que el virus establece con los sistemas celulares (Hobbs, Osborn, & Nolz, 2018; Ploubidou et al., 2000). Una caracterización detallada de la estructura de VV y la morfogénesis sería de gran ayuda para la manipulación de su ensamblaje in vitro y la construcción de vectores virales con características específicas. Algunos de los aspectos más desconocidos de la vía morfogenética de VV son el origen y la formación de las fábricas virales (Grossegesse et al., 2018; Hollinshead et al., 2001).
Las fábricas virales son grandes áreas perinucleares citoplásmicas definidas como los centros de replicación y ensamblaje de VV. Esta última ocurre en masas densas de electrones dentro de las fábricas virales, conocidas como focos de viroplasma (Ding et al., 2018; Blasco & Moss, 1992). Estas estructuras están formadas por el reclutamiento de elementos virales, y muy probablemente también celulares. Por mecanismos aún por definir, los elementos membranosos se adhieren a la superficie de los focos VV, adquieren una curvatura y forman la media luna. Los semilunas virales representan la primera evidencia de ensamblaje de VV, pero se desconoce en gran parte cómo se forman y cómo logran las semilunas para formar los virus esféricos inmaduros (IV). Todavía existe una considerable controversia sobre las fábricas virales, las estructuras básicas y el origen de las semilunas virales de VV.
El uso de la tomografía crioelectrónica fue un paso importante hacia la comprensión de la estructura del virus (Cyrklaff et al., 2005), el ensamblaje (Chichon et al., 2009) y el desmontaje (Cyrklaff et al., 2007); pero, una de las principales limitaciones de cryo-ET se deriva de la penetración por difusión múltiple de electrones en materiales blandos (Huang, Li, & Gao, 2018; Frank, 2006). Incluso con microscopios de 300 kV de alto voltaje equipados con filtros de energía, la reconstrucción tomográfica de electrones está limitada a muestras de aproximadamente 0.5 μm de espesor, lo que impide el análisis directo de la mayoría de los tipos de células.
Un enfoque complementario para superar estos problemas es el uso de microscopía de rayos X. La mayor potencia de penetración de los rayos X combinada con los avances recientes en óptica difractiva de rayos X ha llevado a la implementación de microscopios de rayos X de transmisión de campo completo con resolución espacial en el rango de 20 nm (Lau, Hunter, Stewart, Perozo, & Vandenberg, 2018; Chao, Harteneck, Liddle, Anderson, & Attwood, 2005). Este poder de resolución junto con el uso de rayos X blandos (con longitudes de onda en el rango de la ventana de agua, 2.3 - 4.4 nm), brinda la posibilidad de obtener imágenes de alto contraste de varias micras de muestras biológicas gruesas no teñidas, abriendo así alternativa interesante para el análisis de resolución supramolecular de material biológico (Harkiolaki et al., 2018). Como en el caso de la cryo-ET, la combinación de imágenes de rayos X con la preservación de las muestras a temperaturas criogénicas es necesaria para recuperar información estructural y química cercana a las condiciones fisiológicas, así como para minimizar el efecto del daño de la radiación sobre muestras biológicas (Schneider, 1998).
El potencial actual de la cryo-tomografía de rayos X (cryo-XT) para la obtención de imágenes tridimensionales de muestras biológicas totalmente hidratadas está en expansión. Los desafíos técnicos involucrados en diferentes aspectos de la técnica se encuentran bajo una amplia mejora, como el uso de objetivos de rayos X de alta resolución (placas de zona), mientras que las soluciones a otros problemas como etapas de cryo-muestra precisas y soportes para microscopía de campo completo se están desarrollando en la actualidad. Se ha llevado a cabo un intenso trabajo cualitativo para explorar las posibilidades de cryo-XT con células completas (Jiménez-Lamana, Szpunar, & Łobinski, 2018; Gu, Etkin, Le-Gros, & Larabell, 2007) que proporcionan descripciones morfológicas de los orgánulos celulares y segmentación de los contenidos celulares basados en propiedades de absorción diferencial (Zong et al., 2018; Parkinson, McDermott, Etkin, Le-Gros, & Larabell, 2008).
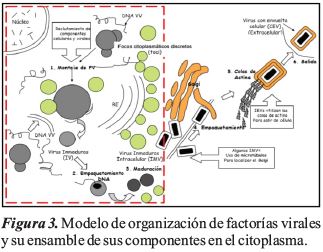
Los estudios de cryo-XT han desempeñado un papel central en la caracterización de la estructura básica, las fábricas virales y el ensamblaje de VV. El objetivo del presente trabajo, es mostrar la organización de las fábricas virales y sus componentes de ensamblaje en el citoplasma de una célula entera infectada mediante VV basado en cryo-XT y la reconstrucción de tomogramas procesando los datos usando un software específico.
MATERIALES Y MÉTODOS
Preparación de virus.
El virus vaccinia atenuado M65 derivado de la cepa WR (Dallo, Maa, Rodriguez, Rodriguez, & Esteban, 1989) se cultivó en la línea celular BSC40 (células de riñón de mono verde 40) y se purificó mediante bandas en gradientes de sacarosa (Esteban, 1984).
Preparación de muestra para Cryo-ET
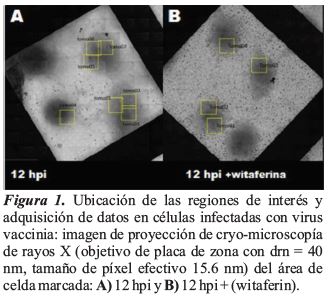
Las rejillas de carbón se prepararon con las muestras de células infectadas por VV a 12 hpi (horas post-infección) y 12 hpi ((horas post-infección)) + (witaferin), se cargaron las rejillas por la superficie de cobre a temperatura ambiente durante 1 minuto. Se vitrificaron las muestras, mediante congelación rápida por inmersión en un robot EM-CPC (Leica, CNB, España), usando etano líquido refrigerado con nitrógeno (± 178 ºC). Las rejillas vitrificadas se mantuvieron a temperatura de nitrógeno líquido en un contenedor para almacenamiento antes de la recolección de datos.
Cryo-Tomografía de rayos X
Las rejillas congeladas se observaron mediante microscopía fluorescente de luz visible en un microscopio DMI6000B (Leica, CNB, España). Las muestras seleccionadas se transfirieron al microscopio de rayos X HZB (línea de haz U41 en el anillo de almacenamiento de electrones BESSY II (Berlín, Alemania) (Schneider et al., 2007) para registrar series de inclinación de ± 65º a 2.43 nm de longitud de onda (energía de fotones E = 510 eV), con un condensador tipo capilar de vidrio elipsoidal de un solo rebote fabricado por Xradia520 Versa (Zeng et al., 2008) con una distancia de trabajo de aproximadamente 5 mm y un tamaño de punto focal de aproximadamente 1 μm FWHM (ancho completo a la mitad máximo) (Guttmann et al., 2009). Para cryo-XT se utilizó una ampliación de 2305 veces correspondiente a un tamaño de píxel de imagen de 8.68 nm a 510 eV de energía de fotones.
Alineación y Reconstrucción.
La alineación de las series inclinadas se realizó con el paquete de software IMOD, herramienta para analizar y visualizar datos de imágenes biológicas tridimensionales (Kremer, Mastronarde, & McIntosh, 1996), y las reconstrucciones finales se realizaron utilizando la opción de reconstrucción iterativa con el programa TOMO3D para permitir realizar ajustes precisos (Agulleiro & Fernández, 2011).
RESULTADOS
Cartografía de la infección por virus Vaccinia mediante microscopía correlativa de luz suave y rayos X.
El flujo de trabajo establecido, permitió ubicar las células infectadas mediante crio-microscopía fluorescente ligera. La obtención de imágenes por cryo-XT fue sencilla después del ajuste del foco para cada área. Las áreas adecuadas para la tomografía se seleccionaron en función de su densidad promedio y alto contraste. En estas áreas, los virus se encontraron fácilmente como objetos redondeados. Inclinar la muestra hasta 65º permitió obtener imágenes bien contrastadas donde los virus aún eran claramente reconocibles. Se adquirieron varios tomogramas de la misma célula para obtener un tomograma de células enteras durante 12 hpi y 12 hpi + (witaferin) (Figura 1).
Organización de las fábricas virales y sus componentes de ensamblaje en el citoplasma de las células infectadas con el virus de la Vaccinia basadas en la tomografía de rayos X.
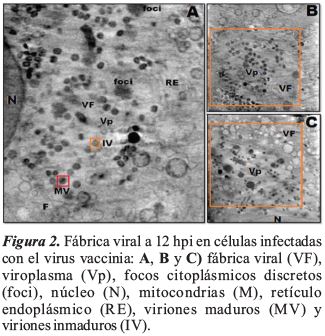
Las células infectadas por VV a 12 hpi mostraron un desplazamiento de mitocondrias y el reticulo endoplasmático en regiones distantes del núcleo, generando una cavidad que acomoda la fábrica de virus y la región de viroplasma. Se observó la aparición de focos citoplásmicos discretos de ADN (foci), también estructuras filamentosas denominadas filamentos de actina (F) y un alto grado de vacuolización y de vesículas intracelulares en células infectadas por VV. La Figura 2 y 3, muestra el área de ensamblaje del VV y la formación de las fábricas virales.
Las áreas estudiadas revelaron la presencia de diferentes formas asociadas a vaccinia, incluyendo partículas inmaduras tempranas (Figura 4A) que comprenden las semilunas iniciales y los denominados viriones inmaduros (IV) (Figura 4B).
Formación de filamentos de actina en el citoplasma de las células infectadas con el virus vaccinia.
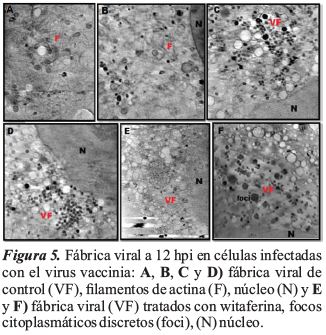
Se realizó un ensayo con células BSC40 infectadas con VV, tratadas y no tratadas con wiferina a 12 hpi, para determinar el efecto de la wiferina sobre la replicación viral y la producción de viriones. En las células BSC40 tratadas con witaferina, la presencia de filamentos de actina intracelular desapareció, (Figuras 5E y 5F).
DISCUSIÓN
La incorporación de la Crio-Tomografia de rayos X, al análisis de materiales biológicos se basa en la posibilidad de penetrar grandes volúmenes celulares (hasta 10 μm) para recuperar información química y estructural a resoluciones intermedias entre la luz y el microscopio electrónico. La combinación de métodos basados en la preparación de muestras criogénicas y la adquisición de imágenes a bajas temperaturas ha llevado a la reconstrucción tridimensional de células congeladas que revelan sus estructuras internas (Chichón et al., 2012). Este estudio es un intento de obtener información sobre la posibilidad para detectar características estructurales relativamente pequeñas dentro del citoplasma de células enteras para fábricas virales y sus componentes de ensamblaje en el citoplasma de células infectadas con VV.
Los cryo-tomogramas de rayos X de células infectadas con VV, mostraron varios organelos celulares bien conservados, cuyas estructuras eran fácilmente reconocibles como los observados en el estudio realizado en microscopia por Harkiolaki et al. (2018). Las células infectadas por VV a 12 hpi mostraron un desplazamiento de mitocondrias y retículo endoplasmático en regiones distantes del núcleo, generando una cavidad donde se acomoda la fábrica de virus y la región de viroplasma. Se observaron la aparición de focos citoplásmicos discretos de ADN (focis), también estructuras filamentosas denominadas filamentos de actina (F) y un alto grado de vacuolización y de vesículas intracelulares en células infectadas por VV. La síntesis de ADN de poxvirus generalmente puede detectarse dentro de las 2 h posteriores a la infección y se produce en el citoplasma dentro de sitios juxtanucleares discretos llamados fábricas o factorias virales. Se puede formar una fábrica o factoria viral de virus a partir de un solo virión, y la cantidad de fábricas es proporcional a la multiplicidad de infección (Moss, 2007). Sin embargo, la coalescencia de las fábricas individuales ocurre con frecuencia con el tiempo (Katsafanas & Moss, 2007). Las fábricas son inicialmente compactas y están rodeadas por membranas de retículo endoplásmico (Tolonen, Doglio, Schleich, & Krijnse-Locker, 2001); se ha sugerido un papel para las membranas en la replicación del ADN (Schramm & Krijnse-Locker, 2005). La fábrica también es el sitio de transcripción y traducción de ARNm virales además del ensamblaje del virión (Katsafanas & Moss, 2007).
El montaje y la maduración de VV es un proceso complejo que implica reorganizaciones drásticas de los componentes estructurales. El análisis de tales eventos intracelulares complejos es técnicamente exigente, y se han sugerido varias hipótesis diferentes a lo largo de los años para dar cuenta de los datos experimentales sobre morfogénesis obtenidos principalmente por microscopía electrónica. Hemos realizado un estudio de cryo-XT, para obtener una visión profunda de las partículas virales intracelulares en proceso de maduración (estadios de IV a VM). Además, el uso de procedimientos tomográficos nos permitió seguir estructuras y membranas en tres dimensiones a través de todo el volumen reconstruido, lo que revela la continuidad de los elementos estructurales sin los problemas de interpretación que surgen por la superposición derivada de los análisis bidimensionales convencionales de secciones delgadas.
El nivel de resolución alcanzado en cryo-XT es tal que ha sido posible detectar regiones citoplasmáticas modificadas por la infección viral (factorias virales), así como dos tipos distintos de partículas virales, las IV y las MV, de particular interés en el contexto de este estudio. Los viriones inmaduros (IV) con aproximadamente 350 nm de diámetro, llenas de material viroplásmico y viriones maduros (MV), que son formas infecciosas de aproximadamente 255 nm de diámetro; estos resultados están relacionados con los observados por Chichon et al. (2009), donde el análisis tomográfico de la primera partícula del ensamblaje VV, el IV, muestra partículas redondeadas con un diámetro cercano a 350 nm rodeado por una envoltura consistente con una sola membrana, esta membrana está cubierta en el lado convexo por una capa gruesa (10 nm) de espículas, construida por la proteína D13L.
Tales observaciones nos llevan a proponer que un pequeño número de semilunas independientes puedan interactuar entre sí para encerrar el volumen de un elipsoide incompleto en el área de la fábrica viral, alcanzando la forma y el tamaño característicos de las IV. Esta propuesta es consistente con la observación de partículas de tipo IV formadas por membranas de tipo media luna no fusionadas en mutantes que carecen de la proteínaA14L, identificados como una proteína de envoltura abundante de la primera forma infecciosa de VV (Rodriguez et al., 2006). Las regiones superpuestas entre semilunas vecinas evolucionarían eventualmente hacia una fusión parcial para producir laIV. El cierre parcial inherente a la estructura IV podría explicar la inestabilidad intrínseca de estas partículas que ha impedido hasta ahora su purificación. Chichon et al. (2012), ha intentado con éxito limitado diferentes enfoques para obtener fracciones enriquecidas de IV, solo en las células permeabilizadas después del tratamiento con toxina (estreptolisina-O) fueron posible obtener muestras con IV frágiles que muestran contactos extensos con membranas celulares.
Uno de los aspectos, que aún no está claro en la morfogénesis de VV es la presunta transformación de una partícula inmadura con una sola membrana (IVN) a un virión maduro (MV) con una sola membrana externa y otra única membrana interna alrededor del núcleo que contiene ADN (Hollinshead et al., 2001). Para obtener una visión de este proceso de transformación en este estudio, se analizaron los tomogramas por cryo-tomografía que sugieren la existencia presuntiva de partículas con un aspecto intermedio IV-MV, estos resultados están relacionados con los observados por Moss (2007), donde la maduración de IVN hacia viriones maduros se asocia a la presencia de partículas que van desde redondeadas a casi forma de ladrillo, con su contenido interno claramente diferente al de IVN, donde el material condensado relacionado con el ADN se transformó en una morfología de núcleo, en que una membrana interna incompleta estaba delineando una estructura similar a la encontrada en los MV.
La infección viral interfiere en las funciones normales de una célula para optimizar la replicación viral y la producción de viriones. Una observación llamativa de esta conversión es la reconfiguración y reorganización de la actina celular, que afecta a todas las etapas del ciclo de vida viral. La extensión y el grado de reorganización del citoesqueleto varía entre las diferentes infecciones virales, lo que sugiere en este trabajo sobre la posible evolución de estrategias virales, resultados similares fueron observados en HSV-1 por Maurer, Sodeik y Grunewald (2008), detectaron cápsides recién liberadas en proximidad cercana a los filamentos de actina que aparentemente se habían reorganizado tras la estimulación viral para facilitar la entrada de la cápside mediante la eliminación de la barrera del citoesqueleto cortical. Los filamentos de actina se han estudiado extensamente in vitro (Galkin, Orlova, Vos, Schröder, & Egelman, 2015); sin embargo, hay menos información disponible sobre la organización precisa de la red de actina in vivo. Con los avances recientes en cryo-XT, y la importancia de la actina en la replicación viral y la producción de viriones, en este estudio, se realizó un ensayo con células BSC40 infectadas con VV, tratadas y no tratadas con wiferina a 12 hpi, para determinar el efecto del fármaco sobre la replicación viral y la producción de viriones.
En las células BSC40 tratadas con witaferina se observó que la presencia de filamentos de actina intracelular desapareció, lo que sugiere que la witaferina se une a la actina y evita su polimerización y elongación de los filamentos de actina; la replicación no se vio afectada, pero el ensamblaje y la morfogénesis se vieron afectados en las células infectadas con VV, causando viriones mal empaquetados o aberrantes; como resultado, la progresión de la infección viral se vió inhibida. Todavía no está claro cómo interactúan los filamentos de actina en el ensamblaje y la morfogénesis del virus vaccinia; Lehmann, Sherer, Marks, Pypaert, y Mothes (2005), estudiaron el efecto de la infección del virus vaccinia, observando también la reorganización dramática de las fibras de actina a nivel celular.
Asi también, Carlier et al. (1997), en estudios con virus mutantes y fármacos que inhiben la morfogénesis viral, demostró que la forma envuelta intracelular del virus vaccinia (IEV) es responsable de la nucleación de los filamentos de actina. Sin embargo, en otro estudio sobre baculovirus que también polimeriza actina ha demostrado que los filamentos de actina su función es permanecer unidos al virus; aún no está muy bien definido la función de la actina en el virus vaccinia, como tampoco está claro, sobre cómo la actina puede empujar a las membranas y los patógenos (Mueller et al., 2014; Small 2015).
La replicación viral requiere la producción coordinada, el procesamiento y el ensamblaje de proteínas virales y ácidos nucleicos para producir viriones de progenie que se utilizarán para infectar nuevas células. Dependiendo del compartimiento celular en el que se produce la replicación y el ensamblaje, el citoesqueleto tiene funciones interesantes y en ocasiones sorprendentes que no siempre se entienden bien.
CONCLUSIONES
Los cryo-tomogramas de rayos X de células infectadas con VV, mostraron varios organelos celulares bien conservados, permitió detectar fábricas virales, así como dos tipos distintos de partículas virales, los IV y las MV y se observó la existencia presuntiva de partículas con un aspecto intermedio IV-MV.
Se observó, que la witaferina posiblemente se une a la actina y evita su polimerización y elongación, obteniéndose viriones mal empaquetados o aberrantes, que inhibe la progresión de la infección viral.
La cryo-XT, abre una posibilidad interesante para investigar muestras gruesas a nivel sub-celular, así como el estudio del proceso del ciclo de vida viral dentro de las células infectadas, es versátil y cierra la brecha entre la microscopía de luz dinámica y las estructuras de alta resolución obtenidas por cryo-EM de partículas individuales, cristalografía de rayos X y RMN. La principal ventaja de cryo-XT, es la oportunidad de observar los procesos o moléculas en el contexto cercano a la condición nativa a una resolución potencialmente alta.
REFERENCIAS BIBLIOGRÁFICAS
Agulleiro, J., & Fernandez, J. (2011). Fast tomographic reconstruction on multicore computers. Bioinformatics, 27(4), 582–583. doi: 10.1093/bioinformatics/btq692 [ Links ]
Blasco, R., & Moss, B. (1992). Role of cell-associated enveloped vaccinia virus in cell-to-cell spread. Journal of virology, 66(7):4170–4179. Retrieved from http://jvi.asm.org/content/66/7/4170.full.pdf+html [ Links ]
Carlier, M.F., Laurent, V., Santolini, J., Melki, R., Didry, D., Xia, G.X., Hong, Y., Chua, N.H., & Pantaloni, D. (1997). Actin depolymerizing factor (ADF/cofilin) enhances the rate of filament turnover: implication in actin-based motility. The Journal of cell biology, 136(6), 1307-1322. doi: 10.1083/jcb.136.6.1307 [ Links ]
Chao, W., Harteneck, B., Liddle, J., Anderson, E., & Attwood, D. (2005). Soft X-ray microscopy at a spatial resolution better than 15 nm. Nature, 435(7046), 1210–1213. doi: 10.1038/nature03719 [ Links ]
Chichón, F., Rodríguez, M., Pereiro, E., Chiappi, M., Perdiguero, B., Guttmann, P., & Carrascosa, J. (2012). Cryo X- ray nano-tomography of vaccinia virus infected cells. Journal of structural biology, 177(2), 202–211. doi: 10.1016/j.jsb.2011.12.001 [ Links ]
Chichon, F., Rodriguez, M., Risco, C., Fraile-Ramos, A., Fernandez, J., Esteban, M., & Carrascosa, J. (2009). Membrane remodelling during vaccinia virus morphogenesis. Biology of the Cell, 101(7), 401-414. doi: 10.1042/BC20080176 [ Links ]
Cyrklaff, M., Linaroudis, A., Boicu, M., Chlanda, P., Baumeister, W., Griffiths, G., & Krijnse-Locker, J. (2007). Whole cell cryo-electron tomography reveals distinct. PLoS one, 2(5), e420. doi: 10.1371/journal.pone.0000420 [ Links ]
Cyrklaff, M., Risco, C., Fernandez, J., Jimenez, M., Esteban, M., Baumeister, W., & Carrascosa, J. (2005). Cryo- electron tomography of vaccinia virus. Proceedings of the National Academy of Sciences of the United States of America, 102(8), 2772-2777. doi: 10.1073/pnas.0409825102 [ Links ]
Dallo, S., Maa, J., Rodriguez, J., Rodriguez, D., & Esteban, M. (1989). Humoral immune response elicited by highly attenuated variants of vaccinia virus and by an attenuated recombinant expressing HIV-1 envelope protein. Virology, 173(1), 323-329. doi: 10.1016/0042-6822(89)90250-X [ Links ]
Ding, S., Diep, J., Feng, N., Ren, L., Li, B., Ooi, Y. S., ... & Kuo, C. J. (2018). STAG2 deficiency induces interferon responses via cGAS-STING pathway and restricts virus infection. Nature communications, 9(1), 1485. doi: 10.1038/s41467-018-03782-z [ Links ]
Esteban, M. (1984). Defective vaccinia virus particles in interferon-treated infected cells. Virology, 133(1), 220-227. doi: 10.1016/0042-6822(84)90443-4 [ Links ]
Frank, J. (Ed.). (2006). Electron Tomography: methods for three-dimensional visualization of structures in the cell. Springer Science & Business Media. Retrieved from https://books.google.es/books?hl=es&lr=&id=LWx6JKQy34AC&oi=fnd&pg=PA1&dq=Frank,+J.+2006).+Electron+Tomography,+Methods+for+Three-dimensional+Visualization+of+Structures+in+the+Cell.+New+York:+Springer.&ots=RnRR_wlrIP&sig=IAQZUD6bquYLuaulwhvr0weoQvo#v=onepage&q=Frank%2C%20J.%20(2006).%20Electron%20Tomography%2C%20Methods%20for%20Three-dimensional%20Visualization%20of%20Structures%20in%20the%20Cell.%20New%20York%3A%20Springer.&f=false [ Links ]
Galkin, V., Orlova, A., Vos, M., Schröder, G., & Egelman, E. (2015). Near-atomic resolution for one state of F-actin. Structure, 23, 173-182. doi: 10.1016/j.str.2014.11.006 [ Links ]
Gu, W., Etkin, L., Le-Gros, M., & Larabell, C. (2007). X-ray tomography of Schizosaccharomyces pombe. Differentiation, 75(6), 529–535. doi: 10.1111/j.1432-0436.2007.00180.x [ Links ]
Guttmann, P., Zeng, X., Feser, M., Heim, S., Yun, W., & Schneider, G. (2009). Ellipsoidal capillary as condenser for the BESSY full-field X-ray microscope. In Journal of Physics: Conference Series (Vol. 186, No. 1, p. 012064). IOP Publishing. Retrieved from http://iopscience.iop.org/article/10.1088/17426596/186/1/012064/meta#artAbst [ Links ]
Grossegesse, M., Doellinger, J., Fritsch, A., Laue, M., Piesker, J., Schaade, L., & Nitsche, A. (2018). Global ubiquitination analysis reveals extensive modification and proteasomal degradation of cowpox virus proteins, but preservation of viral cores. Scientific reports, 8(1), 1807. doi: 10.1038/s41598-018-20130-9 [ Links ]
Harkiolaki, M., Darrow, M. C., Spink, M. C., Kosior, E., Dent, K., & Duke, E. (2018). Cryo-soft X-ray tomography: using soft X-rays to explore the ultrastructure of whole cells. Emerging Topics in Life Sciences, 2(1), 81-92. doi: 10.1042/ETLS20170086 [ Links ]
Hobbs, S. J., Osborn, J. F., & Nolz, J. C. (2018). Activation and trafficking of CD8+ T cells during viral skin infection: immunological lessons learned from vaccinia virus. Current opinion in virology, 28, 12-19. doi: 10.1016/j.coviro.2017.10.001 [ Links ]
Hollinshead, M., Rodger, G., Van Eijl, H., Law, M., Hollinshead, R., Vaux, D., & Smith, G. (2001). Vaccinia virus utilizes microtubules for movement to the cell surface. Journal of Cell Biology, 154(2), 389-402. doi: 10.1083/jcb.200104124 [ Links ]
Huang, X., Li, S., & Gao, S. (2018). Exploring an optimal wavelet-based filter for cryo-ET imaging. Scientific reports, 8(1), 2582. doi: 10.1038/s41598-018-20945-6 [ Links ]
Jiménez-Lamana, J., Szpunar, J., & Łobinski, R. (2018). New Frontiers of Metallomics: Elemental and Species-Specific Analysis and Imaging of Single Cells. In Metallomics (pp. 245-270). Springer, Cham. doi: 10.1007/978-3-319-90143- 5_10 [ Links ]
Katsafanas, G., & Moss, B. (2007). Colocalization of transcription and translation within cytoplasmic poxvirus factories coordinates viral expression and subjugates host functions. Cell Host Microbe, 2(4): 221–228. doi: 10.1016/j.chom.2007.08.005 [ Links ]
Kremer, J., Mastronarde, D., & McIntosh, J. (1996). Computer visualization of three-dimensional image data using IMOD. Journal of structural biology, 116(1), 71–76. doi: 10.1006/jsbi.1996.0013. [ Links ]
Lau, C., Hunter, M. J., Stewart, A., Perozo, E., & Vandenberg, J. I. (2018). Never at rest: insights into the conformational dynamics of ion channels from cryo‐electron microscopy. The Journal of physiology, 596(7), 1107- 1119. [ Links ]
Lehmann, M., Sherer, N., Marks, C., Pypaert, M., & Mothes, W. (2005). Actin- and myosin-driven movement of viruses along filopodia precedes their entry into cells. The Journal of cell biology, 170(2), 317-325. doi: 10.1083/jcb.200503059 [ Links ]
Liu, R., & Moss, B. (2018). Vaccinia Virus C9 Ankyrin Repeat/F-Box Protein Is a Newly Identified Antagonist of the Type I Interferon-Induced Antiviral State. Journal of virology, 92(9), e00053-18. doi: 10.1128/JVI.00053-18 [ Links ]
Maurer, U. E., Sodeik, B., & Grünewald, K. (2008). Native 3D intermediates of membrane fusion in herpes simplex virus 1 entry. Proceedings of the National Academy of Sciences, 105(30), 10559-10564. doi: 10.1073/pnas.0801674105 [ Links ]
Moss, B. (2007). Poxviridae: The viruses and their replication (Knipe DM, Howley PM ed.). Philadelphia: Lippincott Williams & Wilkins. p. 2905-2946. [ Links ]
Mueller, J., Pfanzelter, J., Winkler, C., Narita, A., Le Clainche, C., Nemethova, M., Carlier, M.F., Maeda, Y., Welch, M.D., Ohkawa, T., & Schmeiser, C. (2014). Electron tomography and simulation of baculovirus actin comet tails support a tethered filament model of pathogen propulsion. PLoS biology, 12(1), e1001765. doi: 10.1371/journal.pbio.1001765 [ Links ]
Parkinson, D., McDermott, G., Etkin, L., Le-Gros, M., & Larabell, C. (2008). Quantitative 3D imaging of eukaryotic cells using soft X-ray tomography. Journal of structural biology, 162(3), 380-386. doi: 10.1016/j.jsb.2008.02.003 [ Links ]
Ploubidou, A., Moreau, V., Ashman, K., Reckmann, I., González, C., & Way, M. (2000). Vaccinia virus infection disrupts microtubule organization and centrosome function. The EMBO journal, 19(15), 3932-3944. doi: 10.1093/emboj/19.15.3932 [ Links ]
Rodriguez, D., Barcena, M., Mobius, W., Schleich, S., Esteban, M., Geerts, W. Locker, J. (2006). A vaccinia virus lacking A10L: viral core proteins accumulate on structures derived from the endoplasmic reticulum. Cellular microbiology, 8(3), 427-437. doi: 10.1111/j.1462-5822.2005.00632.x [ Links ]
Schneider, G. (1998). Cryo X-ray microscopy with high spatial resolution in amplitude and phase contrast. Ultramicroscopy, 75(2), 85–104. doi: 10.1016/S0304-3991(98)000 54-0 [ Links ]
Schneider, G., Guttmann, P., Heim, S., Rehbein, S., Eichert, D., & Niemann, B. (2007, January). X‐Ray Microscopy at BESSY: From Nano‐Tomography to Fs‐Imaging. In AIP Conference Proceedings (Vol. 879, No. 1, pp. 1291- 1294). AIP. doi: 10.1063/1.2436300 [ Links ]
Schramm, B., & Krijnse-Locker, J. (2005). Cytoplasmic organization of poxvirus DNA replication. Traffic, 6(10), 839–846. doi: 10.1111/j.1600-0854.2005.00324.x [ Links ]
Small, J. (2015). Pushing with actin: from cells to pathogens. Biochemical Society Transactions, 43, 84-91. [ Links ]
Tolonen, N., Doglio, L., Schleich, S., & Krijnse-Locker, J. (2001). Vaccinia virus DNA replication occurs in endoplasmic reticulum-enclosed cytoplasmic mini-nuclei. Molecular biology of the cell, 12(7), 2031-2046. doi: 10.1091/mbc.12.7.2031 [ Links ]
Zeng, X., Duewer, F., Feser, M., Huang, C., Lyon, A., Tkachuk, A., & Yun, W. (2008). Ellipsoidal and parabolic glass capillaries as condensers for X-ray microscopes. Applied optics, 47(13), 2376-2381. doi: 10.1364/AO.47.002376 [ Links ]
Zong, C., Xu, M., Xu, L. J., Wei, T., Ma, X., Zheng, X. S., ... & Ren, B. (2018). Surface-Enhanced Raman Spectroscopy for Bioanalysis: Reliability and Challenges. Chemical reviews, 118(10), 4946-4980. doi: 10.1021/acs.chemrev.7b00668 [ Links ]
Artículo recibido: 17-05-2018
Artículo aceptado: 30-09-2018
On line: 29-10-2018