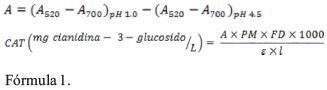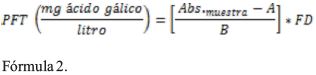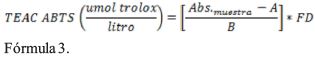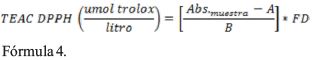Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Altoandinas
versión On-line ISSN 2313-2957
Rev. investig. Altoandin. vol.20 no.4 Puno oct./dic. 2018
http://dx.doi.org/10.18271/ria.2018.419
ARTÍCULO ORIGINAL
Antocianinas, compuestos fenólicos y capacidad antioxidante del mio – mio (Coriaria ruscifolia L)
Characteristics of anthocyanins and bioactive compounds of mio- mio (Coriaria ruscifolia L)
Melquiades Barragán Condori1*, Juan Marcos Aro Aro2, Víctor Justiniano Huamaní Meléndez3, & Raúl Cartagena Cutipa4
1Departamento de Ciencias Básicas, Facultad de Ingenierías, Universidad Nacional Micaela Bastidas de Apurímac, Perú
2Departamento de Agroindustrias, Facultad de Ciencias Agrarias, Universidad Nacional del Altiplano, Puno, Perú
3Departamento de Engenharia e Tecnología de Alimentos, Universidade Estadual Paulista, Brasil
4Departamento de Ing. Agroindustrial, Universidad Privada de Tacna, Perú
*Autor para correspondencia, e-mail: melquim100@hotmail.com
RESUMEN
Frente al creciente incremento de enfermedades cardiovasculares, neurodegenerativos y cancerígenos, es menester el consumo de alimentos con alto poder antioxidante que neutralicen los radicales libres causantes de estas enfermedades. El objetivo de esta investigación fue caracterizar las antocianinas por espectroscopia UV Vis, FTIR-ATR y HPLC, determinar el contenido antocianinas (AT), polifenoles totales (PFT) y capacidad antioxidante en frutos nativos de mio mio (Coriaria ruscifolia L) de Abancay, Apurímac-Perú. Estas determinaciones se efectuaron por métodos de pH diferencial, Folin-Ciocalteu y capacidad antioxidante TEAC ABTS y DPPH. La extracción de pigmentos fue realizada con metanol acidificado con HCl al 0.01%. Los espectros Uv Vis y FTIR mostraron características antociánicas, identificándose por HPLC la cianidina como antocianina mayoritaria. El contenido de (AT) fue de 440.22 (mg cianidina 3-glucosido/100g), PFT de 371.71 (mg ácido gálico/100g), TEAC ABTS 134.40 (µmol trolox/g) y TEAC DPPH 82.70 (µmol trolox/g). En conclusión, los extractos del mio mio corresponden a estructuras antociánicas con una gran capacidad antioxidante, con un futuro promisorio para uso agroindustrial. En este trabajo también se observó correlación significativa entre el contenido de antocianinas totales y la capacidad antioxidante TEAC ABTS.
PALABRAS CLAVES: antocianinas, bioactivos, capacidad antioxidante, polifenoles y radicales libres.
ABSTRACT
The Natural dye demand is growing worldwide. This research is about the extracts of the fruits of (Mio mio) Coriaria ruscifolia L., from which little information is available, but we found in them anthocyanic and polyphenolic compounds which are great interest as bioactive compounds because of their antioxidant capacity. Nowadays, It is known that flavonoids including anthocyanins from (Mio mio) fruit has anticancer properties and other functional properties that made this study a great interest and can be used as a great source of antioxidant as natural dyes. The objective of the present study was to determine the bioactive compounds and antioxidant capacity of (Mio mio) fruit to use in the food industry. The extraction of their pigments were carried out with acidified methanol and into this extract their anthocyanin characteristics were determined by Visible UV spectroscopy, FTIR-ATR, then the composition of their anthocyanins were determined by HPLC. The content of total CAT anthocyanins were determined by diferential pH method. This 440.22 (mg of cyanidin 3-glucoside / 100 g) in addition the total content of polyphenols PFT were quantified using the Folin-Ciocalteu method with 1820.41 (mg gallic acid / 100 g). The antioxidant capacity TEAC - ABTS has also been evaluated with 739.92 (µmoltrolox / 100 g). The results of the bioactive compounds and antioxidant capacity of (mio mio) fruit extracts were notably higher than those reported by diferent similar fruits. This impliesas a conclusion that these fruits can be used as a source of antioxidants in the form of natural dyes. In conclusion, the extracts of (mio mio) correspond to anthocyanin structures with a high antioxidant capacity, with a promising future for agro-industrial use.
KEYWORDS: Antioxidants, anthocyanins, antioxidant capacity, flavonoids, polyphenols and free radicals.
INTRODUCCIÓN
Siendo el Perú un país megadiverso por su amplia variabilidad de ecosistemas y su incomparable ubicación geográfica, es que abunda los frutos denominados mio mio (Coriaria ruscifolia L.), que forma gran parte de la flora silvestre del distrito de Tamburco, Abancay, Apurímac, Perú y crece desde los 2400 – 2900 msnm. Este fruto no es aprovechado en su verdadera dimensión por su potencial como colorante natural y es la razón por el cual el presente trabajo de investigación pretende evaluar y caracterizar dichas propiedades del fruto (Sánchez, et al., 2016). Se encuentra durante casi todo el año, con la más alta producción los meses de marzo a junio, secándose en la propia planta al no tener aprovechamiento, más bien es usado como cercos limítrofes en algunas propiedades del lugar. Los tallos y frutos de este arbusto son usados como tintes naturales para el teñido artesanal de lanas y fibras (Rodríguez, et al., 2017). El interés que se tiene para el estudio de los frutos de este arbusto silvestre son sus compuestos bioactivos cuyo uso debe masificarse como colorante natural para uso en productos agroalimentarios (Cárdenas, Arrazola, & Villalba, 2016).
Se han encontrado trabajos similares con posibles efectos terapéuticos y benéficos para la salud, dentro de los cuales se encuentran la reducción de la enfermedad coronaria, los efectos anticancerígenos, antitumorales, antiinflamatorios y antidiabéticos por sus propiedades antioxidantes en Ganoderma lucidum que posee un elevado potencial nutracéutico y amplia actividad farmacológica (Zavaleta, 2017).
Entre estos compuestos antiradicales están los polifenoles y antocianinas (Arteaga & Arteaga, 2016), siendo estas las propiedades que se buscan en estos frutos del Coriaria ruscifolia L. para su aplicación posterior como colorante natural.
El objetivo de esta investigación fue caracterizar sus antocianinas por espectroscopia UV Vis, FTIR - ATR y HPLC, determinar el contenido de antocianinas, polifenoles totales y su capacidad antioxidante en tres estados de conservación de frutos del mio mio (Coriaria ruscifolia L) como son fresco, congelado y seco.
PARTE EXPERIMENTAL
Material vegetal: Mio mio (Coriaria ruscifolia L), cuyos frutos fueron recolectados en el mes de marzo, en la Provincia de Abancay – distrito de Tamburco (Figura 1), analizados en tres estados de conservación como son fresco, congelado a -4°C a sistema abierto y secado a temperatura ambiente en los laboratorios de Química de la Universidad Nacional de San Antonio Abad del Cusco y la Universidad Micaela Bastidas de Apurímac.
Extracción del pigmento: Se extrajo los pigmentos antociánicos con metanol acidificado al 0.01% HCl. El extracto, se filtró, concentró en rotavapor, luego se centrifugó, decantó y aforó a un volumen conocido para su posterior análisis, purificación y evaluación (Chicaiza & Flores, 2016).
Espectrofotometría UV -Visible: Para obtener el perfil UV Vis de antocianinas presentes en la muestra, se obtuvo una dilución adecuada del extracto para su lectura en el espectrofotómetro UV-Vis Genesys 10S, desde 190 a 1.100 nm de longitud de onda, con una velocidad de barrido de 4.200 nm/minuto, usando como blanco metanol acidificado al 0.01% HCl (Barragan & Aro, 2017).
Espectrometría FTIR - ATR: Los espectros se realizaron en extractos purificados, previamente solidificados a 50°C en una estufa, en luna de reloj de vidrio y luego fue aplicado en forma sólida en el aditamento ATR (Reflectancia total atenuada) del espectrómetro Infrarrojo de Transformada de Fourier FTIR Nicolet iS10, en el rango de infrarrojo medio de 400 a 4000 cm-1. Teniéndose en cuenta los siguientes parámetros de Método standard. Número de barridos de la muestra 32, número de muestras de fondo 32, resolución 4, espaciado 0.482 cm-1, ganancia de la muestra (auto ganancia), velocidad del espejo 0.4747, apertura 80.00, el procesamiento e interpretación de los espectros se realizó usando el software OMNI (Barragan & Aro, 2017).
Cromatografía liquida de alta eficacia HPLC.
El HPLC es el método más común para separar los componentes de una muestra en este caso para identificar las antocianidinas contenidos en los extractos del mio mio, el extracto fue filtrada usando cartucho C-18 y recuperada con metanol acidificado al 0.01% HCl, luego concentrada, aforada a un volumen conocido y analizada por HPLC Agilent Technologies con detector DAD bajo las siguientes condiciones. Columna Eclipse XDB-C18 columna, 4.6 mm x 150 mm 5 µm, temperatura de la columna 30°C, presión de trabajo 200 bar, volumen de inyección 1µL, rango de flujo 0.8 mL/min, fase móvil eluyente A: (Acido fórmico: agua) (1:9); eluyente B: Acetonitrilo, la gradiente utilizada fue: 0-1 min 95% A y 5% de B; 2 min 96% A y 4% B; 20 min 84% A y 16% B y a los 30 min 96%A y 4% B.
La identificación de los picos de HPLC de las antocianidinas en los extractos del mio mio, fueron realizadas en base a la comparación con los cromatogramas a 520 nm de extractos concentrados de antocianidinas de las especies uva y fresa, corridos bajo las mismas condiciones especificadas anteriormente (Del Carpio, Serrano, & Giusti, 2009).
Contenido de antocianinas totales (CAT): El contenido de antocianinas totales se determinó según el método de pH diferencial, el mismo que se basa en el cambio de coloración de las antocianinas de acuerdo al pH en la que se encuentran, quienes presentan más coloración en su forma oxonio a pH 1.0 (KCl 0.025 M) e incoloro en su forma hemiacetal a pH 4.5 (CH3COONa 0.4 M), esta diferencia de color permite la cuantificación de antocianinas mediante la medida de sus absorbancias a diferentes longitudes de onda como son 520 y 700 nm respectivamente usando como blanco agua destilada (Flores, 2017), (Barragán, 2017). Los cálculos se efectúan de la siguiente manera:
Donde A es el cambio en la absorbancia, CAT contenido de antocianinas totales (mg/L), PM masa molecular para cianidina-3-glucósido 449.2 g/mol,εε coeficiente de extinción molar para cianidina-3-glucósido 26900 L/mol.cm, l camino óptico de celda 1 cm, FD factor de dilución.
Análisis de polifenoles totales (PFT): El contenido de polifenoles totales se determinó según el método de Folin Ciocalteu con algunas modificaciones, el cual se basa en la oxidación de compuestos fenólicos con el reactivo Folin Ciocalteu formado por ácido fosfomolibdotúngstico (W+6, Mo+6) de color amarillo en medio ácido, el mismo que al ser reducido a (W+5, Mo+5) por los grupos fenólicos en medio básico, emite un complejo color azul, cuya intensidad medida en absorbancia a 765 nm, Para el contenido de polifenoles se usó como patrón de referencia el ácido gálico desde 0 a 5 (mg/L) cuyo R2 fue 0.969 a partir de la curva de calibración y = 2.701x - 0.0354 (Singleton, Orthofer, & Lamuela-Raventos, 1999),(Guerrero et al., 2010) y (Barragan & Aro, 2017). Los cálculos se efectuaron con la siguiente ecuación.
Donde Abs. muestra es absorbancia de la muestra, A intercepto, B pendiente, FD factor de dilución.
Determinación de capacidad antioxidante TEAC ABTS.
La técnica TEAC ABTS implica primero producir el radical libre del cromóforo ABTS* (ácido 2,2'-azinobis-3- etilbenzotiazolina 6-sulfónico) verde-azul a través de la reacción entre ABTS y el K2S2O8. La adición de antioxidantes al radical ABTS* lo reduce a ABTS cuyo grado de decoloración es medido en absorbancia a 734 nm y expresado como capacidad antioxidante o porcentaje de inhibición del radical catión ABTS*, usando el Trolox como estándar de comparación, bajo las mismas condiciones.
El radical ABTS fue generado haciendo reaccionar una solución de ABTS 7 mM en agua con K2S2O8 2,45 mM en oscuridad durante 12-16 h y cuya absorbancia de este reactante se ajustó 0.700 ± 0.02 a temperatura ambiente a una longitud de onda de 734 nm. Luego se agregan los extractos adecuadamente diluidos a la Solución ABTS* de modo que cuando se añadieron 50 µL del extracto a 3 ml de solución ABTS*, daría una inhibición del 20-80% de absorbancia el mismo que fue leída a 734 nm después de 10 minutos de agregada la muestra. Se construyó una curva de calibración de Trolox midiendo la reducción en la absorbancia de la solución ABTS* en presencia de diferentes concentraciones de Trolox (0-2000 µM). La actividad antioxidante se ha medido comparando con la curva patrón de trolox, cuyos resultados se expresan como equivalentes trolox. TEAC ABTS (µmol trolox/g). Todas las determinaciones fueron realizadas por triplicado (Razali, Razab, Junit, & Aziz, 2008). La capacidad antioxidante equivalente trolox TEAC ABTS se determinó con solución patrón de trolox a partir de curvas de calibración (Re, et al., 1999) cuya ecuación es y = 0.0005+0.359 y R2 fue 0.978. Los cálculos se efectúan con la siguiente ecuación.
Donde Abs. muestra es absorbancia de la muestra, A intercepto, B pendiente, FD factor de dilución.
Capacidad antioxidante método TEAC DPPH. La molécula 1,1-difenil-2-picril-hidrazilo (DPPH) es un radical libre estable en medio metanólico por tener un electrón desapareado sobre su molécula que no se dimeriza. La deslocalización del electrón intensifica su color violeta intenso, el cual absorbe a 515 nm al reaccionar con el sustrato antioxidante, por que éste le dona un átomo de hidrógeno y su color violeta se desvanece, este cambio de color en absorbancia es cuantificado como capacidad antioxidante TEAC DPPH después de 30 a 120 minutos de reacción redox (Mishra, Ojha, & Chaudhury, 2012). Para la determinación de la capacidad antioxidante de los extractos, se han usado como patrón de referencia el trolox desde 100 a 800 (µmol/L) por lo que, tanto los extractos como el estándar actuaron reduciendo el radical DPPH (50 µM) (Brand-Williams, Cuvelier, & Berset, 1995).
A 3.9 mL de solución de DPPH previamente ajustada a absorbancia de 0.700, se le adicionó 100 μL del extracto acuoso diluido o estándar según sea el caso, luego se agitó se dejó por 30 minutos a temperatura ambiente en oscuridad, luego se leyó su absorbancia a 515 nm de longitud de onda. La calibración fue hecha con una solución de trolox y la actividad antioxidante total fue expresada como (µmol trolox/g). Usando el solvente etanol como blanco. La capacidad antioxidante equivalente trolox TEAC DPPH se determinó con solución patrón de trolox cuyo R2 fue 0.9918 y su ecuación y = 0.0008x+0.0101. Los cálculos se efectuaron con la siguiente ecuación (Mamani, Margarita, & Arias, 2011).
Donde Abs. muestra es absorbancia de la muestra, A intercepto, B pendiente, FD factor de dilución.
Análisis estadístico
Los análisis de resultados se procesaron mediante un análisis de varianza y las medias fueron comparadas con la prueba de Tukey usando el software estadístico INFOSTAT y Statgraphics Centurion XVI para correlacion de Pearson. Los resultados se observan en las tablas y figuras de los diferentes métodos de análisis.
RESULTADOS
Espectros UV – Vis de las antocianinas
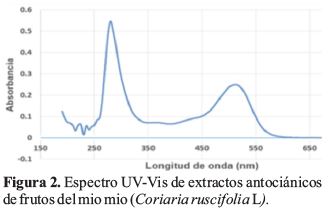
Se determinó el espectro de absorción entre 190 y 700 nm utilizando un espectrofotómetro UV-VIS GENESSYS 10S UV Vis (Thermo Scientific) del extracto hidroalcohólico acidificado del mio mio (Coriaria ruscifolia), (Figura 2).
Espectros FTIR - ATR de las antocianinas
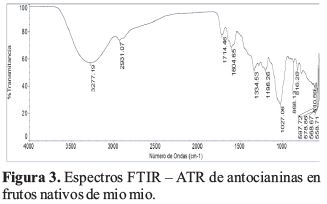
Se determinó los espectros FTIR en extracto previamente secado de frutos nativos de mio mio en el espectrómetro infrarrojo con accesorio ATR, siendo los espectros resultantes la Figura 3.
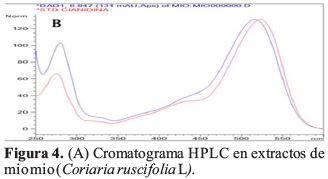
(B) Espectro UV Vis de extractos de mio mio comparada con antocianidinas obtenidas a partir de los frutos de uva morada y fresa.
Contenido de antocianinas totales (AT)
Los resultados de los análisis de contenido de antocianinas totales (AT) se tienen en las Tabla 1.
ontenido de polifenoles totales (PFT)
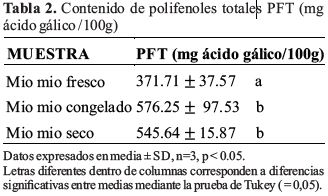
Los resultados de los análisis de contenido de polifenoles totales PFT se tienen en las Tabla2.
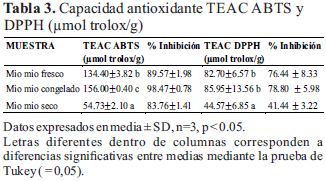
Capacidad antioxidante equivalente de trolox TEAC ABTS y DPPH
Los resultados se expresaron de acuerdo con sus iniciales en inglés como Capacidad Antioxidante en Equivalentes Trolox (TEAC) por el método ABTS y DPPH como en la Tabla 3.
DISCUSIÓN
De los espectros UV – Vis de las antocianinas
Los espectros Uv Visible (Figura 2) presentan bandas de absorción características en la región Uv entre (250 y 370 nm) y visible (500 a 545 nm). La absorbancia en esta última banda varía con el pH del medio, y permite identificar la presencia de antocianinas presentes (Guerra & Ortega, 2006), (Arencibia, 2018).
La posición de estas bandas (Figura 2) entre 500-550 nm (Banda I), además de otras de menor intensidad entre 430- 440 nm y 270-280 nm (Banda II) corresponden a antocianinas (Bedascarrasbure, Maldonado, Fierro, & Alvarez, 2006).
De los espectros FTIR - ATR de las antocianinas
Los espectros FTIR ATR en la matriz analizada tienen características de absorción C=O entre 1680 y 1640, aromáticos entre 1600 y 1500 y la de -OH quelatado (ο-hidroxicetona a 3500-3200, que indican la presencia de estos grupos funcionales propias de una posible estructura antociánica (Pavia, Lampman, Kriz, & Vyvyan, 2008).
De los cromatogramas de HPLC
Una vez comparado todos los picos del cromatograma HPLC (Figura 4) de los frutos del mio mio con los obtenidos de uva morada y fresa, se identificaron que los espectros UV-Vis antes citados se corresponden a los estándares de cianidina que fue retenida en un tiempo 6.549 y 6.944 min, indicando la presencia de esta antocianidina en los frutos del mio mio. En forma similar han encontrado por HPLC, cianidina en antocianinas de capulí (Prunus serotina spp capuli (Cav) Mc. Vaug Cav) y cheqche (Berberis boliviana L) respectivamente, presentándose en el capulí como antocianidina mayoritaria (Del Carpio, et al., 2009). Se puede observar la determinación del contenido de antocianinas, polifenoles totales y su capacidad antioxidante equivalente trolox en comparación de otros frutos similares encontrados para cada determinación.
Del contenido de antocianinas totales (AT)
En investigaciones de contenido de antocianinas totales (AT) en frutos, se tienen resultados de 200 y 416 (mg cianidina 3-glucosido/100g peso fresco) en extractos de mortiño y elderberry respectivamente(Muñoz et al., 2008), (Bridle & Timberlake, 1997), siendo estos valores inferiores a los encontrados en frutos del mio mio de 440.22 (mg cianidina 3- glucosido/100g peso fresco)(Tabla 1), los mismos que se incrementan a 1102.88(mg cianidina 3-glucosido/100g peso seco) cuando los frutos se congelan a -4 °C y disminuyen a 236.96(mg cianidina 3-glucosido/100g) cuando estos frutos se secan por la degradación de las antocianinas por efecto de la senescencia de los mismos.
Del contenido de polifenoles totales (PFT)
Se han efectuado la cuantificación de polifenoles totales PFT de 245 y 297 (mg ácido gálico/100g de peso fresco) en pulpa de Wild berries Rosehip y Mora Rubus glaucus Benth a (-4°C) respectivamente (Guerrero et al., 2010), (León & Elisa, 2012), siendo estos valores similares o menores a los encontrados en frutos del mio mio (Tabla2) de 371.71 (mg ácido gálico / 100g de peso fresco), el mismo que se incrementa al secar y congelar a (-4°C) a 545.64 y 576.25 (mg ácido gálico/100g de peso fresco) respectivamente, con respecto al mio mio fresco.
De la capacidad antioxidante equivalente de trolox TEAC ABTS y DPPH
Existen trabajos de investigación de determinación de capacidad antioxidante TEAC ABTS de 86.94 y 117.83 (µmol trolox/g de muestra fresca) en frutos de mortiño y mora (Rubus glaucus Benth) respectivamente (León & Elisa, 2012) y (Gaviria et al., 2009), que son inferiores a los encontrados en el mio mio (Tabla 3) que fue de 134.40 (µmol trolox/g de muestra fresca) 156.00 (µmol trolox/g) en congelada a -4°C y 54.73 (µmol trolox/g) en muestra seca, siendo inferior esta última porque el efecto del secado de frutos del mio mio disminuyen su capacidad antioxidante.
Se han encontrado investigaciones de capacidad antioxidante TEAC DPPH de 24.04 y 125.69 (µmol trolox/g de muestra fresca) en frutos de mortiño y mora (Rubus glaucus Benth) respectivamente (León & Elisa, 2012) y (Gaviria et al., 2009), que son similares e inferiores a los encontrados en el mio mio que fue de 82.70 (µmol trolox/g de muestra fresca) 85.95 (µmol trolox/g) en congelada a -4°C y 44.57 (µmol trolox/g) en muestra seca.
Las posibilidades de uso de los frutos del (Coriaría ruscifolia L) son inmensas como colorantes naturales en uso agroindustrial (Girón, Martínez, Hurtado, Cuaran, & Ocampo, 2016), dado que presenta una gran cantidad de antocianinas como se ha demostrado, además como sustancias anticancerígenas (Aguirre, Nattier, & Benites Carranza, 2017) por que presenta una gran cantidad de sustancias bioactivas antociánicas y polifenólicas, además de dar valor agregado a la comercialización y consumo masivo de estos frutos como alimentos funcionales (Cárdenas et al., 2016) y su aplicación de estos colorantes en diferentes alimentos procesados como colorante en yogures, colorantes en salchichas (Aro et al., 2015), como antioxidante en aceites (Cutimbo, Aro, & Vivanco, 2016), etc.
CONCLUSIONES
Mediante los espectros UV-vis se identificaron, que los extractos del mio mio presentan pigmentos antociánicos, mientras que los espectros FTIR ATR determinaron grupos funcionales que corresponden a compuestos polifenólicos. Por HPLC se identificó que la antocianina mayoritaria en estos frutos es la cianidina.
El contenido de antocianinas totales en extractos del mio mio (Coriaria ruscifolia L) fue de 440.22 (mg cianidina 3- glucosido/100g), polifenoles totales de 371.71 (mg ácido gálico/100g), capacidad antioxidante equivalente trolox TEAC ABTS de 134.40 (µmol trolox/g) y TEAC DPPH de 82.70 (µmol trolox/g).
AGRADECIMIENTO
Agradecer a la Escuela Profesional de Ing. Agroindustrial de la Universidad Nacional Micaela Bastidas de Apurímac Perú, por facilitar los materiales y equipos de laboratorio para la ejecución del trabajo de investigación.
REFERENCIAS BIBLIOGRÁFICAS
Aguirre, A., Nattier, S., & Benites Carranza, C. Y. (2017). Efecto del fruto de myrciaria dubia (h.b.k) mcvaugh sobre cáncer colorrectal inducido en rattus norvegicus var. albinus. http://dsapce.unitru.edu.pe/handle/UNITRU/7437 [ Links ]
Aro, J. M. A., Rojas, E. G., Cutimbo, M. C., Jara, R. S., Velazco, C. S., & Copa, C. U. E. (2015). Evaluación de la eficacia de extractos antioxidantes de maíz morado (Zea mays L.) en la inhibición de salchichas. Revista Investigaciones Altoandinas, 17(1), 17-22. [ Links ]
Arteaga, A., & Arteaga, H. (2016). Optimización de la capacidad antioxidante, contenido de antocianinas y capacidad de rehidratación en polvo de arándano (Vaccinium corymbosum) microencapsulado con mezclas de hidrocoloides. Scientia Agropecuaria, 7(SPE), 191-200. [ Links ]
Barragán Condori, M. (2017). Evaluación del efecto de la temperatura del proceso de cocción, sobre el contenido de antocianinas y antioxidantes en variedades de papas nativas (Solanum tuberosum spp andigena y Solanum tunerosum spp stenotomun). http://repositorio.unsaac.edu.pe/handle/UNSAAC/3137 [ Links ]
Barragan Condori, M., & Aro Aro, J. M. (2017). Determinacion del efecto de procesos de coccion en papas nativas pigmentadas (Solanum tuberosum spp. andigena) sobre sus compuestos bioactivos. Revista de Investigaciones Altoandinas, 19, 47-52. [ Links ]
Bedascarrasbure, E., Maldonado, L., Fierro Morales, W., & Alvarez, A. (2006). Propóleos. Caracterización y normalización de propóleos argentinos. Revisión y actualización de composición y propiedades. Ediciones Magna. San Miguel de Tucuman Argentina. 218 pag. [ Links ]
Brand-Williams, W., Cuvelier, M.-E., & Berset, C. (1995). Use of a free radical method to evaluate antioxidant activity. LWT-Food science and Technology, 28(1), 25-30. [ Links ]
Bridle, P., & Timberlake, C. (1997). Anthocyanins as natural food colours—selected aspects. Food chemistry, 58(1), 103-109. [ Links ]
Cárdenas Baquero, G. D., Arrazola Paternina, G., & Villalba Cadavid, M. (2016). Frutas tropicales: fuente de compuestos bioactivos naturales en la industria de alimentos. Ingenium, 17(33).
Cutimbo, M. C., Aro, J. M. A., & Vivanco, Z. L. T. (2016). Evaluación de la eficacia de antioxidantes de Isaño (Tropaeolum tuberosum Ruiz&Pavón) en la oxidación de Aceite de Soya. Revista de Investigaciones Altoandinas, 18(2), 143-150. [ Links ]
Chicaiza, V. G., & Flores, E. A. (2016). Evaluación de extracción, encapsulación y capacidad antioxidante de las antocianinas de la flor de Jamaica (Hibiscus sabdarifa L.). https://bdigital.zamorano.edu/bitstream/11036/5760/1/AGI-2016-T015.pdf [ Links ]
Del Carpio Jiménez, C., Serrano Flores, C., & Giusti, M. (2009). Caracterización de las antocianinas de los frutos de Berberis boliviana Lechler. Revista de la Sociedad Química del Perú, 75(1), 76-86. [ Links ]
Flores, E. (2017). Extracción de Antioxidantes de las Bayas del Sauco (Sambucus nigra L. subsp. peruviana) con Ultrasonido, Microondas, Enzimas y Maceración para la obtención de Zumos Funcionales. Información Tecnológica, 28(1), 121-132. [ Links ]
Gaviria, C. A., Ochoa, C. I., Sánchez, N., Medina, C., Lobo, M., Galeano, P. L., . . . Rojano, B. (2009). Propiedades antioxidantes de los frutos de agraz o mortiño (Vaccinium meridionale Swartz). Perspectivas del cultivo de agraz o mortiño en la zona altoandina de Colombia. Universidad Nacional de Colombia, 95-112. [ Links ]
Girón, J. M., Martínez, J. A., Hurtado, L. G., Cuaran, J. D., & Ocampo, Y. A. (2016). Pigmentos vegetales y compuestos naturales aplicados en productos cárnicos como colorantes y/o antioxidantes. http://dx.doi.org/10.26620/uniminuto.inventum.11.21.2016.51-62 [ Links ]
Guerrero, J., Ciampi, L., Castilla, A., Medel, F., Schalchli, H., Hormazabal, E., . . . Alberdi, M. (2010). Antioxidant capacity, anthocyanins, and total phenols of wild and cultivated berries in Chile. Chilean Journal of Agricultural Research, 70(4), 537-544. [ Links ]
Hurtado, N. H., & Pérez, M. (2014). Identificación, estabilidad y actividad antioxidante de las antocianinas aisladas de la cáscara del fruto de capulí (Prunus serotina spp capuli (Cav) Mc. Vaug Cav). Información Tecnológica, 25(4), 131-140. [ Links ]
León, S., & Elisa, D. (2012). Estudio del potencial antioxidante de la mora (Rubus glaucus Benth) y sus cambios en función del proceso de maduración y bajo diferentes temperaturas de almacenamiento. Universidad Nacional de Colombia. http://bdigital.unal.edu.co/10581/ [ Links ]
Lillo, A., Carvajal-Caiconte, F., Nuñez, D., Balboa, N., & Alvear Zamora, M. (2016). Cuantificación espectrofotométrica de compuestos fenólicos y actividad antioxidante en distintos berries nativos del Cono Sur de América. Revista de Investigaciones Agropecuarias, 42(2), 168-174. [ Links ]
Martínez-Cruz, N. d. S., Arévalo-Niño, K., Verde-Star, M. J., Rivas-Morales, C., Oranday-Cárdenas, A., Núñez- González, M., & Morales-Rubio, M. (2011). Antocianinas y actividad anti radicales libres de Rubus adenotrichus Schltdl (Zarzamora). Revista Mexicana de Ciencias Farmacéuticas, 42(4), 66-71. [ Links ]
Muñoz, C., Maihua, R., Peralta, F., Tereschuk, M., Gonzales, M., & Albarracin, P. (2008). Análisis de antocianinas en arándanos del Noa. Universidad Nacional de Tucumán. Departamento de Ingeniería de Procesos y Gestión Industrial. Argentina. [ Links ]
Pavia, D. L., Lampman, G. M., Kriz, G. S., & Vyvyan, J. A. (2008). Introduction to spectroscopy. www.cengagebrain.com.mx/shop/isbn/9781285460123 [ Links ]
Re, R., Pellegrini, N., Proteggente, A., Pannala, A., Yang, M., & Rice-Evans, C. (1999). Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine, 26(9), 1231- 1237. [ Links ]
Rodríguez Rodríguez, E. F., Rodríguez Sevilla, S., Paredes Pizarro, Y., Rimarachín Cayatopa, V., Pollack Velásquez, L., Rodríguez Espejo, M. R., & Aguirre Tocas, R. (2017). Vegetales tintóreos promisorios más utilizados en la región La Libertad, Perú. Arnaldoa, 24(1), 311-332. http://dx.doi.org/10.22497/arnaldoa.241.24114 [ Links ]
Rosero, R. J., & San Juan, D. P. (2017). Extracción y caracterización de los principios activos fenólicos con actividad antioxidante a partir de residuos de aguacate: epicarpio y semilla (Persea americana). www.sired.udenar.edu.co/3884 [ Links ]
Sánchez Hernández, D. J., Fortis Hernández, M., Esparza Rivera, J. R., Rodríguez Ortiz, J. C., de la Cruz Lazaro, E., Sánchez Chávez, E., & Preciado Rangel, P. (2016). Empleo de vermicompost en la producción de frutos de melón y su calidad nutracéutica. Interciencia, 41(3).
Soto-Vásquez, M. R. (2016). Metabolitos secundarios, cuantificación de fenoles y flavonoides totales de extractos etanólicos de propóleos de tres localidades del Perú. In Crescendo, 6(2), 22-32. [ Links ]
Zavaleta Chavez, S. Y. (2017). Propiedades nutracéuticas y farmacológicas de Ganoderma lucidum (Hongo Reishi). http://dspace.unitru.edu.pe/handle/UNITRU/10081 [ Links ]
Artículo recibido: 12-03-2018
Artículo aceptado: 30-09-2018
On line: 29-10-2018