Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Altoandinas
versión On-line ISSN 2313-2957
Rev. investig. Altoandin. vol.20 no.4 Puno oct./dic. 2018
http://dx.doi.org/10.18271/ria.2018.423
REPORTE DE CASO
Estacionalidad de las especies de aves residentes y migratorias altoandinas en el lado peruano de la cuenca del Titicaca
Seasonality of the species o resident birds and migratory high andian on the Peruvian lake of the basin Titicaca
Víctor Pulido Capurro1*
1Instituto de Investigación de la Universidad Inca Garcilaso de la Vega, Lima, Perú
*Autor para correspondencia, e-mail: vpulidoc@uigv.edu.pe
RESUMEN
Las aves que habitan en la cuenca del Titicaca tienen una amplia distribución que comprende, cordilleras, pajonales de puna y el Lago Titicaca reconocido por la Convención Ramsar como Humedal de Importancia Internacional. En el presente trabajo se han registrado 135 especies comprendidas en 17 órdenes 33 familias y 83 géneros. Con respecto a la estacionalidad, 95 especies son residentes y 40 provienen de otras latitudes, de las cuales 17 especies son migratorias neárticas, 10 especies migratorias australes, y 13 especies realizan migraciones verticales desde los Andes peruanos hacia la región costera. Por el tiempo que pasan en la mayor parte de los ambientes, 81 especies son terrestres, 45 acuáticas y 9 en vuelo. Los resultados obtenidos han determinado que las especies de aves residentes pasan todo el año en la cuenca del Titicaca: las migratorias nearticas desde setiembre a marzo, las migratorias australes entre abril a agosto y las que realizan migraciones altitudinales hacia la región costera, de mayo a agosto.
PALABRAS CLAVES: cuenca del Titicaca, aves altoandinas, migraciones, nearticas, australes.
ABSTRACT
The birds that habit in the basin of Titicaca lake have a wide distribution which includes, mountain ranges and "pajonales of puna". The Titicaca lake is recognized by the Ramsar Convention as Wetland of International Importance. In the present work, 135 species comprised in 17 orders, 33 families and 83 genders have been registered. With regard to seasonality, 95 species are residents and 40 are from other latitudes, of which 17 species are Nearctic migrants, 10 migratory species come from the Austral Region, and 13 species make vertical migrations from The Peruvian Andes to the coastal region. For the time they spend in most environments, 81 species are terrestrial, 45 aquatic and 9 in flight. Therefore, the results obtained have determined that the species of resident birds spend all year in the Titicaca basin: the neartic migrants from September to March, the austral migratory birds between April and August and those that make altitudinal migrations to the coastal region, from May to August.
KEYWORDS: Titicaca basin, high Andean birds, migrations, neartic, austral.
INTRODUCCIÓN
Las aves que habitan el altiplano andino tienen una amplia distribución que comprende, la Meseta del Collao rodeada por la Cordillera Carabaya por el norte y la Cordillera Occidental por el sur oeste, y el LagoTiticaca, que tiene una antigüedad de aproximadamente 3 millones de años, en estrecha relación con el emergimiento de la Cordillera de los Andes (Dejoux y Iltis, 1991). El Lago Titicaca reconocido por la Convención Ramsar como Humedal de Importancia Internacional y un Área Importante para la Conservación de lasAves - IBA 097- Ramis y Arapa, cubre más de 8300 kilómetros cuadrados y se extiende 190 km de noroeste hacia sudeste (Dejoux, 1994). El clima de la región es frío y seco, con variaciones bien marcadas de hasta 30 °C entre el día y la noche; dos estaciones climáticas bien diferenciadas: el invierno con noches frías, pero con días soleados y de intensa luminosidad y el verano que es la época de lluvias (Beltrán-Farfán et al., 2015).
En estas condiciones extremas viven un grupo importante de aves altoandinas que han llamado la atención de algunos investigadores y cuya información es relevante. Entre ellos están Agassiz y Garman (1875) que reporta 69 especies de aves, Kalinowski quien en 1896 realizó una expedición por Puno, Dorst que entre 1954 y 1955, estudió las aves altoandinas en los alrededores del lago Titicaca, Venero y Brokaw en 1980, Fjeldså y Krabbe en 1990, (Franke, 2007; Gibbons et al., 2011) y otros investigadores en los últimos años como Herzog et al., (2017), en el sector de Bolivia.
Las aves viven en diferentes hábitats en los cuales encuentran las condiciones apropiadas para desarrollar su ciclo de vida, alimentarse, anidar y reproducirse. El uso de los hábitats andinos, presentes en el lago Titicaca, así como los humedales adyacentes, el pajonal de puna y los bosques de Polylepis (Sevillano- Ríos et al., 2018) revisten especial importancia ya que albergan importantes poblaciones de especies de aves residentes y migratorias procedentes de diferentes latitudes.
En los últimos 23 años se han realizado una serie de inventarios que han permitido tener una aproximación sobre el número de especies de aves, con especial énfasis a las residentes, que habitan en la cuenca del Titicaca. Así lo demuestran los estudios efectuados en las lagunas de la Subregión de Puno (Miranda, 1995), el Diagnóstico e Inventario de Recursos Naturales de Flora y Fauna, en el área de la Reserva Nacional del Titicaca y alrededores en el 2001 y la elaboración de la línea base de la diversidad biológica del sitio Ramsar Lago Titicaca (Ministerio de Ambiente 2013), la evaluación de la Laguna Colorada de Lampa (Espejo, 2000), especies asociadas al lago Titicaca, lagos y lagunas de los altos Andes del sur del Perú (Gamarra, 2006; Mamani y Pari, 2014; Gamarra, 2006); laguna de estabilización de Puno (Mamani y Pari, 2014), bahía de Puno (Vásquez, 2017).
Sin embargo, con respecto a los movimientos migratorios altoandinos existen vacíos de información, y por tanto son poco conocidos; a diferencia de las migraciones que ocurren a lo largo de las costas del Pacífico que han sido más estudiadas, tal como lo demuestran la mayor abundancia de investigaciones efectuadas en estas zonas (Butler et al., 1996; García-Olaechea, 2018; Torres et al., 2006; Bayly et al., 2018).
Por tanto, el objetivo de este estudio es determinar la estacionalidad de las especies de aves residentes y aquellas que realizan migraciones horizontales desde la Región Neártica y Región Austral así como las que realizan migraciones altitudinales hacia la región costera, a través de la cuenca del lago Titicaca.
MATERIALES Y MÉTODOS
Área de estudio
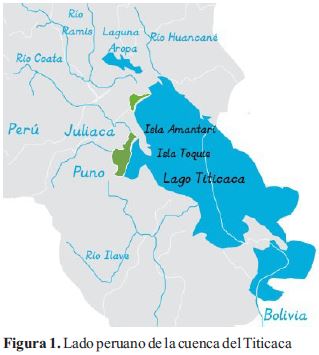
La cuenca del Lago Titicaca tiene un área de 56,168 km2, de los cuales 8,562 km² pertenecen al lago, cuyas tres cuartas partes corresponden a territorio peruano (Fig. 1). El lago tiene un área de 8562 km2, tiene una longitud de 176 km y un ancho máximo de 70; comprende: el lago grande con 6,542 km2 y 283 m de profundidad, el lago pequeño con 1 292 km2 y 45 m de profundidad, y la Bahía de Puno con 564 km2 y 30 m de profundidad. La bahía interior de Puno es un espejo de agua entre los promontorios de Chulluni y Chimu, de casi 4 km de ancho, la profundidad promedio es de 2.4 m y la superficie menor a 2 m de profundidad corresponde al 50% del área total de la Bahía Interior de Puno (Northcote et al., 1991; Ministerio del Ambiente, 2013).
El Lago Titicaca se encuentra sobre una altitud de 3,810 m, tiene un volumen de 903 km3 y en los alrededores donde están los cerros y elevaciones propias del altiplano llega hasta los 4,100 msnm. El Titicaca tiene cinco tributarios principales: los ríos Ramis, Huancané, Coata, Ilave y Suches, siendo los dos primeros los principales afluentes y constituyen el 40% del área de toda la cuenca. El único efluente es el río Desaguadero. La fluctuación anual de los niveles del lago está determinada por una precipitación media anual de 800 mm en los alrededores y 1,400 mm sobre el lago; el máximo nivel se presenta en abril, al final de la época lluviosa, y; el mínimo en diciembre, antes del inicio de las lluvias, con un período seco de mayo a agosto. El relieve y su elevada altitud, hacen que el clima sea frío; pero la presencia del lago constituye una fuente de humedad y efecto termorregulador, en especial de la zona circunlacustre. (Dejoux & Iltis, 1991). La estacionalidad térmica es moderada, con temperaturas relativamente altas de noviembre a febrero y bajas de junio a agosto. Las temperaturas máximas medias mensuales en el lago llega hasta los 16 ºC y las mínimas medias mensuales con valores de –1 ºC y la temperatura ambiental es de 15.3 °C, el pH es ligeramente alcalino y la humedad relativa oscila entre 50 a 65% (Dejoux & Iltis, 1991, Goyzueta et al., 2009).
Identificación de especies
Comprendió los registros de las especies de aves entre los años 2008 y 2018, en los hábitats previamente establecidos para el lago Titicaca: en el área acuática, constituida por el espejo de agua, con zonas litoral y pelágica; y, el área continental, conformada por planicies inundables, deltas de los ríos Ramis, Illpa y Coata, islas, islotes y promontorios emergentes; pajonal de Puna y los bosques de Polylepis. Las evaluaciones comprendieron tanto la época seca como la de lluvias. Para las observaciones de aves, en horas de la mañana de preferencia, se utilizaron binoculares (7 x 35) y la guía de campo de Schulenberg et al., 2007 y para la clasificación taxonómica se siguió a Plenge (2018). Esta información fue complementada mediante registros históricos, tanto los obtenidos por el autor durante los viajes realizados por el altiplano andino como por las fuentes de información bibliográfica (Aparicio, 1957; Venero & Brokaw, 1980; Fjeldså, 1987; Fjeldså & Krabbe, 1990). Las evaluaciones permitieron recoger información sobre la variación estacional de las especies, evidencias de aves en proceso reproductivo y registro de especies migrantes.
RESULTADOS
Composición taxonómica de las aves
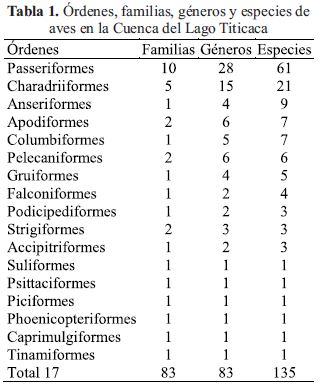
Los registros históricos de las aves, muestran que en la cuenca del Lago Titicaca y alrededores, se han registrado 135 especies de aves, comprendidas en 17 órdenes. El orden con mayor número de familias es el Passeriformes con 10, sigue los Charadriiformes con 5 familias y los Apodiformes, Pelecaniformes y Strigiformes con 2 familias. Con respecto al número de especies, el orden Passeriformes tiene 61 especies, seguido del orden Charadriiformes con 21 especies, continua Anseriformes con 9 especies, Apodiformes y Columbiformes con 7 especies y Pelecaniformes con 6 especies (Tabla 1).
De las 33 familias presentes, la que tiene mayor número de especies es Tyrannidae con 17 y Thraupidae con 16 especies, Furnariidae con 10 especies, Anatidae con 9 especies, Charadriidae y Scolopacidae con 8 especies, Columbidae con 7 especies e Hirundinidae con 6 especies.
El total de géneros es de 83 y los Passeriformes cuentan con el mayor número que es 28, seguido de Charadriiformes con 15, Pelecaniformes y Apodiformes con 6 géneros. Entre los géneros con mayor número de especies se tiene a Muscisaxicola con 11, Anas y Phrygilus con 6, Sicalis y Carduelis con 4.
Registros de la distribución estacional de las aves que habitan en la cuenca del lago Titicaca
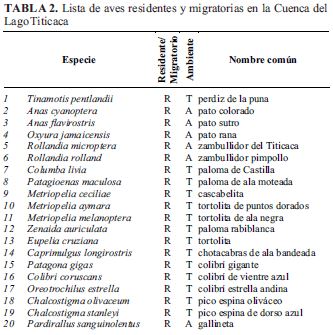
Del total de 135 especies, 95 son residentes y 40 provienen de otras latitudes (Tabla 2).
Las 95 especies residentes, permanecen durante todo el año y realizan su periodo reproductivo en el altiplano de Puno. Se registran especies como: Tinamotis pentlandii la "perdiz de la puna", tres especies de patos (Anas cyanoptera, Anas flavirostris, Oxyura jamaicensis); el zambullidor del Titicaca Rollandia microptera la especie endémica más emblemática, que sólo habita en los totorales en el Lago Titicaca y Rollandia rolland; siete especies de palomas (Columba livia, Patagioenas maculosa, Metriopelia ceciliae, Metriopelia aymara, Metriopelia melanoptera, Zenaida auriculata, Eupelia cruziana), una chotacabras Caprimulgus longirostris; cinco picaflores (Patagona gigas, Colibri coruscans, Oreotrochilus estrella, Chalcostigma olivaceum, Chalcostigma stanleyi); cuatro rállidos (Pardirallus sanguinolentus, Gallinula galeata, Fulica ardesiaca, Porphyrio martinica); siete chorlos y playeros (Charadrius alticola, Gallinago andina, Phegornis mitchellii, Vanellus resplendens, Himantopus mexicanus, Thinocorus rumicivorus, Attagis gayi); Phalacrocorax brasilianus; cuatro garzas (Ardea alba, Bubulcus ibis, Egretta thula, Nycticorax nycticorax); Theristicus melanopis, la "bandurria", ave grande típica de ecosistemas acuáticos altoandinos; cuatro rapaces (Geranoetus polyosoma, Circus cinereus, Falco sparverius, Falco femoralis); tres búhos y lechuzas (Tyto alba, Athene cunicularia, Bubo virginianus); una especie de perico (Psilopsiagon aurifrons); un carpintero (Colaptes rupícola) y 50 especies de passeriformes.
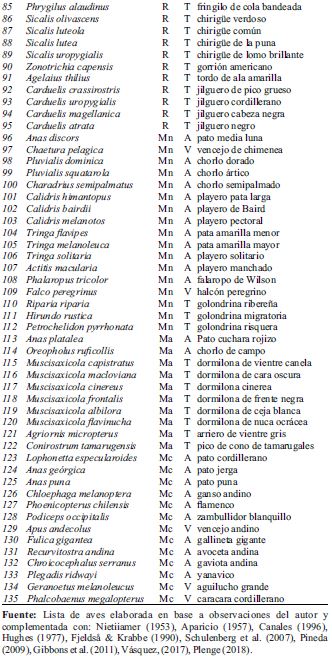
Las especies procedentes de otras latitudes son 40 (Tabla 3) y se dividen en dos grandes grupos: las que realizan migraciones horizontales (migrantes latitudinales): neárticas y australes y las que realizan migraciones verticales (migrantes altitudinales).
Entre las migratorias neárticas, 17 especies, que proceden de la región Boreal (Estados Unidos y Canadá), realizan la migración anual desde setiembre hasta marzo, en la época de invernada que corresponde en el hemisferio sur: Anas discors, Chaetura pelagica, Pluvialis dominica, Pluvialis squatarola, Charadrius semipalmatus, Calidris himantopus, Calidris bairdii, Calidris melanotos, Tringa flavipes, Tringa melanoleuca, Tringa solitaria, Actitis macularia, Phalaropus tricolor, Falco peregrinus, Riparia riparia, Hirundo rustica, Petrochelidon pyrrhonata.
Las migratorias que provienen de la región Austral, son 10 especies que se han registrado durante los meses de mayo, junio, julio y agosto y generalmente se reproducen en tierras de Argentina y Chile: Anas platalea, Oreopholus ruficollis, Muscisaxicola capistratus, Muscisaxicola macloviana, Muscisaxicola cinereus, Muscisaxicola frontalis, Muscisaxicola albilora, Muscisaxicola flavinucha, Agriornis micropterus, Conirostrum tamarugensis.
Y las que realizan migraciones altitudinales, las migratorias andinas, son 13 especies. Si bien se registran durante todo el año, de mayo a agosto el número de especies y de individuos es menor en los Andes peruanos, debido a que se desplazan hacia el Desierto Costero y posiblemente al Bosque Tropical Húmedo en la Amazonia. Así se tiene a: Lophonetta especularoides, Anas georgica, Anas puna, Chloephaga melanoptera, Phoenicopterus chilensis, Podiceps occipitalis, Apus andecolus, Fulica gigantea, Recurvirostra andina, Chroicocephalus serranus, Plegadis ridwayi, Geranoetus melanoleucus, Phalcobaenus megalopterus.
En relación a los registros de las especies por el mayor tiempo que pasan en tierra, agua y aire: 81 especies son de ambientes terrestres, 45 de ambientes acuáticos y 9 están en vuelo, como es el caso de los Apodiformes, Falconiformes y Accipitriformes (Tabla 2).
DISCUSIÓN
Las 135 especies de aves registradas para la zona alto andina, habitan en el pajonal de puna, los bosques de Polylepis sp. y el lago Titicaca que en conjunto dominan el paisaje terrestre y los ambientes acuáticos. Entre las especies que habitan en la cuenca del Titicaca, a las aves acuáticas se les ha dado más énfasis debido a que la mayoría de las investigaciones se han centrado en ellas.
En el lago, los hábitats como los totorales y llachales, las aguas poca profundas, las playas ribereñas fangosas y terrenos circundantes planos, constituyen lugares de gran importancia, donde se concentran las aves residentes y parte del año las migratorias, especialmente los Charadriiformes (Pulido y Bermúdez, 2018). Otro factor que contribuye a las altas concentraciones de aves es el alimento que es obtenido fácilmente, debido a la alta productividad de macrófitas acuáticas, peces, artrópodos, moluscos, crustáceos, platelmintos, anélidos, insectos, etc. (Goyzueta, 2005).
Los inventarios efectuados en diferentes lugares y años, arrojan en general pocas especies. La diversidad de aves para las lagunas de la subregión de Puno (Miranda, 1995; Coila, 2000), fue de 43 especies, pertenecientes a 21 familias y 10 órdenes; y para la Laguna Colorada de Lampa, Puno, 22 especies de aves pertenecientes a 8 órdenes (Espejo, 2000). En los hábitats de los alrededores de la laguna de estabilización se registraron 25 especies residentes y 14 migratorias, y la mayor parte de especies está asociada a los lagos y lagunas de los altos Andes del sur del Perú (Gamarra, 2006). En los totorales de la zona de influencia de la laguna de estabilización de Puno, Mamani y Pari (2014), registraron 38 especies y para las laderas de la Isla el Espinar 28 especies; al igual que Gamarra (2006) reportò 15 especies para una zona con abundante macrófitas. El Ministerio del Ambiente (2013) en la elaboración de la línea base de la diversidad biológica del sitio Ramsar Lago Titicaca, registró 109 especies de aves. En la Bahía de Puno se registró 28 especies de aves y las familias más representativas son Anatidae con 5 especies, Rallidae, Podicipedidae y Scolopacidae con 3 especies, y Ardeidae, Threskiornithidae y Tirannidae con 2 especies (Vásquez, 2017).
Residentes
Las aves residentes permanecen durante todo su ciclo de vida en la región altoandina. En el periodo que corresponde a la época reproductiva los ambientes acuáticos adquieren especial importancia para aves de las Familias Anatidae, Rallidae y Podicipedidae, las cuales anidan en lugares de aguas tranquilas de lagunas y ríos. En este caso, cada laguna representa el territorio de uno o más grupos familiares, con lo que se tiene una mayor área de reproducción para diferentes especies lo que favorece la territorialidad y por lo tanto disminuyen los conflictos entre ellas.
Uno de los investigadores más importantes de las aves altoandinas fue el biólogo francés Jean Dorst, que entre 1954 y 1955, en la Estación Altoandina de Biología fundada por Hernando de Macedo en la Hacienda Checayani, cerca del lago Titicaca, efectuó colectas y observaciones sobre biogeografía, biología, ecología, reproducción y adaptaciones de las aves, y puso especial énfasis en el carpintero andino Colaptes rupicola, picaflor estrella andina Oreotrochilus estella, picaflor estrella de pecho negro Oreotrochilus melanogaster, picaflor oreja violeta de vientre azul Colibri coruscans, picaflor pico espina oliváceo Chalcostigma olivaceum y el picaflor gigante Patagona gigas (Franke, 2007).
Otros investigadores han contribuido con aportes sobre determinadas especies residentes que llegan hasta rangos altitudinales muy altos como es el caso de: Oxyura jamaicensis, en su distribución andina llega hasta 4500 m de altitud, aunque en marzo de 2008 se observó a un solo individuo en la Laguna Sibinacocha, en la Provincia de Canchis en el Cuzco a 4850 m, extendiendo el rango de elevación conocido de esta especie por 350 m (Gibbons et al., 2011). Rollandia rolland es registrada entre los 3200 m a los 4500 m (Schulenberg et al., 2007); y un ejemplar fue observado a 4850 m en la Laguna Sibinacocha (Cuzco). Gallinula galeata se reconoce que llega hasta los 4400 m en los Andes de Perú (Schulenberg et al., 2007); aunque cinco ejemplares fueron vistos cerca de Nuñoa en Puno, en marzo del 2008 a 4600 msnm (Gibbons et al., 2011). Metriopelia aymara (Schulenberg et al., 2007) su distribución geográfica en los Andes presenta algunos vacios de información en los departamentos de Junín y Ayacucho; pero una pareja fue observada cerca de Astobamba en Julio de 2007 a 4550 m; registro que podría representar un rango de distribución o dispersión de individuos o movimientos migratorios (Gibbons et al., 2011). Bubo virginianus sus límites altitudinales son conocidos hasta 4400 m; Gibbons et al., (2011) colectaron un espécimen a 4750 m en Junín; y han notado variación geográfica en las vocalizaciones de esta especie, pero indican que las evidencias son insuficientes para determinar si hay variación a nivel de subespecies. Chalcostigma olivaceum está distribuida irregularmente en los Andes peruanos desde Ancash hasta el noroeste de Junín, Cusco, Apurímac y Puno; esta especie fue observada alimentándose de flores de Gentianella sp. cerca de Astobamba a 4660 m y Abra Chonta a 4750 m, donde no había sido registrado previamente (Schulenberg et al., 2007). Geositta tenuirostris ocurre entre los 2650 m y 4200 m (Schulenberg et al., 2007) y de los 2500 a 4600 m (Fjeldså & Krabbe, 1990); a esa misma altura se ha registrado a Geositta cunicularia en zonas áridas rocosas. Asthenes humilis el canastero, Schulenberg et al. (2007) y Fjeldså & Krabbe (1990) la registran en la zona sur del Titicaca, y, a 4700 m de altura al oeste de Puno. Phrygilus alaudinus observado en Puno a 4565 m (Gibbons et al., 2011). Otro estudio efectuado por Ramírez et al. (2007) en la zona del altiplano en Ajnaco, en pajonales de puna y tola, registró 23 especies de aves, todas residentes, pero ninguna de ellas migratoria. No obstante, es necesario abundar en nuevas investigaciones porque algunas de estas especies podrían ser migrantes australes.
Con respecto a los bosques de Polylepis, Martínez & Villarte (2009), para Bolivia, cerca de la frontera con Perú, reportaron 20 especies típicas asociadas, de las cuales 17 especies han sido registradas en el presente estudio (Buteo polyosoma, Metriopelia melanoptera, Zenaida auriculata, Colibri coruscans, Patagona gigas, Colaptes rupicola, Cinclodes atacamensis, Notiochelidon cyanoleuca, Troglodytes aedon, Turdus chiguanco, Catamenia analis, Phrygilus plebejus, Phrygilus unicolor, Sicalis olivascens, Zonotrichia capensis y Conirostrum cinereum; así mismo señalan que Carduelis atrata fue registradas en la categoría de afinidad estrecha para los bosques de Polylepis según Fjeldså & Kessler (1996, 2004), citado por Martínez & Villarte (2009).
Un tipo adicional de desplazamientos altitudinales no definidos concierne a las aves residentes que van de un lugar a otro en el Altiplano en busca de alimento, especialmente en la época de sequía; ellas llegan a diferentes lagunas, de acuerdo a la disponibilidad y abundancia de sus alimentos preferidos, y cuya ocurrencia depende en general de características ambientales favorables (Ramírez et al., 2007). Estos desplazamientos han sido observados desde 1896 en que Kalinowski llega a Puno, a los alrededores del Lago Titicaca y realiza recorridos, sobre la ruta de Moquegua hasta Titire y al lago de Pahara, en donde encontró a Rhea darwini, Phoenicoparrus jamesi, y Recurvirostra andina, aves que, en ese entonces, aún no se conocían desde el Perú (Franke, 2007).
Así mismo Aparicio (1957), mencionó 20 especies que no han vuelto a ser reportados, debido a que ellas responden a una extensa distribución, en el Altiplano, las cordilleras, otros ambientes acuáticos, y que no han vuelto a ser observadas nunca o muy raramente en el lago. Estas especies no han sido registradas en los inventarios de los últimos años probablemente a dificultades en su identificación o a un problema de sinonimia no esclarecido oportunamente. Del mismo modo, las pocas observaciones acerca de los desplazamientos altitudinales de las aves sea uno de los factores que incidan en que no se tenga un conocimiento más preciso acerca de los movimientos de corta y larga distancia de las especies que habitan la región altoandina; más aún si la cuenca del Titicaca no constituye un ecosistema aislado con una avifauna particular, sino que forma parte de una compleja red de hábitats terrestres y acuáticos. Al respecto, McKinnon & Love (2018) plantearon la necesidad de evaluar zonas extensas teniendo en cuenta que las aves presentes en todas las lagunas cercanas son consideradas en su conjunto como una unidad.
Migratorias neárticas
Algunas especies migratorias neárticas, utilizan alternativamente la ruta altoandina en su migración; ellas pasan su época reproductiva al norte del trópico de cáncer y la época de invernada en América del Sur (Rappole et al., 2013). Estas especies llegan en primavera e influyen directamente en el incremento de la riqueza y abundancia de los ensambles de aves en los humedales; por lo tanto la riqueza como la abundancia de este particular grupo de aves disminuirá hacia el otoño, época en que comienza el retorno migratorio hacia el norte. El periodo en que las aves emprenden las rutas migratorias las convierte en vulnerables ante las amenazas ambientales, lo que tiene efectos directos sobre la supervivencia de sus poblaciones (Bayly, et al., 2018). Lo que sucede en esta época, que es prioritario para su conservación, carece de buena parte de información relevante en relación a aspectos básicos de su ecología, distribución, comportamiento y uso de hábitat en la época no reproductiva para cada especie (Fuller & Wainwright, 2018).
Entre las aves migratorias neárticas se encuentran especies de las Familias Anatidae, Charadriidae, Scolopacidae, que se alimentan en zonas limosas, barrosas, orillas de lagos y ríos, totorales, etc. En los meses de setiembre, noviembre, enero y marzo, se reportan mayor número de especies con la llegada de las aves migratorias neárticas (Torres et al., 2006). Al respecto Vásquez (2017), señaló que las migratorias neárticas, registran mayor abundancia en setiembre en la bahía interior de Puno y en Ojerani, con un leve descenso en diciembre.
Canales (1996) reportó cuatro especies de migratorias neárticas para la zona de Chejona en el Lago Titicaca: Tringa melanoleuca, Tringa flavipes, Calidris bairdii y Phalaropus tricolor. En la bahía interior de Puno, ha sido registrado Tringa melanoleuca (Vasquez, 2017), pero también ha sido observada hasta los 4790 m en Sibinacocha, Cusco, en abril, lo que indicaría que es el mes en que inicia el retorno de la migración hacia Norte América. En 1990 en la zona de Chejona fueron observados 79 ejemplares de Tringa melanoleuca y 120 ejemplares de Tringa flavipes (Canales, 1996). Los limites altitudinales de Tringa flavipes llegan hasta los 4800 m y ha sido registrada en Junín y Moquegua durante el verano austral; en los Andes es más común que Tringa melanoleuca.
El playero pectoral Calidris melanotos es un migrante neártico muy común en las turberas de la puna. Fjeldså and Krabbe (1990) la registraron hasta los 4500 m y observaron 16 ejemplares sobre los 4600 m durante el verano austral del año 2009 en Puno. Y Canales (1996) reportó para la zona de Chejona 49 ejemplares de Calidris bairdii.
Lobo y Fabiana (2017) y Bodrati y Ferrari (2014) brindaron nuevos registros de especies en humedales altoandinos, donde un hallazgo novedoso es Charadrius semipalmatus; una especie migratoria que cría en la tundra ártica o subártica en suelos con grava bien drenada o en terrenos con vegetación espesa, que utiliza la ruta mediterránea además de la línea de costa; llega regularmente a las costas de Buenos Aires y Tierra del Fuego en primavera y verano, donde frecuenta estuarios, bahías, llanuras intermareales y playas. Se alimenta de moluscos acuáticos, crustáceos, moscas, escarabajos y arañas lo que indicaría que la ruta del corredor del Titicaca es muy importante, para las migratorias neárticas procedentes de Norteamérica.
El falaropo común (Phalaropus tricolor) migratoria neártica, nidifica en humedales con vegetación poco profunda en Norteamérica; se alimenta de pequeños crustáceos, larvas y adultos de insectos (Vuilleumier, 2009; De la Peña y Salvador, 2016). En los Andes de Junín a Moquegua llega hasta los 4800 m el verano austral (Fjeldså y Krabbe, 1990; Schulenberg et al., 2007). En su ruta migratoria en el interior del continente, utilizan lagos salados o cuerpos de agua, y en el lago Titicaca se ha registrado en 1990, 1,200 ejemplares diariamente en la zona de Chejona (Canales, 1996); y decenas de miles en el lago Titicaca (Vuilleumier, 2009), en el trayecto hacia el interior del continente en Argentina y ocasionalmente hasta las Islas Malvinas en primavera-verano (Olrog, 1979; Vuilleumier, 2009).
Pluvialis squatarola, que viene desde Canadá, aparece regularmente en invierno (agosto-setiembre) en las orillas del lago para irse antes del verano (diciembre). Sin embargo, Pluvialis dominica llega al lago Titicaca procedente de la región Ártica en la primavera y se va a invernar en abril a la Patagonia (Aparicio, 1957).
La migración de aves procedentes de la región Neártica, presentan un patrón de variación estacional bien definido; de setiembre a marzo el número de especies migratorias es mayor que en los meses de junio, julio y agosto; tal como ha sido reportado para otras zonas del Perú; y por tanto la cuenca del Titicaca se convierte en lugar importante de paso de aves migratorias hacia la Patagonia.
Migración austral
Las migratorias australes que generalmente se reproducen en tierras de Argentina y Chile, llegan a la cuenca del Titicaca entre mayo y agosto. La migratoria austral Oreopholus ruficollis cuya distribución es incierta, ha sido registrada en los Departamentos de Ancash, Junín, Lima y Puno (Fjeldså and Krabbe, 1990); sin embargo las observaciones de Aparicio (1957) señalan que deja las orillas del lago en el mes de octubre y vuelve al extremo sur del continente. Para Anthus furcatus su distribución es por parches en los Andes del sur del Perú y se le registra en Junín, Cusco y Puno. En el caso de Muscisaxicola capistratus dos ejemplares fueron colectados en Puno a 4460 m, 24 km de San Antonio de Esquilache; es una especie frugívora y un caso muy interesante teniendo en cuenta el estudio realizado por Boyle y Conway (2007), que explora el papel de la dieta como un precursor evolutivo de la migración. Esta hipótesis establece que las aves que realizan migraciones de larga distancias así como la de movimientos altitudinales pronunciados se les encuentra en hábitats secos, son frugívoros o nectarívoros. Estos rasgos ecológicos predisponen a estas especies para migraciones de larga distancia o altitudinales, dado que estos recursos son estacionales y eventuales, y las especies que los explotan deben desplazarse para encontrarlos. Las observaciones en especie frugívoras, confirman adicionalmente que las especies que se alimentan regularmente de fruta, pueden ser útiles para desentrañar el papel de los determinantes ecológicos en los desplazamientos de las especies de tyranidos altoandinos (Gibbons et al., 2011). Así mismo las investigaciones de Rakhimberdiev et al. (2018) señalan que las poblaciones de aves migratorias, procedentes del Ártico donde los cambios climáticos son más fuertes, no siempre logran coincidir la época de reproducción con la fenología local de los recursos; por lo tanto eso se expresa en el bajo rendimiento reproductivo y en la disminución de las poblaciones. De tal manera que estas observaciones ilustran lo limitado de los análisis que involucran los estudios de la ecología de las especies, cuando falta información básica sobre su historia natural.
Adicionalmente, un estudio realizado en Bolivia por Martínez & Rechberger (2007) señalan que Thraupis bonariensis, Zonotrichia capensis son consideradas migratorias australes.
Migratorias altitudinales
La migración vertical de las aves implica movimientos estacionales anuales en las diferentes gradientes altitudinales. Aunque muchas especies de aves que habitan en los Andes participan en la migración altitudinal, los patrones estacionales de estos desplazamientos son poco conocidos. La mayoría de las migratorias altitudinales son migrantes parciales, ya que realizan movimientos de descenso hacia áreas no reproductivas. Sin embargo, los patrones espaciales y temporales, la frecuencia y la previsibilidad de la migración a nivel individual y poblacional y los factores ecológicos que determinan el comportamiento de las especies, varían considerablemente (Boyle, 2017).
Algunas especies que habitan regularmente en los Andes emprenden migraciones hacia los humedales costeros o los ríos del Bosque Tropical Húmedo, durante el invierno Austral, entre mayo y agosto; que coincide con época de sequía en zonas más altas, con el descenso pronunciado de las temperaturas. Esta observación ya había sido señalada por Dorst desde 1956, cuando se refería a que una importante migración altitudinal de las aves altoandinas de la puna, sucedía entre abril y setiembre; el cual asociaba a la época seca que es cuando se produce la reducción del hábitat disponible, debido al congelamiento de los espejos de agua en algunas localidades y también disminuye la disponibilidad de alimentos (Franke, 2007). De allí, la necesidad de comprender los patrones de variación de las migraciones altitudinales debido a las amenazas ambientales que afectan a los ecosistemas andinos.
Los reportes para algunas especies mencionan a: los "flamencos" Phoenicopterus chilensis que han sido observados hasta los 4850 m de altura en lagunas de los departamentos de Moquegua y Puno (Schulenberg et al., 2007) y llegan a la costa durante el invierno, en bandadas de algunos cientos de ejemplares a la Reserva Nacional de Paracas y otros humedales costeros como el Santuario Nacional de las Lagunas de Mejía, el Refugio de Vida Silvestre de Pantanos de Villa y el Estuario de Virrila. El yanavico Plegadis ridwayi habita en los humedales altoandinos, desde el Perú central hasta el extremo norte de Argentina y Chile; presenta poblaciones de hasta 129 individuos para la bahía interior de Puno; es una especie indicadora de mala calidad del hábitat, tal como lo demuestran los estudios de Gamarra (2006); en la costa ha sido registrada en el Santuario Nacional de las Lagunas de Mejía, Refugio de Vida Silvestre de Pantanos de Villa (Pulido, 2018); González et al. (1999), encontró cuatro nidos con pichones en islas de Tipha dominguensis. Anas puna habita entre 3000 y 4600 m y también ha sido reportada en humedales de la costa (Schulenberg et al., 2007). Geranoetus melanoleucus registrado en la Bahía de Puno, Isla Flotante Uru San Miguel, Lago Chucuito (Titicaca), puna húmeda, (Richard, 2013), de amplia distribución en costa y vertientes occidentales.
CONCLUSIONES
Con respecto a la estacionalidad, de las 135 especies registradas, 95 son residentes y 40 provienen de otras latitudes, que se dividen en dos grandes grupos: las de migraciones horizontales y las de migraciones altitudinales. Las que realizan migraciones horizontales, en el periodo setiembre a marzo están las neárticas con 17 especies; y las migratorias australes, que generalmente se reproducen en tierras de Argentina y Chile, con 10 especies y la migración hacia la cuenca del Titicaca es entre abril y agosto. Y las migraciones altitudinales con 13 especies migratorias andinas que desde los Andes peruanos se desplazan hacia la región costera o amazónica, entre mayo y agosto.
En relación a los registros de las especies por el tiempo que pasan en la mayor parte de los ambientes, 81 especies son de ambientes terrestres, 45 de ambientes acuáticos y 9 están en vuelo, la mayor parte del tiempo.
Finalmente, estos patrones de migración establecidos indican que hay una sincronización entre ellas. Mientras las residentes están todo el año en la cuenca del Titicaca, las migratorias neárticas llegan en setiembre para volver en marzo a Norteamérica; en abril están llegando las australes y están volviendo en agosto hacia el sur del continente en la Patagonia; mientras tanto un patrón todavía no muy definido indicaría que entre mayo a agosto las migratorias longitudinales se desplazan hacia la costa en las vertientes occidentales de los Andes.
REFERENCIAS BIBLIOGRÁFICAS
Agassiz, A. & Garman, S. W. (1875). Exploration of Lake Titicaca, Bulletin of the Museum of Comparative Zoology. 15, 349-359. [ Links ]
Aparicio, M. (1957). Aves del lago Titicaca. Universidad Nacional Técnica del Altiplano, Puno: 120 p. [ Links ]
Bayly, N.J., Rosenberg, K.V., Easton, W.E., Gómez, C., Carlisle, J., Ewert, D.N., Drake, A., Goodrich, L. (2018). Major stopover regions and migratory bottlenecks for Nearctic-Neotropical landbirds within the Neotropics: A review. Bird Conservation International (1), 1-26. [ Links ]
Beltrán Farfán D.F., R.P. Palomino Calli, E.G. Moreno Terrazas, C.G. Peralta y D.B. Montesinos Tubée. (2015). Calidad de agua de la bahía interior de Puno, lago Titicaca durante el verano del 2011. Revista Peruana de Biología 22(3), 335–340. doi: 10.15381/rpb.v22i3.11440 [ Links ]
Bodrati A. & Ferrari C. (2014). Notas sobre 36 especies de aves nuevas o poco conocidas para la provincia de La Rioja, Argentina. Nuestras Aves 59, 30-42. [ Links ]
Boyle, W. A. & Conway, C. J. (2007). Why migrate? A test of the evolutionary precursor hypothesis. American Naturalist 169, 344-359. [ Links ]
Boyle, W. A. (2017). Altitudinal bird migration in North America. The Auk 134(2), 443–465. doi.org/10.1642/AUK- 16-228.1 [ Links ]
Butler, R., F. Delgado, H. De La Cueva, V. Pulido & Sandercock, B. (1996). Migration Routes of the Western Sandpiper. Wilson Bull., 108(4), 662-672. [ Links ]
Canales, A. G. (1996). Migratory bird activity in the bay of Lake Titicaca, Puno, Peru. International Wader Studies 8(1) 62. [ Links ]
Coila Q. R. (2000). Evaluación poblacional de aves de importancia socioeconómica en tres sectores de la bahía interior de la ciudad de Puno. Tesis para optar el título de Licenciado en Biología. Facultad de Ciencias Biológicas de la Universidad Nacional del Altiplano, Puno, Perú. 42 p. [ Links ]
De la Peña, M. R. & Salvador, S. (2016). Aves argentinas: descripción, comportamiento, reproducción y distribución. Charadriidae a Trochilidae. Comunicaciones del Museo Provincial de Ciencias Naturales "Florentino Ameghino" (Nueva Serie) 20, 1-627. [ Links ]
Dejoux, C. (1994). Lake Titicaca. In K. Martens, B. Goddeeris & G. Coulter (eds), Speciation in Ancient Lakes, Arch. Hydrobiol. Beih. Ergebn. Limnol. 44, 35-42. [ Links ]
Dejoux, C. & Iltis, A. (1991). El Lago Titicaca: Síntesis del conocimiento limnológico actual. Hisbol - ORSTON, La Paz – Bolivia. 584 p. [ Links ]
Espejo, C. (2000). Aves silvestres alto andinas en la laguna colorada y su preferencia de hábitat Lampa Puno. Tesis para optar el título de Licenciado en Biología. Facultad de Ciencias Biológicas de la Universidad Nacional del Altiplano, Puno, Perú. 88 p. [ Links ]
Fjeldså, J. (1987). Birds of the relict forest in the high Andes of Perú and Bolivia. Zoological Museum. Copenhagen 64 p. [ Links ]
Fjeldså, J. & Krabbe, N. (1990). Birds of the high Andes. Copenhagen: Zoological Museum, University of Copenhagen, and Svendborg, Denmark: Apollo Books. 876 p. [ Links ]
Franke I. (2007). Historia de la ornitología peruana e importancia de las colecciones científicas de aves. Revista Peruana de Biología 14(1), 159-164. [ Links ]
Fuller, R. A., & Wainwright, C. E. (2018). Secrets of intercontinental flight. Nat Ecol Evol. 2(10), 1523-1524. doi: 10.1038/s41559-018-0693-1 [ Links ]
Gamarra, P. C. (2006). Evaluación de aves en la zona de influencia de la laguna de estabilización de Puno. Examen de suficiencia para optar el título de licenciado en Biología de la Facultad de Ciencias Biológicas de la Universidad Nacional del Altiplano Puno Perú. 46 p. [ Links ]
García-Olaechea, Á. G., Chávez-Villavicencio, C. L., & Tabilo-Valdivieso, E. L. (2018). ¿Influyen las aves migratorias neárticas en el patrón estacional de aves de los humedales costeros? Revista Peruana de Biología 25(2), 117-122. doi: 10.15381/rpb.v25i2.13281 [ Links ]
Gibbons, R., Benham, P. & Maley, J. (2011). Apuntes sobre aves de los altos Andes de Perú. Ornitología Colombiana 11, 76-86. [ Links ]
González, O, A. Tello & L. Torres. (1999). El Yanavico Plegadis ridwayi de migratorio andino a residente de la costa peruana. Cotinga II: 64-66. [ Links ]
Goyzueta, G. (2005). Majestuoso lago Titicaca, fuente de vida. Editorial FIMART SAC. Lima – Perú. 39 p. [ Links ]
Goyzueta, C. G., Alfaro, T. R. & Aparicio, S. M. (2009). Totorales del lago Titicaca, importancia, conservación y gestión ambiental. Primera Edición. Editorial Meru diseño y publicidad, Puno – Perú. 325 p. [ Links ]
Herzog, S.K., R.S. Terrill, A.E. Jahn, J.V. Remsen, Jr., O. Maillard Z., V.H. García-Solíz, R. Macleod, A. Maccormick & J.Q. Vidoz. (2017). Aves de Bolivia: Guía de campo. Asociación Armonía, Santa Cruz de la Sierra. 501 p. [ Links ]
Lobo, I. & Fabiana, C. (2017). Primer registro de Charadrius semipalmatus (Charadriiformes: Charadriidae) y nuevo registro de Phalaropus tricolor (Charadriiformes: Scolopacidae) en la provincia de La Rioja, Argentina Acta Zoológica Lilloana 61(2), 157–160. [ Links ]
Mamani, M. & Pari, D. (2014). Diversidad de aves en los alrededores de la laguna de estabilización de Puno. Revista. Investig. (Esc. Post Grado) 5(3), 41-50. [ Links ]
Martínez O. & F. Villarte (2009). Estructura dasométrica de las plantas de un parche de Polylepis besseri incarum y avifauna asociada en la Isla del Sol (Lago Titicaca, La Paz - Bolivia). Ecología en Bolivia 44(1), 36-49. [ Links ]
Martínez O. & Rechberger J. (2007). Características de la avifauna en un gradiente altitudinal de un bosque nublado andino en La Paz, Bolivia. Revista Peruana de Biología, 14(2), 225-236. [ Links ]
McKinnon, E. & Love, O. (2018). Ten years tracking the migrations of small landbirds: Lessons learned in the golden age of bio-logging. The Auk 135(4), 834-856. 2018. [ Links ]
Ministerio del Ambiente (2013). Línea base ambiental de la cuenca del Lago Titicaca, Viceministerio de Gestión Ambiental, Dirección General de Calidad Ambiental. Lima 77 p. [ Links ]
Miranda, O. (1995). Comunidad de aves en tres ecosistemas acuáticos alto andinos de la subregión Puno. Tesis para optar el título de Licenciado en Biología. Facultad de Ciencias Biológicas de la Universidad Nacional del Altiplano, Puno, Perú. 63 p. [ Links ]
Northcote, T., Morales, P., Levy, D. & Greaven, M. (1991). Contaminación en el Lago Titicaca. Wetswater Research Center. University of British Columbia. IAA- Puno. Perú. 278 p. [ Links ]
Olrog, C. C. (1979). Nueva lista de la avifauna Argentina. Opera Lilloana, Fundación Miguel Lillo 27, 1-324. [ Links ]
Plenge, M. (2018). List of the birds of Peru / Lista de las aves del Perú. Unión de Ornitólogos del Perú: https:77sites.google.com/site/boletinunop/checklist [ Links ]
Pulido V. (2018). Ciento quince años de registros de aves en Pantanos de Villa. Revista Peruana de Biología, 25(3), 291-306. doi: 10.15381/rpb.v25i3.15212. [ Links ]
Pulido, V. & Bermúdez, L. (2018). Estado actual de la conservación de los hábitats de los Pantanos de Villa, Lima, Perú. Arnaldoa 25(2), 679-702. [ Links ]
Rakhimberdiev, E., Duijns, S., Karagicheva, J., Camphuysen, C. J., Dekinga, A., Dekker, R., Piersma, T. (2018). Fuelling conditions at staging sites can mitigate Arctic warming effects in a migratory bird. Nature Communications 9(1), 1-10 doi: 10.1038/s41467-018-06673-5 [ Links ]
Ramírez, O., Arana, M., Bazán, E. Ramírez, A. & Cano, A. (2007). Assemblages of bird and mammal communities in two major ecological units of the andean highland plateau of Southern Peru. Ecología Aplicada 6 (1,2), 139-14. [ Links ]
Rappole, J.M. (2013). The avian migrant. The biology of bird migration. Columbia University Press, Nueva York. 436 pp. ISBN: 978-0231146784. [ Links ]
Richard, E. (2013). Nuevas localidades para el águila mora (Geranoaetus melanoleucus) en el altiplano de La Paz y Oruro, Bolivia y área circumlacustre del lago Titicaca (Bolivia y Perú) EcoRegistros Revista 3(9), 36-40. [ Links ]
Schulenberg, T. S., D. F. Stotz, D. F. Lane, J. P. O'Neill & T. A. Parker III. (2007). Birds of Peru. Princeton University Press, Princeton, New Jersey, USA. 664 pp. [ Links ]
Sevillano-Ríos, C.S. RodewalD, A. & L. Morales. (2018). Ecología y conservación de las aves asociadas con Polylepis: ¿qué sabemos de esta comunidad cada vez más vulnerable? Ecología Austral 28, 216-228 [ Links ]
Torres M.; Quinteros Z. & F. Takano. (2006). Variación temporal de la abundancia y diversidad de aves limícolas en el refugio de vida silvestre Pantanos de Villa, Perú. Ecología Aplicada 5(1-2), 119-125. [ Links ]
Vásquez, Y. (2017). Efectos de la eutrofización en el hábitat de la bahía de Puno, en la diversidad y abundancia de avifauna del lago Titicaca. Tesis para optar el título de Licenciado en Biología. Facultad de Ciencias Biológicas de la Universidad Nacional del Altiplano, Puno, Perú. 66 p. [ Links ]
Venero, J. L. & Brokaw, H. P. (1980). Ornitofauna de Pampa Galeras, Ayacucho, Perú. Publicaciones del Museo de Historia Natural Javier Prado, Serie A 26,1-32. [ Links ]
Vuilleumier F. (2009). Birds of North America. First American Edition. DK Publishing, New York, pp 742. [ Links ]
Artículo recibido: 02-04-2018
Artículo aceptado: 28-09-2018
On line: 29-10-2018