Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de Investigaciones Altoandinas
versión On-line ISSN 2313-2957
Rev. investig. Altoandin. vol.21 no.2 Puno abr./jun. 2019
http://dx.doi.org/10.18271/ria.2019.455
ARTÍCULO ORIGINAL
Efecto de los reguladores de crecimiento vegetal en la multiplicación y enraizamiento in vitro de senecio calvus (asteraceae), planta medicinal altoandina, endémica del Perú
Effect of plant growth regulators in the in vitro multiplication and rooting of senecio calvus (asteraceae), high-andean medicinal plant, endemic to Peru
Yenilda Laguna-Ibarra1 , Jhonny Cueva-López1 , Carmen Tamariz-Angeles1 & Percy Olivera-Gonzales1*
1Laboratorio de Biología de la Universidad Nacional Santiago Antúnez de Mayolo Huaraz, Perú
* Autor para correspondencia: poliverag@unasam.edu.pe
Yenilda Laguna-Ibarra : https:/orcid.org/0000-0002-2113-592X
Jhonny Cueva-López : https://orcid.org/0000-0003-0625-3167
Carmen Tamariz-Angeles : https://orcid.org/0000-0001-5252-2757
Percy Olivera-Gonzales : https://orcid.org/0000-0002-8263-5901
RESUMEN
Se realizó la propagación in vitro de Senecio calvus como una alternativa para su conservación. Las yemas se desinfectaron con HgCl2 (0.01 y 0.1%) con y sin adición periódica de antibióticos. El medio de cultivo Murashige & Skoog (1/2) más sacarosa 2%, fitagel 0.3% y pH 5.7 fue suplementado con bencilaminopurina para la multiplicación; mientras que para el enraizamiento se usó ácido naftalenacético o ácido giberélico. Se agregaron tratamientos sin regulador de crecimiento. Para la aclimatación se evaluaron dos sustratos naturales. El mayor porcentaje de desinfección se obtuvo con HgCl2 0.1% por 5 minutos con aplicación de rifampicina (72 µg·mL-1) y nistatina (200 µg·mL-1) cada tres días por 18 días. La bencilaminopurina incrementó la sobrevivencia de las yemas introducidas y el porcentaje de plantas con brotes; pero no se encontró diferencias significativas en el número de brotes por planta. El ácido giberélico tuvo efecto positivo sobre el enraizamiento mientras que el ácido naftalenacético indujo la formación de callos. El mejor sustrato para la aclimatación fue tierra + musgo (1:1).
PALABRA CLAVE: Acido giberélico, ácido naftalenacético, Asteraceae, Bencilaminopurina, cultivo in vitro
ABSTRACT
In vitro propagation of Senecio calvus was carried out as an alternative for its conservation. The buds were disinfected with HgCl2 (0.01 and 0.1%) with and without periodic addition of antibiotics. Murashige and Skoog culture medium (1/2) plus 2% sucrose and 0.3% phytagel 0.3%, and pH 5.7 was supplemented with benzylaminopurine for multiplication; while for the rooting naphthaleneacetic acid or gibberellic acid were used. Treatments without growth regulator were added. For acclimation two natural substrates were evaluated. The highest percentage of disinfection was obtained with 0.1% HgCl2 for 5 minutes adding rifampicin (72 μg·mL-1) and nystatin (200 μg·mL-1) every three days per 18 days. Benzylaminopurine increased the survival of the introduced buds and the percentage of shooted plants; however the number of shoots per plant did not show significant differences. Gibberellic acid had a positive effect on rooting while naphthaleneacetic acid induced callusing formation. The best substrate for acclimatization was soil + moss (1: 1).
KEYWORD: gibberellic acid, naphthaleneacetic acid, Asteraceae, benzylaminopurine, in vitro culture
INTRODUCCIÓN
Senecio calvus "huamanripa" es una especie herbácea endémica de Ancash y Canta (Lima), crece asociada a rocas entre los 3500 a 4500 m. s. n. m (Beltrán & Roque, 2015). Los pobladores andinos beben o se bañan con la infusión de sus hojas − sola o en combinación con otras especies − para combatir problemas de tos y para el frío (Carraz et al., 2015; De la Cruz, Malpartida, Beltrán, & Jullian, 2014); así mismo ensayos biológicos muestran que el extracto hidroalcohólico de sus hojas posee actividad antibacteriana sobre Staphylococcus aureus (Tamariz-Angeles, Olivera-Gonzales, & Santillán-Torres, 2018).
Por otro lado, S. calvus es colectada del estado silvestre para el autoconsumo y comercialización (Carraz et al., 2015) causando una progresiva disminución de su población. Este proceso, sobre todo para las hierbas medicinales amenazadas o en peligro de extinción, se viene incrementando anualmente por la sobre explotación, pérdida de sus hábitats y comercio no controlado (Ahsan, Amjad, Iqbal, & Javed, 2013).
S. calvus no está ajena a la disminución de su población por estar considerada entre las plantas medicinales más populares de los mercados de Huaraz (De la Cruz et al., 2014), y a pesar de su extensa colecta se observa una ausencia de planes de manejo y domesticación. Además, frente al cambio climático se proyectan efectos negativos en la biodiversidad de especies alto-andinas tropicales (Ramírez-Villegas, Cuesta, Devenish, & Peralvo, 2014) lo cual podría incrementar su riesgo de extinción, demandándose el desarrollo de alternativas para producción y conservación.
En este sentido, las técnicas biotecnológicas del cultivo in vitro de tejidos vegetales son una alternativa para la conservación de plantas endémicas, en peligro de extinción y medicinales porque contribuyen a su propagación y uso racional (Cristea, Brummer, Jarda, & Miclăuş, 2010; Izquierdo, 2006; Olivera-Gonzales, Yldefonzo, Mestanza, &Tamariz-Angeles, 2017a; Tripathi & Tripathi, 2003). Entre estas técnicas la más usada es la micropropagación porque permite producir en corto tiempo gran número de plantas uniformes y libres de patógenos usando pequeñas partes asépticas de tejidos u órganos comparado con la propagación vegetativa convencional (Kumar & Reddy, 2011). Sin embargo, cada especie requiere del desarrollo de una metodología específica para su micropropagación y aclimatación.
Las plantas para su crecimiento, desarrollo y reproducción además de los nutrientes y condiciones físicas requieren sustancias endógenas muy activas conocidas como hormonas vegetales − producidas por diferentes vías metabólicas esenciales − que regulan la expresión de factores de transcripción y genes específicos permitiéndoles cumplir sus funciones (George, Hall, & Klerk, 2008; Johri & Mitra, 2001; Kaur, Mall, Sheokand, Singh, & Datta, 2018). Es así que los medios para el cultivo in vitro pueden contener sustancias sintéticas similares a las hormonas vegetales denominadas reguladores de crecimiento vegetal, los cuales son importantes en el metabolismo, distribución de los solutos, en el crecimiento y fisiología de la planta regulando la expresión genética interna al igual que las hormonas naturales (Bisht, Rawat, Chakraborty, & Yadav, 2018; George et al., 2008).
Los reguladores de crecimiento vegetal más importantes son las auxinas y citoquininas, porque controlan la ramificación de los brotes, la formación y mantenimiento de los meristemos, la formación de raíces y otras funciones (George et al, 2008; Su, Liu & Zhang, 2011; Umehara et al., 2008). En este sentido, el objetivo del presente trabajo fue determinar el efecto de los reguladores de crecimiento vegetal en la multiplicación y enraizamiento in vitro de S. calvus. Con este fin se evaluaron metodologías para la desinfección, multiplicación, enraizamiento y aclimatación, haciendo uso de reguladores de crecimiento vegetal.
MATERIALES Y MÉTODOS
Material vegetal
Las partes aéreas de S. calvus fueron colectadas en Portachuelo de Llanganuco, con coordenadas 9°2’47.08"S 77°35’34.72"W (Parque Nacional Huascarán, Yungay, Ancash), y fueron transportadas en bolsas de papel estériles al laboratorio y algunas muestras se herborizaron para su depósito y determinación taxonómica en el Herbario David Smith de la Universidad Nacional Santiago Antúnez de Mayolo. La Figura 2A, muestra el hábito de la planta en el momento de la colecta. Toda la investigación se realizó en el Laboratorio de Biología de la UNASAM (Huaraz, Perú), desde enero del 2013 hasta septiembre del 2016.
Medio de cultivo basal y condición ambiental de cultivo
El medio de cultivo basal usado en todas las etapas fue Murashige & Skoog a mitad de sales (MS ½) suplementado con sacarosa 2% y fitagel 0.3%, pH de 5.7. La condición ambiental de cultivo fue: fotoperiodo de 16 horas luz y temperatura ambiental 16-25 °C.
Desinfección del material vegetal
Se retiraron las hojas adultas dejando las yemas apicales de 5 mm de longitud conteniendo 1cm de tallo aprox. Estas yemas (explantes) fueron lavados con agua corriente, luego con solución jabonosa (2%) por 20 minutos y se enjuagaron tres veces con agua destilada. La desinfección tuvo lugar en una cámara de flujo laminar y se usó HgCl2 0.1% ó HgCl2 0.01% por 5 minutos y tres enjuagues con agua destilada estéril tres minutos cada vez.
Las yemas desinfectadas fueron trasferidas a viales de 2 cm de diámetro con 1.5 mL de agua peptonada 0.1%. Se agregó rifampicina 72 µg·mL-1 y nistatina 200 µg·mL-1 (concentración final) a 30 explantes provenientes de HgCl2 0.1% y HgCl2 0.01%; además 30 explantes desinfectados con HgCl2 0.1% se cultivaron sin adición de antimicrobianos.
Los explantes se incubaron a condición ambiental de cultivo por tres días. Los explantes sin signos de contaminación fueron trasladados a tubos de 55 mL con 10 mL de medio de cultivo basal. En el caso de los tratamientos con antimicrobianos se continuó agregando rifampicina y nistatina cada 3 días. Los explantes fueron cultivados por 15 días, a condición ambiental.
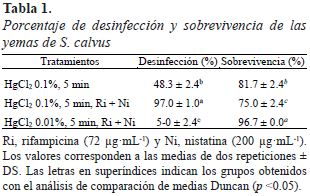
Cada tratamiento estuvo formado por dos bloques de 15 repeticiones cada uno y se evaluó el porcentaje de desinfección y sobrevivencia de los explantes a los 18 días del cultivo.
Establecimiento de los cultivos in vitro
Los explantes sin contaminación provenientes de la desinfección fueron trasladados a tubos de 55 mL con 10 mL de medio de cultivo basal fresco, y se cultivaron en condición ambiental por 15 días.
Multiplicación de yemas
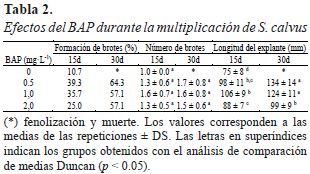
Los explantes establecidos se recortaron a 2.0 cm de largo y fueron trasladadas a magentas con medio de cultivo basal suplementado con BAP 1.0; 1.5; 2.0 y 2.5 mg·L-1, y un control libre de BAP. Se colocaron 4 explantes por magenta y fueron cultivados en condición ambiental. Se evaluó el número de brotes y altura del explante a 15 y 30 días. Cada tratamiento estuvo formado por 7 magentas.
Enraizamiento in vitro
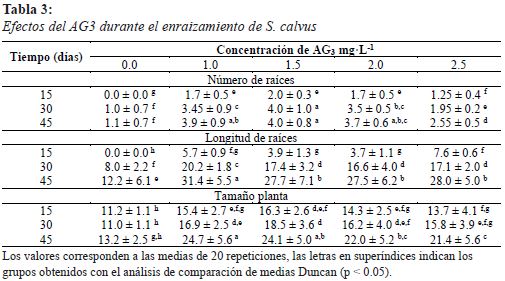
Los brotes obtenidos de la multiplicación fueron separados y trasladados a magentas con medio de cultivo basal fresco sin BAP y cultivados por 30 días. Luego fueron trasladados a tubos 55 mL con 10 mL de medio de cultivo basal suplementado con 1.0: 1.5; 2.0 y 2.5 mg·L-1 de ANA ó AG3; y un tratamiento control libre de reguladores de crecimiento vegetal. Se cultivaron por 45 días con fotoperiodo de 16 horas luz y temperatura de 20 ± 2 °C. Cada tratamiento tuvo 20 repeticiones y se evaluó la altura del explante, número de raíces adventicias, longitud de raíces y número de brotes a 15, 30 y 45 días.
Aclimatación en invernadero
Los sustratos: arena + musgo (1:1) y tierra agrícola + musgo (1:1) fueron esterilizados y distribuidos en recipientes de plástico (8 x 10 cm) previamente desinfectados con alcohol 70°.
Los explantes del mejor tratamiento de enraizamiento fueron seleccionadas al azar, se lavaron las raíces con agua destilada estéril y se trasladaron a los sustratos en condiciones de invernadero.
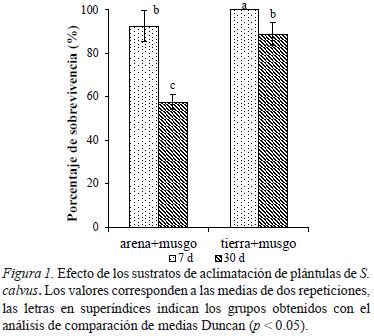
La humedad se mantuvo cubriendo con vasos descartables con un agujero de 1cm de diámetro en la parte superior. Cada tratamiento estuvo formado por dos bloques con 40 plantas. La primera semana se regó cada 48 horas y luego de acuerdo al requerimiento hídrico. Se evaluó el porcentaje de sobrevivencia a 7 y 30 días.
Análisis estadísticos
Se usó el Diseño Completamente al Azar para todas las etapas. Se calcularon promedios y desviaciones estándar; así mismo se realizó el análisis de varianza (ANOVA) y la prueba de comparación de medias de Duncan con p < 0.05, estos análisis se realizaron con el software libre InfoStat versión 2017.
RESULTADOS
Desinfección de las yemas
La Tabla 1 muestra que el mayor porcentaje de desinfección (97.0 ± 1.0%) se obtuvo con 0.1% de HgCl2 por 5 minutos y la aplicación de rifampicina (72 µg·mL-1) y nistatina (200 µg·mL-1). Por otro lado, el mayor porcentaje de sobrevivencia se observó con 0.01% de HgCl2 por 5 minutos y la aplicación de rifampicina (72 µg·mL-1) y nistatina (200 µg·mL-1) pero la desinfección fue muy baja (5.0 ± 2.4 %).
Multiplicación de brotes
Los explantes tratados con BAP y sin BAP, a los 15 días formaron brotes, con mayor porcentaje en el tratamiento con BAP (Tabla 2). Estos valores se incrementaron a los 30 días en los tratamientos con BAP, pero en el tratamiento sin BAP los explantes se fenolizaron y murieron (fig . 2B).
El número de brotes se obtuvo de los explantes que formaron brotes, y no presenta diferencias significativas en todos los tratamientos a 15 y 30 días, excepto el tratamiento sin BAP a 30 días (Figura 2B). Respecto a la longitud del explante los mejores resultados se obtuvieron con los tratamientos de 0.5 y 1.0 mg·L-1 BAP a 30 días.
Enraizamiento in vitro
El 100% de las plántulas tratadas con ANA (1.0 – 2.5 mg·L-1) formaron callos; mientras que el 100% de plantas tratadas con AG3 (1.0 – 2.5 mg·L-1) y el control libre de reguladores de crecimiento vegetal formaron raíces sin presencia de callos a partir de los 15 días de tratamiento. El número de raíces en los tratamientos con AG3 1.0; 1.5 y 2.0 mg·L-1 no presentaron diferencias significativas a los 45 días; la mayor longitud de las raíces se obtuvo con 1.0 mg·L-1 de AG3 a los 45 días y el mayor tamaño de plántula se obtuvo con 1.0 y 1.5 mg·L-1 de AG3 a los 45 días (Tabla 3 y Figura 2C).
Aclimatación en invernadero
Se seleccionaron las plantas provenientes del tratamiento con AG3 (1.0 mg·L-1) porque presentaron mayor longitud de raíces (Tabla 3). El porcentaje de sobrevivencia a los 15 y 30 días fue mayor en el sustrato musgo + suelo (1:1), lográndose hasta 88.8 ± 5.3% de sobrevivencia a los 30 días (fig. 1). En la Figura 2D se observa que la plántula producida mediante el cultivo in vitro tiene características morfológicas similar a la planta silvestre.
DISCUSIÓN
Los microorganismos presentes en las plantas provenientes de campo o invernadero pueden matar al explante cuando son introducidos al cultivo in vitro haciéndose necesaria la esterilización superficial con agentes esterilizadores apropiados y que dependerá de la superficie del tejido y del tipo de explante (Jan et al., 2013; Padhi & Singh, 2017).
El HgCl2 ha sido usado para la desinfección de bulbos, cormos y rizomas (Teixeira et al., 2016) mostrando resultados efectivos en la desinfección de Perezia coeulescens (Olivera, Tamariz, & Gutiérrez, 2010), Fragaria (Jan et al., 2013), Salacia chinensis (Majid et al., 2014) y P. pinnatifida (Olivera-Gonzales, Espinoza, & Tamariz-angeles, 2017b). Así mismo, el HgCl2 es ideal para el control de los hongos endofíticos de la caña de azúcar (Mng’omba, Sileshi, du Toit, & Akinnifesi, 2012) señalan que el. Por lo tanto, para la desinfección de las yemas de S. calvus se utilizó HgCl2, porque esta es una planta herbácea y rizomatosa que tiene mayor superficie de contacto con el suelo contaminado con altos niveles de microorganismos.
La desinfección de S. calvus con HgCL2 (0.1% x 5 min.) solo alcanzó el 48.3 ± 2.4 %. Frente a este problema se usan antimicrobianos por periodos cortos cuando los microorganismos son difíciles de eliminar considerando la sensibilidad y capacidad del explante (Roca & Mroginski, 1991). Por lo cual, se aplicó de manera periódica rifampicina (72 µg·mL-1) y nistatina (200 µg·mL-1) durante la introducción, encontrándose que la aplicación de estos antimicrobianos a las yemas de S. calvus provenientes del tratamiento con HgCl2 (0.1% x 5 min.) mejoró la desinfección logrando contralar los contaminantes endofíticos y obteniéndose 97% de desinfección y 75% de supervivencia (Tabla 1).
Durante la multiplicación de los brotes se observó que los explantes (yemas) de S. calvus −provenientes del campo− sembradas en medio libre de BAP se fenolizaron y murieron antes de los 30 días, mientras que el 100% de explantes sembrados en medio con BAP sobrevivieron (Tabla 2). Estos resultados coinciden con lo obtenido en el cultivo in vitro de Solanum nudum, sin aplicación hormonal, donde la mayoría de los explantes murieron antes de finalizar la experimentación (Suárez, Naranjo, Garcés, & Trujillo, 2011).
La fenolización ocurre a causa del estrés durante la preparación y desinfección del explante (Olmos, Luciani, & Galdeano, 2010) y está demostrado que la citoquinina tiene efectos anti-estrés y anti-edad (Mazid, Khan, & Mohammad, 2011). Por lo tanto, la presencia de BAP habría contrarrestado el estrés que se ocasionó a los explantes de S. calvus durante la desinfección y aplicación de antimicrobianos, mejorando su adaptación al cultivo in vitro.
El efecto positivo de BAP, en los cultivos in vitro, se debe a una red de vías de señalización y activación de genes que regulan las respuestas al estrés ambiental (Ha, Vankova, Yamaguchi-shinozaki, Shinozaki, & Tran, 2012), así mismo la aplicación exógena de citoquininas en el cultivo in vitro induce a la división celular, promueve la formación de clorofila y mejora los procesos de fotosíntesis y energéticos (George et al., 2008; Ha et al., 2012; Mazid et al., 2011) permitiendo la adaptación de los explantes a las nuevas condiciones de cultivo. En este sentido S. calvus sólo requirió BAP después de la introducción al cultivo in vitro, porque en posteriores sub-cultivos no fue necesario.
Las citoquininas y las auxinas son usadas en cultivos vegetales donde los mayores niveles de citoquininas se usan para promover la formación de brotes laterales mediante el estímulo de la división celular y pérdida de la dominancia apical (George et al., 2008). A pesar que el BAP redujo la fenolización de los explantes introducidos de S. calvus, la inducción de formación de brotes a los 15 y 30 días no mostró diferencias con el control de 15 días. Este resultado concuerda con la multiplicación in vitro de Alstroemeria donde la adición de BAP no tuvo efectos significativos en el número de brotes respecto al tratamiento sin hormona (Seyyedyousefi, Kaviani, & Dehkaei, 2013).
También, se debe tener en cuenta que, la concentración de BAP influye en las características de los explantes de S. calvus; es así que a los 30 días los explantes cultivados en 0.5 y 1.0 mg·L-1 de BAP mostraron mayor longitud que disminuyó a medida que aumentó la concentración a 2.0 mg·L-1. En el cultivo in vitro de Musa acuminata se encontró que las longitudes de sus brotes disminuyeron cuando se incrementaron las dosis de BAP (Cruz-Rosero et al., 2016); así mismo, los brotes de Bacopa monnieri disminuyeron su longitud en concentraciones mayores a 1.0 mg·L-1 de BAP (Jain, Pandey, Benjamin, Meena, & Singh, 2014). Contrariamente, los brotes de Musa sp. cultivados con 0.0; 2.0; 4.0; 6.0 y 8.0 mg·L-1 de BAP no mostraron diferencias en longitud (Ngomuo, Mneney, & Ndakidemi, 2013). Estas respuestas diferentes podrían deberse a que el BAP no comparte completamente todos los mecanismos de acción con las citoquininas naturales (Mazid et al., 2011).
Para la formación de raíces en el cultivo in vitro por lo general se usan auxinas, pero los medios de cultivo ricos en éstas pueden inducir la formación de callo en los explantes (Cob-Uicab et al., 2011; George et al., 2008; Shang et al., 2016); es así que durante el enraizamiento de S. calvus la aplicación de ANA (1.0; 1.5; 2.0 y 2.5 mg·L-1) produjo 100% de callos y la inhibición de la formación de raíces. Esto concuerda con el enraizamiento in vitro de Oreocallis grandoflora, donde se encontró la formación de callos en 100% de los explantes cuando se aplicó 1.0 mg·L-1 de ANA en el medio de cultivo (Olivera-Gonzales et al., 2017a).
Por otro lado, la función de las giberelinas está asociada a diversos aspectos del desarrollo y ciclo de vida de las plantas, tales como la floración, senescencia y la germinación (Niu et al., 2013; Vieira, Sousa, Santos, & Santos, 2010). En el caso de S. calvus se usó AG3 (1.0; 1.5; 2.0 y 2.5 mg·L-1) para evaluar su efecto sobre el enraizamiento, encontrándose efectos positivos como: mayor número y longitud de raíces, así como mayor tamaño del explante comparado con el control sin reguladores de crecimiento vegetal.
Existen resultados similares reportados en Prunus avium (Ford, Taylor, Blake, & Marks, 2002) y Oreocallis grandiflora (Olivera-Gonzales et al., 2017a) donde AG3 aumentó el tamaño de los brotes y mejoró el enraizamiento. También se observó que a mayor concentración de AG3, los efectos positivos sobre las plántulas de S. calvus disminuyeron, siendo más evidente en el tratamiento con 2.5 mg·L-1. Se conoce que los altos niveles de ácido giberélico pueden inhibir el inicio de la formación de raíces adventicias en el tabaco (Niu et al., 2013).
Luego del enraizamiento in vitro, las plantas de S. calvus fueron sembradas en arena + musgo (1:1) o tierra + musgo (1:1), estos sustratos fueron esterilizados para evitar la proliferación de microorganismos. En ambos sustratos se usó musgo, porque provee buena aireación, drenaje y retención de humedad (Alvarado & Solano, 2002) encontrándose que en combinación con tierra alcanzó hasta un 88.8 ± 5.3 % de sobrevivencia a 30 días evaluación; mientras que combinado con arena se obtuvo 57.5 ± 3.5 % de sobrevivencia, probablemente por los escasos nutrientes y menor capacidad de retención de humedad de la arena (Alvarado & Solano, 2002).
Adicionalmente, se realizaron pruebas preliminares de aclimatación in situ donde se encontró que las plantas de S. calvus provenientes del cultivo in vitro y aclimatadas por 60 días tienen altos porcentajes de sobrevivencia en su hábitat natural.
CONCLUSIONES
Los resultados obtenidos demuestran que S. calvus puede ser propagado in vitro donde su desinfección además del HCl2 requirió la aplicación de rifampicina y nistatina; el BAP tuvo efectos positivos en la sobrevivencia de las yemas introducidas y mejoró la multiplicación de las mismas; su enraizamiento no requirió la aplicación de reguladores de crecimiento vegetal, sin embargo fue favorecida con la adición de AG3 mientras que el ANA indujo a la formación de callos; y el mejor sustrato para su aclimatación fue turba + tierra (1:1).
AGRADECIMIENTO
Los autores agradecen a la Dirección del Instituto de Investigación – Vicerrectorado de Investigación de la Universidad Nacional Santiago Antúnez de Mayolo (UNASAM) por el financiamiento del proyecto "Caracterización Fitoquímica, biológica y molecular de plantas altoandinas peruanas con potencial en la industria farmacológica", a través del cual se realizó el presente trabajo como uno de sus objetivos.
También expresan su agradecimiento a la Dra. Pilar Caycho Medrano por la orientación brindada en los análisis estadísticos.
REFERENCIAS BIBLIOGRÁFICAS
Ahsan, T., Amjad, N., Iqbal, A., & Javed, A. (2013). A review: tissue culturing of important medicinal plants. International Journal of Water Resources and Environmental Sciences, 2 (4), 76-79. doi: 10.5829/idosi.ijwres.2013.2.4.11120 [ Links ]
Alvarado, M. A., & Solano, J. A. (2002). Producción de sustratos para viveros. Costa Rica: Editorial Proyecto regional de Fortalecimiento de la Vigilancia fitosanitaria en cultivos de exportación no tradicional-VIFINEX. Recuperado de http://www.cropprotection.es/documentos/Compostaje/Sustratos-para-Viveros.pdf [ Links ]
Beltrán, H., & Roque J. (2015). El género Senecio L. (Asteraceae-Senecioneae) en el Departamento de Lima, Perú. Arnaldoa, 22 (2), 395-412. [ Links ]
Bisht, T. S., Rawat, L., Chakraborty, B., & Yadav, V. (2018). A recent advances in use of plant growth regulators (pgrs) in fruit crops - a review. International Journal of Current Microbiology and Applied Sciences, 7 (5), 1307-1336. https://doi.org/10.20546/ijcmas.2018.705.159 [ Links ]
Carraz, M., Lavergne, C., Jullian, V., Wright, M., Gairin, J. E., Gonzales de la Cruz, M., & Bourdy, G. (2015). Antiproliferative activity and phenotypic modification induced by selected Peruvian medicinal plants on human hepatocellular carcinoma Hep3B cells. Journal of Ethnopharmacology, 166, 185-199. doi: https://doi.org/10.1016/j.jep.2015.02.028 [ Links ]
Cob-Uicab, J.V., Sabja, A.M., Ríos-Leal, D., Lara-Aguilar, A., Donoso, P., Gonzáles, M., & Escobar, B. (2011). Potencial de la organogénesis como estrategia para la masificación in vitro de Fitzroya cupressoides en Sudamérica Austral. Revista Chapingo Serie Ciencias Forestales y del Ambiente, 17 (3), 423-433. Recuperado de http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007-40182011000300012 [ Links ]
Cristea, V., Brummer, A.T., Jarda, L., & Miclăuş, M. (2010). In vitro culture initiation and phytohormonal influence on Dianthus henteri – a Romanian endemic species. Romanian Biotechnological Letters, 15 (1), 25-33. Recuperado de https://www.rombio.eu/rbl1vol15Supplement/4%20Victoria%20Cristea.pdf [ Links ]
Cruz-Rosero, N., Canchignia-Martínez, H., Morante-Carriel, J., Nieto-Rodríguez, E., Cruz-Rosero, E., & Cabrera-Casanova, D. (2016). In vitro propagation of the Orito banana cultivar (Musa acuminata AA). Biotecnología Aplicada, 33 (4), 4201-4204. Recuperado de http://www.medigraphic.com/pdfs/biotecapl/ba-2016/ba164a.pdf [ Links ]
Ford, Y. Y., Taylor, J. M., Blake, P. S., & Marks, T. R. (2002). Gibberellin A3 stimulates adventitious rooting of cuttings from cherry (Prunus avium). Plant Growth Regulation, 37 (2), 127-133. doi: 10.1023/A:1020584627919 [ Links ]
George, E. F., Hall, M. A., & Klerk, J. D. (2008). Plant growth regulators I: Introduction; auxins, their analogues and inhibitors. In: E. F. George, M. A. Hall & G.J. Klerk Ed.), Plant propagation by tissue culture. (pp. 175–204). Dordrecht, Netherlands: Springer. Recuperado de https://investigacionfitopatologiaumar.files.wordpress.com/2016/06/plant-propagation.pdf [ Links ]
De la Cruz, M. G., Malpartida, S.B., Beltrán, H.S., & Jullian, V. (2014). Hot and cold: Medicinal plant uses in quechua speaking communities in the high andes (Callejón de Huaylas, Ancash, Perú). Journal of Ethnopharmacology, 155, 1093-1117. doi: http://dx.doi.org/10.1016/j.jep.2014.06.042 [ Links ]
Ha, S., Vankova, R., Yamaguchi-shinozaki, K., Shinozaki, K., & Tran, L. S. (2012). Cytokinins: metabolism and function in plant adaptation to environmental stresses. Trends in Plant Science, 17 (3), 172-179. doi: https://doi.org/10.1016/j.tplants.2011.12.005 [ Links ]
Izquierdo, P. (2006). Development of micropropagation protocols for two species critically endangered Asteraceae endemic of the Galapagos Island. Lyonia, 9 (2), 57-62. Recuperado de https://www.lyonia.org/downloadpdf-2.461.pdf [ Links ]
Jain, A., Pandey, K., Benjamin, D., Meena, A., & Singh, R. (2014). In vitro approach of medicinal herb: Bacopa monnieri. International Journal of Innovative Research in Science, Engineering and Technology, 3 (5), 12088-12093. Recuperado de http://www.ijirset.com/upload/2014/may/12_In-vitro.pdf [ Links ]
Jan, A., Bhat, K.M., Bhat, S.J., Mir, M. A., Bhat, M. A., Imtiyaz, A., &Rather, J. A. (2013). Surface sterilization method for reducing microbial contamination of field grown strawberry explants intended for in vitro culture. African Journal of Biotechnology, 12 (39), 5749-5753. doi:10.5897/AJB2013.12918 [ Links ]
Johri, M. M., & Mitra, D. (2001). Action of plant hormones. Current Science, 80 (2), 199-205. Recuperado de https://pdfs.semanticscholar.org/9589/fb99c718faa849b1c96566c3b74875d2c2a9.pdf [ Links ]
Kaur, P., Mall, D., Sheokand, A., Singh, L., & Datta, S. (2018). Role of plant growth regulators in vegetable production: a review. International Journal of Current Microbiology and Applied Sciences, 7 (6), 2177-2183. https://doi.org/10.20546/ijcmas.2018.706.258 [ Links ]
Kumar, N., & Reddy, M. P. (2011). In vitro plant propagation: a review. Journal of Forest Science, 27 (2), 61-72. Recuperado de https://www.researchgate.net/publication/263638941_in_vitro_plant_propagation_a_review [ Links ]
Majid, B.N., Roopa, G., Sampath, K.K., Kini, R. K., Prakash, H. S., Abbagani, S., Mehdi, K., & Geetha, N. (2014). Establishment of an efficient explant surface sterilization protocol for in vitro micropropagation of Salacia chinensis L., an endangered anti-diabetic medicinal plant. World Journal of Pharmacy and Pharmaceutical Sciences, 3 (12), 1266-1274. Recuperado dehttps://www.researchgate.net/publication/317351184_establishment_of_an_efficient_explant_surface_sterilization_protocol_for_in_vitro_micropropagation_of_salacia_chinensis_l_an_endangered_anti-diabetic_medicinal_plant [ Links ]
Mazid, M., Khan, T. A., & Mohammad, F. (2011). Cytokinins, a classical multifaceted hormone in plant system. Journal of Stress Physiology & Biochemistry, 7 (4), 347-368. Recuperado de https://www.researchgate.net/publication/301620057_Cytokinins_A_classical_multifaceted_hormone_in_plant_system [ Links ]
Mng’omba, S. A., Sileshi, G., du Toit, E. S., & Akinnifesi, F. k. (2012). Efficacy and utilization of fungicides and other antibiotics for aseptic plant cultures. In D. Dhanasekaran, N. Thajuddin and A. Panneerselvam (Ed.), Fungicides for Plant and Animal Diseases (pp. 245-254). Croatia: INTECH. doi: 10.5772/1130
Ngomuo, M., Mneney, E., & Ndakidemi, P. (2013). The effects of auxins and cytokinin on growth and development of (musa sp.) var. "yangambi" explants in tissue culture. American Journal of Plant Sciences, 4, 2174–2180. doi: http://dx.doi.org/10.4236/ajps.2013.411269 [ Links ]
Niu, S., Li, Z., Yuan, H., Fang, P., Chen, X., & Li, W. (2013). Proper gibberellin localization in vascular tissue is required to regulate adventitious root development in tobacco. Journal of Experimental Botany, 64 (11), 3411-3424. doi:10.1093/jxb/ert186 [ Links ]
Olivera, P., Tamariz, C., & Gutiérrez, M. (2010). Desinfección e influencia del bencil aminopurina (BAP) y ácido naftalénacético (ANA) en la multiplicación de Perezia coerulescens Wedd, planta medicinal altoandina. Rev. Aporte Santiaguino, 3 (1), 117-124. Recuperado de http://www.scielo.org.pe/pdf/as/v3n1/a16v3n1.pdf [ Links ]
Olivera-Gonzales, P., Yldefonzo, E., Mestanza, E., & Tamariz-Angeles, C. (2017a). In vitro propagation of Oreocallis grandiflora (Lam.) R. Br., a medicinal threatened plant. Annual Research & Review in Biology, 14 (3), 1-9. doi: https://doi.org/10.9734/ARRB/2017/34724 [ Links ]
Olivera-Gonzales, P., Espinoza, R., & Tamariz-angeles, C. (2017b) Multiplicación in vitro y embriogénesis somática de Perezia pinnatifida (Asteraceae) planta medicinal andina, Revista Peruana de Biología, 24 (3), 323-328. doi: http://dx.doi.org/10.15381/rpb.v24i3.13911 [ Links ]
Olmos, S., Luciani, G., & Galdeano, E. (2010). Micropropagación. En G. Levitus, V. Echenique, C. Rubinstein, E. Hopp and L. Mroginski Ed.), Biotecnología y mejoramiento vegetal II (pp. 353-362). Argentina: Ediciones INTA. Recuperado de https://www.agroindustria.gob.ar/sitio/areas/escuelagro/_archivos//000011_INTA%20Biotecnologia/000000_Inta%20-%20B%C3%ADotecnolog%C3%ADa.pdf [ Links ]
Padhi, M., & Singh, S. P. (2017). Surface sterilization for reducing microbial contamination in in vitro propagation of lasora (Cordia myxa Roxb.) using nodal segments. International Journal of Current Microbiology and Applied Sciences, 6 (8), 836-842. https://doi.org/10.20546/ijcmas.2017.608.106 [ Links ]
Ramírez-Villegas, J., Cuesta, C.F., Devenish, C., & Peralvo, M. (2014). Using species distributions models for designing conservation strategies of Tropical Andean biodiversity under climate change, Journal for Nature Conservation, 22 (5), 391–404. http://dx.doi.org/10.1016/j.jnc.2014.03.007 [ Links ]
Roca, W. M., & Mroginski, L. A. (1991). Cultivo de tejidos en la agricultura: fundamentos y aplicaciones. Colombia: Centro Internacional de Agricultura Tropical (CIAT). [ Links ]
Seyyedyousefi, S.R., Kaviani, B., & Dehkaei, N.P. (2013). The effect of different concentrations of NAA and BAP on micropropagation of Alstroemeria. European Journal of Experimental Biology, 3 (5), 133-136. Recuperado de http://www.imedpub.com/articles/the-effect-of-different-concentrations-of-naa-and-bap-on-micropropagation-of-alstroemeria.pdf [ Links ]
Shang, B., Xu, C., Zhang, X., Cao, H., Xin, W., & Hu, Y. (2016). Very-long-chain fatty acids restrict regeneration capacity by confining pericycle competence for callus formation in Arabidopsis. PNAS, 113 (18), 5101-5106. doi: http://www.pnas.org/cgi/doi/10.1073/pnas.1522466113 [ Links ]
Su, Y. H., Liu, Y. B., & Zhang, X. S. (2011). Auxin – cytokinin interaction regulates meristem development. Molecular Plant, 4 (4), 616-625. doi: https://doi.org/10.1093/mp/ssr007 [ Links ]
Suárez, O.M., Naranjo, E.J., Garcés, L. A., & Trujillo, S. B. (2011). Organogénesis directa in vitro a partir de hojas de la planta antiplasmodial Solanum nudum Dunal. Revista Colombiana de Biotecnología, 13 (2), 186-192. Recuperado de https://revistas.unal.edu.co/index.php/biotecnologia/article/view/28010/28263 [ Links ]
Tamariz-Angeles, C., Olivera-Gonzales, P., & Santillán-Torres, M. (2018). Antimicrobial, antioxidant and phytochemical assessment of wild medicinal plants from Cordillera Blanca (Ancash, Peru). Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 17 (3), 270-285. Recuperado de https://www.blacpma.usach.cl/sites/blacpma/files/articulo_4_-_1426_-_279_-_285.pdf [ Links ]
Teixeira da Silva, J. A., Kulus, D., Zhang, X., Zeng, S., Ma, G., & Piqueras, A. (2016). Disinfection of explants for saffron (Crocus sativus) tissue culture. Environmental and Experimental Biology, 14, 183–198. doi: 10.22364/eeb.14.25 [ Links ]
Tripathi, L., & Tripathi, J. N. (2003). Role of biotechnology in medicinal plants. Tropical Journal of Pharmaceutical Research, 2 (2), 243-253. Recuperado de http://www.bioline.org.br/pdf?pr03018 [ Links ]
Umehara, M., Hanada, A., Yoshida, S., Akiyama, K., Arite, T., Takeda-Kamiya, N., Magome, H., Kamiya, Y., Shirasu, K., Yoneyama, K., Kyozuka, J., & Yamaguchi, S. (2008). Inhibition of shoot branching by new terpenoid plant hormones. Nature, 455, 195-200. doi: 10.1038/nature07272 [ Links ]
Vieira, E. L., Sousa, G. S., Santos, A. R., & Santos, J. (2010). Manual de fisiologia vegetal. São Luis, Brasil: ediciones EDUFMA. Recuperado de http://www.univale.br/sites/biblioteca/biblioteca_online_agronegocio/livrosbiblioteca/manual%20de%20fisiologia%20vegetal.pdf [ Links ]
Artículo recibido: 25/10/2018
Artículo aceptado: 30/03/2019
On line: 30/04/2019