Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Investigaciones Altoandinas
On-line version ISSN 2313-2957
Rev. investig. Altoandin. vol.21 no.4 Puno Oct./Dic. 2019
http://dx.doi.org/10.18271/ria.2019.501
10.18271/ria.2019.501
ARTÍCULO ORIGINAL
Producción de embriones in vitro en una incubadora portatil de dióxido de carbono y viabilidad in vivo post transferencia a vacas receptoras
Production of in vitro embryos in vitro a portable carbon dioxide incubator and viability in vivo post transfer to recipients cows
Manuel Guido Pérez Durand*, Benicio Quispe Villalta & Uri Harold Perez Guerra
Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional del Altiplano de Puno, Perú.
*Autor para correspondencia: guidpe@yahoo.es
Manuel Guido Pérez Durand https://orcid.org/0000-0001-6544-2924
RESUMEN
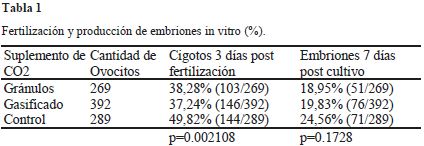
El objetivo fue determinar la adición del 5% de dióxido de carbono (CO2) a partir de gránulos efervescentes o gasificado a una incubadora portátil (taper) para evaluar la producción in vitro de embriones de ovocitos aspirados de ovarios de vacas sacrificadas en el matadero y evaluar la viabilidad in vivo a través de la gestación en vacas receptoras. Como incubadora portátil se utilizó un taper de plástico de capacidad de 500 cm3 a la que se acondicionó una válvula para el control de adición de CO2. La maduración se realizó por 24 h, fertilización por 18 h y cultivo de embriones por 7 días en 500 uL de los medios en placas petry e introducidos dentro la incubadora portátil, la misma que se colocó dentro un baño María a 38,5oC. A las 72 h post fertilización se determinó la proporción de cigotos, a los 7 días post cultivo se contabilizo los embriones. Los resultados de fertilización con adición de CO2 a partir de gránulos efervescentes fue 38,28% (103/269), con adición de CO2 gasificado 37,24% (146/392) y control 49,82% (144/289) (p<0,05); para la producción de embriones fue 18,95% (51/269), 19,38% (76/392) y 24,56% (71/289), respectivamente (p>0,05); la tasa de gestación en vacas receptoras fue 38,46% (5/13). En conclusión, es posible producir embriones in vitro de vacunos, utilizando una incubadora portátil de CO2 a nivel de campo.
Palabras clave: fertilización, transferencia embrionaria, gestación.
ABSTRACT
The objective was to determine the addition of 5% carbon dioxide (CO2) from effervescent granules or gasified to a portable incubator (taper) to evaluate the in vitro production of embryos of oocytes aspirated from ovaries of cows slaughtered in the slaughterhouse and evaluate viability in vivo through pregnancy in recipient cows. As a portable incubator, a 500 cm3 plastic taper was used, to which a valve for controlling the addition of CO2 was conditioned. The maturation was carried out for 24 h, fertilization for 18 h and embryo culture for 7 d in 500 uL of the media in petry plates and introduced into the portable incubator, which was placed in a water bath at 38.5 ° C. At 72 h post fertilization the proportion of zygotes was determined, at 7 d post culture the embryos were counted. The fertilization results with the addition of CO2 from effervescent granules was 38.28% (103/269), with the addition of gasified CO2 37.24% (146/392) and control 49.82% (144/289) (p<0.05); for embryo production it was 18.95% (51/269), 19.38% (76/392) and 24.56% (71/289), respectively (p>0.05); the pregnancy rate in recipient cows was 38.46% (5/13). In conclusion, it is possible to produce in vitro embryos of cattle, using a portable CO2 incubator at field level.
Keywords: fertilization, embryo transfer, pregnancy.
INTRODUCCIÓN
En la ganadería lechera del altiplano se inició la inseminación artificial hace cuatro décadas y producto del uso continuo de semen de reproductores de alta genética, se observan en ferias y en concursos hembras con alta producción y tipo para la raza Brown Swiss. Es así que en los hatos que poseen vacas mejoradas con alta producción láctea, aproximadamente 20% de éstas manifiestan infertilidad prolongada y hasta esterilidad, las cuales son excluidas del hato y se destinan a los mataderos. Se ha reportado que las causas de la baja fertilidad en vacas de alta producción lechera son debido a selección genética para producción de leche, condición corporal, balance energético negativo al postparto, desordenes metabólicos, infecciones uterinas, fallas en la fertilización y mortalidad embrionaria (Walsh et al. 2011), las cuales se observan en los hatos lecheros del altiplano y a esto se le suman factores como la altura (hipoxia) y las temperaturas variables en las diferentes épocas del año.
En el altiplano peruano (3828 m de altitud) no existen reportes de la producción de embriones in vitro de vacunos y transferencia a vacas receptoras; por lo tanto, la importancia de la producción de embriones in vitro con estas condiciones de altitud, radica en aprovechar los ovocitos de los ovarios de las vacas de alta producción láctea que se sacrifican en los mataderos. Diversos estudios sugieren que este tipo de producción de embriones in vitro, son una herramienta en programas de mejoramiento genético en ganado lechero, donde el costo por embrión es bajo, si se adiciona semen sexado con lo cual producirían hembras de remplazo a bajo costo (Wilson et al., 2005); por lo tanto, esta estrategia se puede aplicar en la ganadería lechera del altiplano. El embrión producido in vitro tiene una función en el incremento de la producción láctea y cárnica, mediante la selección genética y los esquemas de cruzamiento que pueden optimizarse. Además, existen perspectivas de uso de los embriones de producción in vitro, para mejorar la tasa de preñez en hatos con baja fertilidad (Hansen, 2006). Como adición en la producción de embriones in vitro, se ha demostrado la eficiencia del uso de semen sexado para la producción de crías hembras a gran escala (Pontes et al., 2010).
Se ha reportado el uso de una tecnología económica y viable para realizar en el campo producción de embriones in vitro de bovinos y en diferentes especies, mediante el uso de una simple incubadora portátil de CO2, desarrollada por Suzuki et al. (1999); con la cual han obtenido embriones de búfalos, vacunos, transferencia nuclear y producción de embriones en otras especies (Dong et al., 2004; Dong et al., 2001; Fujii et al., 2010; Iwayama et al., 2005; Kandil et al., 1999; Varisanga et al., 2000b).
El objetivo fue determinar la adición de CO2 en forma de gránulos o gasificado dentro una incubadora portátil (taper), con modificaciones para producir embriones in vitro de vacunos además de evaluar la viabilidad in vivo.
MATERIALES Y MÉTODOS
La investigación se realizó durante los meses de enero a marzo del 2017 en las instalaciones del Laboratorio de Reproducción Animal de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional del Altiplano de Puno – Perú, ubicada a una altitud de 3 820 msnm en la Meseta del Collao. La mayoría de los reactivos se compraron de Sigma-Aldrich (St. Louis, MO USA).
Descripción de la incubadora portátil de dióxido de carbono y funcionamiento
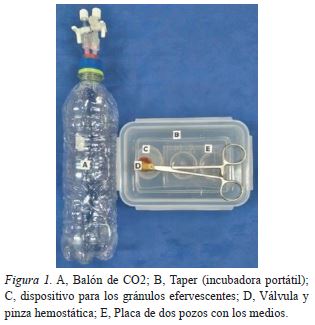
Se utilizó un taper de plástico con modificaciones al método desarrollado por Suzuki et al. (1999) como incubadora portátil para la adición de CO2, el taper de plástico tiene las siguientes medidas: largo= 16 cm, ancho= 11 cm, alto= 5,8 cm, con un volumen de 500 cm3, en la tapa se le acondicionó una válvula de conexión con una aguja 18 G unido a una manguera de silicona de 5 mm de diámetro y una pinza hemostática para evitar la salida del CO2 de su interior (ilustrada en la figura 1). Las placas petry que contenían los medios en las diferentes fases de la producción de embriones in vitro (maduración, fertilización y/o cultivo), se colocaron dentro la incubadora portátil:
Para la adición del CO2 en forma de gránulos efervescentes, se colocó 0,21 g de un producto comercial donde cada 100 g contenía: Bicarbonato de sodio 45,6 g; sulfato de magnesio desecado 1765 g; excipientes csp, dentro un depósito de plástico (diámetro= 35 mm y alto= 20 mm), que también se colocó dentro el taper (incubadora portátil) a la altura de la válvula. Por la válvula se aspiró 50 cm3 de aire con una jeringa de plástico y seguidamente se adicionó 5 mL de agua bidestilada sobre los gránulos efervescentes mediante la manguera de silicona para que se libere el CO2 en el interior de la incubadora portátil y para que no escape el CO2 liberado la manguera de silicona fue presionada con una pinza hemostática (ilustrada en la figura 1).
Para la adición del CO2 en forma gasificada, previamente se depositó 10 g de gránulos efervescentes (sobre completo) en una botella de plástico de 600 cm3 de capacidad, a la tapa de la botella se le acondicionaron dos válvulas una de salida y otra de entrada, por una de las válvulas se succionó todo el aire de la botella y por la otra, se vertieron 10 ml de agua bidestilada que en contacto con los gránulos efervescentes se desprendió CO2, con lo cual se insufló nuevamente la botella y se tuvo CO2en forma gasificada. La adición de CO2 gasificada dentro la incubadora portátil fue como se describió anteriormente con la diferencia de que por la válvula se adicionaron 25 cm3 de CO2 extraído de la botella (ilustrada en la figura 1).
Posteriormente y luego de asegurar la válvula de la incubadora portátil con una pinza hemostática, se colocó dentro un baño María donde el agua cubría a la incubadora portátil por encima de 3 cm. La temperatura del baño María se mantuvo a 38,5°C durante todo el proceso de producción de embriones in vitro (maduración, fertilización y cultivo) y con permanente supervisión. La producción de embriones in vitro del grupo control se llevó a cabo dentro una incubadora estándar de CO2(CO2CELL 48).
Proceso de la fertilización in vitro de embriones de bovinos
La colección y transporte de ovarios de las vacas Brown Swiss beneficiadas en el matadero se colectaron en bolsas de polietileno que contenían solución salina (0,9% NaCl) + antibióticos (100 UI/mL de penicilina + 1 mg/mL de estreptomicina), la bolsa con los ovarios se colocó dentro de un termo que contenía agua a temperatura entre 30 a 35°C, los ovarios se transportaron al laboratorio dentro de 2 a 3 h posteriores, ya en el laboratorio los ovarios se lavaron tres veces con solución salina (0,9% NaCl) atemperada a 37°C.
La colección de ovocitos fue aspirando los folículos de 3 a 8 mm con ayuda de una aguja 20 G x 1" con una jeringa de 5 ml, el contenido de la aspiración (fluido folicular + ovocitos) se vertió a un tubo de ensayo de 12 ml atemperada y protegida a 37°C, al final de la aspiración de los ovocitos se dejó en reposo por 10 min para separar el sobrenadante. El sedimento se vertió a una placa petry (35 x 10 mm) posteriormente los ovocitos se seleccionaron aquellos ovocitos de categoría A y B evaluados en estereoscopio a 40X (Leica S8APO).
La maduración de ovocitos, se seleccionaron 20 a 30 ovocitos que fueron lavados tres veces con gotas de 50 uL del medio de maduración (TCM 2520 adicionado con 0,4 mM de L-glutamine y 25 mM de Hepes suplementado con 0,2 mM de piruvato de sodio, 5 mM de bicarbonato de sodio/mL, 10% de suero fetal, 10 uL de anfoterecina B/mL, 10 UI/mL de gonadotropina corionica equina [Folligon® intervet], 5 UI/mL de gonadotrpina corionica humana [Pregnyl® N.V. ORGANON]), ajustado el pH a 7,4. El medio de maduración 500 uL se colocó en placas de petry con pocillos, se cubrió con aceite mineral dejando por 2 h para su equilibración dentro la incubadora portátil y luego los ovocitos seleccionados y lavados se introdujeron dentro del medio para ser manenidos por 24 h para su respectiva maduración a 38,5oC dentro del baño María (ilustrada en la figura 2).
La fertilización in vitro se realizó según protocolo de Parrish et al. (1986) con ciertas modificaciones de acuerdo con las condiciones del laboratorio, el cual se describe en forma breve: Se utilizaron espermatozoides descongelados de un toro adulto de la raza Brown Swiss seleccionado con habilidad para producción de embriones in vitro. Se descongeló una pajilla de 0,5 mL de semen en baño María a 37°C por 30s, los espermatozoides descongelados se mezclaron con 1 mL de SPERM TALP en un tubo vidrio de 12 mL, el tubo se cerró con su tapa de goma y con ayuda de la aguja de una jeringa de tuberculina se adicionó 0,6 cm3 de CO2 (5% del volumen del tubo). El tubo con la mezcla se colocó dentro el baño María (38,5oC) por espacio de 25 min, para que los espermatozoides vivos sobrenadaran en la superficie (swim up). Se extrajo 700 uL de la superficie con ayuda de un tip y una jeringa de tuberculina. La muestra se colocó a otro tubo de vidrio para centrifugar por 10 min a 280 g eliminando el sobrenadante.
Seguidamente la porción abundante en espermatozoides (sedimento o pellet) fue re-suspendido con 100 uL de FERT TALP que contenía 100 ug/mL de heparina y nuevamente se tapó y adicionó 5% de CO2 para luego incubar por 15 min más a 38,5oC. La suspensión fue re-diluida con otro volumen igual (100 uL) de FERT TALP. La concentración espermática se ajustó a 1 x 106 espermatozoides/mL. En el pocillo de una placa petry se vertió 500 uL del medio de fertilización FERT TALP suplementado con 6 mg/mL de BSA, se cubrió con aceite mineral y se equilibró por 2 h dentro la incubadora portátil (38,5oC) con su respectiva adición de CO2 de acuerdo con los tratamientos, 15 min antes de la fertilización se suplementó al FER TALP equilibrado con 0,2 mM de piruvato de sodio, 10 uM de hipotaurina, 1 uM epinefrina, 20 uM de penicilamina/mL. Los ovocitos madurados se lavaron tres veces y colocaron dentro del FER TALP adicionando 4 uL de espermatozoides tratados. La incubadora portátil con la placa que contenía a los ovocitos madurados + espermatozoides y con la adición de CO2 correspondiente de acuerdo a los tratamientos, se introdujo dentro del baño María a 38,5oC por espacio de 18 h para la fertilización.
El cultivo de embriones, los presuntos cigotos una vez fertilizados, se desnudaron transfiriendo a un tubo de vidrio de 12 mL de capacidad que contenía 0,5 mL de mSOFaa (Tervit et al., 1972) el tubo se vorterizó a máxima velocidad por 30 s. El contenido del tubo fue vertido a una placa petry (35 x 10 mm) y para recuperar todos los cigotos desnudados el tubo se lavó tres veces con 0,5 mL de mSOFaa. Los presuntos cigotos se cultivaron en 500 uL de medio de cultivo mSOFaa suplementado con el 10% de suero fetal, cubierto con aceite mineral. Las placas petry acondicionadas dentro la incubadora portátil y la adición CO2 según tratamientos pasaron dentro el baño María (38,5oC) para el cultivo de embriones que cada tres días se fue cambiando el medio de cultivo.
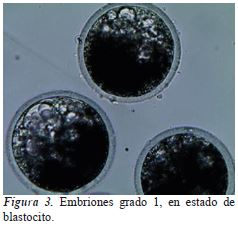
La evaluación de embriones se realizó a las 72 h post fertilización en un estereoscopio a 200X (Leica Microsystems CMS GmbH), se determinó la cantidad de embriones fertilizados por la presencia de blastómeros y a los siete días post cultivo se contaron los embriones según el estado de desarrollo como mórulas, blastocitos. (figura 3).
Transferencia de embriones y diagnóstico de preñez
Las vacas receptoras fueron 13 animales multíparas con diferentes grados de cruzamiento con la raza Brown Swiss, para la transferencia de embriones en las vacas receptoras se detectó el estro (día 0 y día de fertilización en el laboratorio), la transferencia se realizó siete días post estro, los embriones se transportaron por espacio de 3 a 4 h acondicionado dentro una pajilla de 0,25 mL en el medio mSOFaa suplementado con el 20% de suero fetal, protegido dentro una caja de tecnopor. Previamente, en las vacas receptoras se verificó por palpación rectal la presencia y tamaño del cuerpo lúteo y solo aquellas con un diámetro ≥ 13 mm recibieron un embrión. Para la transferencia del embrión, cada receptora recibió una anestesia epidural (5 mL de lidocaína al 2%, Medifarma S.A. Lima-Perú). El embrión fue transferido al cuerno uterino ipsilateral del ovario donde poseía el cuerpo lúteo. El diagnóstico de gestación se determinó por palpación rectal a los 70 días post transferencia.
Análisis estadístico
Los datos registrados se sometieron a una prueba estadística no paramétrica de chi-cuadrada, evaluando los porcentajes de fertilización (72 h) y el porcentaje de producción de embriones (7 d). Los análisis estadísticos se procesaron mediante el programa R 3.5.1. y para los gráficos se utilizó del programa Microsoft Excel®. La viabilidad in vivo de los embriones se evaluó en las vacas receptoras mediante la tasa de gestación.
RESULTADOS
Fertilización y producción de embriones in vitro
La proporción de ovocitos fertilizados y medidos por la presencia de los pro-núcleos o presencia de blastómeros fueron diferentes (p=0.002108), siendo en mayor proporción los ovocitos fertilizados en el grupo control en comparación a los grupos de adición de CO2 en forma gránulos o gasificado. La producción de embriones dentro los tratamientos fueron similares (p=0.1728) observándose porcentajes de embriones parecidos en los dos tratamientos comparado con el grupo control.
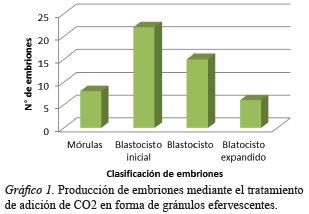
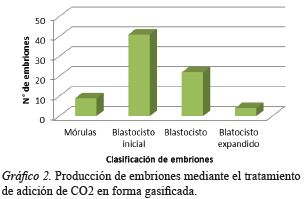
En el tratamiento de CO2 a partir de gránulos efervescentes se logró un total de 51 embriones que se clasificaron en 8 mórulas, 22 blastocitos iniciales, 15 blastocitos y 6 blastocitos expandidos 6 (Gráfico 1); además, se observaron 4 embriones detenidos en su desarrollo con 4 blastómeros y 1 embrión con 8 blastómeros, que no se consideraron en el reporte de los resultados. Para la adición de CO2 en forma gasificada de los 76 embriones producidos se clasificaron en 9 mórulas, 41 blastocitos iniciales, 22 blastocitos y 4 blastocitos expandido 4 (Gráfico 2); además, se encontraron 2 embriones con dos blastómeros, 1 embrión con 4 blastómeros, que no se consideraron en el reporte de los resultados. Finalmente, en el grupo control de los 71 embriones producidos se obtuvieron 9 mórulas, 31 blastocitos iniciales, 25 blastocitos y 6 blastocitos expandidos.
Tasa de gestación en receptoras
Los resultados de gestación después de transferir los embriones en las vacas receptoras y diagnosticadas a los 70 días por palpación rectal, resultaron 5 vacas gestantes de 13 a las que fueron transferidas embriones, resultando en 38,46% de tasa de gestación.
DISCUSIÓN
El porcentaje de fertilización en ambos tratamientos fue menor frente a los reportados, pero la tasa de producción de embriones al final del cultivo se mantuvo en porcentajes similares reportados en diferentes estudios (Dong et al., 2001; Suzuki et al., 1999). En reportes de producción de embriones en incubadoras portátiles, lograron del 52% al 76,6% de fertilizaciones (Dong et al., 2004; Dong et al., 2001; Suzuki et al., 1999; Varisanga et al., 2000), estos investigadores realizaron una aspiración parcial de aire de la incubadora portátil para proporcionar 300 mmHg de presión atmosférica, para disminuir la concentración de oxígeno entre 8 al 10% indicando que favoreció la producción de embriones, de la misma manera porcentajes de oxígeno al 5% tiene efecto positivo sobre el desarrollo temprano del embrión (Lim et al., 1999; Suzuki et al., 1999). Mientras que, en el presente estudio, se aspiró 50 cm3 de aire de la incubadora portátil para intentar que la presión atmosférica tuviese 300 mmHg, sabiendo que a una altitud de 4000 m la presión atmosférica es de 460 mm Hg (Garcia & Padilla, 2000), efecto que no se cuantificó en proporción de oxígeno y que probablemente no proporcionó el ambiente requerido, por esta razón la proporción de fertilización en el presente estudio fue menor.
Al final del cultivo, la proporción de embriones logrados en el presente estudio fueron similares a los reportados por Dong et al., (2001) y Suzuki et al., (1999). La producción de embriones in vitro del grupo control fue ligeramente mayor, pero similares a los reportados para vacunos (Hamdi et al., 2018; Hansen, 2006; Wilson et al., 2005).
La cantidad de embriones de categoría I en estado de blastocito, transferidos a vacas receptoras procedieron al azar de ambos tratamientos de adición de CO2. Posterior a la transferencia y al diagnóstico de gestación se logró 38,46% (5/13) de vacas gestantes, resultado menor comparado con los reportados en otras investigaciones. Así en estudios de transferencia de embriones frescos de producción in vitro a nivel comercial lograron entre 39 a 53% de gestaciones, al lugar de transferencia los embriones transportaron en pajillas y acondicionado en medio de mantenimiento al interior de una incubadora a 38, 5°C (Barceló-Fimbres et al., 2015; Pontes et al., 2010; Sanches et al., 2016) en comparación con lo reportado en el presente estudio donde los embriones se transportaron en pajillas a temperatura ambiental (<15°C), existen reportes que en embriones refrigerados su metabolismo es inhibido, así estos embriones deben ser capaces de mantener su viabilidad por periodos largos, pero al transferirlos estos embriones producen tasas de gestación disminuidas (Tsuchiya et al., 2013). La tasa de gestación menor en este estudio se atribuiría a la temperatura de transporte que se realizó y que afectó la viabilidad de los embriones.
La producción de embriones in vitro en la incubadora portátil adicionando CO2 en forma de gránulos o gasificado, confirma a los reportes que indican que el uso de una incubadora portátil puede ser efectivo para la producción de embriones in vitrobajo condiciones de campo (Dong et al., 2004, 2001; Kandil et al., 1999; Suzuki et al., 1999). Además, la tasa de gestación obtenida coincide con lo reportado por Dong et al. (2004) quienes indican que posterior a la transferencia de embriones in vitro producidos en incubadoras portátiles se logran gestaciones en vacas receptoras, por lo tanto, esta técnica reproductiva se puede aplicar en las condiciones del Altiplano (figura 4)
CONCLUSIÓN
La producción de embriones in vitro de vacunos en la incubadora portátil (taper), con adición del CO2 a partir de gránulos efervescentes y gasificados alcanzan 18.95% y 19.83% respectivamente menor a los producidos en incubadoras convencionales (control: 24.56%). Finalmente, la tasa de gestación alcanzada fue de 38.46% con el nacimiento de la primera cría producto de la transferencia de embriones in vitro a vacas en condiciones del Altiplano.
AGRADECIMIENTO
Un especial agradecimiento especial a los Bachilleres en Medicina Veterinaria y Zootecnia, Darwin Arqque y Madeleyne Catari, por su apoyo en todo el proceso de producción de embriones in vitro en el Laboratorio de Reproducción Animal de FMVZ-UNA-Puno-Perú.
REFERENCIAS BIBLIOGRAFICAS
Barceló-Fimbres, M., Campos-Chillón, L. F., Mtango, N. R., Altermatt, J., Bonilla, L., Koppang, R., & Verstegen, J. P. (2015). Improving invitro maturation and pregnancy outcome in cattle using a novel oocyte shipping and maturation system not requiring a CO2 gas phase. Theriogenology, 84(1), 109–117. https://doi.org/10.1016/j.theriogenology.2015.02.020 [ Links ]
Dong, Y. J., Bai, X. J., Varisanga, M. D., Mtango, N. R., Otoi, T., Rajamahendran, R., & Suzuki, T. (2004). Production of Cloned Calves by the Transfer of Somatic Cells Derived from Frozen Tissues Using Simple Portable CO2 Incubator. Asian-Australasian Journal of Animal Sciences, 17(2), 168–173. https://doi.org/10.5713/ajas.2004.168 [ Links ]
Dong, Y. J., Varisanga, M. D., Mtango, N. R., Aono, M., Otoi, T., & Suzuki, T. (2001). Improvement of the culture conditions for in vitro production of cattle embryos in a portable CO2 incubator. Reproduction in Domestic Animals, 36(6), 313–318. https://doi.org/10.1046/j.1439-0531.2001.00308.x [ Links ]
Fujii, A., Kaedei, Y., Tanihara, F., Ito, A., Hanatate, K., Kikuchi, K., ... Otoi, T. (2010). In Vitro Maturation and Development of Porcine Oocytes Cultured in a Straw or Dish Using a Portable Incubator with a CO2 Chamber, 624, 619–624. https://doi.org/10.1111/j.1439-0531.2008.01316.x
Garcia, J. C. V., & Padilla, R. P. (2000). Valores gasometricos estimados para las principales poblaciones y sitios a mayor altitud en Mexico. Revista Del Instituto Nacional de Enfermedades Respiratorias, 13(1), 6–13. [ Links ]
Hamdi, M., Lopera-Vasquez, R., Maillo, V., Sanchez-Calabuig, M. J., Núnez, C., Gutierrez-Adan, A., & Rizos, D. (2018). Bovine oviductal and uterine fluid support in vitro embryo development. Reproduction, Fertility and Development, 30(7), 935–945. https://doi.org/10.1071/RD17286 [ Links ]
Hansen, P. J. (2006). Realizing the promise of IVF in cattle — an overview, 65, 119–125. https://doi.org/10.1016/j.theriogenology.2005.09.019
Iwayama, H., Ishikawa, H., & Ohsumi, S. (2005). Attempt at In Vitro Maturation of Minke Whale (Balaenoptera Bonaerensis) Oocytes Using a Portable CO2 Incubator. J. Reprod. Dev. 51: 69-75. [ Links ]
J.J. Parrish, J.L.Susko-PArrish , M.L. Leibfried-Rutltdge, E.S. Crister, W.H. Eyestone, and N. L. F. (1986). Bovine in vitro fertilization with frozen-thawed semen. Theriogenology, Vol. 25(Nro. 4), 951–600. [ Links ]
J.M.Lim; B.C. Reggio; R.A. Godke and W. Hansel. (1999). Development of in-vitro-derived bovine embryos cultured in 5% CO2 in air or in 5% O2, 5% CO2 and 90% N2. Human Reproduction, 14(2), 458–464. [ Links ]
Kandil, O. M., Abdoon, A. S. S., Murakami, M., Otoi, T., & Suzuki, T. (1999). New technique, using a portable co<inf>2</inf> incubator, for the production of in vitro fertilized egyptian buffalo embryos. Journal of Reproduction and Development, 45(5), 1–6. https://doi.org/10.1007/978-94-007-2229-3_13 [ Links ]
Pontes, J. H. F., Silva, K. C. F., Basso, A. C., Rigo, A. G., & Ferreira, C. R. (2010). Large-scale in vitro embryo production and pregnancy rates from Bos taurus , Bos indicus , and indicus-taurus dairy cows using sexed sperm, 74, 1349–1355. https://doi.org/10.1016/j.theriogenology.2010.06.004
Sanches, B. V., Lunardelli, P. A., Tannura, J. H., Cardoso, L., Colombo, M. H., Gaitkoski, D., ... Seneda, M. M. (2016). A new direct transfer protocol for cryopreserved IVF embryos. Theriogenology.https://doi.org/10.1016/j.theriogenology.2015.11.029
Suzuki, T., Sumantri, C., Khan, N. H. A., Murakami, M., & Saha, S. (1999). Development of a simple, portable carbon dioxide incubator for in vitro production of bovine embryos. Animal Reproduction Science, 54(3), 149–157. https://doi.org/10.1016/S0378-4320(98)00134-1 [ Links ]
Tervit, H. R., Whittingham, D. G., & April, R. (1972). SUCCESSFUL CULTURE IN VITRO OF SHEEP AND CATTLE OVA Agricultural Research Council, Unit of Reproductive Physiology and Biochemistry, * Physiological Laboratory, University of Cambridge, 493–497. [ Links ]
Tsuchiya, K., Tsuda, S., Kamijima, T., Nishimiya, Y., Aoyagi, Y., & Ideta, A. (2013). A simple medium enables bovine embryos to be held for seven days at 4°C. Scientific Reports, 3(1), 1–5. https://doi.org/10.1038/srep01173 [ Links ]
Varisanga, M. D., Dong, Y., Mtango, N. R., Fahrudin, M., Wayan, K. K. N. I., & Suzuki, T. (2000). Bovine blastocyts obtained for reconstructed Cytoplast and Karyoplasts Using a simple portable CO2 incubator. Cloninng, 2(4), 167–173. [ Links ]
Walsh, S. W., Williams, E. J., & Evans, A. C. O. (2011). A review of the causes of poor fertility in high milk producing dairy cows. Animal Reproduction Science, 123(3–4), 127–138. https://doi.org/10.1016/j.anireprosci.2010.12.001 [ Links ]
Wilson, R. D., Weigel, K. A., Fricke, P. M., Rutledge, J. J., Matthews, D. L., & Schutzkus, V. R. (2005). In Vitro Production of Holstein Embryos Using Sex-Sorted Sperm and Oocytes from Selected Cull Cows. J. Dairy Sci. 88: 776–782. [ Links ]
Recibo 02/04/2019
Aceptado 06/09/2019
En Línea 25/10/2019