INTRODUCCIÓN
En la actualidad la industria alimentaria busca alternativas naturales para garantizar la inocuidad de los alimentos, así como prevenir el crecimiento de patógenos y extender la vida útil del producto. La industria alimentaria utiliza sustancias químicas que están asociadas a la resistencia antimicrobiana y problemas tóxicos (Ozdikmenli & Demirel Zorba, 2016).
Entre las bacterias patógenas presentes en la industria esta Listeria monocytogenes y Staphylococcus aureus. L. monocytogenes es una bacteria con capacidad de desarrollarse incluso bajo condiciones de refrigeración y que habitualmente ocasiona cuadros gastrointestinales, pero en personas inmunosuprimidas puede ocasionar la muerte; son microorganismos potencialmente perjudiciales para la salud del consumidor (Obaidat & Stringer, 2019).
S. aureus adquiere rápidamente resistencia antimicrobiana, como resistencia a la meticilina, que es un importante problema de salud pública (Katsarou et al., 2019). Esta bacteria puede colonizar las narinas, la piel y el pelo de animales y humanos (Voss, Loeffen, Bakker, Klaassen, & Wulf, 2005). Por lo tanto, existe el riesgo de transmisión de cepas de S. aureus a humanos y animales productores de alimentos (Pantosti, 2012).
La necesidad de nuevos desinfectantes y tratamientos para infecciones clínicas causadas por bacterias multirresistentes, ha llevado al estudio de extractos y aceites esenciales de plantas con el objetivo de utilizar antimicrobianos naturales y no químicos. Dentro de las sustancias estudiadas tenemos al aceite esencial de orégano el cual contiene moléculas bioactivas como el timol y el carvacrol (Cid-Perez, Avila-Sosa, Ochoa-Velasco, Rivera-Chavira, & Nevarez-Moorillon, 2019). Estudios realizados en México indican que el aceite esencial de orégano (Lippia berlandierimuestra), presenta eficacia antimicrobiana contra aislados clínicos resistentes a múltiples fármacos (Zapien-Chavarria et al., 2019).
El nombre común del orégano es utilizado en varias especies: Origanum (familia: Lamiaceae) y Lippia (familia: Verbenaceae), entre otras. Los principales compuestos antimicrobianos identificados en los diferentes aceites esenciales de orégano (AO) son el carvacrol y el timol. Sin embargo, su contenido puede variar según la especie, temporada de cosecha y origen geográfico (Rodriguez-Garcia et al., 2016).
El timol y el carvacrol son los componentes antimicrobianos de mayor importancia presentes en AO, estos compuestos desintegran la membrana externa de las bacterias Gram negativas, liberando parte del lipopolisacárido y, por lo tanto aumenta la permeabilidad del ATP (trifosfato de adenosina) en la membrana citoplasmática produciendo poros en está, y lisando a la bacteria (Abdul Qadir, Shahzadi, Bashir, Munir, & Shahzad, 2017).
En la actualidad la industria alimentaria utiliza sustancias químicas para prevenir la contaminación de los alimentos durante su producción y elaboración y aumentar su vida útil durante el almacenamiento. Muchas de estas sustancias pueden producir en el consumidor intoxicaciones alimentarias y en algunos casos resistencia antimicrobiana (Lee, Kim, Kim, Beuchat, & Ryu, 2018). El AO es una alternativa natural que puede realizar la función de desinfectar. Por ello, el presente estudio tuvo por objetivo evaluar del efecto antimicrobiano del aceite esencial del orégano (Origanum vulgare), proveniente de Concepción, región Junín -Perú, frente a Listeria monocytogenes y Staphylococcus aureus.
MATERIALES Y MÉTODOS
Extracción de aceite esencial
El orégano fresco (7,5 kg), proveniente de la provincia de Concepción, región Junín -Perú; se deshojó y deshidrató a 35ºC durante 9 horas en un deshidratador de alimentos (BLANICK modelo BDA020). La obtención del aceite esencial se realizó por hidrodestilación durante 2 h utilizando 3 litros de agua. El producto obtenido fue colectado en una pera de decantación; posteriormente el aceite fue deshidratado con sulfato de sodio anhídrido (5g). El AO se almacenó a 4°C hasta su uso (Tohidpour, Sattari, Omidbaigi, Yadegar, & Nazemi, 2010).
Rendimiento del aceite esencial (AO)
El rendimiento fue calculado dividiendo la cantidad de AO obtenido entre el peso de masa en seco multiplicado por cien (Pino, Gaviria, Quevedo-Vega, García-Lesmes, & Quijano, 2010).
Cromatografía de gases-análisis de espectrometría de masas del aceite esencial del orégano.
Los aceites esenciales fueron analizados en un cromatógrafo de gases Agilent Technologies 7890 acoplado a un espectrómetro de masas Agilent Technologies 5975C. Se utilizó una columna J&W 122-1545.67659 DB-5ms, (60 m x 250 μm x 0.25 μm). El programa de temperatura fue 40 °C de inicio con incrementos de 5 °C/min hasta 180 °C; seguido de aumentos de 2.5 °C/min hasta 200 °C por 5 min y finalmente 10 °C/min hasta 300 °C, manteniéndose por 3 minutos.
El inyector se mantuvo a 325ºC. La muestra (20 μL) se diluyó en diclorometano (1 mL). Se usó helio como gas portador con un caudal de 1 ml/min. La ionización se realizó por impacto de electrones a 70 eV. El perfil de los compuestos químicos fue determinado por comparación de los tiempos de retención y los patrones de fragmentación presentes en la base de datos del cromatógrafo (García-Díez, Alheiro, Falco, Fraqueza, & Patarata, 2017).
Microorganismos y condiciones de crecimiento.
Las cepas de Listeria monocytogenes (ATCC 19115) y Staphylococcus aureus (ATC 25923) fueron obtenidas del laboratorio Gen Lab. Ambas cepas fueron mantenidas a 4ºC hasta el momento de ser cultivadas en Agar Triptona Soya (TSA, Merck). La incubación se realizó a 37°C durante 24 h para ambas cepas.
Ensayo de difusión en disco (DDA).
El perfil inhibitorio del AO se analizó mediante el DDA (ZAIKA, 1988). Se realizó la siembra del inóculo bacteriano (0.5 en la escala de McFarkand) sobre la superficie del agar Mueller-Hinton con un hisopo estéril, después se colocó sobre la superficie los discos de papel filtro (Whatman No.1, 6 mm de diámetro, GE Healthcare, Madison, WI, EE. UU.), que contenían el aceite esencial (0,25%, 0,5%, 2%, 4%, 6%, 8%, 10%, 12%, 16%, 20%, 32%).
Las placas se mantuvieron a 4ºC durante 2 h para permitir la dispersión del aceite y luego se incubaron las 11 concentraciones por 24 h por cada microorganismo. El perfil inhibitorio fue evaluado visualmente, observándose como un halo de inhibición que rodea el disco. Los resultados fueron obtenidos a partir de la media de 3 evaluaciones por cada concentración de AO.
Determinación de la Concentración Mínima Inhibitoria (CMI) y Concentración Mínima Bactericida (CMB).
Las diluciones de los AO se establecieron en base al perfil inhibitorio con el DDA, asimismo los rangos finales de concentración de los AO fueron de 0.25% al 10%, estos rangos se eligieron en base a investigaciones publicadas (Ozdikmenli & Demirel Zorba, 2016).
La determinación del CMI y CMB, se basó en el procedimiento del Instituto de estándares clínicos y de laboratorio con placas de micro titulación de 96 pocillos (Balouiri, Sadiki, & Ibnsouda, 2016). Para CMI se consideró la concentración más baja del AO en la cual las bacterias no crecieron, los valores de la densidad óptica fueron obtenidos mediante un espectrofotómetro. Para determinar la CMB, se evaluó la supervivencia de las bacterias expuestas a diferentes concentraciones de AO, para ello, se tomó una muestra de cada pocillo y se sembró en placas Petri con agar Baird Parker para S. aureus. La evaluación de L. monocytogenes se hizo mediante la hibridación de ADN usando el kit Gene Quence de L. monocytogenes. La CMB es la concentración más baja que produce una reducción en la población bacteriana hasta el 99.9%.
Hibridación de ADN con el kit GeneQuence de Listeria monocytogenes
Se tomó una muestra de cada uno de los pocillos de las placas de microtitulación y se sembraron en agar Cerebro Corazón Infusión, se removieron con un asa de siembra e introdujeron en un vial conteniendo 1 ml de solución salina amortiguada por fosfatos (PBS), posteriormente se extrajo 0.4 µl para la prueba y se colocó en viales. Se usó este kit comercial ya que posee una sensibilidad del 96.2% y especificidad del 100% (Barrientos H, Lucas L, Ramos D, Rebatta T, & Arbaiza F, 2015). Se siguieron las instrucciones del protocolo del kit y se leyeron las densidades ópticas a través del espectrofotómetro a 450 nm.
RESULTADOS
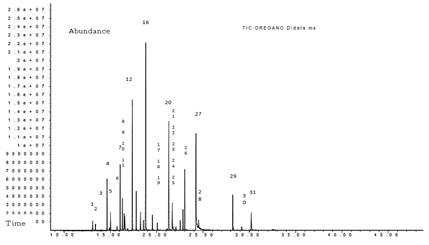
El análisis taxonómico, realizado en el Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos, clasificó al orégano utilizado como Origanum vulgare. El rendimiento del AO fue de 1,31%.Tabla 1 muestra como compuestos químicos mayoritarios a monoterpenos como el timol (11.9%) y carvacrol (1.7%), asimismo la Figura 1 muestra el cromatograma de la GC-MS.
Tabla 1 Composición Química del Origanum vulgare del Orégano por GC-MS
| Componente | % | TR(min) | |
|---|---|---|---|
| 1 | α-Tujeno | 0,77 | 13,08 |
| 2 | α-Pineno | 0,52 | 13,38 |
| 3 | Sabineno | 4,44 | 14,64 |
| 4 | β-Pineno | 0,23 | 14,87 |
| 5 | β-Mirceno | 1,44 | 15,01 |
| 6 | α-Felandreno | 0,32 | 15,72 |
| 7 | α-Terpineno | 5,57 | 16,06 |
| 8 | o-Cimeno | 2,73 | 16,30 |
| 9 | 1-metil-5-(1-metiletenil)-Ciclohexeno | 1,98 | 16,47 |
| 11 | β-cis-Ocimeno | 0,16 | 16,85 |
| 12 | γ-Terpineno | 11,8 | 17,37 |
| 14 | 1-metil-4-(1-metiletiliden)-Ciclohexeno | 1,57 | 18,25 |
| 15 | β-Linalool | 0,81 | 18,57 |
| 16 | Cis-β-Terpineol | 20,68 | 18,82 |
| 17 | Trans-1-metil-4-(1-metiletil)-2-Ciclohexen-1-ol | 1,39 | 19,53 |
| 20 | L-4-terpineol | 10,09 | 21,30 |
| 21 | α-Terpineol | 2,5 | 21,69 |
| 27 | Timol | 11,90 | 24,24 |
| 28 | Carvacrol | 1,7 | 24,51 |
| 29 | β-Cariofileno | 3,31 | 28,21 |
Nota: TR = Tiempo de retención
El AO mostró actividad antimicrobiana contra S. aureus y L. monocytogenes. La Tabla 2 muestra la CMI y CMB del AO frente S. aureus y L. monocytogenes.
Tabla 2 Zonas de inhibición mediante el DDA, CMI y CMB del aceite esencial del orégano contra S. aureus y L. monocytogenes
| Aceite esencial | Prueba | Staphylococcus aureus | Listeria monocytogenes |
|---|---|---|---|
| Orégano | DDA (mm) | 24 | 12 |
| CMI (%) | 2% | 4% | |
| CMB (%) | 4% | 4% |
Nota: DDA= Ensayo de difusión en disco; CMI= Concentración mínima de inhibitoria; CMB= Concentración mínima de bactericida
DISCUSIÓN
La composición química del AO representado en la Tabla 1, depende de diversos factores como la genética, la temporada de cosecha y el lugar geográfico (Shange, Makasi, Gouws, & Hoffman, 2019). El orégano utilizado en el estudio, fue recolectado por el productor antes de la floración en la provincia de Concepción, Región Junín (Perú) ubicada a 3068 msnm. Este orégano es vendido localmente y en la ciudad de Lima, siendo utilizado para la preparación de alimentos. Sin embargo, la literatura indica que el tiempo ideal para la recolección es cuando las plantas comienzan a florear entre un 15 a 20%, y alcanzan entre 45 a 55 cm de altura. En este momento las hojas presentan un aroma intenso y se encuentran bien desarrolladas (Yilmaz & Jasinskas, 2016).
Un estudio en Perú evaluó los ecotipos de Origanum vulgare ssp. procedentes del valle de Urubamba-Cusco y presentó porcentajes de timol (entre 18.3 y 2.3) y carvacrol (entre 2.04 y 0.20) valores similares al encontrado en el presente estudio. Estos bajos porcentajes están asociados, al bajo estrés hídrico que se presenta cuando la planta se desarrolla a baja altitud (3092 - 3260 msnm) (Tellez Monzon, 2017). El orégano usado en este estudio fue cultivado en Concepción, provincia que cuenta con condiciones similares a las descritas por Téllez; por ello, los valores encontrados de timol y carvacrol son bajos.
El carvacrol y el timol, compuestos fenólicos monoterpenos, son los principales responsables de la actividad antimicrobiana del AO (Zairi et al., 2019). Por ello, se investiga al AO como un desinfectante natural que puede ser una alternativa al uso de desinfectantes químicos que presentan derivados tóxicos cancerígenos con efectos residuales como trihalometanos y cloraminas (Ding et al., 2018). Investigadores sugieren más estudios para determinar al AO como un desinfectante de amplio espectro, ellos sugieren que se debe de enfrentar a diferentes bacterias y utilizar combinaciones con otros aceites esenciales para evaluar el posible sinergismo (Santos et al., 2017).
La industria alimentaria utiliza compuestos químicos que están asociados a la resistencia antimicrobiana y toxicidad, actualmente se adicionan antimicrobianos a los piensos y al agua para promover el crecimiento y aumentar la eficiencia alimentaria; esta exposición prolongada a dosis bajas de antimicrobianos tiene probabilidad de dar origen a la aparición de resistencias en animales productores de alimentos; las bacterias resistentes exigen un tratamiento más difícil y caro (Rana, Lee, Kang, & Hur, 2019). El aceite esencial del orégano podría ayudar en el tratamiento como un antimicrobiano natural ya que presentó efecto antimicrobiano frente a S aureus y L. monocytogenes.
La Tabla 2 indica la CMI y CMB del aceite esencial de orégano; estas concentraciones son altas si lo comparamos con lo obtenido en Chile donde obtuvieron una CMI de 0,04% para S. aureus multirresistente (Lofa et al., 2019). Otro estudio determinó que las CMI y CMB del AO mexicano (Poliomintha longiflora) enfrentado a S. aureus, fue de 0,025% y 0,05% respectivamente. El AO de esa especie presento altos contenidos de timol y carvacrol (28,31% y 17,06%) (Cid-Perez et al., 2019).
Un estudio realizado en el año 2018 en Houston (Estados Unidos) encontró que no hay diferencia en la susceptibilidad al AO, de cepas de S. aureus resistente (MRSA) y sensibles a la meticilina (MSSA), observándose que el AO tiene actividad antimicrobiana. En este estudio se determinó valores de 6.62% para timol y 72.25% para carvacrol. Ellos concluyen que el alto porcentaje de carvacrol altera la pared bacteriana y otras estructuras celulares produciendo la muerte de la bacteria y que el orégano puede ser una alternativa al uso de antibióticos en infecciones bacterianas susceptibles a antibióticos (Lu, Dai, Murray, & Wu, 2018).
Un estudio realizado en el año 2017 en México determino que el timol y carvacrol alteran las proteínas y lípidos de la pared celular y membrana citoplasmática; además de alterar la síntesis de ARN, la actividad ATPasa, etc. El AO causa desequilibrio en la presión osmótica intracelular debido a la fuga de contenido citoplasmático producto de la lesión a nivel de la pared celular y la membrana citoplasmática. Finalmente, la formación de vacuolas citoplasmáticas pueden llegar a producir la necrosis celular (Tapia-Rodriguez et al., 2017).
El uso indiscriminado de antibióticos como profiláctico o promotor de crecimiento; en la producción de animales de abasto; es una de las causas para el desarrollo de cepas de L. monocytogenes resistente a antibióticos (Olaimat et al., 2018). En el año 2019 se analizaron varias publicaciones sobre L. monocytogenes, determinándose que esta bacteria está presente en alimentos de origen animal siendo muchas veces resistente a antibióticos como: la penicilina, la ampicilina y la gentamicina (Khademi & Sahebkar, 2019).
La CMI y CMB del AO frente a Listeria monocytogenes obtenida en el presente estudio fue de 4% y >4%, respectivamente. Un estudio en el cual se evaluó la influencia de la composición del alimento y de aditivos alimentarios (lactato de sodio, fosfato y nitrito sódico) sobre el efecto antimicrobiano del AO. Determinó una CMI y CMB del AO de 0,005% y >0,005%, respectivamente, frente a L. monocytogenes. Ellos atribuyen la actividad inhibitoria del AO para L. monocytogenes a su principal compuesto químico que fue el timol (93,34%) (Garcia-Diez et al., 2017). En el presente estudio el nivel de timol fue de 11,9%, este bajo porcentaje hace que la CMI y CMB sean más elevados. Sin embargo, el AO en estudio puede ser utilizado con un antimicrobiano natural frente a L. monocytogenes resistentes a antimicrobianos.












 uBio
uBio