INTRODUCCIÓN
Physalis peruviana (L.), es una Solanaceae, conocida como “aguaymanto”, “tomate silvestre”, “uchuva”, “cereza de Perú” etc. y nativa de las regiones andinas de Perú. Se conocen más de noventa especies de este género, de las cuales alrededor de cincuenta son especies silvestres. El “tomate silvestre” es una hierba semileñosa y perenne muy ramificada, su fruto, de sabor semiácido, es una baya de color amarillo a anaranjado brillante. Se propaga por semillas o también por propagación asexual, siendo el primero el método más usado, aunque no sea el método más recomendado para la producción de semillas; debido, a la variabilidad genética (Morillo-Coronado et al., 2018; Chacón et al., 2016).
En los últimos años el “aguaymanto” se ha vuelto popular; debido, a sus propiedades nutricionales y medicinales. Sus propiedades nutricionales se les atribuye a los altos niveles de vitaminas A, C y complejo B. Sus propiedades medicinales le permiten ser utilizado como antidiabético (disminuye la glicemia postprandial), antioxidante, antiasmático, diurético, antiséptico y otras. Es un cultivo de importancia económica en países como Colombia, Ecuador y Perú; por ello, se hacen necesarias formas de propagar de manera rápida el cultivo; además, de buscar alternativas para su mejora (Yucesan, et al.,2015; Garzón-Martinez et al., 2015; Castro et al., 2015; Garcia-Osuna et al., 2015).
En la actualidad la estandarización de protocolos de cultivo in vitro con tejidos de alta respuesta de regeneración es parte importante del proceso de micro propagación masiva; además es el punto de partida para poder aplicar técnicas de mejoramiento como la obtención de plantas haploides y la transformación genética (Leakey, 2014; Swartwood y Van Eck, 2019).
Entre las técnicas de cultivo de tejidos in vitro la organogénesis representa una buena alternativa para aumentar la tasa de multiplicación vegetal; también, es una buena herramienta para inducir cambios a nivel genético (Su y Zhang, 2014; Sugiyama, 2014). La organogénesis es la capacidad para regenerar plantas a partir de células indiferenciadas que son sometidas a un estímulo y como consecuencia se reorganizan para desarrollar un meristemo. Comprende la formación de yemas, brotes o de meristemas radicales a partir directamente de explantes (organogénesis directa) o previa formación de un callo (organogénesis indirecta). En la competencia morfogenética, los explantes adquieren la habilidad de responder a señales hormonales de inducción de órganos. Este proceso se conoce también como desdiferenciación. Estas señales hormonales, especialmente auxinas y citoquininas, requieren ser aplicados de manera simultánea o secuencial; además, de depender de la habilidad de los tejidos para responder a estos cambios. (Morillo-Coronado et al., 2018, Sugiyama, 2014).
Revisando la bibliografia internacional encontramos el trabajo de Guney et al. (2016) quienes micropropagaron esta especie a partir de brotes apicales; luego, Rao et al,(2014) lograron regenerar plantas de Physalis pubescens a partir de segmentos nodales y hojas vía organogénesis utilizando BAP y ANA. Antes (2013) indujo rizogénesis en la misma especie empleando las mismas hormonas a diferentes concentraciones; luego, Sandhya y Rao (2015) trabajando con segmentos nodales de Physalis minima indujeron organogénesis con 2,4 D y KIN a varias concentraciones; y observaron alta frecuencia de inducción de brotes con BAP y KIN, y otros investigadores obtuvieron mayor regeneración en explantes de hojas y nudos utilizando BAP y KIN. (Otroshy et al., 2013).
Revisando la literatura del país no encontramos trabajos sobre organogénesis; pero, si sobre micropropagación, como la tesis de Ventura (2019) que se refiere al efecto del manitol y sorbitol sobre el desarrollo de microesquejes cultivados in vitro encontrando buenos resultados con ambas sustancias osmóticas. Otra tesis de Ventura (2016) logró evaluar el efecto del ácido giberélico y bencilaminopurina con resultados satisfactorios con ácido giberélico.
Debido a la creciente demanda del “aguaymanto” en el mundo, éste se ha convertido en una buena alternativa de producción en el Perú y en Sudamérica; pero, hay problemas que resolver como la variación genética, que no garantiza que se obtenga una población homogénea (característica de gran importancia en la agricultura); por ello, es necesario establecer protocolos de propagación rápidos que permitan la producción de plantas con características uniformes; por lo que , en el presente trabajo se planteó como objetivo inducir brotes y raíces en hipocótilos y cotiledones de P. peruviana L. “aguaymanto” utilizando distintas concentraciones de 6-bencilaminopurina (BAP) y ácido 2,4-diclofenoxiacético (2,4-D).
MATERIAL Y MÉTODOS
MATERIAL
Los frutos de P. peruviana “aguaymanto” fueron adquiridos en el mercado central de la ciudad de Trujillo.
METODOS
En el laboratorio se procedió a su desinfección utilizando alcohol etílico al 70% e hipoclorito de sodio al 2.5%. Luego se cortaron los frutos para extraer las semillas que, posteriormente, fueron sembradas en medio de cultivo de Murashige y Skoog (MS, 1964) y suplementado con sacarosa (3%), agar (0.8%), tiamina-HCl (0.4 ppm) y mio-inositol (100ppm). Después de 20 días, las plántulas in vitro se utilizaron para el experimento.
Para preparar los diferentes tratamientos se utilizó las sales de MS, al cual se agregó sacarosa (3%), fitagel (0.5%), tiamina HCl (0.4 ppm), mio-inositol (100 ppm), suplementado con ácido 2,4-diclorofenoxiacético (2,4-D) y 6-bencilaminopurina (BAP) según las concentraciones que se muestran en la Tabla 1.
Tabla 1 Composición de los distintos tratamientos para la regeneración de hipocótilos y cotiledones de P. peruviana L .
| Tratamientos | T1 | T2 | T3 | T4 | T5 | T6 | T7 | T8 | T9 |
|---|---|---|---|---|---|---|---|---|---|
| Componentes mg/L | |||||||||
| 2,4-D | 0,25 | 0,25 | 0,25 | 0,5 | 0,5 | 0,5 | 1,0 | 1,0 | 1,0 |
| BAP | 0,1 | 0,25 | 1,0 | 0,1 | 0,25 | 1,0 | 0,1 | 0,25 | 1,0 |
De las plántulas in vitro se procedió a aislar el hipocótilo y los cotiledones. Los hipocótilos se cortaron en porciones de 1cm; mientras, que los cotiledones completos fueron introducidos con su lado adaxial en contacto con el medio de cultivo. Se introdujeron 30 explantes por tratamiento. Éstos se mantuvieron expuestos a fotoperiodos de 16 horas luz y 8 horas oscuridad, a temperatura promedio de 25 °C durante 70 días. Se aplicó un diseño experimental completamente al azar con tres repeticiones y 10 unidades experimentales por cada repetición.
Se evaluó la presencia o ausencia de callos, el número de explantes con presencia o ausencia de brotes y raíces, el número de raíces por explante y la elongación (cm) de las mismas, y el número de hojas. Se seleccionaron explantes de cada tratamiento, se fijaron en solución AFA, por 48 horas; luego, se procedió a realizar cortes histológicos al micrótomo de 25 micras. Las observaciones se hicieron utilizando un microscopio óptico Olympus y una cámara fotográfica. Para conocer la diferencia estadística de los datos se aplicó el Análisis de Varianza (ANAVA) con un nivel de confianza del 95%, utilizando el programa SPSS Statistics 21.
RESULTADOS
Tabla 2 Promedio y porcentaje de explantes con formación de raíz en hipocótilos y cotiledones de P. peruviana.
| T1 | T4 | T7 | T8 | T9 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| N° | % | N° | % | N° | % | N° | % | N° | % | ||
| Hipocótilos | ---- | ---- | ---- | 2.33a | 23.3 | 1.67b | 16.7 | 0.33c | 3.33 | ||
| Cotiledones | 0.33a | 3.33 | 0.33b | 3.33 | 2.33c | 23.3 | 7.33d | 73.3 | 7e | 70 | |
*Letras diferentes, por explante, indican diferencias significativas, puesto que el valor-P de la prueba-F es menor que 0.05, existe una diferencia estadísticamente significativa entre la media de número de explantes con formación de raíz en hipocótilos y cotiledones entre un nivel de tratamiento y otro, con un nivel del 95.0% de confianza.
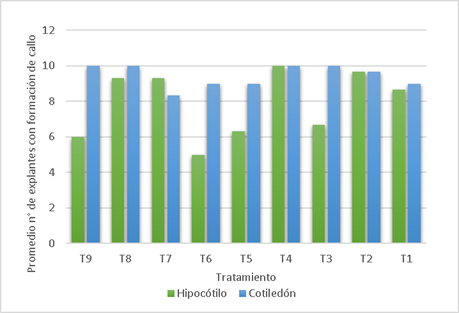
En todos los tratamientos (Fig. 1) se obtuvieron callos para ambos tipos de explantes. Para los hipocótilos en T4 (0.5 ppm de 2,4-D y 0.1 ppm de BAP) todos los explantes fueron inducidos a callos (100%), y en T6 sólo se obtuvo el 50 %. Para los cotiledones hubo 100% de callos inducidos en T3 (0.25 2,4-D - 1 BAP), T4, T8 (1 2,4-D - 0.25 BAP) y T9 (1 2,4-D - 1 BAP), los demás tratamientos no disminuyeron del 80%. La presencia de raíces solo se presenta en cinco tratamientos, así en hipocotilos se observa en T7, T8 y T9 (1 2,4-D - 0.1 BAP), siendo este último el de más alto porcentaje (23.3%). En cotiledones, además de los mencionados para hipocotilos, se incluye a T1 y T4 siendo T8 el de más alto porcentaje (73.3%) Los tratamientos T2, T3, T5 y T6 no indujeron la formación de raíces en ambos tipos de explantes (Tabla 2).
Los callos se presentan de diferentes formas y colores (Fig. 2a), las raíces adventicias primero emergen como una protuberancia luego se alargan, son transparentes con abundantes pelos radiculares (Fig. 2b), para finalmente tomar un color crema, sin pelos radicales (Fig. 2c) con emergencia y desarrollo del brote con hojas (Fig. 2d).
Tabla 3 Promedio de número de raíces por explante y longitud promedio de raíces por explante formadas en hipocótilos y cotiledones de P. peruviana. Se presentan los tratamientos que indujeron raíces en los explantes
| Tratamientos | T1 | T4 | T7 | T8 | T9 | |||||
| Explantes | Nr | Lr | Nr | Lr | Nr | Lr | Nr | Lr | Nr | Lr |
| H | ---- | --- | ----- | ---- | 1,4 | 0,3a | 0,37 | 0,12a | 0,03 | 0,04a |
| C | 0,17 | 0,18a | 0,37 | 0,3b | 1,07 | 0,3c | 16,3 | 4,36d | 16,5 | 5,13e |
*Letras iguales, por explante, indican que no hay diferencias significativas entre tratamiento, letras diferentes si hay diferencias significativas entre tratamientos con un nivel del 95% de confianza. Nr: número de raíces por explante, Lr: longitud promedio de raíces por explante, H: hipocótilos, C: cotiledones, T: tratamientos, E: explantes
En la Tabla 3 observamos que los hipocótilos forman una raíz por explante (T7), en cambio los cotiledones forman hasta 16 raíces por explante en T8 y T9. La longitud de las raíces (cm) llega a 0.12 en T8 para hipocótilos y en cotiledones llegan de 4.36 (T8) hasta 5.13 en T9. El tratamiento T9 fue el único que presentó formación de brotes y hojas (Tabla 4, Fig. 2).

Fig. 2 Callos de P. peruviana inducidos en cotiledón a los 30 días (a). Formación de raíces en T7 a los 60 días a partir de hipocotilo (b) y desarrolladas a partir de cotiledones (c) a los 70 días. Plántulas regeneradas (d).
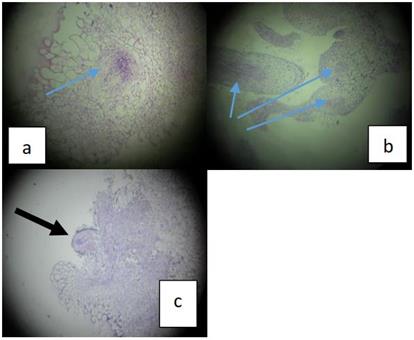
Fig. 3 Presencia de nuevas células (meristemoide) que darán origen a un nuevo órgano. en T9. Varios centros de origen de nuevos órganos (b) y formación de raíz (c) a los 40 días. (Microfotografía de corte histológico de callo. 400x. Coloración hematoxilina.
DISCUSIÓN
Los cotiledones presentan alta competencia para formar callos en relación a los hipocótilos; según lo observado en la Fig. 1, lo cual no concuerda con lo expuesto por Sandhya y Rao (2015), quienes al evaluar diferentes tipos de explante en P. minima, encontraron que los tallos presentaban mejor respuesta a la inducción de callos seguido por los nudos y las hojas. Esto se debe a la habilidad de cada tipo de explante a responder a los cambios generados por las auxinas y citoquininas presentes en el medio de cultivo, ya que las distintas partes de una planta pueden responder de diferente manera ante las mismas condiciones de cultivo. Según Pan et al. (2019), la callogénesis está íntimamente ligada a la adición de auxinas al medio de cultivo, si previamente todos los explantes son expuestos al 2,4-D, y que el efecto de éstas podría potenciarse al agregar una citoquinina en el mismo medio. Además, la proliferación de la masa de callos puede deberse al efecto de las auxinas sobre el ciclo celular, ya que en forma combinada con las citoquininas promueven la disociación de tejidos en grupos celulares. Asimismo, el potencial regenerativo del explante utilizado para inducción de callos largamente depende de su estado de desarrollo (Radhakrishnan et al. 2018, Tymoszuk y Antkowiak 2018).
En los cotiledones (Tabla 2 y 3; Fig. 2 y 3), cuando fueron expuestos al tratamiento T8 (1,0 de 2,4-D + 1,0 de BAP), se tuvieron las mejores respuestas en la inducción de raíces, sea en número y longitud de las mismas por explante, cuando fueron expuestas a concentraciones iguales de auxina y citoquinina, coincidiendo con Otroshy et al, (2013). Las hormonas exógenas utilizadas, accionan a las hormonas endógenas y así afectan los eventos regulatorios que controlan el nivel hormonal del explante. Además, el solo uso de citoquininas, en la experiencia el BAP, no es suficiente para inducir los cambios moleculares y divisiones celulares requeridas para establecer la pluripotencia y su habilidad regenerativa en los explantes; como lo sostienen Radhakrishnan et al. (2018). Otros autores reportan que se puede inducir raíces utilizando solo auxinas, como los trabajos de Aniel et al., (2015) en P. angulata; Jahirhussain et al. (2016), Sandhya y Rao (2015) en P. minima.
El proceso de regeneración del explante (Tabla 4) se debe a la pluripotencia celular en la cual cualquier célula somática es capaz de desdiferenciarse y regresar a su estado proliferativo (meristemoide, Fig. 3) según Greb y Lohmann (2016) este proceso requiere considerable energía, ya que incluye no solo células madre sino, divisiones celulares rápidas para formar el primordio de la raíz (Chen et al., 2014) o también requerir Ca y H2O2 como sugiere Xu (2018).
CONCLUSIONES
Se logró regenerar brotes y raíces en cotiledones de P. peruaviana lo cual representa una gran capacidad regenerativa y una alternativa en la propagación masiva in vitro de este cultivo.
Los reguladores del crecimiento utilizados influenciaron en la regeneración in vitro, siendo la combinación adecuada 1,0mg/L de 2,4-D+ 1,0 mg/L de BAP para los cotiledones
Los explantes utilizados formaron callos en todos los tratamientos que contenían combinaciones de auxinas y citoquininas.












 uBio
uBio