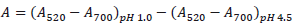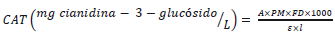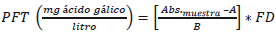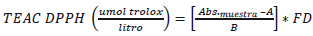INTRODUCCIÓN
la Región Apurímac - Perú presenta una enorme biodiversidad por sus diferentes ecosistemas que presenta y tiene una enorme variabilidad de flora silvestre como el caso del fruto nativo (Muehlembeckia volcanica) (Navarro, 2018). Este fruto por su colorante azul oscura y la solubilidad en el agua puede ser de gran potencial antocianico el mismo que reemplazaría a los colorantes artificiales utilizados normalmente en el procesamiento de alimentos y bebidas.
Las antocianinas son pigmentos solubles en agua que pertenecen a la familia de los flavonoides (compuestos fenólicos), son glicosidos de antocianidinas derivados del 2-fenilbenzopirilio (ion flavilio) (Welch, Wu, & Simon, 2008), que contienen dos anillos aromáticos (A y B) separados por un oxígeno que está formando un anillo heterocíclico de seis miembros (anillo C) (Zhao et al., 2017).
Las antocianinas son comúnmente sintetizadas por las plantas y son las responsables, bajo diferentes condiciones de pH, de los colores rojo, naranja, azul y púrpura de muchas flores, frutas y verduras (Navas et al., 2012). La presencia de antocianinas en diversas partes de la planta es de gran importancia, se sabe que las antocianinas juegan un papel importante en la ecofisiologia y en la propagación de plantas; ayudan a atraer polinizadores y participan en los mecanismos de defensa de las plantas contra factores de estrés bióticos y ambientales (Menzies et al., 2016).
Investigaciones realizadas mencionan que las antocianinas y sus derivados son aliados para la salud humana, se ha encontrado que son antioxidantes (Wang et al., 2018), (Cervantes, Barragán, & Chaquilla, 2019); anticancerígenos (Bontempo et al., 2015); tienen actividad antidiabética (Hong et al., 2013); contra la obesidad (Xie, et. al., 2018); previenen enfermedades cardiovasculares (Cassidy, 2018), generan un efecto protector en la prevención de procesos degenerativos de enfermedades cancerígenas (Nardini & Garaguso, 2020) y tienen potencial para prevenir la pérdida de memoria y enfermedades neurodegenerativas (Saulle, Semyonov, & La Torre, 2013).
La importancia de esta investigación se basa en el estudio de los colorantes del fruto de Muehlembeckia volcanica, que podrían ser aprovechados como fuente de compuestos bioactivos y antocianicos para su uso en la industria de alimentos y bebidas. Este fruto requiere una evaluacion de sus componentes bioactivos (Altemimi et. al., 2017) y la determinacion de su capacidad antioxidante (Cömert, Mogol, & Gökmen, 2020).
Existen diversas investigaciones que han confirmado los beneficios para la salud que aporta la ingesta de frutas y verduras ricas en antioxidantes, principalmente en la reducción de enfermedades cardiovasculares (Rangel et. al., 2015), efecto protector en la prevención de procesos degenerativos de enfermedades cancerígenas, mostrar actividad antioxidante (Nardini & Garaguso, 2020), atrapar radicales libres y actuar como agentes quimioprotectores.
Investigaciones sobre esta especie la consideran como un alimento nutraceútico y funcional de gran interés para la agroindustria alimentaria por su alto contenido de antocianinas monoméricas totales y fenolicos. Los frutos que poseen una coloración roja azul o morada son considerados como colorantes alimenticios y como antocianinas que son agentes potenciales en la obtención de productos con valor agregado para el consumo humano (Garzón, 2008). Sin embargo se requieren investigaciones basicas sobre la Caracterización de antocianinas y capacidad antioxidante en extractos de Muehlembeckia volcanica.
Se plantea la hipótesis de que los frutos nativos pigmentados de color azul y rojo poseen compuestos fenólicos y antocianinas (Haddar et. al., 2018).
El objetivo general de éste trabajo de investigación es determinar sus componentes bioactivos y capacidad antioxidante en extractos de frutos de Muehlembeckia volcanica
Identificar por espectroscopia UV-Vis, FTIR-ATR y HPLC los compuestos bioactivos en extractos de frutos nativos de Muehlembeckia volcanica.
Determinar el contenido de antocianinas CAT y polifenoles totales PFT en extractos de frutos nativos de Muehlembeckia volcanica.
Determinar la capacidad antioxidante en extractos de frutos nativos de Muehlembeckia volcanica.
MATERIALES Y MÉTODOS
Material vegetal: Los frutos nativos de (Muehlembeckia volcanica) fueron recolectados en el distrito de Circa, Provincia Abancay, Apurímac - Perú a 3120 m.s.n.m. (Figura 1).
Extraccion antociánica: Se extrajo los pigmentos antociánicos con metanol acidificado al 0.01% en una relacion frutos:solvente (10:100) (p/v) previamente molido se filtró, concentró en rotavapor,se centrifugó y decantó para su posterior análisis, purificación y evaluación del extracto (Castillo et al., 2010), (Barragán, Aro, Meléndez, & Cartagena , 2018)
Espectrofotometría UV -Vis: Los espectros se leyeron en un rango de longitud de onda de 190 a 1100 nm en un espectrofotómetro Thermo Scientific GENESYS 180S UV VIS en cubetas de cuarzo de 10 mm de espesor con velocidad de registro de 1600 nm/min, con 5 nm de resolucion de datos usando metanol como solvente (Barragán et al., 2018).
Espectrometría FTIR-ATR: Los espectros se realizaron en un intervalo de 4000 a 600 cm-1 en número de onda y en unidades de transmitancia, en un Espectrómetro FTIR - ATR Nicolet™ iS-10. Las muestras semisólidas se aplicaron en el aditamento ATR (Barragán, et al., 2018) y el procesamiento de los espectros se realizó mediante el Software OMNIC (Paraíso et al., 2020).
Identificación por Cromatografía HPLC
El HPLC fué usado para separar las antocianinas del extracto que fué filtrada usando cartucho Sep-Pak C-18 corto y recuperada con metanol acidificado al 0.01% HCl, y fué analizada por HPLC serie 1200 Agilent Technologies con detector DAD bajo las siguientes condiciones. Columna Eclipse XDB-C18 columna, 4.6 mm x 150 mm 5 um, temperatura de la columna 30°C, presión de trabajo 158 bar, volumen de inyección 2 uL, rango de flujo 1.0 mL/min, fase móvil eluyente A: (Acido fórmico: agua) (1:9); eluyente B: Acetonitrilo y en gradiente. La identificación de los picos de las antocianidinas fué realizada en base a la comparación de los cromatogramas a 520 nm y tiempos de retención de los extractos concentrados de antocianidinas de las especies (uva y fresa), corridos bajo las mismas condiciones especificadas anteriormente para tener patrones de comparación que nos ayudaron a identificar los picos del cromatograma en extractos de frutos nativos de Muehlembeckia volcanica (Del Carpio, Serrano, & Giusti, 2009), (Vieira et. al., 2017).
Cantidad de antocianinas totales (CAT): La Cantidad de antocianinas totales se determinó según el método de pH diferencial (Giusti & Wrolstad., 1996), (Barragán. et al., 2018) usando dos sistemas buffer: cloruro de potasio (KCl); pH 1,0 (0,025 M), y acetato de sodio (CH3COONa), pH 4,5 (0,4 M).
Se utilizó un espectrofotómetro UV- visible Genesys 180 Thermo Scientifics, las mediciones fueron realizadas a 520 y a 700 nm. El contenido de antocianinas monoméricas fue calculado como cianidina-3-glucósido de acuerdo a la ecuación 1 y 2
Donde A es el cambio en la absorbancia, CAT contenido de antocianinas atron (mg/L), PM masa molecular para cianidina-3-glucósido 449.2 g/mol, ε coeficiente de extinción molar para cianidina-3-glucósido 26900 L/mol.cm, l camino óptico de celda 1 cm, FD factor de dilución.
Determinación de polifenoles totales (PFT): La concentración de polifenoles totales en extractos, fue medida por espectrofotometría, basándose en una reacción colorimétrica de óxido-reducción. El agente oxidante utilizado fue el reactivo Folin-Ciocalteu (Singleton, & Lamuela, 1999), (Barragán et al., 2018). Para el contenido de polifenoles se usó como patrón de referencia el ácido gálico desde 0 a 0.2 (mg/mL) cuyo R2 fue 0.969 a partir de la curva de calibración Y = 2.701X - 0.0354 (Guerrero et al., 2010). Los cálculos se efectuaron con la ecuación 3.
Donde Abs. muestra es absorbancia de la muestra, A intercepto, B pendiente, FD factor de dilución.
Capacidad antioxidante método TEAC DPPH.
La molécula 1,1-difenil-2-picril-hidrazilo (DPPH) es un radical libre estable en medio metanólico por tener un electrón desapareado sobre su molécula que no se dimeriza. La deslocalización del electrón intensifica su color violeta intenso, el cual absorbe a 515 nm al reaccionar con el sustrato antioxidante, porque éste le dona un átomo de hidrógeno y su color violeta se desvanece, este cambio de color en absorbancia es cuantificado como capacidad antioxidante TEAC DPPH después de 30 a 60 minutos de reacción redox. Para la determinación de la capacidad antioxidante de los extractos, se han usado como patrón de referencia el trolox desde 0 a 800 (umol/L) por lo que, tanto los extractos como el estándar actuaron reduciendo el radical DPPH (0.1 mM) \l "(Brand-Williams, Cuvelier, & Berset, 1995), (Barragán et al., 2018).
A 1.2 mL de solución de DPPH previamente ajustada a absorbancia de 0.700, se le adicionó 50 μL del extracto acuoso diluido o estándar según sea el caso, luego se agitó se dejó por 30 minutos de reacción redox a temperatura ambiente en oscuridad, luego se leyó su absorbancia a 515 nm de longitud de onda. La calibración fue hecha con una solución de trolox y la actividad antioxidante total fue expresada como (umol trolox/g). Usando el solvente etanol como blanco. La capacidad antioxidante equivalente trolox TEAC DPPH se determinó con solución patrón de trolox cuyo R2 fue 0.9918 y su ecuación Y= 0.0008X+0.0101. Los cálculos se efectuaron con la ecuación 4.
Donde Abs. muestra es absorbancia de la muestra, A intercepto, B pendiente, FD factor de dilución.
Análisis estadístico
Los análisis de resultados se procesaron mediante un análisis de varianza y las medias fueron comparadas con una significancia de 0.05 usando el software estadístico INFOSTAT (Di Rienzo et al., 2011) Versión 2019. Los resultados se observan en las tablas de respuestas de los diferentes métodos de análisis.
RESULTADOS
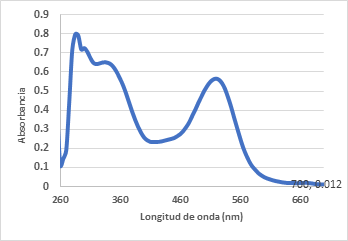
Espectros UV - Vis de las antocianinas
Los espectros UV - Visible de los extractos se han determinado en solucion metanolica de los extractos acidificados de Muehlembeckia volcanica en un espectrofotometro UV Visible y pueden variar con el pH y solvente utilizados (Figura 2).
Espectros FTIR - ATR de las antocianinas
Se determinó los espectros FTIR en extractos semisólidos de frutos de Muehlembeckia volcanica (Barragán et al., 2018) aplicados en el accesorio ATR, siendo el espectro resultante la figura 3
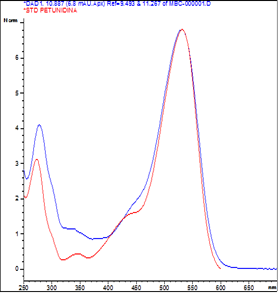
Cromatogramas HPLC
Se han obtenido los siguientes cromatogramas de las antocianinas, como en la figura 4.
Cuantificación de antocianinas (CAT), polifenoles totales (PFT) y Capacidad antioxidante TEAC DPPH
Los resultados de los análisis del contenido de antocianinas, polifenoles totales y capacidad antioxidante en equivalentes trolox (TEAC) DPPH se muestra en la tabla 1.
Tabla 1: Contenido de Antocianinas Totales CAT, Polifenoles Totales PFT y Capacidad antioxidante TEAC DPPH en extractos de (Muehlembeckia volcanica)
| Papas | CAT (mg C-3-G/100g) | PFT(mg ácido gálico/100g) | TEAC DPPH (umol trolox/g) |
| Extracto de (Muehlembeckia volcanica) | 171.85 ± 15.14 | 275.55 ± 66.07 | 31.37 ± 7.19 |
Datos expresados en media ± SD, n=3.
DISCUSIONES
De los espectros UV - Vis de las antocianinas
Los espectros UV Visible (Figura 2) presentan bandas de absorción características en la región UV entre (250 y 370 nm) y visible (500 a 545 nm) e indica la presencia de antocianinas, tal como se ha determinado en diferentes materiales vegetales: frutos, jugos y vinos, así como en flores (Ortega & Guerra, 2006), ademas se pudo observar un pico bien definido entre 460 y 530 nm, similar al espectro UV-Vis reportado para antocianinas (Arencibia, 2018), (Zapata et al., 2014).
De los espectros FTIR - ATR de las antocianinas
Los espectros FTIR ATR en la matriz analizada tienen características de absorción C=O entre 1680 y 1620, aromáticos entre 1600 y 1500 y la de -OH quelatado (ο-hidroxicetona a 3500-3200, que indican la presencia de estos grupos funcionales propias de una posible estructura antociánica (Pavia, Lampman, Kriz, & Vyvyan, 2008).
De los cromatogramas HPLC
Una vez comparado todos los picos del cromatograma HPLC (figura 4) de extractos de frutos de (Muehlembeckia volcanica) con los obtenidos de uva morada y fresa, se identificaron que los espectros UV-Vis antes citados se corresponden a los estándares de la delfinidina y petunidina en los tiempos de retención 6.201 y https://doi.org/10.885 min respectivamente.
En forma similar han encontrado por HPLC, cianidina en antocianinas de capulí (Prunus serotina spp capuli (Cav) Mc. Vaug Cav), delfinidina, cianidina, petunidina, peonidina y malvidina en el cheqche (Berberis boliviana L) (Del Carpio et al., 2009) y cianidina en (Coriaria ruscifolia L) (Barragán et al., 2018).
De la cuantificación de antocianinas (CAT), polifenoles totales (PFT) y capacidad antioxidante TEAC DPPH
En investigaciones de contenido de antocianinas totales (CAT) en frutos antocianicos se tienen resultados de 200 y 416 (mg cianidina 3-glucosido/100g peso fresco) en extractos de mortiño y elderberry respectivamente, (Bridle & Timberlake, 1997), siendo estos valores similares a los encontrados en extractos de (Muehlembeckia volcanica) (Tabla 1) de 171.85 (mg cianidina 3-glucosido/100g).
Se han efectuado investigaciones en la cuantificación de polifenoles totales PFT de 245 y 297 (mg ácido gálico / 100g) en pulpa de Wild berries Rosehip y Mora Rubus glaucus Benth a (-4°C) respectivamente (Guerrero et al., 2010), (León & Elisa, 2012), de la misma manera de 234 (mg ácido gálico / 100g) en arandanos frescos (Barreto, Cánoves, & Más, 2016), siendo estos valores similares o menores a los encontrados en extractos de frutos de (Muehlembeckia volcanica) (Tabla 1) de 275.55 (mg ácido gálico / 100 g).
Se han encontrado investigaciones de capacidad antioxidante TEAC DPPH de 24.04 y 125.69 (µmol trolox/g) en frutos de mortiño y mora (Rubus glaucus Benth) respectivamente (León & Elisa, 2012), (Gaviria et al., 2009), y de 13,50 mg Trolox/ g de cáscara de arándanos (Canchos, Veramendi, & Eva-gina, 2016), que son similares a los encontrados en extractos de frutos de (Muehlembeckia volcanica) que fue de 31.37 (µmol trolox/g) (Tabla 1).
CONCLUSIONES
Los espectros UV - Visible, FTIR - ATR en extractos de frutos de (Muehlembeckia volcanica) corresponden a espectros antociánicos, identificandosé ademas las antocianidinas delfinidina y petunidina por Cromatografia HPLC.
Se ha determinado el contenido de antocianinas y polifenoles totales en extractos de frutos de Muehlembeckia volcanica de 171.85 (mg cianidina 3-glucosido/100g) y 275.55 (mg ácido gálico / 100 g) respectivamente.
Se ha determinado la capacidad antioxidante TEAC DPPH, en extractos de frutos de Muehlembeckia volcanica de 31.37 (µmol trolox/g), de esta manera los extractos de estos frutos se pueden usar como colorantes naturales en la industria alimentaria por su alto poder antioxidante y contenido de compuestos bioactivos benéficos para la salud y como alimento funcional y bebidas fermentadas por presentar bastante cantidad de polifenoles con respecto a otros frutos similares.












 uBio
uBio