INTRODUCCIÓN
El cambio climático antropogénico es una de las principales causas de pérdida de la biodiversidad en el planeta y muestra una creciente preocupación por el futuro de las especies a nivel mundial (Bellard, Bertelsmeier, Leadley, Thuiller, & Courchamp, 2012). Se ha sugerido que muchas especies no podrán migrar o adaptarse lo suficientemente rápido al ritmo acelerado del cambio climático, por lo que estarán cada vez más vulnerables a la extinción (Evangelista et al., 2016; Harrison & Noss, 2017). Los efectos de las fluctuaciones climáticas son más severos en ecosistemas que albergan la mayor biodiversidad como en el caso de los Andes; considerada una de las regiones más importantes a nivel mundial, debido a su alta riqueza específica y porcentaje de endemismo (Myers, Mittermeier, Mittermeier, Fonseca, & Kent, 2000).
Entre las metodologías más utilizadas para estudios de impactos de cambio climático están los modelos de distribución potencial de especies que son herramientas poderosas para predecir los efectos del cambio de clima global en las distribuciones de especies y los riesgos de extinción (Feeley & Silman, 2010). La idea básica detrás de estos modelos se centra en modelar los espacios geográficos que presenten condiciones ambientales adecuadas para su desarrollo (Dolgener, Freudenberger, Schneeweiss, Ibisch, & Tiedemann, 2014). Además, es una de las herramientas más útiles para generar decisiones en políticas y prácticas de conservación (Villero, Pla, Camps, Ruiz-Olmo, & Brotons, 2017).
Con la finalidad de demostrar la aplicabilidad del modelo y por la necesidad de cuantificar las áreas potenciales actuales y futuras (Chen, Hill, Ohlemüller, Roy, & Thomas, 2011), seleccionamos a una especie en peligro de extinción, como es el caso de Puya raimondii, una bromelia endémica de los Andes de Perú y Bolivia, categorizada En Peligro (EN) según la Unión Internacional para la Conservación de la Naturaleza (Lambe, 2009). Especie que presenta una enorme inflorescencia (4 - 6 m de alto), que florece una sola vez en su vida a los 100 años en promedio (Sgorbati et al., 2004; Williams, 2009). Lamentablemente P. raimondii, es considerada como amenaza para la pastura de ovinos y otros mamíferos menores, ya que estos al hacer contacto con sus hojas espinosas; en los extremos de las hojas, quedan atrapados en ellas (Chase, Christenhusz, Sanders, & Fay, 2009), por ello los pobladores andinos queman la especie en las áreas de pastoreo, alterando su desarrollo y regeneración natural (Williams, 2009).
Los objetivos de la investigación fueron (1) modelar la distribución potencial actual y para los escenarios futuros de cambio climático de P. raimondii; y (2) cuantificar sus áreas adecuadas de distribución actuales y futuras. Nuestros resultados ayudarán a identificar áreas prioritarias para la futura conservación de la especie endémica P. raimondii.
MATERIALES Y MÉTODOS
Área de estudio y puntos de presencia
Este estudio comprende los rodales de P. raimondii, distribuidos naturalmente en los Andes desde los 3500 a 4800 msnm de Perú y Bolivia (Aquino, Condo, Romero, & Yllaconza, 2018). Las coordenadas geográficas o puntos de presencia (longitud y latitud) de P. raimondii se extrajeron de bases de datos de artículos científicos, datos en línea de GBIF (http://www.gbif.org ), Inaturalist (https://www.inaturalist.org/), herbarios virtuales como: Atrium Biodiversity Information System (http://atrium.andesamazon.org/), The Field Museum (https://www.fieldmuseum.org/) , Tropicos (https://www.tropicos.org/) y salidas al campo, obteniendo un total de 72 puntos de presencia para P. raimondii. Para reducir los posibles errores en las ubicaciones de los especímenes, donde se eliminaron los datos duplicados, es decir los registros de ocurrencia que tenían el mismo valor de longitud y latitud (Chandra, Phinn, Butt, & McAlpine, 2017). Asimismo, se eliminaron los puntos de ocurrencia geográficas erróneos en su ubicación que fueron corroborados mediante la observación de los rodales mediante Google maps y Big maps del complemento QuickMapServices 0.19.11.1 (https://plugins.qgis.org/plugins/quick_map_services/ ) del software QGIS versión 3.10. Tambien se verificó que estos puntos de presencia estuvieran separados a una distancia > 1 km entre ellos, esto con la finalidad de reducir los errores de autocorrelación espacial. Obteniendo un total de 29 puntos de presencia para Perú y 3 para Bolivia, que fueron parte del modelado de distribución actual y futura.
Variables bioclimáticas
Los datos climáticos actuales y futuros constan de 19 capas ambientales, que son una combinación de datos de precipitación y temperatura, que se descargó de la base de datos de Worldclim versión 1.4 (http://www.worldclim.org/version1) a una resolución de 30 segundos de arco (~ 1 km), donde los datos son el promedio de temperatura y precipitación de 1960-1990 para capas actuales y para las proyecciones futuras utilizamos tres modelos climáticos globales (GCM) del Proyecto de Intercomparación del Modelo Acoplado Fase 5 (CMIP5), que son muy utilizados en estudios similares: ACCESS 1.0, HadGEM2-ES, IPSL-CM5A-LR (Bosso, Di Febbraro, Cristinzio, Zoina, & Russo, 2016; Chandra et al., 2017; Cuyckens, Christie, Domic, Malizia, & Renison, 2016; López-Tirado, Vessella, Schirone, & Hidalgo, 2018; Manish, Telwala, Nautiyal, & Pandit, 2016; Molloy, Davis, & Van Etten, 2016; Ramírez-Amezcua, Steinmann, Ruiz-Sanchez, & Rojas-Soto, 2016; Wróblewska & Mirski, 2017). Con dos vías de concentración representativas de CO2 para el año 2070 (RCP 4.5 y RCP 8.5) de acuerdo al quinto informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático (IPCC, 2014). Las capas se recortaron para límites de Perú y Bolivia utilizando QGIS con la extensión de archivo ASC (.asc), proyectadas al sistema coordenadas WGS84. Posteriormente se verificó que el número de columnas y filas de todas las capas ambientales fueran iguales para el procesamiento en Maxent y se seleccionó las capas con correlaciones < |±0.8| para el mejor rendimiento del modelo (Ma & Sun, 2018), suprimiendo 10 y se conservó 9 capas bioclimáticas (Tabla 1) para el proceso de modelamiento.
Modelo de distribución de especies
Utilizamos el software MaxEnt (Versión 3.4.1) para desarrollar los modelos de distribución actual y futura de P. raimondii. Maxent es un software que funciona según el principio de máxima entropía para el modelado de distribución de especies en función a registros de solo presencia de la especie y capas bioclimáticas (Jaynes, 1957; Phillips, Anderson, & Schapire, 2006). Se utilizó la configuración predeterminada de Maxent a excepción de create response curves para hacer un mejor análisis de las variables bioclimáticas, para el proceso de modelado en escenarios futuros se realizó el mismo procedimiento, pero cargando las capas bioclimáticas futuras en Projection layers directory/file de MaxEnt. El análisis del rendimiento del modelo se realizó mediante el área debajo de la curva (AUC) que es una relación entre la sensibilidad y la especificidad del modelo, donde los valores menores a 0.5 indican un bajo rendimiento y los cercanos a 1 indican un alto rendimiento del modelo (Dolgener et al., 2014).
Post Análisis del Modelado
La probabilidad de presencia de la especie está representada con valores entre 0 y 1, donde valores cercanos a 0 indican baja probabilidad de presencia y 1 alta probabilidad de presencia; donde la alta probabilidad de presencia son espacios ambientalmente adecuados para el desarrollo de especie (Yan et al., 2017). Para un mejor representación del mapa de resultados los valores de probabilidad de presencia de la especie se clasifico en cuatro categorías: (a) < 0.25, que incluyó áreas de probabilidad de presencia nula que codificamos con el color blanco; (b) 0.25 - 0.50, áreas de probabilidad de presencia baja que codificamos con el color naranja; (c) 0.50 -0.75, áreas de probabilidad de presencia media que codificamos con el color verde claro; (d) > 0.75, áreas de alta probabilidad de presencia que codificamos con el color verde (Merow, Smith, & Silander, 2013; Yan et al., 2017). Para convertir los modelos con valores de probabilidades de presencias binarias (ausencia / presencia), se utilizó el umbral del décimo percentil de la presencia de entrenamiento, comúnmente utilizada en estudios de conservación (Abba, Tognelli, Viviana, Benjam, & Vizca, 2012; Escalante, Rodríguez-Tapia, Linaje, Illoldi-Rangel, & González-López, 2013)). Para el presente estudio, este valor fue 0.4868, que incluye bien la presencia de P. raimondii. El mapa de alta probabilidad de hábitat que en futuro se hiso mediante el promedio de todas las proyecciones RCP 8.5, delimitando prioridad alta y baja de acurdo al umbral del modelo.
RESULTADOS
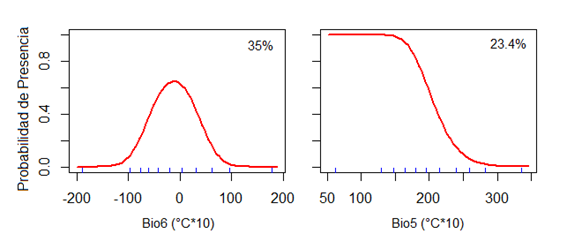
La evaluación estadística mostró un alto poder predictivo del modelado de distribución actual y futura de P. raimondii, en donde el AUC fue de 0.893. Del subconjunto de nueve variables bioclimáticas incluidas en el modelo, la temperatura mínima en el periodo más frío (Bio6) y la temperatura máxima en el periodo más caliente (Bio5) explican más del 58% del patrón de distribución de P. raimondii (35% y 23.4% respectivamente; Tabla 1). La probabilidad de presencia es más óptima 0 ± 2.5 °C en invierno (junio a agosto) y menores a 20 °C en verano (diciembre a marzo) (Fig. 1).
Predicción de distribuciones actuales y futuras de P. raimondii
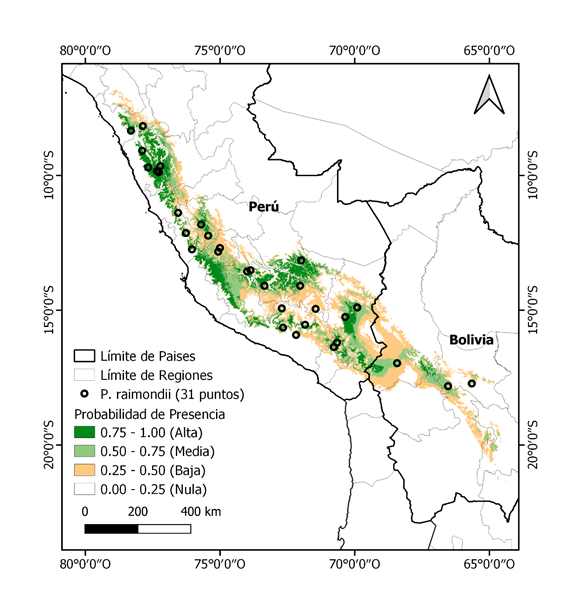
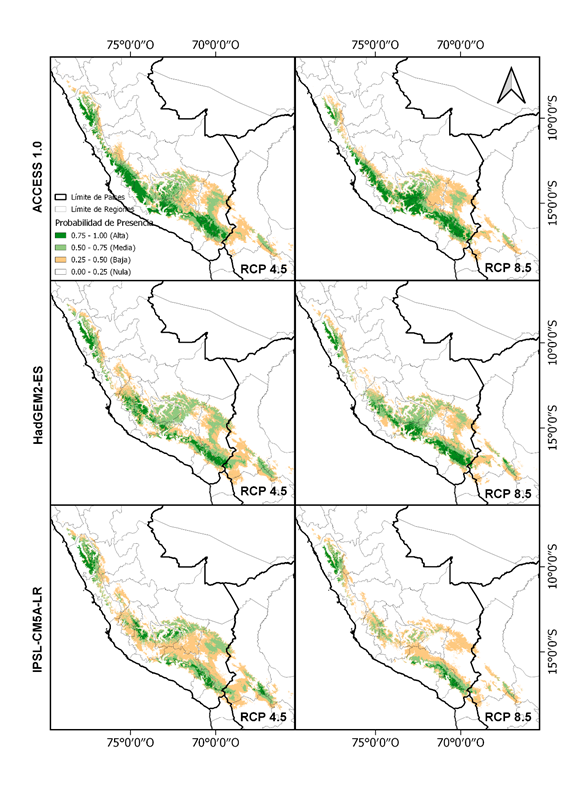
El modelo MaxEnt, predijo la distribución actual adecuada para P. raimondii y están centradas en los andes de Perú y Bolivia con una extensión total de 154268.4 km2 (Fig. 2), en escenarios futuros de cambio climático para la década de 2070 (Fig. 3) de acuerdo a varios GCMs, las regiones extremas norte y sur de la distribución actual pierden sus áreas potenciales, así como las distribuciones se restringe más al oeste de la distribución actual, viéndose una reducción de promedio de área considerable a -34326.53 km2 (-22.25%) y -68193.22 km2 (-44.20%) para RCP 4.5 y RCP 8.5 respectivamente (Tabla 2).
DISCUSIONES
El modelo de la distribución potencial de P. raimondii presentó un alto rendimiento predictivo, según el AUC de 0.890, lo que indica una predicción confiable (Jiang et al., 2016; Phillips et al., 2006). En el modelado se utilizó 9 variables bioclimáticas, de las cuales la temperatura mínima en el periodo más frío (Bio6) presento un alto porcentaje de contribución en el proceso de modelado con 35%, dando a conocer que la probabilidad de presencia está restringida por la temperatura mínima de 0 ± 2.5 °C de los meses más fríos que en caso de los andes corresponden a los meses de junio a agosto, a valores menores a este rango de temperatura es probable que la especie no se adapte y la otra variable también con un porcentaje de contribución alto que corrobora la probabilidad de presencia fue la temperatura máxima en el periodo más caliente (Bio5) con 23.4%, dando a conocer que, a temperaturas menores a 20°C en los meses de verano austral de diciembre a marzo la probabilidad de presencia es alta.
La influencia de estas dos variables estaría relacionada con los requisitos de hábitat actuales de P. raimondii, en donde el clima condiciona la permanencia de rodales, marcando una clara fecha para que los individuos florezcan, fructifiquen y que dejen una regeneración en una fecha marcada (Aquino et al., 2018; Kelly & Goulden, 2008). Además, las dos variables están relacionadas con la germinación de las semillas de P. raimondii, que de acuerdo a estudios de laboratorio estas semillas presentan un alto poder germinativo a temperaturas menores a 21°C (Suni, Cano, & Vadillo, 2001; Vadillo, Suni, & Cano, 2004).
Además esta especie se desarrolla en lugares con mayor radiación solar y tiene preferencia por los terrenos rocosos que al estar en contacto con el suelo mantiene homogénea la temperatura (Salazar, J., Cacéres, F., Poma, I., Raimondo, 2010), esto hace que la semillas con embriones pequeños muy esporádicos, necesitan extensos período tiempo y condiciones ambientales homogéneas para el creciente del embrión antes de la germinación por la que hay una escasa regeneración en su habitad natural (Lima et al., 2018; Vandelook, Janssens, & Probert, 2012).
El modelo de distribución actual para P. raimondii nos indica que el hábitat altamente adecuado cubre 154268.40 km2 de los Andes del Perú que abarcando las regiones (nombradas de norte a sur) de Cajamarca, La Libertad, Ancash, Huánuco, Lima, Pasco, Junín, Huancavelica, Ica, Ayacucho, Apurímac, Cusco, Arequipa, Puno, Moquegua y Tacna coincidiendo con todos los sitios conocidos para presencia de rodales de P. raimondii (Aquino et al., 2018; Salazar, J., Cacéres, F., Poma, I., Raimondo, 2010; Vadillo, Suni, & Roca, 2007) y para los Andes de Bolivia que comprendiendo regiones o departamentos de La Paz, Cochabamba, Oruro, Potosí y Chuquisaca, coinciden con todos los sitios conocidos para presencia de rodales de P. raimondii en Bolivia (Salazar Castillo, Caceres De Baldarrago, & Poma, 2014).
En escenarios futuros de cambio climático para la década de 2070, hay una pérdida de áreas potenciales, viéndose una reducción de promedio de área a -34326.53 km2 (-22.25%) y -68193.22 km2 (-44.20%) para RCP 4.5 y RCP 8.5 respectivamente (Tabla 2). Las regiones extremas norte y sur de la distribución actual perdieron sus áreas potenciales en el futuro, esto a causa de que el cambio climático traerá consigo alteraciones de las condiciones de temperatura y precipitación, que de acuerdo a las proyecciones de cambio climático para los Andes se sugieren que se producirá un calentamiento significativo de al menos 2 °C y la precipitación disminuirá en un 10-20% como resultado del cambio climático en 2100 (Beaumont, Pitman, Perkins, Zimmermann, & Yoccoz, 2011; Urrutia & Vuille, 2009), esto conducirán a cambios en la distribución de organismos que habitan en bosques templados y montañas (Colwell, Brehm, Cardelús, Gilman, & Longino, 2008), lo que resultaría una migración ascendente de plantas tropicales andinas, se menciona que las especies vegetales poseen una capacidad limitada para responder al aumento de las temperaturas, y si no hay mudanza a otros hábitats, aumentaran sus riesgos de extinción (Colwell et al., 2008; Feeley et al., 2011).
Además, se observa que, en las distribuciones futuras, P. raimondii se restringen más al oeste de la distribución actual, prefiriendo zonas más altas cercanas a los nevados y volcanes. Es probable que los microrefugios en el futuro sean zonas próximas a las corrientes oceánicas, ya que estas desempeñan un papel importante en la generación de estabilidad climática regional y en la creación de centros terrestres de endemismo, que a menudo son espacios muy cercanos a las costas que coinciden con las cadenas montañosas (Harrison & Noss, 2017).
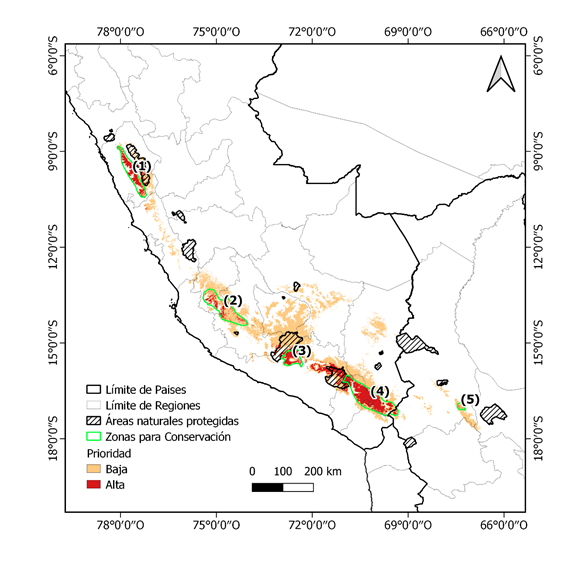
Conocer los refugios en el futuro ayudara a la toma de acciones para la conservación, en este estudio se identificó cinco zonas de alta probabilidad de hábitat que en futuro pueden albergar bien a P. raimondii, estas zonas son: (1) la cordillera negra en la región Ancash, (2) las partes altas de los límites de Huancavelica y Ayacucho, (3) la cordillera Ampato en Arequipa, (4) la parte alta de las regiones Moquegua, Tacna y sur de Puno en Perú y (5) el sur de La Paz en Bolivia (Fig. 4). Estas cinco zonas tienen que estar conectados por corredores biológicos, con la finalidad de esto aseguraría el flujo de genes entre poblaciones (Thomas et al., 2014).
Sin embargo, es importante señalar que este estudio tuvo limitaciones. Primero, en este estudio no se consideró el factor antrópico, ya que es uno de los factores más importantes en el cambio, fragmentación y perdida de ecosistema, se recomienda que para los próximos estudios se considere este factor importante. Segundo, nuestro estudio no consideró completamente la capacidad de dispersión de las especies. La evolución de las comunidades de plantas es compleja, particularmente bajo el cambio climático.
Por lo tanto, los estudios futuros deben integrar las interacciones bióticas con otras especies de plantas, planta - polinizador, dispersores de semillas o hasta puede haber sitios en las que el hombre haya introducido y que estén bien adaptados. En tercer lugar, a pesar de la gran importancia ecológica, económica (atractivos turísticos) de P. raimondii, en los países de Perú y Bolivia no es valorada, hay mucha quema y tala de esta especie y son muy pocos los estudios para su conservación, ya que hay pocas publicaciones de la ecología de P. raimondii, habiendo poca información en revistas confiables.
En el presente estudio, realizamos un estudio más detallado sobre la probabilidad de presencia adecuado de P. raimondii que funcionará como un primer paso importante en el desarrollo de estrategias y políticas para la conservación, reintroducción de esta importante especie alto andina. En cuarto lugar, la perturbación humana, cambio de clima, las interacciones bióticas, las condiciones del suelo y otros factores también influyen en la presencia de especies en el futuro. A pesar de estas limitaciones, el modelo de distribución de especies es considerada como una las herramientas más poderosas para la conservación de la diversidad biológica bajo el cambio climático (Aguilar-Soto, Melgoza-Castillo, Villarreal-Guerrero, Wehenkel, & Pinedo-Alvarez, 2015; Dolgener et al., 2014; Yan et al., 2017; Zhang, Cao, Bai, Li, & Mao, 2016).
CONCLUSIÓN
El modelo de distribución actual para P. raimondii tiene una extensión de 154268.40 km2 de los Andes de Perú y Bolivia. En escenarios futuros de cambio climático para la década de 2070, hay una pérdida de áreas potenciales, viéndose una reducción de promedio de área a -34326.53 km2 (-22.25%) y -68193.22 km2 (-44.20%) para RCP 4.5 y RCP 8.5 respectivamente. En este estudio se identificó cinco zonas de alta probabilidad de hábitat que en futuro pueden albergar a P. raimondii, estas zonas son: (1) la cordillera negra en la región Ancash, (2) las partes altas de los límites de Huancavelica y Ayacucho, (3) la cordillera Ampato en Arequipa, (4) la parte alta de las regiones Moquegua, Tacna y sur de Puno en Perú y (5) el sur de La Paz en Bolivia. Nuestros resultados servirán como base de información para las organizaciones e instituciones conservacionistas que ayudara a la toma de decisiones para la protección de esta especie endémica de los andes que actualmente está camino a la extinción.












 uBio
uBio