Introducción
En el contexto de la ganadería peruana, una actividad de gran importancia social es la crianza de camélidos sudamericanos, por su adaptación y productividad sobre los 4 000 m.s.n.m. El Perú posee alrededor de 3 millones de alpacas, un millón de llamas y alrededor de 125 mil vicuñas; la mayoría se encuentra en regiones de la sierra sur, particularmente en Cusco y Puno (CENAGRO, 2012). De esta ganadería dependen 2,9 millones de habitantes que representa el 12% de la población nacional (Moya y Torres, 2008).
Una de las principales limitantes en la crianza de alpacas es la baja eficiencia reproductiva, considerándose dentro de ella a la mortalidad embrionaria como uno de los factores de importancia y que puede llegar hasta un 50% al mes de gestación (Fernández-Baca et al., 1970).
En el empadre a campo, se observan diferencias entre alpacas en el número de copulas durante tres días consecutivos (Novoa, 1970); sin embargo, se desconoce si hubo diferencias en la tasa de gestación y natalidad entre alpacas que recibieron diferentes números de copulas.
En alpacas, el celo es aparentemente continuo y la cópula induce la ovulación (Novoa y Leyva, 1996), mediado por el factor de crecimiento neurotrópico del plasma seminal β-NGF (Adams et al., 2005), en la producción del pico preovulatorio de LH, sin embargo, este proceso de cópula, también ocurre después de la ovulación incluso durante la fertilización, por la receptividad de la hembra hasta el día 4 poscópula (Leyva y García, 1999a). En un estudio con cópulas adicionales los días 3 y 4 posovulación, se reportó una tasa de sobrevivencia embrionaria de 85% respecto a un 75% sin cópulas adicionales (Aparicio et al., 2003). Como estos sucesos son fisiológicos, se asume que deben tener un rol en regular el transporte de los gametos para la fecundación, para la fertilización en el oviducto y el acondicionamiento del ambiente uterino para la viabilidad embrionaria. Estas son características sexuales poco estudiadas en relación a la tasa de sobrevivencia embrionaria y estas informaciones permitirían entender el efecto poscópula en la fisiología reproductiva y su posible aplicación en el manejo reproductivo de las alpacas. Por lo que el objetivo del presente estudio fue: Determinar el efecto de una cópula versus dos copulas adicionales a las 24 h y 4 8h, después de la ovulación sobre la tasa de sobrevivencia embrionaria.
Materiales y métodos
El presente trabajo se realizó durante los meses de enero a abril correspondiendo a los meses de encaste, en el Centro Experimental La Raya de la Facultad de Medicina Veterinaria y Zootecnia, de la Universidad Nacional del Altiplano, ubicado en el distrito de Santa Rosa, provincia de Melgar, región de Puno; a una altitud entre 4 136 a 5 470 m; localizado entre las coordenadas 14°30’33’’de latitud Sur, y 20°57’33’’ de longitud oeste. La temperatura anual promedio fue de 6,20°C; con una máxima de 14,16°C y mínima de -1,75°C y una precipitación pluvial de 525,7 mm (SENAMHI, 2016).
Fueron seleccionadas 47 alpacas hembras Huacaya de un rebaño en base al celo y ovulación, de 5 a 8 años de edad, con descanso sexual posparto mayor o igual a 20 días y para el servicio machos de 5 años de edad pertenecientes al núcleo de reproductores de la estación experimental y por ello con capacidad reproductiva comprobada a través de su historia en campañas anteriores de empadre. Todos los animales estuvieron bajo las mismas condiciones de manejo.
Canchas de pastoreo, se utilizó potreros destinados a la parición divididos en dos áreas, una para las madres aún gestantes y madres con crías hasta 10 días de nacidas (cancha de parición) y la otra para madres con crías mayores a 10 días (tantaje). Se acondicionó otra cancha o potrero destinado para los machos.
Boxes o cubiles para el empadre controlado, se utilizaron paneles metálicos, armando 8 boxes de 6 x 3m cada uno y un pasaje para la circulación y movimiento de los animales durante el empadre.
Brete para ecografía, para realizar las ecografías en las instalaciones del galpón de esquila se adecuó un brete para realizar la observación ecográfica seguida por el pesaje de los animales.
Todas las instalaciones estuvieron cercanas al caserío del Centro experimental.
En el empadre controlado, para facilitar la identificación de los animales se utilizó pintura de varios colores, libreta de campo, cronómetro, sogas, numeradores metálicos (marcadores).
Para la ecografía transrectal, se utilizó un Ecógrafo, con transductor lineal de 5MHz (Marca: MADISON, USA), gel para ecografía, guantes obstétricos o de palpación rectal, guantes de exploración, papel toalla.
Para la evaluación seminal (poscópula), se utilizó un microscopio óptico (LEICA DM 2000, USA), platina y regulador de temperatura (marca, LT), micropipeta de 10 a 100 μl (BOECO), láminas portaobjetos y láminas cubreobjetos, y un proctoscopio adaptado como Espéculo vaginal.
Todas las hembras seleccionadas tuvieron un periodo posparto igual o mayor a 20 días de parición, y comportamiento de celo detectado por confrontación con el macho (Fernández-Baca, 2005). Y la presencia en los ovarios de un folículo preovulatorio igual o mayor a 7mm de diámetro.
Todas estas hembras fueron trasladadas a los boxes para el empadre controlado. Durante el proceso de empadre se verificó que la cópula fuera efectiva considerándose un tiempo mínimo de 15 minutos. Entre las 26 a 35 horas posmonta se verificó la ovulación mediante ecografía transrectal de los ovarios por la desaparición del folículo preovulatorio observado previamente.
Los cinco machos utilizados para el empadre controlado, fueron evaluados semanas previas al inicio de esta actividad, a través del examen clínico de los órganos genitales, el comportamiento sexual y evaluación seminal poscópula.
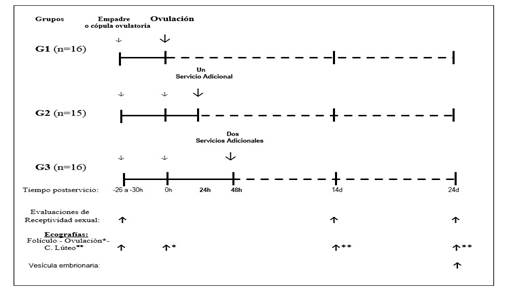
Después de verificada la ovulación, 47 alpacas hembras fueron seleccionadas y distribuidas al azar en 3 grupos experimentales, según el siguiente diseño experimental.
G1: Cópula ovulatoria (control), (n=16).
G2: Cópula ovulatoria + una cópula adicional a las 24 horas posovulación (n=15).
G3: Cópula ovulatoria + dos cópulas adicionales a las 48 horas posovulación (n=16).
Cada grupo recibió equitativamente el servicio de los 5 machos, y cada servicio o cópula efectiva tuvo una duración promedio de 20 minutos, con un mínimo de 15 minutos.
A través de la observación mediante ecografía transrectal de los ovarios y los cuernos uterinos en los días 14 y 24 posencaste se detectó la presencia del cuerpo lúteo y del embrión (preñez temprana), para evaluar y determinar la sobrevivencia embrionaria (Olivera et al., 2003; Sánchez et al., 2017).
La Evaluación seminal se realizó en el semen obtenido por aspiración vaginal poscópula (Bravo et al., 2000), considerándose solamente la presencia de espermatozoides y una motilidad mínima (60%).
La tasa de receptividad sexual, presencia de cuerpo lúteo y sobrevivencia embrionaria o preñez temprana entre los grupos experimentales fue analizada mediante la prueba estadística de Chi - cuadrado. Adicionalmente, para observar la asociación entre grupos experimentales con receptividad sexual, presencia de cuerpo lúteo y tasa de sobrevivencia embrionaria o preñez temprana se utilizó el Análisis de Correspondencia Simple, cuyo objetivo es representar gráficamente la estructura de relaciones de variables cualitativas mediante mapas de posicionamiento y corroborar dependencia entre ellas.
Resultados
Receptividad, presencia de cuerpo lúteo (CL) y tasa de sobrevivencia embrionaria a los 14 días posencaste.
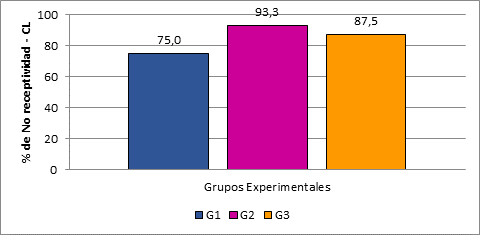
En la Tabla 1, se muestran los resultados del comportamiento sexual y presencia de CL a los 14 días posmonta, notándose una marcada asociación entre la no receptividad de las hembras al macho y la presencia de CL.
Tabla 1 Receptividad y presencia de CL en alpacas a los 14 días posmonta de los grupos control (G1), 1 servicio adicional a las 24 horas (G2) y 2 servicios adicionales a las 48 horas (G3) posovulación.
| Grupos Experimentales | Número de animales | Receptividad (rechazo) | Presencia de Cuerpo Lúteo | ||
| n | % | n | % | ||
| Grupo 1 (G1): | 16 | 12 | 75,0 | 12 | 75,0 |
| Grupo 2 (G2): | 15 | 14 | 93,3 | 14 | 93,3 |
| Grupo 3 (G3): | 16 | 14 | 87,5 | 14 | 87,5 |
| TOTAL | 47 | 40 | 85,1 | 40 | 85,1 |
x2 c = 2,163 X2 t (2 gl; α 0,05) = 5,991
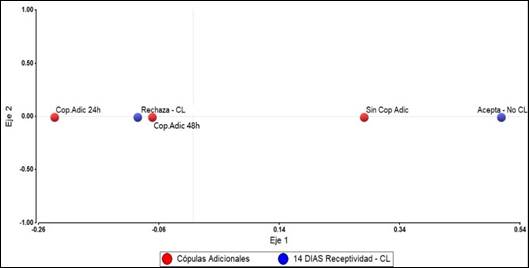
Hubo un mayor % de no receptividad al macho con presencia de cuerpo lúteo en los grupos G2 (93,3%) y G3 (87,5%) que en G1 control (75,0%) (Fig. 2), no obstante, estas diferencias no fueron significativas (P>0,05); sin embargo, el análisis de correspondencia simple (Fig.4 de anexo) muestra acercamiento entre los grupos que recibieron cópulas adicionales (G2 y G3) con el rechazo al macho y presencia de cuerpo lúteo, mientras que ambos se apartan marcadamente del grupo sin copulas adicionales (G1) control.
Receptividad, presencia de cuerpo lúteo y tasa de sobrevivencia embrionaria a los 24 días poscópula.
La Tabla 2, muestra los resultados del comportamiento sexual y presencia de cuerpo lúteo a los 24 días poscópula, reafirmándose la asociación entre la no receptividad de las hembras al macho y la presencia de cuerpo lúteo, verificado para este momento con la presencia de la vesícula embrionaria, también mediante la ecografía transrectal.
Tabla 2 Receptividad-CL, preñez temprana y mortalidad embrionaria en alpacas, a los 24 días poscópula de los grupos control (G1), 1 servicio adicional a las 24 horas (G2) y 2 servicios adicionales a las 48 horas (G3) posovulación.
| Grupos | Número de animales | Receptividad (rechazan) CL | Preñez temprana* (Sobrevivencia embrionaria) | Mortalidad embrionaria ** | ||||
| n | % | n | % | n | % | |||
| Grupo 1 (G1): | 16 | 10 | 62,5 | 10 | 62,5 | 2 | 12,5 | |
| Grupo 2 (G2): | 15 | 13 | 86,7 | 13 | 86,7 | 1 | 6,7 | |
| Grupo 3 (G3): | 16 | 14 | 87,5 | 14 | 87,5 | 0 | 0,0 | |
| TOTAL | 47 | 37 | 85,1 | 37 | 85,1 | 3 | 19,2 | |
* Con presencia de vesícula embrionaria X2 c = 3,815 X2 t (2 gl; α 0,05) = 5,991
** Determinado en base a la evaluación de los 14D y 24D
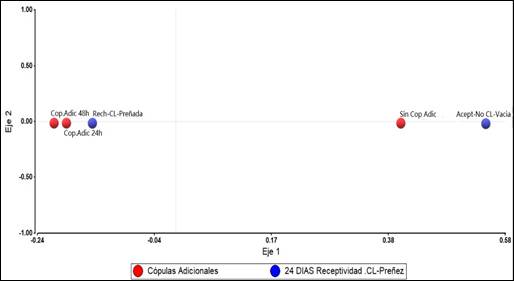
El mayor porcentaje de Sobrevivencia embrionaria a los 24 días posencaste, evaluado mediante la no receptividad de la hembra al macho y corroborado por la presencia de cuerpo lúteo se da en el G3 con 87,5%, seguido del grupo G2 con 86,7%, frente al grupo control G1 con 62,5% (Fig.3). A pesar de la ausencia de diferencias significativas entre tratamientos (p>0,05), también en este momento se observa una tendencia porcentual mayor de sobrevivencia embrionaria (Tabla 2 y Fig.3) en alpacas que recibieron montas adicionales a las 24 y 48 horas posovulación, lo que estaría siendo demostrado por el análisis de correspondencia simple, en cuyas gráficas (Fig.5 de Anexos), se muestra un mayor acercamiento entre los grupos que recibieron cópulas adicionales (G2 y G3) con el rechazo al macho, presencia de cuerpo lúteo y preñez, y a su vez ambos grupos se alejan del grupo control.
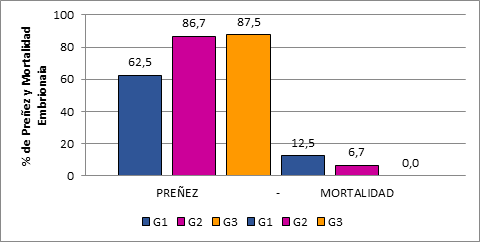
Figura 3 Porcentaje de Preñez y ME de alpacas a los 24 días poscópula, que no recibieron (G1) y que recibieron cópulas adicionales a las 24 horas (G2) y 48 horas (G3) posovulación.
Por otro lado, se puede observar en la Figura 3, que a los 24 días posmonta en los grupos G1 y G2, se ha presentado mortalidad embrionaria en un 12,5% y 6,7% respectivamente, y no así en G3 (0%), respecto a la evaluación realizada a los 14 días posmonta.
Discusión
Receptividad, presencia de cuerpo lúteo y tasa de sobrevivencia embrionaria a los 14 poscópula.
La ovulación en alpacas está mediada por la acción del factor neurotrópico del plasma seminal del macho (Adams et al., 2005) que estimula la producción del pico preovulatorio de LH. Algunos investigadores describieron también que existen interneuronas en el hipotálamo que median la ovulación inducida por el factor inductor de la ovulación-FIO (Carrasco et al., 2018; El-Allali et al., 2017). Además, en otras especies se describió también que es posible un efecto del β-NGF sobre la maduración de los ovocitos, en el proceso de fertilización (Crispo et al., 2016), y principalmente tener un efecto luteotrópico temprano (Carrasco et al., 2016).
Los resultados que mostramos tienen concordancia con los resultados de (Aparicio et al., 2003), donde los grupos de hembras que recibieron copulas adicionales solo en los días 3 y 4 posovulación tuvieron una sobrevivencia embrionaria de 87% y 92% respectivamente. Aparentemente ambos reportes muestran que no existe mayor diferencia en los días D1, D2, D3 y D4; lo cual podría ser diferente a lo que ocurre en el empadre a campo, donde la hembra alpaca recibe varias cópulas posovulación en un mismo día hasta el D4 (Fernández-Baca y Novoa, 1968), el cual podría tener un efecto acumulativo en la sobrevivencia embrionaria.
Leyva y García, (1999a; 1999b), encontraron que el celo posovulación desaparece con la aplicación de progesterona (P4) sugiriendo que este celo ocurre porque el cuerpo lúteo en reciente organización no libera niveles apropiados de P4 para ejercer su efecto inhibitorio; e indirectamente asume la necesidad del efecto de la LH, en la secreción de la P4 por el cuerpo lúteo para alcanzar el nivel que ejerce el efecto inhibitorio el cual ocurre fisiológicamente en la mayoría de los casos en el cuarto día posovulación (Aparicio et al., 2003). Reportes indican que; - existe un incremento en los niveles basales de LH después de cópulas posovulatoria (Aba et al., 1995) y - que la aplicación de LH en los días D1 y D3,5 posovulación redujeron en un porcentaje razonable el celo posovulatorio entre los días D2 y D4 (Fernández, 2013). Estas informaciones indicarían que, en el empadre a campo, el efecto acumulativo de las cópulas continuas (por ende, el β-NGF), deben estar relacionadas con la mantención de un elevado nivel basal de LH, para que el cuerpo lúteo se establezca produciendo el nivel apropiado de progesterona para inhibir el celo y continuar con la función de mantención de la gestación; en caso contrario los niveles crecientes de E2 indirectamente mediarían la secreción de PGF2α, afectando la viabilidad del Cuerpo lúteo (Leyva y García, 2000), ocasionando una muerte embrionaria temprana, puesto que la sobrevivencia del embrión en este periodo, depende principalmente de la eficiencia con la que se establece el reconocimiento materno de la preñez (Mor et al., 2015). Lo anterior está mediado por el útero, que por la estructura y organización de la matriz extracelular y mecanismos de adhesión celular afecta en la sobrevivencia del embrión durante el período de implantación después de la preñez (Moraes et al., 2018). Algunos investigadores demostraron que algunas razas de animales presentan mayores niveles sanguíneos de Progesterona en los días 6 y 12 posovulación lo que podría favorecer el ambiente uterino y por consiguiente disminución de las pérdidas embrionarias tempranas (Ayala et al., 2017). Estos análisis sugieren un posible efecto fisiológico de las cópulas posovulación en la sobrevivencia embrionaria.
Receptividad, presencia de cuerpo lúteo y tasa de sobrevivencia embrionaria a los 24 días posencaste.
Aparicio et al., (2003) para grupos de hembras que recibieron copulas adicionales los días 3 y 4 posovulación, reportaron la presencia de cuerpo lúteo los días 19 y 20 poscópula como indicador de sobrevivencia embrionaria en un 80% y 85% respectivamente, (equivalente a 72 y 96 horas posovulación), siendo en nuestro caso de 86,7% y 87,5% para cópulas adicionales a las 24 y 48 horas, si bien es cierto que se ven ligeras diferencias, podríamos deducir que las cópulas adicionales en ambos estudios (debido al FIO que estimula la secreción de LH) mejoran la sobrevivencia embrionaria, que para este momento de evaluación (24 días poscópula), una de las causas se debería a un efecto potenciador de las mismas, considerando que hubo un mejor establecimiento del cuerpo lúteo y por ende secreción de progesterona y reconocimiento materno de la preñez, (Chipayo et al., 2003). La importancia de la progesterona durante la preñez radica en que induce la quietud del miometrio, además promueve la proliferación de las células del endometrio para soportar la implantación del embrión y el desarrollo a término del feto (Hafez, 2000). También se sabe que la progesterona junto con los 5α-pregnanes son secretada por el cuerpo lúteo e induce la producción de histotrofo endometrial que es responsable de la nutrición conceptual hasta la placentación (Aurich y Budik, 2015). Aunque algunos investigadores reportan que algunos animales con niveles de progesterona aun altos tuvieron pérdidas embrionarias tempranas, demostraron que las perdidas embrionarias no siempre están relacionadas con los niveles bajos de progesterona (Bravo et al., 2010).
Las perdidas embrionarias tempranas en rumiantes se dan con mayor frecuencia hasta antes de los 16 días después de la concepción (Diskin y Morris, 2008; Hashem y Soltan, 2017), mientras que Fernández-Baca (1971), a los 30 días posmonta, reporta una mortalidad embrionaria de hasta 50%, sin considerar cópulas adicionales ni hembras que hayan ovulado como en el presente estudio. Otra causa, pero atribuida a la mortalidad encontrada en este periodo (24 días posempadre) en los grupos G1 y G2, podría deberse a fallas cuando el embrión inicia la implantación el día 14 posovulación con las interdigitaciones que se forman entre las células epiteliales del endometrio y el trofoblasto del embrión (prioritariamente en el cuerno izquierdo), zonas que al parecer facilitan el reconocimiento maternal de la preñez y luego el intercambio gaseoso entre la madre y el feto (Olivera et al., 2003; Skidmore et al., 1996). Entonces estos factores que tienen que ver con la mortalidad temprana no están del todo claros por lo que deberán ser demostrados en otras investigaciones. Es importante considerar la identificación de genes en alpacas como se ve en otras especies, genes que estén asociados a este evento de transición y la definición de su significado funcional podrían proporcionar información vital para identificar las razones por la que no se da el reconocimiento materno de la preñez (Mor et al., 2015).
El incremento de la tasa de sobrevivencia embrionaria observada en el presente estudio de investigación está relacionado con los grupos que recibieron cópulas adicionales (24 y 48 horas) como se observa en las pruebas de correspondencia simple, pero no llegan a alcanzar el 95% de significancia estadística (P>0.05); que puede ser el resultado del número de animales utilizado en cada grupo experimental. Estos resultados nos permiten sugerir que se puede mejorar el porcentaje de sobrevivencia embrionaria e incrementar el porcentaje de gestantes y por ende el porcentaje de natalidad en alpacas que reciben copulas adicionales posovulación. Si bien el proceso depende del útero, no ocurre in vitro, existiendo una variación significativa entre los conceptos que es independiente del útero y puede apuntar a una variación en la calidad de los embriones y los ovocitos (Sánchez et al., 2019); además, el papel del padre en la determinación de la calidad del embrión y en el desarrollo del concepto recién comienza a apreciarse que podrían estar involucrados (Ortega et al., 2018).
Conclusiones
Las alpacas que recibieron una cópula ovulatoria y con una cópula adicional a las 24 horas posovulación y las que recibieron dos cópulas adicionales a las 48 horas posovulación evidencian una tendencia porcentual mayor de sobrevivencia embrionaria respecto a las alpacas que solo tuvieron una cópula ovulatoria, a pesar que la metodología empleada tenga un efecto sobre la sobrevivencia embrionaria los mecanismos fisiológicos no están del todo claros. Sin embargo, el rápido desarrollo de métodos biológicos, moleculares contribuirá a resolver y comprender estos mecanismos.
Se requieren estudios con grupos con mayor número de animales para aseverar resultados significativos.












 uBio
uBio