Introducción
Rubus es uno de los géneros más más diversos que pertenece a la familia Rosaceae, posee alrededor de 750 especies distribuidas en todos los continentes, excepto la Antártida (Alice & Campbell, 1999). Actualmente, la propagación in vitro de Rubus sp. es considerada una alternativa viable, con la finalidad de obtener plantas libres de virus, uniformidad genética y en menor tiempo (Clark & Finn, 2014).
Es así, que especies de Rubus son propagadas in vitro empleando explantes como segmentos nodales (Ayub et al., 2019; Da Silva et al., 2016; Hunková et al., 2016; Pérez-Martínez & Castañeda-Garzón, 2016), brotes (Hunková et al., 2016, 2018), y estacas de tallo con yemas dormantes (Gajdošová et al., 2015).
Asimismo, los reguladores de crecimiento empleados para inducir una respuesta morfogénica en explantes de Rubus incluye a citocininas y auxinas (Bueno et al., 2018), citocininas y giberelinas (Cancino-Escalante et al., 2015; Millones, 2018; Pérez-Martínez & Castañeda-Garzón, 2016), Además, para la elongación de los brotes de R. ideaus ha sido empleado brasinolido, hormona vegetal de tipo esteroidal (Robres-Torres et al., 2015).
Por otro lado, la regeneración y elongación de brotes adventicios etiolados in vitro, proporciona un eficiente sistema para la multiplicación de especies de importancia económica, por lo cual ha sido utilizada en la propagación in vitro, a partir de segmentos de hipocótilos, de Solanum melongena (Muktadir et al., 2016), y Ricinus communis (Zhang et al., 2016). Por lo antes indicado, la presente investigación, tuvo como objetivo evaluar la regeneración de brotes adventicios etiolados para el desarrollo de un protocolo de propagación in vitro de los cultivares Castilla, Tupy y Navaho Rubus sp.
Material y métodos
El material vegetal estuvo constituido por semillas botánicas de Rubus sp. cultivares Castilla, Tupy y Navaho. Para la obtención de segmentos basales caulinares, las semillas fueron desinfectadas con HgCl2 0,1% más 4 gotas de Tween20 por 15 minutos, posteriormente con ayuda de un estereoscopio fueron extraídos los embriones y colocados en tubos de ensayo con medio de establecimiento (Millones, 2018), suplementado con 150 mg/L de ácido ascórbico, 0,1 mg/L de ácido giberélico (AG3), 0,04 mg/L de 6-furfurilaminopurina (KIN), phytagel Sigma 0,15%, y pH ajustado a 5,8. Los embriones fueron incubados en cámara de crecimiento a 24 °C, fotoperiodo 16/8h e irradiación 50 μmol m-2 s-1.
Plántulas de Rubus sp. germinadas fueron subcultivadas a medio de crecimiento y desarrollo a base de las sales y vitaminas MS (Murashige & Skoog, 1962), suplementado con mio-inositol 100 mg/L, sacarosa 3%, 18 mL/L de buffer fosfato, ácido ascórbico 150 mg/L y phytagel Sigma 0,15%, pH ajustado a 5,8.
En la regeneración de brotes adventicios etiolados, se emplearon las plántulas establecidas en la etapa anterior, con longitud de brotes de 60-70 mm y 90 días de cultivo.
El primer tratamiento de etiolación consistió en escindir los 2/3 del brote aéreo, poda de raíz y escisión de los limbos foliares. Posteriormente, los segmentos basales caulinares fueron colocados en recipientes con medio de crecimiento y desarrollo, envueltos con papel aluminio, colocados en cámara de crecimiento a 24°C, y sometidas a la primera etiolación por once días (1° etiolación). Posteriormente, los brotes adventicios etiolados regenerados fueron colocados en fotoperiodo 16/8h durante siete días. Las secciones nodales obtenidas fueron colocadas en medios de cultivo de enraizamiento, a base de las sales y vitaminas MS, myo-inositol 100mg/L, sacarosa 3%, ácido ascórbico 150 mg/L, buffer fosfato 18 mL/L, phytagel Sigma 0,15%, carbón activado 0,3%, y suplementado con 1 mg/L de ácido indolbutírico (AIB) y 1 mg/L de ácido naftalenacético (ANA) más 2 mg/L de AIB.
El segundo tratamiento de etiolación, consistió en colocar nuevamente las secciones basales caulinares (con brotes aéreos escindidos) de la primera cosecha de brotes etiolados en medios de crecimiento y desarrollo y sometido a etiolación por seis días (2° etiolación), siete días de fotoperiodo, y en el día 13 de cultivo las secciones nodales fueron colocados en medio de enraizamiento. Por último, se utilizó un control en cada cultivar que no fue expuesto a periodos de etiolación.
El análisis de datos de la respuesta morfogénica en los segmentos basales caulinares de los cultivares de Rubus sp. fue un diseño completamente al azar con tres repeticiones y cinco submuestras, las medias fueron comparadas utilizando la prueba Tukey 0,05% de nivel de significación. Para el análisis de datos de la respuesta morfogénica en los segmentos basales caulinares en cada cultivar de Rubus sp. versus el control, y el efecto de los reguladores de crecimiento ANA y AIB en la inducción de raíces adventicias de brotes de Rubus sp, se empleó la prueba t de dos medias con 0,05% de nivel de significación con 15 repeticiones. Los datos de las variables número de brotes, número de yemas por brote y número de raíces, fueron transformados mediante la √Y+0,5 antes de someterlos al ANVA y/o prueba t. Todos los datos fueron procesados empleando el paquete estadístico SAS (Statistical Analysis System) for Windows V8.
Resultados
Los embriones de los cultivares Castilla, Tupy y Navaho germinaron a los nueve días de instalados in vitro (Figura 1a y 1b), y las plántulas después de un periodo de 90 días de cultivo alcanzaron una longitud entre 60 a 70 mm (Figura 1c y d), y posteriormente fueron acondicionadas para la obtención de segmentos basales caulinares para la inducción de brotes adventicios etiolados (Figura 1e, f y g).

Figura 1 Obtención de segmentos basales caulinares en cultivares de Rubus sp. a) Embrión de Rubus sp. b) Crecimiento y desarrollo del embrión en medio de establecimiento. c y d) Plántulas de Rubus sp. después de 90 días de cultivo in vitro. e) Preparación de secciones basales caulinares de Rubus sp. f y g) Segmentos basales caulinares preparados para la regeneración de brotes adventicios etiolados.
La respuesta morfogénica de los segmentos basales caulinares sometidos a oscuridad entre los cultivares de Rubus se muestra en la Tabla 1. En el primer tratamiento de oscuridad durante once días no se registraron diferencias significativas en la respuesta morfogénica en los tres cultivares, obteniendo valores de longitud de brote que osciló entre 28,9 a 34,3 mm, número de brotes 1,8 a 2,1 y número de yemas por brote 1,2 a 1,4. Igualmente, los segmentos basales caulinares sometidos a un segundo tratamiento de oscuridad durante seis días no mostraron diferencias significativas en las variables evaluadas, registrándose longitud de brote entre 17,6 a 26,5 mm, número de brotes 1,8 a 2,1 y número de yemas por brote 1,1 a 1,7.
Tabla 1 Respuestas morfogénicas de los segmentos basales caulinares entre cultivares de Rubus sp. Castilla, Tupy y Navaho sometidos a tratamiento de oscuridad por periodos de 11 días (primera etiolación) y 6 días (segunda etiolación).
| Cultivar | Tratamiento oscuridad (días) | Respuestas morfogénicas | ||
|---|---|---|---|---|
| Long. de brote1 (mm) | N° de brotes1 | N° de yemas/brote1 | ||
| Castilla Tupy Navaho Castilla Tupy Navaho | 11 11 11 6 6 6 | 28,9 ± 11,2 a 30,8 ± 9,8 a 34,3 ± 8,9 a 17,6 ± 6,1 a 26,5 ± 9,1 a 22,0 ± 6,0 a | 1,8 ± 0,6 a 2,0 ± 0,4 a 2,1 ± 0,6 a 1,8 ± 0,7 a 2,1 ± 0,3 a 2,1 ± 0,6 a | 1,4 ± 0,5 a 1,2 ± 0,4 a 1,4 ± 0,7 a 1,5 ± 0,7 a 1,1 ± 0,3 a 1,7 ± 0,8 a |
1 Medias con diferentes letras minúsculas indican diferencias significativas entre cada una de los cultivares de Rubus sp. en la primera y segunda etiolación para ρ≤ 0,05 de acuerdo con la prueba Tukey.
Por otro lado, los segmentos nodales en medio de crecimiento y desarrollo sin tratamiento de oscuridad registraron longitud de brotes, a los 21 días de cultivo, en los cultivares Castilla 12,6 ± 2,9 mm, Tupy 12,7 ± 2,1 mm y Navaho 10,6 ± 3,6 mm, siendo estas longitudes menores respecto a los brotes adventicios etiolados, siendo la prueba significativa (Figura 2). Además, estas plántulas mostraron una apariencia arrosetada que no permitió la adecuada multiplicación a partir de segmentos nodales, respuesta mejorada con los brotes adventicios etiolados, los que mostraron alargamiento de entrenudos, facilitando la propagación in vitro de esta especie (Figura 3a, 3b, 3c y 3d).
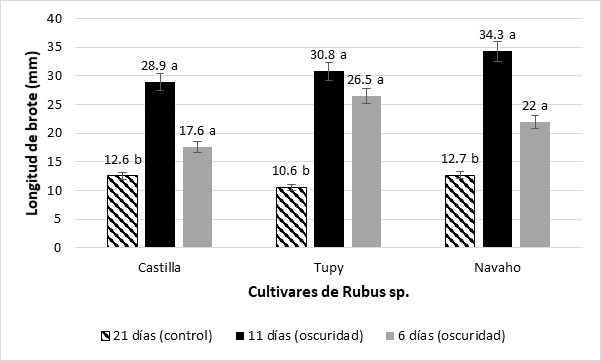
Figura 2 Efecto de los regímenes de luz y oscuridad versus el tratamiento sin oscuridad (control) sobre la longitud de brotes de los segmentos basales caulinares en cultivares de Rubus sp. Castilla, Tupy y Navaho. Medias en cada columna con diferentes letras minúsculas indican diferencias significativas entre cada uno de los cultivares de Rubus sp. para ρ≤ 0,05 de acuerdo con la prueba t.
Las respuestas morfogénicas dentro de los cultivares de Rubus se muestra en la Tabla 2, cuyas medias en dos periodos de oscuridad (11 y 6 días), no registraron diferencias significativas en las variables evaluadas.
Tabla 2 Respuestas morfogénicas de los segmentos basales caulinares comparados en dos periodos de tratamiento en oscuridad (11 y 6 días) dentro de cultivares de Rubus sp. Castilla, Tupy y Navaho.
| Cultivar vs periodo tratamiento de oscuridad | Long. de brote1 (mm) | N° de brotes1 | N° de yemas/brote1 |
|---|---|---|---|
| Castilla 11 días Castilla 06 días | 28,9 ± 11,2 a 17,6 ± 6,1 a | 1,8 ± 0,6 a 1,8 ± 0,7 a | 1,4 ± 0,5 a 1,5 ± 0,7 a |
| Tupy 11 días Tupy 06 días | 30,8 ± 9,8 a 26,5 ± 9,1 a | 2,0 ± 0,4 a 2,1 ± 0,3 a | 1,2 ± 0,4 a 1,1 ± 0,3 a |
| Navaho 11 días Navaho 06 días | 34,3 ± 8,9 a 22,0 ± 6,0 a | 2,1 ± 0,6 a 2,1 ± 0,6 a | 1,4 ± 0,7 a 1,7 ± 0,8 a |
1 Medias con diferentes letras minúsculas indican diferencias significativas entre cada una de los cultivares de Rubus sp. en la primera y segunda etiolación para ρ≤ 0,05 de acuerdo con la prueba t.

Figura 3 Regeneración de brotes adventicios etiolados. a) Segmentos basales caulinares de Rubus sp. b) Regeneración de brotes adventicios etiolados. c) Brotes adventicios etiolados después de 7 días de exposición a fotoperiodo 16/8h. d y e) Brotes nodales en medio de enraizamiento y f) Segmentos nodales con raíces adventicias después de cuatro semanas.
En la Tabla 3 se muestra la respuesta del enraizamiento en los cultivares de Rubus sp a las cuatro semanas de cultivo empleando las auxinas ANA y AIB (Figura 3e y 3f). La longitud de raíces (102 y 97 mm) y número de raíces (2,5 y 2,4) en el cultivar Castilla no mostraron diferencias significativas. El cultivar Tupy registró diferencias significativas en la longitud de raíces (81 mm), mostrando respuesta cuando se empleó ambas auxinas, en tanto, el número de raíces (2,7) no mostraron diferencias significativas. El cultivar Navaho, registró respuesta de inducción de raíces cuando se empleó ambas auxinas, registrando 65 mm y 1,7 de longitud y número de raíces, respectivamente.
Tabla 3 Respuestas morfogénicas en la inducción de raíces adventicias in vitro de secciones nodales de Rubus sp. cultivares Castilla, Tupy y Navaho a las cuatro semanas de cultivo in vitro.
| Cultivares de Rubus sp. | Regulador de crecimiento | Respuesta morfogénica | |||
| ANA (mg/L) | AIB (mg/L) | Longitud raíces (mm)1 | N° de raíces1 | Sobrevivencia de explante (%)1 | |
| Castilla Castilla | 1,0 --- | 2,0 1,0 | 102 ± 46 a 97 ± 39 a | 2,5 ± 0,9 a 2,4 ± 1,8 a | 87,5 96,7 |
| Tupy Tupy | 1,0 --- | 2,0 1,0 | 81 ± 68 a 58 ± 51 b | 2,7 ± 0,8 a 2,7 ± 1,0 a | 100,0 83,3 |
| Navaho Navaho | 1,0 --- | 2,0 1,0 | 65 ± 54 --- | 1,7 ± 0,9 --- | 80,6 --- |
1 Diferentes letras indican diferencias significativas entre los tratamientos para ρ≤ 0,05 de acuerdo a la prueba t.
Discusión
En su estado natural el género Rubus forma brotes caulinares subterráneos, iniciando la activación de una o más yemas latentes (Monasterio Huelin, 1995). Similar proceso ha sido observado in vitro en el presente estudio, donde los segmentos basales caulinares sometidos a oscuridad, probablemente permitió la activación de yemas latentes, reflejado en la regeneración de brotes adventicios, lo cual probablemente pueda ser explicado que el tratamiento en oscuridad tiene un efecto positivo en la producción de auxinas que permite la inducción y alargamiento del brote etiolado (Yang et al., 2019; Wang et al., 2019). Por otra parte, Muktadir et al. (2016) evaluaron la eficiencia de la regeneración de hipocótilos de plántulas de Solanum melongena, donde los periodos de oscuridad mejoran la regeneración de brotes adventicios, Zhang et al. (2016) reportaron que los hipocótilos y meristemos apicales de Ricinus communis requirieron tratamiento de oscuridad para promover un mayor número de brotes adventicios, Wang et al. (2019), empleando thidiazuron y 14 días de cultivo bajo oscuridad en explantes foliares de Fragaria vesca obtuvieron alto porcentaje y regeneración de brotes por explante. Makenzi et al. (2018), colocando esquejes de Ipomoea batata en oscuridad, demostraron que el número de yemas adventicias fueron mayores en aquellas colocadas bajo luz. Igualmente, Zhao et al. (2013) al someter explantes de Rhodiola crenulata a un pretratamiento de oscuridad, obtuvieron mayor números de brotes comparado a un control sin tratamiento de oscuridad.
En tanto, en Lachenalia sp. la regeneración del número de brotes y yemas empleando oscuridad está por debajo de las condiciones del espectro de luz blanca/azul y por encima del espectro de luz roja (Bach et al., 2018). Por otra parte, en yemas de Capsicum el tratamiento de oscuridad por siete días no tiene efecto en la organogénesis (Gammoudi et al., 2018).
El género Rubus ha sido propagado exitosamente por cultivo de tejidos, es así que, Cancino-Escalante et al. (2015) en el cv. Castilla registraron 21,6 mm de longitud de brotes y 1,8 brotes por explante empleando reguladores de crecimiento 2,5 mg/L de BAP más 0,03 mg/L de AG3 a las cuatro semanas de establecidos in vitro, Ayub et al. (2019) reportaron longitud de brotes de 25 mm en el cv. Tupy a los 56 días en biorreactor de inmersión temporal. En el presente estudio se registró similares respuestas morfogénicas en el cv. Castilla y Tupy sin el uso de reguladores de crecimiento y en menor tiempo. Sin embargo, existen reportes de regeneración de brotes adventicios en otras especies donde se emplea mayor periodo de tiempo, como los reportados en brotes de la seleção IAPAR8 que requiere 30 días (Oliveira-Cauduro et al., 2016); y brotes etiolados de Anthurium marícense se obtienen en 60 días (Serafim et al., 2018).
Taiz & Zeiger (2013) indican que las plántulas desarrolladas en oscuridad exhiben un crecimiento etiolado, caracterizado por el alargamiento de los hipocótilos y represión de genes regulados por la luz (aspectos escotomorfogénicos), similares eventos pudieron observarse en los brotes etiolados de los cultivares de Rubus sp., donde los entrenudos experimentaron alargamiento y no acumularon clorofila en la oscuridad (Figura 3b). Por otro lado, Taiz & Zeiger, (2013), relatan que los pro-plastidios de las plantas etioladas no sintetizan clorofila, y una serie de enzimas y proteínas estructurales necesarias de la maquinaria fotosintética; estos pro-plastidios pueden también desarrollar a cloroplastos, cuando las plántulas etioladas son iluminadas, evento similar a lo observado cuando los brotes etiolados de Rubus sp. fueron sometidos a exposición de luz por siete días (Figura 3c).
En la presente investigación, el medio de enraizamiento permitió inducir raíces en los segmentos nodales a la cuarta semana de cultivo in vitro, y estuvieron aptos para su posterior fase de aclimatación. En tanto, Millones (2018), empleando 1 mg/L de AIB en la accesión silvestre de Rubus sp. (004-Rsp-UNTRM) registraron inducción de raíces a la novena semana de cultivo, similares respuestas de inducción de raíces fueron registrados en Rubus idaeus, R. futicosus empleando 1 mg/L de AIB, cuyas raíces fueron observadas después de seis semanas de incubación (Hunková et al., 2016). Asimismo, Lebedev et al. (2019) registraron inducción de raíces a la sexta semana de cultivo en R. idaeus cuando emplearon 0,2 y 0,1 mg/L de AIB.
Conclusiones
Los segmentos basales caulinares de Rubus sp. cultivares Castilla, Tupy y Navaho, sometidos a periodos de 11 o 6 días en oscuridad, regeneran brotes adventicios etiolados sin el empleo de reguladores de crecimiento, facilitando la propagación in vitro de estos cultivares.
La combinación de AIB 2 mg/L más ANA 1 mg/L en el medio de enraizamiento, fueron adecuados en la inducción de raíces adventicias en segmentos nodales de los cultivares de Rubus sp.
La regeneración de brotes adventicios etiolados en los tres cultivares de Rubus sp. se obtiene en seis semanas aproximadamente, es decir una semana en el proceso de etiolación, una semana bajo fotoperiodo de los brotes etiolados y cuatro semanas de inducción de raíces adventicias bajo iluminación.












 uBio
uBio 


