Introducción
El ñame espino (Dioscorea rotundata Poir.) es uno de los tubérculos con mayor potencial como alimento funcional en los trópicos y subtrópicos de todo el mundo (Darkwa et al., 2020). Debido a lo anterior, ocupa un área importante de la tierra cultivable en muchos países tropicales, alcanzando a nivel mundial una producción de 7,258 millones de toneladas. En Colombia es un cultivo que registra áreas importantes de siembra, especialmente en la región Caribe, en los departamentos de Córdoba (47%), Sucre (10%) y Bolívar (36%), con áreas menores de siembra en el departamento de Antioquia (7%) (Agronet, 2018). Con lo anterior, Colombia registra una producción anual aproximada de 419,267 toneladas, ubicándose en el puesto 12 en producción a nivel mundial.
Durante el cultivo, el ñame en Colombia es atacado por muchas enfermedades, dentro de las cuales una de las más importantes es la pudrición seca del tubérculo, la cual ocasiona pérdidas que se han calculado entre 20-50% de la producción (Sánchez-López et al., 2020). Esta enfermedad ataca los tubérculos durante el desarrollo del cultivo afectando la producción y continúa ocasionando daños posteriormente después la cosecha durante el almacenamiento de los tubérculos. En la literatura científica se mencionan los hongos Aspergillus niger, A. flavus, A. ochraceus, Lasiodiplodia theobromae, Colletotrichum sp., Curvularia sp., F. solani F. moniliforme, F. oxysporum, Rhizoctonia spp., Rhizopus nodosus, Penicillium expansum, P. digitatum, P. oxalicum, P. purpurogenum (Anwadike, 2018; Gwa y Richard, 2018; Ijato, 2019), como posibles agentes causales de esta enfermedad en otras partes del mundo.
En Colombia los niveles de afección de esta enfermedad han aumentado ostensiblemente en los últimos años, lo que ha ocasionado pérdidas de producción que afectan significativamente los ingresos de los pequeños productores y comerciantes de ñame vinculados a este cultivo, y pone en riesgo la seguridad alimentaria de muchas familias rurales (Nwankiti y Gwa, 2018).
Los cambios ambientales que se han generado en las sabanas y zonas costaneras donde predominan las siembras de ñame pueden haber contribuido a la generación de variabilidad genética en estos hongos, por ende, se hace necesario que los agricultores de estas zonas puedan mitigar el impacto económico de los daños causados por estos patógenos en el cultivo de ñame (Haller y Branca, 2020). Una mejor comprensión de esta problemática en las sabanas y zonas costaneras de la región Caribe en Colombia podría contribuir a la recuperación de los niveles de ingresos de los pequeños productores y a un desarrollo más sostenible del cultivo de ñame (Escobar et al., 2020).
Por lo anterior, en un estudio previo, se colectaron tubérculos que presentaban síntomas visibles de la enfermedad en las principales zonas productoras, logrando el aislamiento de 56 hongos, los cuales fueron agrupados por sus características morfo-genéticas en 11 morfotipos (Sanchez-López et al., 2020). Se desconoce si efectivamente estos 11 morfotipos están asociados con la enfermedad de la pudrición seca, por lo que la presente investigación se llevó a cabo con el fin de determinar su capacidad de infección y desarrollo de síntomas en las plantas de ñame en el Caribe colombiano.
Materiales y métodos
Condiciones experimentales
La presente investigación se realizó bajo condiciones de invernadero, durante los meses de febrero a octubre de 2020, en el Centro de Investigación Turipaná, perteneciente a la Corporación Colombiana de Investigación Agropecuaria-AGROSAVIA. Este centro se encuentra ubicado a una altitud de 18 msnm, con coordenadas geográficas de 8°51.8’46.97” N y 75°49.2’ 27.53” O, en el municipio de Cereté, departamento de Córdoba, Colombia. Las condiciones ambientales predominantes durante el desarrollo del experimento fueron de 65% de humedad relativa y 30±2°C de temperatura promedio.
Material vegetal
La virulencia de los 11 morfotipos se evaluó usando dos materiales genéticos de ñame espino provenientes del Programa de Mejoramiento de Ñame de AGROSAVIA, los cuales se identifican con los números de referencia 0307-49SB y 0307-50CB. Para el experimento, se cultivaron plantas en invernadero mediante la siembra de secciones o porciones sanas de tubérculo, de 80-100 g de peso, las cuales fueron obtenidas de tubérculos que no presentaban síntomas visibles de afectaciones por enfermedades, daños físicos o mecánicos. Previo a la siembra, las secciones de tubérculo fueron desinfectadas mediante inmersión durante cinco minutos en una solución que contenía una mezcla de fungicidas e insecticidas (Metalaxil-M + Mancozeb en dosis de 4 g L-1 y Fipronil en dosis de 2 mL L-1). La siembra se realizó en macetas de 35 cm de alto y 25 cm de ancho que contenían 18 kg de sustrato. El sustrato se preparó mediante la mezcla de aluvión y arena fina, en proporción 1:1, el cual fue desinfectado con Dazomet (3 g L-1), con posterior solarización por un período de 30 días. En la Tabla 1 se muestran las propiedades físico-químicas del sustrato utilizado para la siembra.
Tabla 1 Propiedades físico-químicas del sustrato utilizado en el establecimiento del experimento.
| Determinación analítica | Unidad | Valor |
|---|---|---|
| Clase Textural | No aplica | Franco Arcillosa |
| pH (1:2,5) | No aplica | 6,61 |
| Conductividad eléctrica (CE) (1:5) | dS.m-1 | 0,22 |
| Materia orgánica (MO) | g.100 g-1 | 0,49 |
| Fósforo disponible (P) Bray II | mg.kg-1 | 4,05 |
| Azufre (S) disponible | mg.kg-1 | 14,87 |
| Capacidad Interc Catiónico Efect (CICE) | cmol (+). k-1 | 6,48 |
| Boro (B) Disponible | mg.kg-1 | 0,20 |
| Acidez Al+H) | g100.g-1 | ND** |
| Aluminio intercambiable (Al+H) | cmol (+).kg-1 | ND** |
| Calcio (Ca) Disponible | cmol(+).kg-1 | 4,76 |
| Magnesio (Mg) Disponible | cmol(+).kg-1 | 1,57 |
| Potasio (K) Disponible | cmol (+).kg-1 | <0,09 |
| Sodio (Na) Disponible | cmol (+).kg-1 | <0,14 |
| Hierro (Fe) olsen Disponible | mg.kg-1 | 31,51 |
| Cobre (Cu) olsen Disponible | mg.kg-1 | 1,5 |
| Manganeso (Mn) olsen Disponible | mg.kg-1 | 1,90 |
| Zinc (Zn) olsen Disponible | mg.kg-1 | <1,00 |
**ND=No detectable
Hongos patógenos
En el presente experimento se evaluó la capacidad de infección de los 11 morfotipos asociados a la pudrición seca de los tubérculos de ñame en la región Caribe de Colombia que fueron reportados por Sánchez-López et al. (2020), (Tabla 2 y Figura 1). Los morfotipos fueron reactivados en medio PDA® suplementado con Amikacina® (1 mL L-1) e incubados a una temperatura 30 ± 2 °C durante 15 días. La reactivación se comprobó mediante observación microscópica con azul de lactofenol (Ijato, 2019).
Tabla 2 Morfotipos de hongos usados para evaluar su capacidad de infección en tubérculos de ñame espino.
| Morfotipo | Especies |
| DH2 | Lasiodiplodia theobromae |
| DH3 | Fusarium solani #1 |
| DH6 | Neocosmospora rubicola |
| DH9 | Neoscytalidium hyalinum |
| DH11 | Curvularia aeria |
| DH13 | Fusarium solani #2 |
| DH16 | Aspergillus oryzae |
| DH17 | Fusarium equiseti |
| DH18 | Curvularia pseudorobusta |
| DH20 | Aspergillus niger |
| DH22 | Penicillium sclerotigenum |
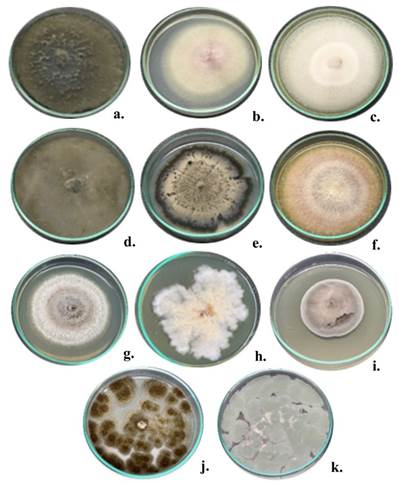
Figura 1 Crecimiento radial de los morfotipos de hongos usados para evaluar la capacidad de infección en tubérculos de ñame espino. (a.) DH2-L. theobromae, (b.) Fusarium solani #1, (c.) DH6-Neocosmospora rubicola, (d.) DH9-Neoscytalidium hyalinum, (e.) DH11-Curvularia aeria, (f.) DH13-Fusarium solani #2, (g.) DH16-Aspergillus oryzae, (h.) DH17-Fusarium equiseti, (i.) DH18-Curvularia pseudorobusta, (j.) DH20-Aspergillus niger y (k.) DH22-Penicillium sclerotigenum.
Preparación del inóculo
Una vez reactivados los hongos se depositaron discos de micelio en 100 mL de caldo de papa suplementado con sacarosa al 10%. El caldo con cada hongo se mantuvo bajo agitación constante a una temperatura de 30 ± 2 °C y 150 rpm durante 3 días. Posteriormente, se realizó un conteo de esporas utilizando una cámara de Neubauer (Brightline “Boeco®”, Germany) y con base en los resultados se procedió a realizar la calibración para que el inóculo correspondiente a cada morfotipo presentará una concentración constante de 1,5 x 106 conidias mL-1, mediante dilución con agua destilada.
Para la inoculación se tomaron 5 mL de cada inóculo y mediante la utilización de una jeringa se inyectó el inóculo de cada morfotipo en el área de crecimiento de las raíces de las plantas de ñame. Una vez realizada la inoculación, las macetas se cubrieron con papel vinilo envolvente y se mantuvieron así por un espacio de 45 días. La inoculación de los hongos se realizó cuando las plantas en las macetas presentaban 150 días de sembradas y se encontraban en el proceso de formación de los tubérculos. Para facilitar la entrada del patógeno a la planta, se realizó una perturbación física de la zona de raíces en la maceta, tratando de ocasionar heridas en los puntos de crecimiento de las raíces. Bajo condiciones naturales de crecimiento del cultivo, estos morfotipos son capaces y tienen la habilidad de penetrar e infectar el tejido de las plantas de ñame, tal como ha sido descrito por Adeniji et al. (2020) y Anwadike (2021). En este caso se realizó el disturbio de las raíces a fin de asegurar una igual penetración de los morfotipos bajo estudio.
Variables evaluadas
Al cabo de los 45 días de la inoculación (DDI) se procedió a extraer la parte aérea y subterránea de las plantas, dividiéndolas en tubérculos y tallos en los cuales se evaluaron las afectaciones ocasionadas por los morfotipos inoculados, calificándola como presentes (1) y/o ausentes (0), describiendo además los síntomas observados. Los datos obtenidos de incidencia fueron transformados mediante el enfoque de transformación de rango (RT) mediante la utilización del paquete estadístico SAS v.9.4.
Tratamientos y diseño experimental
Se evaluaron un total de 24 tratamientos, correspondientes a la inoculación de los 11 morfotipos de hongos asociados a la pudrición seca de los tubérculos y un testigo absoluto sin inoculación, y dos materiales genéticos de ñame (0307-49SB y 0307-50CB). El experimento se estableció bajo un diseño completamente al azar con arreglo factorial 12x2 completo y tres repeticiones, en donde el primer factor correspondió a los morfotipos y el segundo factor a los materiales genéticos de ñame. La unidad experimental estuvo conformada por tres macetas o plantas de ñame por tratamiento.
Manejo del experimento
Con base en el análisis físico-químico del sustrato, se realizó una fertilización a cada maceta acorde a los requerimientos del cultivo (O’sullivan, 2010). Para la fertilización se preparó una mezcla equivalente a 60,7 kg ha-1 de N, 24 kg ha-1 de P y 24 kg ha-1 de K, la cual se aplicó a una dosis de 100 g planta-1 de forma fraccionada, correspondiendo la primera fertilización al 30% a los 60 días después de la brotación (DDB) y la segunda fertilización al 70% a los 90 DDB. El control de arvenses se realizó en forma manual, cada 15 días. El riego se efectúo igualmente de forma manual, aplicando 1600 mL de agua a cada matera con una frecuencia de tres veces por semana.
Análisis estadísticos
Para el procesamiento y análisis de los datos se tuvieron en cuenta las siguientes consideraciones: los datos obtenidos no cumplieron con los supuestos de normalidad y homogeneidad de varianzas, por lo cual, no se pudieron emplear técnicas estadísticas paramétricas. Los procedimientos estadísticos por utilizar para este tipo de casos involucran los métodos no paramétricos, sin embargo, debido a que en el montaje del experimento se empleó un DCA bajo estructura factorial, no existe una prueba específica o modificación de la prueba Kruskall-Wallis que permita analizar los datos a través de este tipo de método.
Teniendo en cuenta lo descrito anteriormente, se optó por realizar una combinación de métodos no paramétricos con métodos paramétricos. En primera instancia los datos de las variables fueron transformados en rangos, seguidamente se efectuó un análisis de varianza y finalmente se examinaron los efectos principales e interacción de los promedios de rangos, a esto tipo de análisis se le conoce como enfoque de transformación de rango (RT). La significancia de los efectos principales se analizó a través de la prueba LSD al 5% y la interacción a través de contrastes ortogonales. El análisis de los datos se realizó utilizando el paquete estadístico SAS v.9.4.
Resultados
Infección en tubérculos
Los resultados de los análisis estadísticos mostraron diferencias significativas (p<0,05) en la capacidad de infección de los tubérculos entre los 11 morfotipos de hongos evaluados (Tabla 3). Por el contrario, no se presentaron diferencias entre genotipos de ñame, ni en la interacción entre los morfotipos de hongos y los genotipos de ñame evaluados (p>0,05).
Tabla 3 Análisis de varianza de los rangos de infestación en tubérculos de los materiales genéticos 0307-49SB y 0307-50CB
| Variable: Tubérculo | |||
|---|---|---|---|
| Fuente | gl | Cuadrados medios | p- valor |
| Material genético | 1 | 54,00 | 0,78 |
| Morfotipos | 11 | 43646,72 | <,0001** |
| Material genético*Morfotipo | 11 | 996,54 | 0,1788 |
| C.V | 24,65 | ||
| R2 | 0,78 | ||
**Altamente significativo (p<0,01); *significativo (p<0,05); ns: no significativo (p>0,05).
La mayor capacidad de infección en los tubérculos del ñame ocurrió por efecto de cuatro (4) de los morfotipos evaluados, los cuales generaron una infección severa con síntomas similares a los reportados en campo, ocasionando la pudrición seca y el deterioro de los tubérculos. Los morfotipos DH2-L. theobromae, DH11-C. aeria, DH20-A. niger y DH17-F. equiseti fueron los que presentaron la mayor capacidad de generar infección en los tubérculos, por lo que en este estudio se consideran como los principales agentes causales de la enfermedad conocida como “pudrición seca” de los tubérculos del ñame (Figura 2).
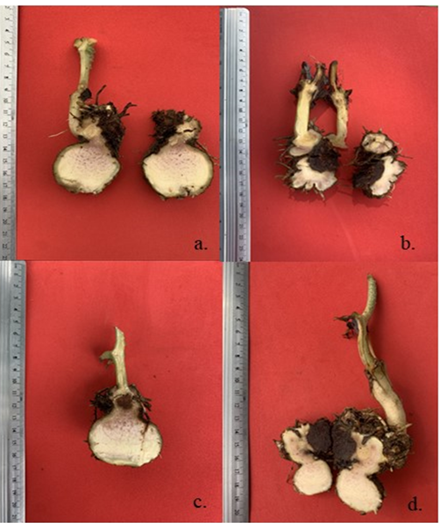
Figura 2 Lesiones producidas por los cuatro morfotipos de hongos con mayor capacidad de infección en los tubérculos de ñame (a.) DH2-L. theobromae, (b.) DH11-C. aeria, (c.) DH20-A. niger y (d.) DH17-F. equiseti.
Los análisis estadísticos mostraron una menor capacidad de infección con los morfotipos DH3, DH16 y DH22, mientras que los morfotipos DH6, DH9, DH13 y DH18, mostraron nula capacidad de infección en los tubérculos (Figura 3). No se observaron diferencias en el comportamiento entre los dos materiales genéticos de ñame espino evaluados (0307-49SB y 0307-50CB).
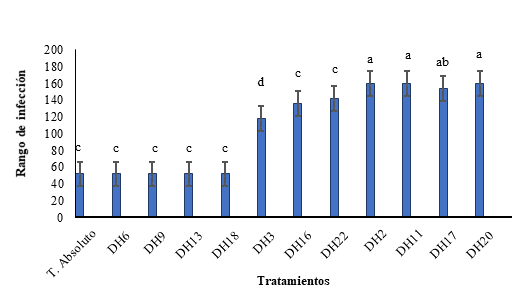
Figura 3 Rango de infección de 11 morfotipos de hongos en los tubérculos de ñame. El Rango de infección corresponde a: Bajo (0-52); Moderado (53-150); Severero (>151). Promedio de tres repeticiones.
Los síntomas generados se caracterizaron por presentar lesiones con formas y colores que se describen en la Tabla 4, para los cuatro morfotipos de mayor infección en los tubérculos.
Tabla 4 Descripción de síntomas observados en los tubérculos de ñame por efecto de los cuatro morfotipos de hongos con mayor capacidad de infección
| Morfotipo | Síntomas internos en el tubérculo |
|---|---|
| DH2-L. theobromae | Lesiones secas de forma irregular, con centro de color café rojizo, borde marrón y halo café claro. |
| DH11-C. aeria | Lesiones secas concéntricas, con centro de color café claro, borde grueso de color café rojizo y halo amarillo. |
| DH17-F. equiseti | Lesiones secas de forma irregular, centro de color café claro, bordes de color café oscuro y halo café claro. |
| DH20-A. niger | Lesiones secas de forma irregular, centro de color café oscuro, bordes de color café rojizo y halo café claro. |
Se evidenció el desarrollo de algunos síntomas en los tallos de las plantas de ñame y en este caso los morfotipos con mayor capacidad de infección difirieron de los observados en los tubérculos, con interacción significativa entre materiales genéticos de ñame y los morfotipos (p<0,0006). En el material genético 0307-49SB, la mayor infección se presentó con los morfotipos DH3 y DH6. Por su parte, en el genotipo 0307-50CB, la mayor infección se observó con los morfotipos DH9 y DH13. En las Figuras 4 se muestran los rangos de infección presentados por estos morfotipos y en la Figura 5 los síntomas observados en los tallos de la planta de ñame. Los restantes morfotipos de hongos no mostraron síntomas aparentes de infección en el tallo de las plantas de ñame, por lo cual no se muestran en la Figura 4.
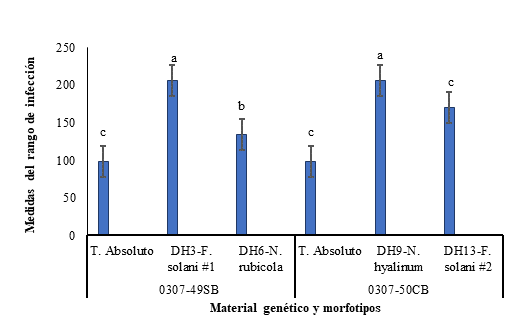
Figura 4 Rango de infección de cuatro morfotipos de hongos en los tallos de plantas de dos genotipos de ñame. El Rango de infección corresponde a: Bajo (0-100); Moderado (100-150); Severo (>141). Las letras con distinta letra representan deferencias estadísticas significativas entre tratamiento (p<0,05). Promedio de tres repeticiones.

Figura 5 Síntomas producidos por los cuatro morfotipos de hongos con capacidad de infección en los tallos de ñame (a.) DH3-F. solani #1, (b.) DH6-N. rubicola, (c.) DH9-N. hyalinum y (d.) DH13-F. solani #2.
En la Tabla 5, se detallan los síntomas que se observaron en los tallos a partir de la infección de los distintos morfotipos y la mortalidad ocasionada por los mismos en las plantas de ñame.
Tabla 5 Descripción de síntomas ocasionados por los morfotipos en los tallos
| Genotipos | Morfotipos | Síntomas | %Mortalidad de plantas |
|---|---|---|---|
| 0307-49SB | DH3-F. Solani | Pérdida de turgencia de los brotes apicales de las guías del tercio medio e inferior. En la parte interna de las secciones del tallo se observaron lesiones de color café claro de forma alargada a lo largo de los tejidos vasculares apreciables a los 45 DDI. | 0% |
| DH6-N. rubicola | Necrosis externa ascendente en la base del tallo, con decoloración interna de color amarillo claro a café oscuro apreciable a los 45 DDI. | 11.11% | |
| 0307-50CB | DH9-N. hyalinum | Las guías del tercio superior expresaron pérdida de turgencia a los 45 DDI. | 33.33% |
| DH13-F. solani | En la base del tallo principal se observó necrosis en la parte externa, y decoloración café claro en la parte interna. | 11.11% |
Discusión
Los resultados de la presente investigación permitieron evaluar la capacidad de infección ocasionada por 11 morfotipos de hongos que previamente habían sido asociados como posibles agentes causales de la enfermedad conocida como “pudrición seca” de los tubérculos de ñame en la región Caribe de Colombia (Sánchez et al., 2020). Dentro de los anteriores, se identificaron cuatro (4) morfotipos con capacidad de infección en los tubérculos (DH2-L. theobromae, DH11-C. aeria, DH20-A. niger y DH17-F. equiseti), los cuales ocasionaron daño a los tubérculos y desarrollaron los síntomas típicos de la enfermedad, por lo que se consideran en este estudio como los principales agentes causales de la enfermedad en el Caribe Colombiano. Los restantes siete (7) morfotipos, a pesar de haber sido inoculados en las raíces de las plantas, mostraron efectos menores sobre los tubérculos y otros afectaron órganos distintos de la planta, especialmente los tallos y la parte aérea de la planta de ñame. Por lo anterior, éstos últimos se consideran como agentes residentes en el suelo, causales de otro tipo de enfermedades, probablemente de tipo vascular.
Es particularmente conocida la especificidad de los patógenos por órganos específicos de la planta, en donde encuentran las mejores condiciones para su proliferación y desarrollo. Lo anterior ha sido relacionado por una parte con el desarrollo de sistemas genéticos complementarios, que condicionan el desarrollo de las enfermedades en sitios específicos del huésped (Cruz-Borruel et al., 2006; Delaux y Schornack, 2021). Por otro lado, también se relaciona con la disponibilidad de nutrientes, azúcares y aminoácidos requeridos por los patógenos y disponibles en el tejido vegetal, los cuales posibilitan el desarrollo de los patógenos de manera mucho más rápida en órganos específicos de la planta. Por consiguiente, los morfotipos DH2-L. theobromae, DH11-C. aeria, DH20-A. niger y DH17-F. equiseti, mostraron especificidad por los tubérculos de las plantas de ñame, en donde probablemente encuentran la mejor condición para penetrar las células vegetales, colonizar y proliferar en el tejido vegetal.
Los anteriores resultados coinciden con algunos reportes de la literatura que relacionan las especies Lasiodiplodia theobromae, Curvularia aeria, Aspergillus niger y Fusarium equiseti con enfermedades en los tubérculos del ñame y otras especies vegetales.
Investigaciones realizadas por Borges-García et al. (2020) asociaron al hongo L. theobromae como principal agente causal de daños en tubérculos de ñame en cosecha y almacenamiento, ocasionando disminución en el porcentaje de masa fresca del tubérculo. Asimismo, Aidoo et al. (2020) reporta en sus investigaciones que el hongo L. theobromae ocupó el mayor porcentaje de frecuencia de aparición dentro de los patógenos que ocasionan la pudrición del tubérculo del ñame en postcosecha. El hongo L. theobromae se caracteriza por presentar una gran capacidad de adaptación y se encuentra asociado con numerosos huéspedes y enfermedades de las plantas (Félix et al., 2016), ocasionando cancros y lesiones necróticas, que eventualmente conducen a la muerte de las plantas hospedantes. Este hongo tiene además la capacidad para producir pigmentos de melanina en los conidios y el micelio, lo cual es considerado un factor esencial para su patogenicidad, al igual que tirosina y fenilalanina que dan lugar a la síntesis de compuestos implicados en la estructura y defensa (Rangel-Montoya et al., 2020). En revisiones de literatura realizados por Salvatore et al. (2020) se relacionan más de 134 compuestos bioquímicos perteneciente a metabolitos secundarios y ácidos grasos como ciclohexenos, ciclohexenonas, jasmonatos, lactonas, fenoles y otros compuestos, producidos por L. theobromae, lo cual hace que este hongo presente un alto potencial fitotóxico, con la capacidad para causar enfermedades en las plantas.
Por su parte, los hongos pertenecientes al género Curvularia se han reportado principalmente como causantes de manchas foliares en diferentes cultivos como tomate, banano, lechuga, entre otros (Pornsuriya et al., 2018; Khan y Javaid, 2020). Nuestros resultados por el contrario indican que el morfotipo DH11-C. aeria presenta la capacidad para ocasionar daño en los tubérculos de ñame, mostrando especificidad por este tipo de órgano de la planta.
Por otro lado, A. niger fue reportado por Mabou et al. (2020) como uno de los agentes fúngicos causantes de pudrición seca del ñame en las zonas productoras de Camerún, lo cual coincide con esta investigación. A. niger es un hongo que ha sido reportado en la literatura como productor de micotoxinas que ocasionan putrefacción de los tejidos, por lo que se le considera un contaminante de productos en almacenamiento. El-Baky et al. (2021) reportaron que este hongo tiene la capacidad para producir aflatoxinas y ocratoxinas, sustancias que son consideradas carcinogénicos y pueden afectar la salud humana (Gil-Serna et al., 2020). En el mismo sentido, Patrice et al. (2017) consideran que A. niger es uno de los hongos más dañinos para los productos en almacenamiento, ocasionando pérdidas que se calculan entre un 25-60%.
En cuanto a la especie DH17-F. equiseti se ha reportado que dicho hongo produce compuestos metabólicos (zearalenone diacetoxiscirpenol, monoacetoxyscirpenol y scirpentriol), los cuales son altamente fitotóxicos (Kosiak et al., 2005; Kostić et al., 2019; Vedovatto et al., 2020). No obstante, Azil et al. (2021) reporta ocho aislamientos identificados como F. equiseti en tubérculos de Solanum tuberosum con síntomas de podredumbre seca en las regiones de Argelia, presentando micotoxinas como tricotecenos y zearalenona, las cuales presentan una alta toxicidad. Las especies del Fusarium se han descrito como hongos filamentosos ocasionales, incluidos como patógenos oportunistas infectando diverso tipo de plantas en todo el mundo, pero a su vez pueden crecer como saprofitos en un rango de zonas climáticas (Stępień et al., 2020) y presenta una producción de metabolitos secundarios tóxicos, que son motivo de preocupación para la salud humana y animal (Li et al., 2020). Las especies de Fusarium pueden causar la infección de las partes subterráneas del tubérculo de ñame desde etapas muy tempranas, presentado una alta especificidad por las variedades de pulpa blanca y ocasionando el 68.4% de las infecciones en los tubérculos. El aumento de la virulencia y distribución de Fusarium en cultivares de ñame podría estar relacionado con un incremento de los cambios de huésped de los patógenos de Fusarium a otras plantas hospederas del ñame (Dongzhen et al., 2020). El Fusarium spp. presenta una baja prevalencia en el cultivo de ñame, pero alta patogenicidad, ya que ha venido incrementado su presencia en este cultivo infectado las partes aéreas y los tubérculos; comenzando en etapas tempranas de los tubérculos e infectando los tejidos y cambiando de color continuamente, lo que resulta en marchitez vascular y, finalmente, pudrición y muerte de la planta (Zhu et al., 2016). Esta enfermedad puede continuar propagándose incluso después de la cosecha, durante el almacenamiento. El cual es perjudicial para el desarrollo sostenible del cultivo de ñame.
Se pudo evidenciar que, en la investigación que los morfotipos DH3, DH6, DH9 y DH13, aunque presentan efectos adversos sobre la parte aérea de la planta, el hecho de no ocasionar síntomas en los tubérculos indicaría que son agentes causales de enfermedades vasculares, considerándose como hongos emergentes en el cultivo de ñame en la región Caribe de Colombia. De los anteriores, el género Fusarium, encontrado en los morfotipos DH3 y DH13, ha sido considerado como uno de los patógenos vegetales más devastadores, causando hasta un 50% de pérdida de rendimiento en cultivos de frutas tropicales como banano y piña, lentejas, tomate, guisantes entre otros (Abbasian et al., 2020). Se puede señalar que existen en la naturaleza diferentes cepas de F. solani que exhiben variaciones en sus características morfológicas y culturales, patogenicidad y virulencia (Patel et al., 2020). En esta investigación se pudo evaluar dos tipos de cepas con características macroscópicas distintas y su comportamiento fue diferente para los dos materiales genéticos. De igual forma, la especie F. solani fue identificada por Jahén-Rivera et al. (2020) quien menciona que es uno de los agentes causales de pudrición del tallo de la higuera (Ficus carica), después de realizar pruebas de patogenicidad. Las especies de la familia Botryosphaeriaceae como N. hyalinum tienen una distribución mundial y son reconocidas patógenos importantes en varios árboles en todo el mundo. Se ha informado que N. hyalinum es la especie más prevalente asociada con cancros de ramas de cítricos en las regiones desérticas del sur de California. Este hongo ha sido recuperado de C. paradise mostrando síntomas de gomosis y muerte regresiva (Mayorquin et al., 2016). Por lo tanto, esta investigación, es el primer reporte de este hongo causando daños graves de necrosis y muerte en D. rotundata.
Por otro lado, N. rubicola, encontrado en el morfotipo DH6, fue reportado por Zheng et al. (2018) como agente causal de pudrición del tallo, lo cual coincide con esta investigación. Este hongo se encuentra reportado como saprofito de la familia Nectriaceae, asociado varias verduras, frutas, tubérculos y pudrición de cultivos (Riaz et al., 2020). Además, informa Shahzadi et al. (2020) que la temperatura, pH, nutrientes y la ecología del sitio, están relacionado con expresiones de crecimiento radial, esporulación y crecimiento de la colonia. También produce toxinas que afectan la salud humana, animal y vegetal; entre los metabolitos tóxicos producidos por el género Neocosmospora se destacan furanoterpenoides, ipomeanoles e ipomeanina (Sandoval-Denis et al., 2019). Por su parte, el hongo N. hyalinum, ha sido reportado por varias investigaciones por causar cancro y hollín en verduras, frutas y árboles en regiones tropicales y subtropicales en todo el mundo (Espargham et al., 2020).
Debido a que los tejidos de los tubérculos de ñame espino constituyen una fuente importante de nutrientes, a su vez pueden convertirse en una fuente hospedera óptima para facilitar la proliferación de diversos hongos. Según informes realizados por Lacaze y Joly (2020) menciona que los hongos presentan una especificidad y adaptación a un órgano determinado, así como respuestas celulares mediadas por la superficie celular o los receptores inmunitarios intracelulares, los cuales pueden propiciar la infección del patógeno. La combinación de diferentes factores podría conducir a una resistencia total hacia un patógeno, pues estos hongos no han desarrollado mecanismos específicos para infectar otras estructuras de la planta. Además, se debe establecerse una compatibilidad del huésped-patógeno como requisito primario para que se dé una invasión y destrucción del huésped por un agente patógeno, dando como resultado la compatibilidad genética entre enzimas hidrolíticas y los tejidos constitutivos del hospedador (Mabou et al., 2020), esto puede confirmar la capacidad de infección que tienen los morfotipos DH2, DH11, DH20 y DH17 por los tubérculos de ñame espino. Algunos autores sugieren que los cambios ambientales, pueden estimular a que algunos hongos se conviertan en patógenos agresivos, a través de la liberación de enzimas degradantes, proteínas inhibitorias y toxinas (Gonçalves et al., 2019; Perincherry et al., 2020).
Conclusiones
Los morfotipos DH2-L. theobromae, DH11-C. aeria, DH20-A. niger y DH17-F. equiseti inoculados a los tubérculos de plantas de 150 DDS presentaron la capacidad de generar infección en los tubérculos, por lo tanto, se consideran como principales agentes causales de la enfermedad conocida como “pudrición seca” de los tubérculos del ñame en la región Caribe de Colombia. Debido a su capacidad de daño a los tubérculos, estos morfotipos tienen la potencialidad de ocasionar pérdidas considerables a la producción del ñame espino bajo condiciones ambientales favorables y materiales genéticos susceptibles. Con base en lo anterior, esta investigación es un punto de partida hacia el desarrollo de planes y estrategias de manejo que permitan disminuir la incidencia y pérdida de calidad de los tubérculos de D. rotundata durante la cosecha y posterior almacenamiento. Esta investigación, por tanto, contribuye a recuperar la productividad y disminuir las pérdidas en postcosecha del ñame en la región Caribe de Colombia, a la vez que propicia la recuperación del nivel socio-económico de los pequeños productores vinculados a este cultivo y a salvaguardar la seguridad alimentaria de las familias rurales.












 uBio
uBio 


