Introducción
Bolivia presenta problemas ambientales severos de degradación de suelos, cerca del 48% de la superficie del país presenta erosión, afectando notoriamente a los departamentos de Oruro, Potosí, Chuquisaca y Tarija; siendo el Altiplano una de las zonas más susceptibles. Asimismo, se vislumbran cambios en el uso de la tierra debido a la expansión agrícola (Coppus et al., 2003). La pérdida de suelo por la ampliación de parcelas agrícolas en zonas del intersalar es de 50 a 120 t ha-1 año, esta situación es preocupante ya que se pierden alrededor de 46% de la superficie cultivada de quinua (Cossio, 2008).
La principal actividad económica del intersalar (Altiplano Sur de Bolivia) depende casi exclusivamente de la producción de la quinua y la crianza de llamas (Lama glama), por lo que, en esta zona, se cultivan grandes extensiones destinadas a la exportación las cuales por sus condiciones agroecológicas no es posible desarrollar otro cultivo (Jacobsen y Sørensen, 2011). Sin embargo, el cambio de sistema de producción y la ampliación de nuevas áreas de cultivo en las últimas décadas, ha conllevado serios problemas de índole ambiental, socio-económicos y erosión de suelo cuyo efecto directo es la tendencia negativa de los rendimientos por unidad de superficie y la degradación de los ecosistemas (Risi et al., 2015).
La mineralización es un proceso de transformación de la materia orgánica (MO) a un estado inorgánico a través de la acción de microorganismos que poseen enzimas adecuadas para el rompimiento de los enlaces de las macromoléculas orgánicas (Ordoñez et al., 2016). Los microorganismos también sintetizan y liberan enzimas extracelulares para hidrolizar sustratos de peso molecular elevado hasta que sean lo suficientemente pequeños para poder ser metabolizados por sus células (Senesi et al., 2009). En este sentido, se considera al suelo como uno de los principales reservorios de la diversidad microbiana y que su abundancia está ligada estrictamente con la heterogeneidad de hábitats. A modo de ejemplo, anteriores estudios han estimado de 2000 a 18000 genomas distintos en un gramo de suelo (Torsvik y Øvreås, 2002). Asimismo, otros estudios revelan de 2.6 x 1029 células en un suelo orgánico (Paul, 2007).
En ese sentido, la aplicación de la MO a los suelos agrícolas tiene diversos beneficios tales como el mantenimiento de la fertilidad, la conservación de los elementos como nitrógeno (N) y carbono (C), el incremento de la actividad biológica, el mejoramiento de la estructura y la disminución de la erosión y salinización del suelo (Cristóbal et al., 2015). Sin embargo, escasos estudios han evaluado el efecto de las poblaciones microbianas sobre los parámetros de mineralización del estiércol bovino, hecho que puede ser una poderosa herramienta para el mejoramiento de la fertilidad de los suelos.
El Altiplano Sur de Bolivia se caracteriza por poseer un estado climático y geográfico que genera las circunstancias propicias para que la región sea predominantemente árida y semiárida debido a su baja precipitación (< 300 mm/año), un balance hídrico negativo, temperaturas bajas (medias anuales entre 0º y 9ºC), con grandes oscilaciones térmicas, heladas muy frecuentes y constantes vientos, los cuales contribuyen a una alta erosión edáfica (Barrientos et al., 2017). En este contexto, el análisis de las poblaciones microbianas busca entender el rol fundamental que tienen en la liberación de nutrientes, por lo tanto, su función en el establecimiento de especies vegetales para favorecer el equilibrio ecológico en las áreas de restauración (Beltrán et al., 2017). El objetivo de nuestro estudio se orientó a evaluar la influencia bacteriana y fúngica en la mineralización de estiércol bovino (EB) en el suelo.
Materiales y métodos
Área de estudio
El presente trabajo se realizó en el municipio de Caracollo de la provincia Cercado, específicamente en el Centro Experimental Agropecuario de Condoriri a 49 km de la ciudad de Oruro, dependiente de la Facultad de Ciencias Agrícolas y Naturales de la Universidad Técnica de Oruro, geográficamente situada a 17º31’41’’ latitud Sur y 67º14’02’’ longitud Oeste, a una altitud de 3830 msnm. La zona se caracteriza por su clima árido frío con una temperatura media anual de 9.2°C, precipitaciones pluviales de 360 mm anuales y con 45.2% de humedad relativa. Los vientos predominan de norte a sur con una velocidad promedio de 3.4 km s-1.
Aplicación de EB
Para la aplicación de estiércol bovino (EB) se utilizaron proporciones de 0.9, 1.9, 3.3, 4.2, 5.0, 5.6 y 6.7%, cada una de ellas fueron homogenizadas con arena de río por separado e introducidas a las macetas (bolsas de polietileno) de forma independiente, luego se regaron con agua de grifo hasta que la humedad llegó a capacidad de campo. Una vez logrado la humedad adecuada, se sembraron en las macetas de 5 a 10 semillas de C. quinoa de forma manual a una profundidad de 2 a 3 cm aproximadamente. Cada tratamiento se realizó con cuatro réplicas.
Riego
El riego de cada maceta se aplicó de forma manual con regadera de jardín cada 2 días en la etapa de emergencia a desarrollo inicial de las plántulas; una vez que pasaron a la fase de ramificación, el riego fue realizado cada 3 días. El riego se aplicó de 8:30 a 9:30 de la mañana hasta que las plantas completaron su madurez fisiológica.
Raleo
A tres semanas de la emergencia, se realizó la actividad de raleo dejando en cada maceta solo 2 plántulas de C. quinoa. Esta actividad se realizó con el fin de que las macetas tengan la misma cantidad de plantas para su evaluación microbiológica y análisis de macronutrientes de cada uno de los tratamientos.
Muestreo de suelos
Se recolectaron muestras de suelo de aproximadamente 1 kg de peso de las macetas (bolsas de polietileno) con plantas de C. quinoa mediante metodología estándar recomendada por FAO (2009), las cuales fueron enviadas al laboratorio de suelos y aguas de Spectrolab de la Universidad Técnica de Oruro para su análisis de macronutrientes (Ca, K, N, P, Mg y Na). Para el análisis microbiológico, se recolectaron en frascos estériles 200 g de suelo a una profundidad entre 5 a 25 cm por tratamiento mediante la utilización de pala jardinera estéril cada 30 días desde el momento de la siembra hasta el 85% de madurez fisiológica de las plantas. Las muestras fueron trasladadas en una caja microbiológica a temperatura ambiente hasta el laboratorio del Centro de Investigación de la Quinua para su análisis.
Medición de humedad del suelo y pH
Para determinar la humedad, se añadió 50 g de suelo (Peso 1) a sobres de papel sábana. Posteriormente, éstas fueron introducidas a una estufa a una temperatura de 105°C por 48 horas, para proceder a pesar los suelos secos nuevamente (Peso 2). Por otra parte, se pesó 20 g de suelo, los cuales luego se depositaron a un vaso de precipitación de 250 ml, donde le fue añadido 50 ml de agua destilada para luego mezclar durante 3 min con la ayuda de una varilla. Una vez realizada la mezcla, se dejó en reposo por 5 min. Finalmente se procedió a la toma de lectura de pH con la ayuda de un pHmetro (medición estándar).
Cuantificación de microorganismos
Para recuento de las colonias microbianas en las placas, se optó por aplicar la técnica de dilución seriado (Guzmán, 2011). De esta manera, de cada dilución correspondiente a 10-2 y 10-5 se tomaron 0.5 mL de muestra para transferir la primera dilución a placas Petri con Potato Dextrose Agar (PDA) para hongos, y la segunda dilución a placas Petri con Plate Count Agar (PCA) para bacterias, cada uno con tres repeticiones por muestra de suelo las cuales se incubaron a 25°C. Después de cinco días de incubación se contaron las colonias formadas en las placas Petri de forma detallada en cada tratamiento.
Análisis estadístico
Para realizar el análisis comparativo de las poblaciones microbianas sobre la mineralización de EB y el efecto de humedad del suelo, se utilizó un diseño completamente al azar. Los datos obtenidos fueron transformadas a Unidades Formadoras de Colonias (UFC) por gramo de suelo seco y sometidos al análisis de varianza (ANOVA) para establecer si existen diferencias significativas entre los niveles de EB mediante la prueba de medias de Tukey a un nivel de significación de p < 0.05. Adicionalmente, se realizaron pruebas de correlación de Pearson entre los recuentos de bacterias y hongos presentes en cada nivel de pH para conocer los posibles efectos de sus poblaciones. El análisis estadístico se realizó mediante el programa R Project versión 4.0.2.
Resultados
Comportamiento de bacterias y hongos frente al pH
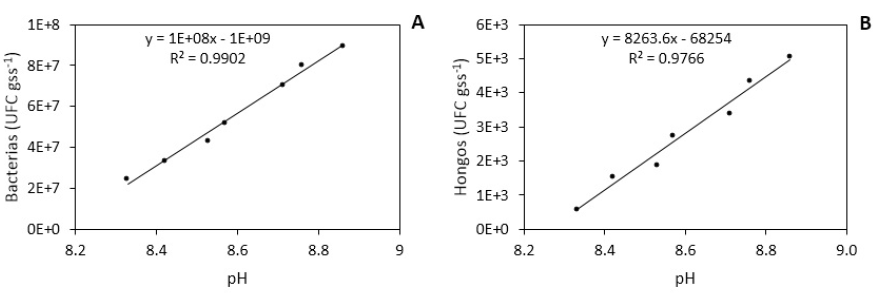
No se obtuvieron diferencias significativas entre tratamientos en lo que respecta al pH (p = 0.1500). No obstante, existe alta significancia en contraste lineal (p = 0.0074), denotando una diferencia de poblaciones microbianas entre tratamientos. En la figura 1 se observa que la población de bacterias (A) y hongos (B) se incrementa relativamente para cada nivel de pH positivamente.
Mineralización de nutrientes
Para el sodio (Na), el análisis de varianza es altamente significativo (p = 0.0035), además en análisis de contraste también existe alta significancia linealmente (p = <.0001). El magnesio (Mg) no presenta significancia (p = 0.1016) en análisis de varianza ni en contraste lineal (p = 0.1720) entre los diferentes tratamientos. El fósforo (P) presenta varianza significativa (p = 0.0119), pero en contraste lineal alta significancia (p = 0.0002) entre las poblaciones microbianas (figura 2).
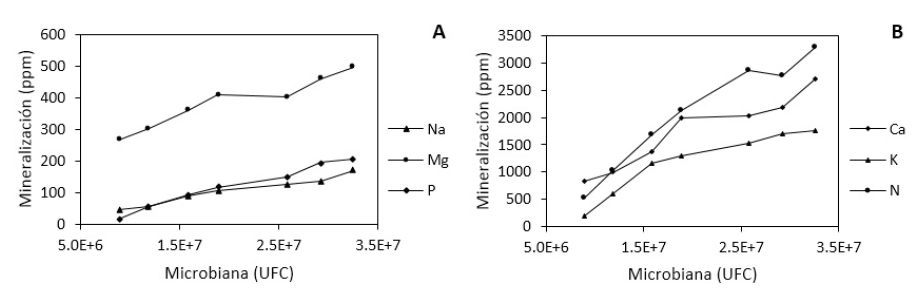
Figura 2 Liberación de nutrientes del suelo, según la población microbiana: a) Sodio, Magnesio, Fósforo y b) Calcio, Potasio y Nitrógeno.
Por otra parte, para el análisis de varianza del calcio (Ca) existe alta significancia (p = 0.0010) entre las diferentes poblaciones microbianas, así como también en contraste lineal (p = 0.0002). En cuanto al potasio (K) y nitrógeno (N) también se percibe alta significancia (p = < 0001) en varianza y contraste lineal (p = <.0001). Lo que se traduce que la mineralización de diferentes elementos en el suelo, se incrementa a mayor presencia de microorganismos.
Bacterias y hongos a cada nivel de EB
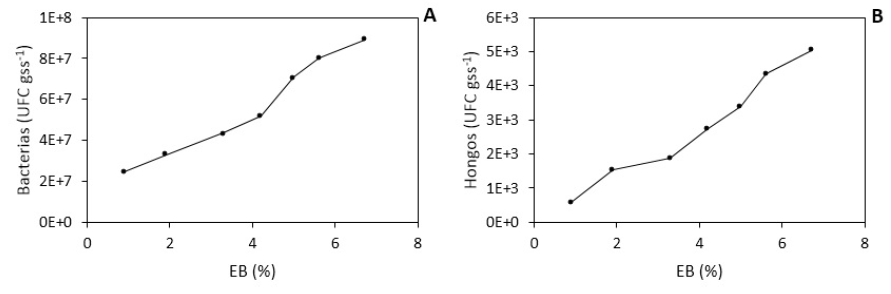
La prueba de análisis de varianza indica que existe alta significancia (p = <.0001) entre bacterias y hongos, es decir que al menos en uno de las concentraciones de EB es diferente. Por otro lado, el análisis de contraste ortogonal también indica que existe alta significancia (p <.0001) entre cada nivel de la aplicabilidad de EB, las poblaciones de bacterias y hongos se incrementan linealmente a mayor concentración de EB, lo que indica que estos dos factores no son independientes (figura 3).
Bacterias y hongos frente a la humedad
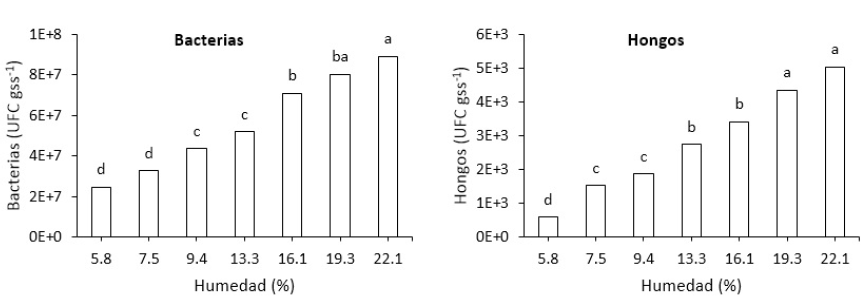
El análisis de varianza como en contraste lineal indican que existe alta significancia (p = <0001) entre los tratamientos, es decir que la población de bacterias y hongos son diferentes a cada nivel de humedad del suelo, esto hace comprender que la humedad es de vital importancia en los ecosistemas para los procesos de la degradación y mineralización de compuestos orgánicos (figura 4). La deficiencia de humedad en los suelos conducirá a la pérdida de muchas bacterias y hongos beneficiosos para los procesos biogeoquímicos, esto se traduciría en la pérdida de la fertilidad de los suelos.
Discusión
En la actualidad, los principales factores naturales y antrópicos relativos al decrecimiento productivo en Bolivia se asocian principalmente a: la ampliación de áreas de cultivo con inadecuada gestión, privatización de tierras, decrecimiento de la población de ganado, escasez en la implementación de tecnologías de cultivo, aumento de la sequía producto de las disminuciones de precipitaciones suelos livianos y erosión edáfica (DICyT- UTO, 2013; Barrientos et al., 2017). Para evitar la pérdida de suelo en estos agrosistemas, existen investigaciones que sugieren alternativas interesantes como la utilización de leguminosas silvestres (Lupinus spp.) para la producción sostenible de quinua (Bonifacio et al., 2014), la aplicación de abono orgánico (estiércol de oveja y/o llama y compost) y el uso de franjas de cultivo con barreras vivas entre otras prácticas ambientales (Cossio, 2008). En este contexto, este es el primer reporte tendiente para evaluar la influencia bacteriana y fúngica en la mineralización de EB en el suelo.
Las variables de poblaciones analizadas en nuestro estudio parecen estar más relacionadas con cambios ambientales locales y no con el pH del suelo. Esto evidencia que los microorganismos del suelo se adaptan y sobreviven a diferentes cambios. En este sentido, al momento de alcanzar pH de rangos entre 8.3 a 9.0, los grupos de bacterias y hongos presentaron un crecimiento poblacional lineal y no se observó el efecto en el desarrollo de la variabilidad poblacional de los mismos (figura 1). Al respecto, anteriores estudios concluyen que en suelo el pH determina el metabolismo y la supervivencia de los microorganismos, donde la mayoría logran crecer en pH de 4 a 9 (Sainz et al., 2011). El pH del suelo fue moderadamente alcalino durante todo el desarrollo de la investigación y no generó un descenso significativo en la población bacteriana, excepto en los hongos donde se observó un ligero descenso, lo que ratifica lo hallado en anteriores investigaciones que señalan que en condiciones estándares de temperatura y humedad del suelo, éste no es influenciada por el pH (Ramos y Zuñiga, 2008). Por otra parte, se ha reportado que las poblaciones fúngicas de suelo presentan mayor tolerancia a la acidez del suelo y son afectadas en menor medida por las variaciones del pH en relación con las bacterianas (Thorn y Lynch 2007; Strickland y Rousk, 2010).
En base a nuestros hallazgos, los resultados indican que la liberación de Na, Mg, P, Ca, K y N es dependiente de las poblaciones bacterianas y fúngicas del suelo, siendo que a menor población la liberación de nutrientes se reduce (figura 2). En este sentido, no existe ninguna divergencia de los estudios que señalan que la mineralización de la MO en el suelo depende de las poblaciones microbianas (Guadarrama et al., 2018), mientras que otros estudios reportan que las raíces vivas de las plantas y sus exudados afectan a la actividad microbiológica del suelo (Tao et al., 2015). En nuestro estudio es probable que los exudados de las raíces de C. quinoa pueda haber estimulado la mineralización de EB, por lo que podría ser una buena vía posterior para evaluar esta hipótesis.
Para cada nivel de EB la población bacteriana y hongos se observó que la liberación de nutrientes es distinta durante toda la investigación, donde se apreció que la mayor liberación fue de N y la que menos se liberó fue de Na, al respecto, anteriores investigaciones sugieren que la mineralización de N está relacionada con el contenido de arena y de las propiedades físicas, químicas y microbiológicas del suelo (Sissoko y Kpomblekou, 2010; Monsalve-C. et al., 2017; Chen et al., 2018). Este reporte tiene similitud con nuestros resultados, ya que se evidenció mayor mineralización de N en un suelo arenoso, pero el Na fue persistente en su degradación.
El incremento de las poblaciones de bacterias y hongos mostraron una correlación con EB, esto se traduce en un incremento de la población microbiana a cada nivel de EB. En este sentido, encontramos mayor población en UFC por gramo de suelo seco a una aplicación de 6.7% de EB con 8.9 x 107 de bacterias y 5.0 x 103 en hongos; asimismo, se ha observado que la población disminuye a concentraciones bajas de EB (figura 3). Al respecto, estudios afirman que las variaciones de las poblaciones microbianas son temporales, en función de la disponibilidad de la MO (Kätterer et al., 2014). En el presente estudio se ha observado que EB aplicado al suelo influye en el incremento de las poblaciones, coincidiendo con otros trabajos que reportan esta misma situación (Tao et al., 2015). Otras investigaciones reportan que las enmiendas orgánicas aplicadas a C. quinoa presentan variación temporal según el contenido de MO y del estado vegetal (Brockett et al., 2012; Paco y Guzmán, 2019), y la distribución microbiana está controlada por el tamaño y la continuidad de los poros del suelo (Asghari et al., 2009). En nuestro estudio los suelos fueron arenosos con alto contenido de macro poros y con baja capacidad de retención de agua y nutrientes, por lo tanto, la actividad microbiana principalmente la población de hongos se halló muy reducida.
Por otro lado, se puede deducir que el comportamiento de las poblaciones bacterianas y fúngicas en diferentes niveles de humedad del suelo presentan heterogéneas poblaciones (figura 4), ya que a 22.1% existe mayor incremento de bacterias y hongos, pero no solo dependen de la humedad, si no están influenciadas por varios factores como el pH, MO, textura, estructura y estado fisiológico de la planta entre otros. Al respecto, anteriores autores afirman que la humedad y la temperatura son los factores ambientales más comúnmente relacionados con la población microbiana (Drenovsky et al., 2010), aunque también han demostrado que la variación estacional del año genera cambios en las poblaciones microbianas (Bardgett et al., 1999; Paco et al., 2017), ya que estos factores afectan a distintos tipos de microorganismos existentes en el suelo (Griffiths et al., 2003). Los reportes de la población bacteriana de nuestro estudio son los organismos clave que intervienen en la descomposición, mineralización y nitrificación del EB.
Conclusiones
La expansión de la frontera agrícola en el Altiplano Sur de Bolivia ha traído consigo una serie de problemas ambientales, entre los cuales la erosión edáfica y la remoción de material vegetal para ampliar zonas de cultivo han mermado notablemente la calidad del sustrato. En este sentido, el uso inadecuado de los suelos en planicies y la ya mencionada extensión agrícola está convirtiendo a la zona intersalar boliviana en una región con alta tendencia a la insostenibilidad ambiental y productiva, afectando seriamente el balance ambiental para el cultivo de C. quinoa, en consecuencia, una de las alternativas para frenar la degradación de suelos y el medio ambiente es la búsqueda de sustratos de origen orgánicos que ayuden a mantener este equilibrio. En nuestro estudio, las diferentes dosis de EB aplicadas al suelo no provocaron un ascenso significativo en los valores de pH, lo que no impactó sobre las poblaciones microbianas. Este comportamiento puede atribuirse a que las bacterias y hongos toleran pH de 8 a 9. Los cambios de estos organismos pueden ser utilizados como indicadores de sostenibilidad y estabilidad del suelo. Sin embargo, en base a nuestros hallazgos las poblaciones microbianas varían en función a la humedad del suelo, ya que se observaron valores altos poblacionales en condiciones de alta humedad. Las plantas de C. quinoa hospedan un gran número de bacterias y hongos, pero altas concentraciones de EB, temperatura, humedad y la textura del suelo, son factores determinantes para el incremento de poblaciones microbianas.
El EB incorporado al suelo muestra índices poco favorables en la tasa de mineralización de los elementos como P, K, Na, Mg y Ca, pero el N es potencialmente mineralizable, lo que permite predecir con mucha certeza que este nutriente se mineraliza durante la etapa del desarrollo fisiológico de C. quinoa, además, se ha observado tendencias claras que ha mayor población microbiana incrementa la liberación de este elemento.
A mayor concentración de EB en el suelo, se ha observado un aumento apreciable de las poblaciones bacterianas y fúngicas, por lo que se puede considerar que el EB tiene la capacidad de mejorar la heterogeneidad espacial de los microorganismos, así como también de estimular las interacciones con las plantas, en donde se modifican las formas químicas de los nutrientes.












 uBio
uBio