Introducción
El manganeso, un metal abundante en la corteza terrestre, es uno de los mayores contaminantes de aguas subterráneas y superficiales y hasta ahora se desconoce la magnitud de su impacto en el medio ambiente (Herndon & Brantley, 2011). Es el quinto elemento en abundancia en la corteza terrestre; puede presentarse en tres formas: disuelto como Mn2+, como partículas con un estado de oxidación de Mn4+, y en forma de coloide (Guillen-Rivas et al., 2021). En los acuíferos subterráneos la contaminación por manganeso se produce por efecto de la disolución de las rocas y minerales que se encuentran en forma de óxidos, sulfuros, carbonatos y silicatos; y antropogénico a partir de las aguas residuales industriales generadas por la minería, plaguicidas, productos químicos orgánicos, procesamiento de metales (Anu, 2015). Cuando está presente en niveles elevados se considera indeseable debido a que en la interacción con el aire provoca la oxidación a Mn (IV), y el agua adopta un sabor amargo (Kwakye et al., 2019). A nivel mundial, de acuerdo con la legislación, los niveles máximos de concentración de manganeso del agua de consumo no deben exceder 0.05 mg L-1 (Vries et al., 2017).
Las aguas ácidas de mina tienen pH entre 2 y 6, contienen cationes y aniones en disolución, predominan SO4, Fe, Mn, Al, Cu, Pb, Zn, además de Cd, Ca, Na, K, Mg y otros (Loza & Aduvire, 2017). El manganeso disuelto en las aguas ácidas produce efectos nocivos ya que genera daños irreparables en los sistemas acuáticos, inhibe el crecimiento de las comunidades vegetales, afecta a la calidad de las aguas superficiales, subterráneas y acuíferos poco profundos (Aduvire, 2006). Así mismo, produce una coloración oscura, mal olor y sabor, también contribuye al crecimiento de microorganismos, además existe evidencia de que altas concentraciones por largos períodos están relacionadas con enfermedades del sistema nervioso como el Parkinson (Li et al., 2016). Su presencia involucra problemas estéticos y de salud, dificultades en la operación y mantenimiento en los sistemas de abastecimiento y distribución. La acumulación de los precipitados de Mn reduce la capacidad de las tuberías y ocasiona pérdidas de la presión de la red de distribución, lo cual deriva en una situación de carácter técnico y económico (Guillen-Riva et al., 2021).
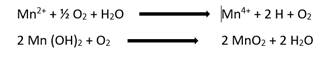
En cuanto a los métodos de remoción, van de acuerdo con su estado de oxidación. Cuando se encuentra disuelto en forma de Mn+2 se utiliza el método de oxidación-coagulación-precipitación, para ello existe una variedad de agentes oxidantes (oxígeno, cloruro férrico, hipoclorito de sodio, peróxido de hidrogeno, etc.), pero previamente es necesario que el agua se encuentre en un rango de pH alcalino (El Azher et al., 2008). Un primer método para el Mn2+ disuelto consiste en que, con la presencia de oxígeno disuelto, el manganeso con un estado de oxidación de 2+ es termodinámicamente inestable a todos los valores de pH, por lo tanto, se oxida y luego se hidroliza para posteriormente ser removido en forma de partículas (MnO2).
La reacción propuesta es la siguiente (Sharma et al., 2005).
Un segundo método es el intercambio iónico, usando un agente oxidante que tendra la función de entregar el ion sodio e intercambie el ion manganeso. Un tercer método es el de aireación-filtración, en el cual se aprovecha el oxígeno del aire para oxidar el ion manganeso y luego precipitarlo y filtrarlo. Cuando el manganeso se encuentra en forma de partícula, asociado a Mn+4, los métodos de remoción utilizan arena sílice, calcita, partículas cuarcíferas para atrapar las partículas de manganeso. Cuando el manganeso se encuentra en forma coloidal, el método a utilizar está basado en el uso de agentes floculantes con el fin de aglomerar las partículas coloidales, para que precipiten debido a su mayor gravedad específica (Hem & Lind, 1994; Bamforth et al., 2006; Bora, Mohan, & Dutta, 2017; Cheng et al., 2020).
En el Perú existe gran número de compañías mineras que tratan las aguas ácidas en plantas de neutralización, como son los casos de Santa Luisa en Ancash, Paragsha en Pasco, Chinalco en Junín, Quiruvilca en la Libertad, Victoria Compañía Minera Volcán en Junín, preocupadas por la conservación del ambiente. Todas ellas reducen la concentración de los metales pesados disueltos (Cu, Pb, Fe, Zn), pero no reducen la concentración del ion manganeso (Loroña-Calderón & Gómez-Lora, 2017). La norma aprobada por D.S. N° 004-2017-MINAM (MINAM, 2017) entró en vigencia a finales del año 2021, por tal razón las compañías mineras vienen realizando pruebas experimentales para reducir el manganeso presente en las aguas ácidas, cumplir con la normativa legal y garantizar la conservación de los ecosistemas de agua dulce.
Las labores de extracción de los minerales generan aguas ácidas, las cuales al ser evacuadas a la superficie son vertidas a receptores, como lagos, lagunas y ríos; en este caso específico son vertidas al río Yauli, entre los 4100 y 4900 msnm, en la provincia de Yauli, Región Junín. Por este motivo las unidades mineras han visto conveniente tratar las aguas ácidas para reducir y mitigar daños al ecosistema y adecuarse a la normativa legal del DS. 010-2010-LMP y DS. 004-2017-ECA (MINAM, 2010; MINAM, 2017). El Estándar de Calidad Ambiental (ECA) concedió un plazo de adecuación a las empresas hasta diciembre del 2021, fecha a partir de la cual las aguas generadas por sus actividades que contengan manganeso disuelto se adecuarán al límite máximo permisible < 0.2 mg/l. Para ello se ha tomado en cuenta el hipoclorito de sodio, un recurso atractivo debido a su bajo costo y alta disponibilidad en el mercado.
Esta investigación, expone los resultados orientados hacia la interacción entre los seres humanos y el ambiente en la región altoandina (Haller & Branca, 2020). En tal perspectiva, este es un primer paso para neutralizar la serie de problemas y riesgos; y, de igual modo, busca una manera inusual de empoderar a los pueblos de alta montaña y de expandir como nunca antes los pequeños núcleos rurales del saber de la sierra (Escobar-Mamani, Branca & Haller, 2020).
El objetivo de la presente investigación es analizar el comportamiento del ion manganeso Mn2+ presente en las aguas ácidas provenientes de la operación minera, para lo cual se propone el uso de un agente oxidante como el hipoclorito de sodio en medio alcalino para precipitar al ion Mn2+ en forma de óxido MnO2.
Materiales y Métodos
Ubicación del Área
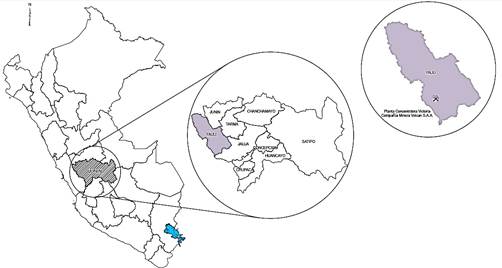
El río Yauli está ubicado en la región central del Perú, en el flanco este de la Cordillera Occidental de los Andes centrales. Las coordenadas geográficas son: 76°05’ de longitud oeste y 11°43’ de latitud sur. La unidad donde realizaron las pruebas se encuentra sobre los 4100 y 4900 msnm, en el distrito de Yauli, provincia de Yauli, Región Junín (Figura 1).
Nota. Tomado de Compañía Minera Volcán SAA.
El método seleccionado para el manganeso en forma de Mn2+ disuelto comprende las etapas de oxidación, coagulación y precipitación. Para ello existe una variedad de agentes oxidantes (oxígeno, cloruro férrico, hipoclorito de sodio, peróxido de hidrogeno, etc.) por lo que es necesario que el agua se encuentre en un rango de pH alcalino. En cuanto a los agentes oxidantes, el pH debe estar comprendido entre 6 y 9; con pH mayores a 9, se estaría incumpliendo la normativa legal establecida en el D.S. 010-2010-LMP. Por ello se usa el hipoclorito de sodio, en concentraciones (mg/L), dosificaciones (%) y a pH ligeramente inferiores a 9, lo que permite reducir la concentración del ion manganeso por debajo de 0.2 mg/L. Además, el agente oxidante mencionado tiene un bajo costo y alta disponibilidad en el mercado de los reactivos químicos. La utilización de sustancias químicas, como oxidante de manganeso, requiere un tiempo de contacto entre 5 y 30 minutos, para una eficiente y completa reacción química (Vries et al., 2017; Bora et al., 2017; Calderón de Alvarado & Tuiro, 2021)).
La compañía cuenta con una planta de neutralización para aguas ácidas, en la que se disminuye la cantidad de los metales pesados tales como: Pb2+, Cu2+, Fe2+, Zn2+, pero no considera al Mn2+, el cual es exigido en el Estándar de Calidad Ambiental (ECA-2017). La planta de neutralización actualmente cumple con la siguiente normativa legal establecida en el D.S. 010-2010-LMP-Vertimiento de Aguas Industriales-MINAM (MINAM, 2010).
Reactivos y Materiales
Las muestras de agua ácida provienen de la bocamina, son recolectadas en forma manual y dispuesta en envases de polietileno, en un rango de pH de 3.5 a 5.5. Se obtuvieron un total de 22 muestras (88 submuestras), colectadas durante cuatro meses a intervalos de 30 minutos, las 24 horas del día, y usando envases de polietileno de un litro. El muestreo se realizó de acuerdo con el Protocolo Nacional de Monitoreo de la Calidad de los Cuerpos Naturales de Agua Superficial, aprobado por Resolución Jefatural N°182-2011-ANA, (ANA, 2011). Todas las pruebas de laboratorio fueron realizadas en el Instituto de Minería y Medio Ambiente de la Universidad Nacional de Ingeniería (UNI) y los análisis químicos de cada una de las pruebas fueron reportados por el laboratorio ambiental J. Ramón del Perú.
Metodología Experimental
Se midieron los parámetros fisicoquímicos (Aduvire, 2006): concentración inicial del Mn2+, pH, conductividad eléctrica, temperatura y turbidez. Se realizaron en total 22 pruebas de laboratorio divididas en dos grupos. El Grupo A comprende los análisis aplicados a las muestras de cabeza de agua de mina y relave fino, con el fin de determinar el pH adecuado para tratar el Mn2+. El grupo B representa las pruebas hechas con muestras de bocamina más relave fino procedente de la planta concentradora, para determinar la concentración y la cantidad añadida del agente oxidante (hipoclorito de sodio).
Resultados
La concentración del ion manganeso (Mn+2) en el agua ácida que se evacúa del interior de la mina se encuentra en un rango de 100 a 250 mg/l y las pruebas que se llevaron a cabo con el hipoclorito de sodio (NaClO) reportan valores por debajo de 0.2 mg/l, de acuerdo a lo especificado en la normativa ECA-2017. Las muestras de agua ácida a la salida de la bocamina, así como la pulpa de relave fino y la mezcla de ambas, tienen contenidos de metales de arsénico, cadmio, cobre, hierro, manganeso, plomo, zinc; donde se han obtenido muestras de 85.50 mg/l, 91.82 mg/l, 136.50 mg/l, 256.6 mg/l, 152.10 mg/l y 8.34 mg/l de manganeso (Tabla 1).
Tabla 1 Concentraciones de metales en el agua ácida + relave fino y mezcla
| Procedencia | Túnel Victoria | Túnel Victoria | Túnel Victoria | Túnel Victoria + relave fino | Túnel Victoria | Líquido de relave fino | |
|---|---|---|---|---|---|---|---|
| Fecha de toma de muestra | 31/10/2019 | 11/12/2019 | 26/02/2020 | 26/02/2020 | 03/03/2020 | 03/03/2020 | |
| pH | 5.8 | 5.8 | 4.53 | 5.2 | 4.27 | 10.5 | |
| Parámetros | mg/L | mg/L | mg/L | mg/L | mg/L | mg/L | |
| Metales totales (ICP) | Arsénico | 0.0829 | 0.3059 | 0.3678 | 38.529 | 0.4522 | 0.2616 |
| Cadmio | 0.0238 | 0.0437 | 0.1175 | 0.1577 | 0.1239 | <0.0015 | |
| Cobre | 0.125 | 1.191 | 4.777 | 5.824 | 6.189 | 0.130 | |
| Hierro | 506.8 | 138.8 | 180.8 | 506.9 | 186.7 | 20.4 | |
| Manganeso | 85.50 | 91.82 | 136.50 | 256.6 | 152.10 | 8.34 | |
| Plomo | 0.3641 | 21.141 | 2.707 | 5.509 | 3.944 | 0.224 | |
| Zinc | 50.35 | 79.19 | 116.3 | 127.6 | > 100.0 | 110.50 | |
Nota. Tomado de Unidad Minera Volcán.
En el grupo A se trabajó a diferentes valores de pH (8.0, 8.5, 8.8 y 9.0) y se observó que en un rango de pH entre 8.8 y 9.0 se logran resultados cercanos al LMP (0.2 mg/l) (Tabla 2). Para el grupo B, se realizaron pruebas a diferentes concentraciones (0.02, 0.03, 0.05 y 0.08%) y dosificaciones (0.5, 0.8, 1.0 y 1.5 mg/l) de NaClO, porque es un agente oxidante (Tabla 3).
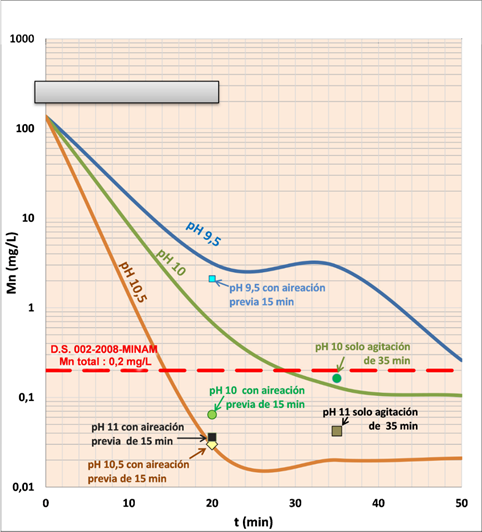
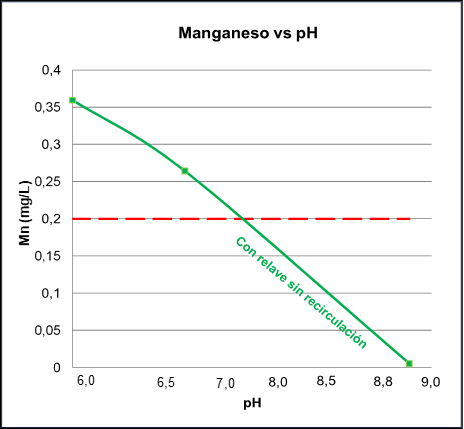
Se muestra la determinación del pH y el tiempo de neutralización a partir de los resultados de las pruebas del grupo A (Figura 2), lo cual indica la concentración de manganeso que se obtiene a escala laboratorio luego de tratar el agua de mina más relave fino a pH 8.0, 8.5, 8.8 y 9.0, forzando ligeramente la aireación. Al respecto la aireación superficial es una buena opción debido a que presenta una mayor eficacia y menor potencia energética.
Nota. Cabeza: agua de mina
Se muestran el consumo de cal (g/L) para la neutralización de las pruebas realizadas con la muestra de los grupos A y B respectivamente (Tabla 2, Tabla 3).
Tabla 2 Resultados de las pruebas de laboratorio del grupo A
| Prueba Nº Grupo A | 1A | 2A | 3A | 4A | 5A | 6A | 7A | 8A | 9A | |
|---|---|---|---|---|---|---|---|---|---|---|
| pH | 8.0 | 8.0 | 8.5 | 8.5 | 8.5 | 8.8 | 8.8 | 9.0 | 9.0 | |
| Cal (gL) | 0.5936 | 0.6021 | 0.8530 | 0.8530 | 0.8530 | 0.8530 | 0.8530 | 0.8530 | 0.8530 | |
| Hipoclorito de Na (0.02%) | 0.02 | 0.02 | 0.03 | 0.03 | 0.03 | 0.05 | 0.05 | 0.08 | 0.08 | |
| Dosis hipoclorito (mg/l) | 0.5 | 0.5 | 0.8 | 0.8 | 0.8 | 0.5 | 0.5 | 1.5 | 1.5 | |
| Parámetros | mg/l | mg/l | mg/l | mg/l | mg/l | mg/l | mg/l | mg/l | mg/l | |
| Metales totales (ICP) | Cobre | 0.0181 | 0.0191 | 0.0131 | 0.0134 | 0.0132 | 0.0140 | 0.0145 | 0.0093 | 0.0102 |
| Hierro | 0.0142 | 0.1883 | 0.1091 | 0.1123 | 0.0556 | 0.0336 | 0.0339 | 0.0485 | 0.0427 | |
| Manganeso | 0.393 | 0.278 | 0.143 | 0.125 | 0.110 | 0.115 | 0.079 | 0.080 | 0.072 | |
| Plomo | <0.004 | 0.008 | <0.004 | 0.026 | 0.018 | <0.004 | <0.004 | <0.004 | <0.004 | |
| Zinc | 0.0225 | 0.1076 | 0.0360 | 0.0430 | 0.0451 | 0.0325 | 0.0251 | 0.0533 | 0.0531 | |
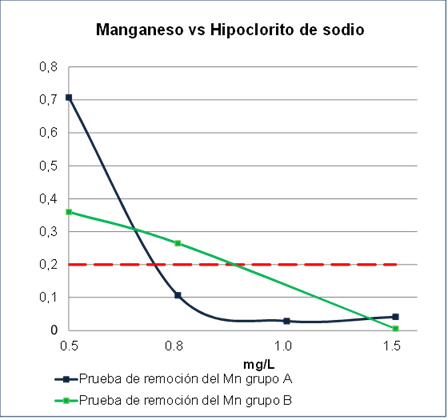
En el grupo B, se realizaron pruebas a diferentes concentraciones (0.02, 0.03, 0.05 y 0.08%) y dosificaciones (0.5, 0.8, 1.0 y 1.5 mg/l) de NaClO. Se muestra la remoción del manganeso versus el uso de hipoclorito de sodio; que son los resultados de los grupos A y B respectivamente (Figura 3).
Los resultados de las pruebas del grupo A reportan valores de Mn2+ por debajo de 0.1 mg/L a partir de una dosificación o cantidad añadida de 0.8 mg/L de hipoclorito de sodio, y se nota estable hasta un valor de adición de 1.5 mg/L. Respecto al grupo B, a partir de 1.2 mg/L de dosificación o cantidad añadida de hipoclorito de sodio se registra que el Mn2+ empieza a removerse por debajo de 0.1 mg/L. Los mejores resultados de remoción de Mn2+ y que se encuentren por debajo de 0.1 mg/L son los del grupo A; teniendo en cuenta el factor de escalamiento que es de 2 (Figura 3).
Tabla 3 Resultados de las pruebas de laboratorio del grupo B
| Prueba Nº Grupo B | 1B | 2B | 3B | 4B | 5B | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| pH | 8.0 | 8.0 | 8.0 | 8.0 | 8.5 | 8.5 | 8.8 | 8.8 | 9.0 | 9.0 | ||
| Cal (gL) | 0.5936 | 0.6021 | 0.6340 | 0.7025 | 0.7799 | 0.7100 | 0.9347 | 0.9669 | 0.9499 | 0.9631 | ||
| Hipoclorito de Na (0.02%) | 0.02 | 0.02 | 0.03 | 0.03 | 0.03 | 0.03 | 0.05 | 0.05 | 0.08 | 0.08 | ||
| Dosis hipoclorito (mg/L) | 0.5 | 0.5 | 0.5 | 0.5 | 0.8 | 0.8 | 1.0 | 1.0 | 1.5 | 1.5 | ||
| Parámetros | mg/L | mg/L | mg/L | mg/L | mg/L | mg/L | mg/L | mg/L | mg/L | mg/L | ||
| Metales totales (ICP) | Cobre | 0.0181 | 0.0191 | 0.0193 | 0.0212 | 0.0150 | 0.0131 | 0.0150 | 0.0129 | 0.0093 | 0.0120 | |
| Hierro | 0.3875 | 0.2774 | 0.1446 | 0.1024 | 0.4135 | 0.3142 | 0.2207 | 0.1330 | 0.2386 | 0.1999 | ||
| Manganeso | 3.153 | 2.891 | 0.259 | 2.098 | 0.105 | 0.064 | 0.020 | 0.021 | 0.032 | 0.020 | ||
| Plomo | <0.004 | 0.009 | 0.012 | 0.006 | 0.005 | 0.019 | 0.025 | 0.013 | 0.008 | <0.004 | ||
| Zinc | 0.1793 | 0.1367 | 0.0925 | 0.070 | 0.1079 | 0.0778 | 0.0797 | 0.0501 | 0.0796 | 0.0662 | ||
El efecto del pH en la remoción del ion manganeso, se registra cuando el pH está en un rango entre 8.3 y 8.9 y la remoción es significativa, por debajo de 0.2 mg/l; cabe indicar que la fuerza o grado de pureza de la cal empleada debe estar dentro de un rango del 70 a 80% CaO (Figura 4).
Como se puede apreciar en la Tabla 4 y la Tabla 5, los resultados de las pruebas indican que habría una mayor remoción del manganeso (del orden de 99.99 %) cuando el pH del proceso se mantiene entre 8.5 hasta cercano a 9.0. Con estos valores las concentraciones del ion manganeso serían < 0.1 mg/L, considerando que el factor de escala de laboratorio a planta es de 1 a 2; vale recordar que el LMP para el Mn2+ es de 0.2 mg/l y, por lo cual estaría adecuado con la legislación ambiental vigente respecto al manganeso.
Tabla 4 Resultados de pruebas de neutralización y precipitación del Mn2+
| pH | Concentración de Mn (mg/L) | ||||
|---|---|---|---|---|---|
| Muestra cabeza (mg/L) | Hipoclorito de sodio (Concentración %/Dosis mg/L) | ||||
| 0.02/0.5 | 0.02/0.8 | 0.02/1.0 | 0.02/1.5 | ||
| 8.0 | 241.6 | 7.235 | 5.340 | 4.245 | 4.235 |
| % remoción | 97.005 | 97.790 | 98.243 | 98.350 | |
| 8.5 | 241.6 | 3.153 | 2.891 | 0.250 | 0.255 |
| % remoción | 98.695 | 98.803 | 99.899 | 99.893 | |
| 8.8 | 241.6 | 0.683 | 0.130 | 0.112 | 0.101 |
| % remoción | 99.717 | 99.946 | 99.956 | 99.958 | |
| 9.0 | 241.6 | 0.029 | 0.020 | 0.021 | 0.020 |
| % remoción | 99.988 | 99.992 | 99.992 | 99.992 | |
| ECA-LMP-para Mn (mg/L) | 0.20 | 0.20 | 0.20 | 0.20 | |
Tabla 5 Resultados de pruebas de neutralización y precipitación de Mn+2con aireación inicial
| pH | Concentración de Mn (mg/L) | |||
|---|---|---|---|---|
| Muestra cabeza | Hipoclorito de sodio (Concentración % / Dosis mg/L) | |||
| (mg/L) | 0.02 / 1.0 | 0.05 / 0.8 | 0.05 / 1.0 | |
| 8.5 | 241.6 | 0.259 | 2.891 | 0.193 |
| % remoción | 99.899 | 98.873 | 99.920 | |
| 8.8 | 241.6 | 0.112 | 0.110 | 0.085 |
| % remoción | 99.956 | 99.957 | 99.965 | |
| 9.0 | 241.6 | 0.021 | 0.020 | 0.020 |
| % remoción | 99.992 | 99.992 | 99.992 | |
| ECA-LMP- para Mn (mg/L) | 0.20 | 0.20 | 0.20 | |
En la Tabla 5 se ha realizado una prueba para cada pH evaluado, utilizando una aireación normal con diferente tiempo antes de neutralizar la solución tratada para ver el efecto del aire en la remoción del ion manganeso. Los resultados, tomando como base el ion manganeso, indican que hay un efecto ligeramente positivo por una mayor velocidad de remoción de este elemento. Se puede apreciar que a pH entre 8.5 a 8.8, el porcentaje de remoción va de 99.920 a 99.965; mientras que a pH 9.0 el porcentaje de remoción es de 99.992; lo que equivale a un incremento en el porcentaje de remoción de 0.027%. Debido a lo anterior se deja a consideración de las operaciones en la planta de neutralización utilizar aire forzado. Así también, en esta etapa (química del proceso) se realizó una prueba a pH 9 y otra a pH 9.5 con aireación normal dentro del proceso de neutralización y precipitación de manganeso, es decir, solo la muestra se mantuvo agitada al pH del proceso establecido versus un pH distinto del proceso establecido, para observar cuál es el efecto de un pH por encima de 9 en la remoción del manganeso. En este caso, la remoción de Mn (%) es prácticamente similar (99.89 %), si el pH del proceso se mantiene igual o mayor a 8.5, e inclusive hasta 9.
Pruebas del grupo B, con concentración y cantidad añadida de hipoclorito de sodio, han definido la química del proceso. Se realizaron las pruebas para determinar la eficacia del agente oxidante respecto a la remoción del Mn2+. En este sentido, se hicieron pruebas utilizando concentraciones y dosificaciones o añadiendo cantidades diferentes de NaClO, pero a pH ya establecidos. Como se puede apreciar en la Tabla 5, los resultados de las pruebas indican que la dosificación de cantidades del agente oxidante de 1.0 mg/l añadidas en muestras procesadas, señalan una mayor eficacia en la remoción del ion manganeso (Mn2+).
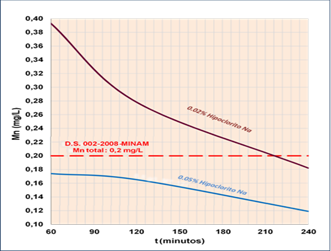
Asimismo, dentro de esta etapa se realizaron pruebas para determinar la concentración óptima del agente oxidante que en este estudio es el hipoclorito de sodio. Como resultado, se logró la mayor mitigación o reducción del ion manganeso. Como puede observarse en la Figura 5 la concentración óptima obtenida es de 0.05%.
Discusión
El proceso y método utilizados han determinado la eficacia del agente oxidante hipoclorito de sodio, ya que remueve el Mn2+ en 99.89% hasta un pH 8.5 y luego con un 99.96% hasta un pH de 8.8. También, desde una concentración inicial de Mn2+ entre 100 y 250 mg/l, hasta una concentración final de 0.085 mg/l. Se determinó que la concentración y cantidad óptima añadida es de 0.05% y 1.0 mg/L respectivamente y un pH óptimo en el rango 8.5 a 8.8. Esto demuestra la eficacia en el uso de un agente oxidante como el NaClO que reduce la concentración del ion manganeso (Mn2+) presente en las aguas ácidas. Pero hay que tener en cuenta que el medio en el cual actúa el agente oxidante debe ser alcalino; por ello es muy importante considerar la concentración y dosificación del agente oxidante, así como el pH de la solución (Kwakye et al., 2019; Rusydi et al., 2021).
Resulta conveniente tratar el agua de mina con adición del relave fino proveniente de la planta concentradora polimetálica, a la cual se ajusta el pH con lechada de cal y el agente oxidante hipoclorito de sodio. Lo que indicaría que el proceso analizado cuenta con eficiencia de remoción superior a 90% y 80% de manganeso, así como pone en evidencia las ventajas en relación al costo, eficiencia, factibilidad de manejo y estabilidad del proceso (Guillen et al., 2021).
En Perú se están realizando pruebas en las diferentes unidades mineras para adecuarse al ECA-2017, allí donde se observa el ion manganeso, cuyo límite máximo permisible es de 0.2 mg/l. Es conveniente indicar que el plazo para adecuarse a esta norma legal prácticamente venció a fines del año 2021. Existen varios métodos para reducir o mitigar los iones presentes en las soluciones o aguas ácidas; se utiliza diversos agentes químicos y en general todos reducen la concentración del Mn2+ (Loroña-Calderón & Gómez-Lora, 2017). El inconveniente viene dado en el pH de la solución, ya que la mayoría de estos agentes químicos necesita un pH mayor a 10 para reducir el Mn2+ por debajo de 0.2 mg/l, que es el límite máximo permisible (ECA-2017) (MINAM, 2017).
Eliminar manganeso implica diferentes procedimientos en la búsqueda de eficiencia de remoción apropiada para que el efluente obtenido sea aceptado para sus variados usos (Kasim, 2016). En países como Chile y Canadá desarrollan la minería del cobre con el pH relave < 9 y se está utilizando el hipoclorito de sodio que reduce su concentración en forma exitosa, pero con un costo más elevado por el uso de cantidades mayores de cal para elevar el pH (Patil, Chavan, & Oubagaranadin, 2016). En estos países es prácticamente nula la minería polimetálica; en el caso peruano se tiene abundante minería polimetálica. Se usa en la primera etapa el relave de plantas concentradoras que son del orden mayor de pH 11 para elevar el pH hasta niveles entre 5 y 6; luego, se usa lechada de cal a fin de lograr un pH entre 8.5 y 8.8 (Loroña-Calderón & Gómez-Lora, 2017). Desde ese punto de vista, se parte de la premisa que las tecnologías convencionales son las más apropiadas en el aspecto técnico y económico debido a que los principios en que se basan dichas tecnologías comprenden procesos de clarificación, que pueden ser químicos, físicos o físico-químicos; y la filtración de manera sencilla para grandes cantidades de afluentes (Vries et al., 2017). Adicionalmente son tecnologías cuya operación no exige mayores complicaciones y por lo general no hacen uso de tecnologías patentadas (Civardi & Tompeck, 2015).
El uso de hipoclorito de sodio en la disminución de manganeso en aguas ácidas de mina además de estar estrechamente relacionado con la actividad productiva también se vincula con el cuidado del medio ambiente y la responsabilidad social de la mina para con la población rural aledaña (Acuña-Moraga, Severino-González & Cires-Gómez, 2019). La dimensión ambiental debe ser analizada en la estructura de sus componentes naturales y del valor paisajístico, pero también en los efectos de las actividades mineras generadoras de contaminación, la alteración de costumbres y tradiciones humanas y los efectos sobre la salud de las personas (Rosario Ferrer, 2016).
La contaminación por manganeso perjudica a las comunidades locales, debido a que les impide utilizar los recursos hídricos para su consumo personal o el riego. Esto es lo que ha sucedido durante muchos años con las comunidades de Yauli y Pachachaca, en la Región Junín, debido a la contaminación del río Yauli que atraviesa estas comunidades. Actualmente se ha reducido la concentración de los metales pesados disueltos como el plomo, zinc, hierro, cobre, en el agua ácida. En esa dirección, la tendencia actual se ha orientado a reducir la concentración del manganeso tal como lo estipula la normativa legal emitida por el Ministerio del Ambiente (MINAM, 2017).
En esa perspectiva la empresa minera tiene la capacidad de dar respuesta a las responsabilidades económicas, legales, sociales, éticas y filantrópicas que le corresponden (Acuña-Moraga et al., 2019). Desde un punto de vista pragmático, la empresa tiene la facultad de obtener ganancias en el marco de la obediencia de la ley, la ética y el cuidado del ambiente, para el mejoramiento de la calidad del agua del río Yauli.
El agua es uno de los recursos naturales esenciales para la vida y es parte esencial de la salud pública, la seguridad alimentaria, la energía, la conservación del ambiente, la educación, el crecimiento económico sostenible y tiene efecto en el cambio climático. Por ello, la conservación de los ecosistemas de agua dulce es de vital importancia para la sociedad y la economía, porque proveen una enorme variedad de bienes y servicios indispensables para la subsistencia humana como: provisión de agua para uso doméstico, industrial y agropecuario, energía, alimento, captación de carbono, navegación, servicios culturales, recreación y paisajes (Pulido Capurro et al., 2021). La calidad de los servicios depende de ecosistemas saludables, lo cual significa sin contaminación (Tognelli et al., 2016). Más aun, teniendo en cuenta que el 80% de las fuentes de agua dulce y el 25% de la diversidad biológica del planeta se encuentran en las montañas; de allí la importancia de enfatizar en el enfoque agro-ecológico integral de montaña en el desarrollo sostenible (Escobar-Mamani et al., 2020).
En este escenario de cambios ambientales el calentamiento global, la destrucción de la capa de ozono, la perdida de la biodiversidad y la contaminación amenazan a los habitantes y a los ecosistemas de montaña (Escobar-Mamani & Pulido Capurro, 2021). En tal caso todos los esfuerzos que se haga para la disminución de la contaminación por manganeso, que son técnica y económicamente factibles, son los que se requieren para su implementación en el río Yauli, Junín, Perú.
Conclusiones
El proceso y método utilizado han determinado la eficacia del agente oxidante hipoclorito de sodio. De ello resulta que la concentración y cantidad óptima añadida es de 0.05% y 1.0 mg/l y un pH óptimo en el rango 8.5 a 8.8. Para la remoción química del ion Mn2+ y para cumplir con el ECA-2017 es conveniente tratar la mezcla de agua ácida de mina y relave fino con un agente oxidante, el hipoclorito de sodio a pH mayor a 8.5 hasta pH 8.8, con aireación del ambiente y agitación mecánica de 20 a 30 minutos. La concentración de cal >70% de CaO y 1,100 g/l de concentración está en el orden de 0.84 g/l de solución neutralizada, dependiendo del pH del agua de mina, que en el presente caso está en el rango de 3.5 - 5.5. Es importante que la cal sea adecuadamente tamizada para minimizar la presencia de granos grandes que limiten la reacción. El hipoclorito de sodio ha demostrado ser una alternativa de bajo costo y alta disponibilidad, eficaz para la remoción del ion Mn2+, y que contribuye a la conservación del ambiente. Al remover el ion manganeso hasta niveles por debajo del LMP normado por el MINAM, el agua que se vierte al río Yauli está dentro de la Categoría 3 (riego de plantas vegetales y bebida para animales); por lo tanto, se cumple con la normativa legal que es el ECA-2017, y se contribuye a la conservación de los ecosistemas altoandinos.












 uBio
uBio