Introducción
Los Camélidos Sudamericanos (CSA) son una riqueza pecuaria y genética de las poblaciones altoandinas. Bajo el término CSA se incluyen dos especies domésticas, la alpaca (Vicugna pacos) y la llama (Lama glama), y dos silvestres, la vicuña (Lama vicugna) y el guanaco (Lama guanicoe). El Perú tiene una ventaja comparativa importante por ocupar el primer lugar en el mundo en cuanto a población de alpacas y vicuñas y el segundo lugar en cuanto a llamas (FAO, 2005).
Fray Vicente de Valverde (quien fuera el primer sacerdote en pisar tierras incaicas, en 1533, junto a Francisco Pizarro, y el que se entrevistó con Atahualpa y fuera primer obispo del Cusco en 1539), así como fray Diego de Ocaña y Alonso Gonzales de Nájera, describen en sus crónicas que los incas consumían leche y queso de llama (Dávila, 2007). Sin embargo, hay controversias y vacíos sobre este tema y en realidad no se conoce de forma fehaciente si en los Andes Sudamericanos se consumió leche y queso no solo de llama sino en general de CSA como la alpaca.
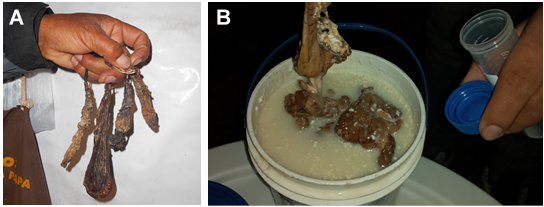
La práctica de utilizar el cuajo de crías de alpacas lactantes, fallecidas por diversas causas como neumonía, enterotoxemia, parasitosis, desnutrición, muerte embrionaria temprana o causas fortuitas, que puede superar el 50% en época de friaje (Caman, 2018), en la coagulación de la leche de vaca para elaborar quesos artesanales, está extendida en las comunidades altoandinas del Perú (y también de Bolivia), especialmente entre las regiones de Huancavelica y Ayacucho. Uno de esos lugares es el conjunto de barrios queseros del anexo de Viscapalca (Huancavelica-Perú, 4003 msnm), donde se ha observado que incluso se utiliza el cuajo extraído de fetos de alpaca abortados, por tener mayor fuerza, pero no se encuentra científicamente documentado.
Los coagulantes de la leche son preparaciones de proteasas de origen animal, microbiano o vegetal capaces de provocar la desestabilización de la micela de caseína con formación de un gel lácteo en las condiciones habituales de elaboración del queso; en cambio, el cuajo es el producto obtenido exclusivamente por extracción de los cuajares o abomasos de rumiantes, cuyo componente activo está constituido por quimosina pura o en mezcla con pepsina (Pérez, 1996; Ferrandini, 2006). Tradicionalmente, desde tiempos ancestrales y actualmente en mayor proporción en la industria lechera de todo el mundo, en la coagulación enzimática de la leche para la elaboración de quesos se utiliza el cuajo animal (Martínez, 2019; Rivera, 2012). Sin embargo, en los últimos años se viene utilizando también el cuajo recombinante, de origen microbiano o animal, que se comercializa en forma de tabletas (Celis, 2019; Gómez, 2017).
Los coagulantes de origen microbiano, sobre todo fúngico, que se utilizan en más de un tercio en la industria lactocasearia, son producidos experimental o industrialmente a partir de Thermomucor indicae-seudaticae, Bacillus subtilis natto, Mucor circinelloides, Rhizomucor nainitalensis, Mucor mucedo DSM 809, Rhizomucor pusillus y Rhizomucor miehei (Morillo, 2015). Los coagulantes lácteos de origen vegetal, en cambio, se utilizan poco, siendo conocidas las preparaciones de proteasas de flores de Cynara cardunculus “cardo”, el extracto del látex de Ficus carica “higuera”, que se ha usado desde la antigüedad; pero existen también muchos otros extractos de fuentes vegetales que coagulan la leche, siendo algunos demasiado proteolíticos, como la papaína de la papaya, la bromelina de la piña y el ricino del aceite de las semillas. Estas enzimas son proteasas ácidas y las secuencias de aminoácidos y sus estructuras tridimensionales presentan una elevada homología estructural con la quimosina (Martínez, 2019, Nolivos, 2011).
El queso de Viscapalca, de elaboración artesanal, tiene gran aceptación entre los consumidores locales, regionales y nacionales que llegan a degustarlo. Su tecnología tradicional comprende características muy particulares, tales como, el empleo de leche de vacas criollas ordeñadas manualmente, alimentadas al pastoreo natural, la utilización de cuajo de alpaca para coagular la leche, la utilización de sal “roja” procedente de Hurancancha o Izcuchaca, entre otras, que determinan sus características sensoriales especiales, superiores a los quesos artesanales elaborados con cuajo comercial.
El objetivo del presente estudio fue caracterizar el cuajo de alpaca y evaluar su actividad coagulante, describiendo su manejo en campo, obtención del extracto enzimático crudo, determinación de proteínas, determinación del perfil electroforético SDS-PAGE, tiempo de coagulación y actividad proteolítica.
Materiales y métodos
Lugar de estudio
Viscapalca significa “pampa con muchas vizcachas”. Para llegar a este lugar, partiendo desde Ayacucho, se viaja por la Vía Libertadores-Wari con dirección a Lima, hasta el Centro Poblado de San Felipe (unas tres horas hasta el Puente Rumi Chaca y luego unos 15 minutos de subida). De ahí hay un desvío a la izquierda y llegar a Viscapalca toma una hora y media por trocha carrozable. Viscapalca fue una hacienda, que luego fue parcelada y enajenada, pero sigue siendo propiedad privada. Hoy en día es un anexo que geopolíticamente pertenece al distrito de Pilpichaca, provincia de Huaytará, región de Huancavelica-Perú. Este lugar consiste en barrios queseros ubicados tanto en el mismo pueblo, como fuera de él, los cuales están dispersos a distancias de una a tres horas de camino a pie o a lomo de bestia.
Procedencia de los abomasos o cuajares de alpaca
La producción de quesos en Viscapalca es una actividad económica que necesita abastecerse permanentemente de abomasos o cuajares secos de alpaca y también de “sal roja” proveniente de Hurancancha o Izcuchaca. Estos abomasos o cuajares secos se consiguen en la feria quincenal del Centro Poblado de San Felipe o en las ferias semanales de Occollo o Licapa (se compran o se cambian como trueque con otros productos). Cuando no hay oferta de estos en las ferias, los productores de queso tienen que trasladarse al interior de otras comunidades de la zona como Ingawasi, Pichccawasi o Llillinta para conseguirlos. También utilizan alternativamente el cuajar de vicuña, que tiene incluso una fuerza de cuajo mayor (comentario de los productores alpaqueros).
Preparación del cuajo de alpaca
Los abomasos o cuajares de alpaca provienen principalmente de crías fallecidas al nacer o de fetos abortados de 5 a 7 meses de edad gestacional. En todos los casos, se hace una disección abdominal del animalito recientemente fallecido, se extrae el estómago y se separa el abomaso o cuajar y luego se lleva a desecación. Este secado se realiza colgando el abomaso o cuajar con una pita cerca del fogón o tullpa de la cocina, a manera de un proceso de ahumado, que garantice su conservación por un tiempo prolongado. El secado dura normalmente una a dos semanas, pero más tiempo (3-6 meses), es mejor. Así secos, pueden durar meses, antes de usarse. En el momento de usarse, el abomaso o cuajar seco, se sumerge en el suero de la leche que se produce en el lugar, por 2 a 3 días, luego se corta en trozos pequeños y se deja macerar por uno o dos días más para favorecer la extracción y activación de las enzimas coagulantes.
Obtención del Extracto Enzimático Crudo (EEC)
En las queserías de Viscapalca, utilizando un tubo Falcon de 50 ml, se tomó una muestra de cuajo de alpaca listo para ser usado (mezcla de suero y trozos de abomaso o cuajar). Luego se colocó en un cooler provisto de hielo en gel para ser transportado a 4-5°C hasta el laboratorio. El EEC se obtuvo por centrifugación a 560 x g (6,330 rpm), durante 10 min a 4°C, correspondiente al sobrenadante; el sedimento y la película superficial de color blanquecino, fueron descartados. Finalmente, se alicuotó en tubos eppendorf de 1,5 ml, en fracciones de 1000 ml y se congeló a -20°C hasta su posterior uso.
Determinación de proteínas por el método de Bradford
Para la curva de calibración se preparó una solución madre con BSA (Sigma, USA) a una concentración de 10 mg/ml, con agua desionizada. El reactivo comercial Bradford (Bio-Rad, USA) se diluyó previamente 1:2.5 con agua desionizada. Las soluciones estándar se prepararon por triplicado, a concentraciones de 0, 4, 8, 12, 16 y 20 mg/ml de BSA. A 100 ml de estándar o extracto crudo (cuajo de alpaca), se añadieron 100 ml de reactivo Bradford diluido. Las lecturas de A595 se hicieron en un espectrofotómetro BioPhotometer plus (Eppendorf, Germany), después de los 5 min y antes de los 60 min, tiempo en el cual se desarrolló el color (Bradford, 1976).
Perfil electroforético SDS-PAGE
La electroforesis SDS-PAGE se hizo en una cámara de electroforesis vertical Mini-Protean, modelo 1658029 (Bio-Rad, USA), de acuerdo con los protocolos establecidos por Laemmli (1970) y Andrews (1986). Se utilizó como marcador de peso molecular el Catálogo # S8445 (Sigma, USA), de amplio rango, 6,5-200 KDa, el cual se reconstituyó de acuerdo a las indicaciones del fabricante (al producto liofilizado, se adicionó 100 ml de agua desionizada, lo cual resultó en una solución con 2-3,5 mg de proteína por ml de Tris-HCl 62 mM, pH 6,8, EDTA 1 mM, sucrosa 4%, TCEP 10 mM, SDS 2% y azul de bromofenol 0.01%). Luego se agitó en el vortex por breves segundos para asegurar que todo el material haya quedado completamente disuelto. Las corridas electroforéticas se hicieron en un gel de acrilamida de 3-13%, a 110 V por espacio de dos horas y media.
Evaluación del tiempo de coagulación
Se utilizó el ensayo de coagulación de la leche descrito por Wei y col. (2016). Brevemente, a 400 µl de leche fresca se agregaron 55 µl de CaCl2 100 mM y 50 µl de EEC (cuajo de alpaca) en tubos eppendorf de 1,5 ml y se mezclaron bien. A continuación, los tubos fueron incubados en baño María a 37°C por 50 min. Dos cuajos comerciales (Hansen y Marschall), el EEC calentado a 100°C por 5 min y el tampón PBS 0,1M pH 7,4 se utilizaron como controles positivo, negativo y blanco, respectivamente.
Determinación de actividad proteolítica
Se realizó según el método descrito por Takahashi y Ohsaka (1970). Se incubaron 1,5 ml de caseína al 2% disuelta en buffer Tris HCl 0,2M (pH 3,5, 4,5 y 5,5), con 0,4 ml de agua destilada y 100 ml de EEC (cuajo de alpaca) durante 15 min a 37 °C. La reacción se detuvo con 1,5 ml de ácido tricloroacético 0,44M en frío y los productos ácidos solubles obtenidos por centrifugación a 1,500 x g durante 15 min fueron leídos a 280 nm en un espectrofotómetro BioPhotometer plus (Eppendorf, Germany). La actividad proteolítica fue estimada en base a las lecturas de A280 a tres condiciones de pH, por desaparición del sustrato.
Resultados y discusión
La determinación de proteínas por el método de Bradford en los EEC (cuajos de alpaca), así como los valores de pH, se muestran en la Tabla 1. El contenido de proteínas en los EEC varió en el rango de 29.80 a 52.91 mg/ml; el Cuajo 3 fue el que tuvo un valor mayor de contenido de proteínas, y el Cuajo 4 el de menor valor. Sin embargo, estadísticamente, no hubo diferencia significativa entre los cuajos 1, 2 y 3, pero sí con el Cuajo 4; tampoco hay diferencia significativa entre los Cuajos 2 y 4.
La codificación de los EEC (cuajos de alpaca) como: CA1, CA2, CA3 y CA4, corresponde a cuatro barrios queseros de Viscacapalca, donde se consideraron tres muestras, analizadas por triplicado. La A595 del reactivo Bradford diluido 1:2.5 fue de 0.485. Todas las muestras se diluyeron 1:2 (200 ml + 400 ml de agua desionizada).
El ensayo de proteínas de Bradford es popular debido a su facilidad de ejecución y relativa sensibilidad. El método de Bradford se basa en la unión del Azul de Coomassie G-250, a las proteínas. Las proteínas se unen al colorante para formar un complejo proteína-colorante con un coeficiente de extinción mayor que el colorante libre. Este método es sensible (1-15 µg), simple, rápido, barato y pocas sustancias interfieren en su determinación. Entre las sustancias que interfieren están los detergentes y las soluciones básicas (Bradford,1976; Pedrol y Ramos, 2001).
Para establecer la curva de calibración con el reactivo comercial Bradford se hicieron varios ensayos; resultó ser el más apropiado el rango de 0-20 mg/ml de BSA, porque se obtienen valores de A595 que están dentro del rango lineal, es decir, entre 0,0 y 08. Las soluciones estándar se prepararon por triplicado, a concentraciones de 0.0, 4.0, 8.0, 12.0, 16.0 y 20.0 mg/ml de BSA, hasta completar un volumen de 100 ml con agua desionizada. Este rango de concentraciones obtenido por el protocolo presentado aquí simplifica aún más el ensayo, ya que las muestras desconocidas no necesitan caer dentro del rango del gráfico de calibración. La cantidad de proteína presente en cada una de las muestras de cuajo de alpaca se determinó sobre la base de la ecuación de la recta obtenida por regresión lineal (Y = 0.2294 + 0.0234X). El reactivo Bradford comercial (Bio Rad, USA) tiene un color marrón rojizo y a medida que aumenta la concentración de BSA en los estándares se torna azul, con intensidad que aumenta cuando aumenta la concentración de proteína. (Ernst and Zor, 2010). Es absolutamente obligatorio que se utilice en todo momento agua desionizada como blanco. No se puede obtener una curva de calibración lineal sin el estándar de proteína cero. La muestra que contiene solamente el colorante se utilizó como blanco.
Respecto a la determinación del perfil electroforético SDS-PAGE de los EEC (cuajos de alpaca), de acuerdo con la Figura 2 las condiciones de electroforesis seleccionadas después de varios ensayos fueron adecuadas, permitieron revelar la presencia de por lo menos siete proteínas diferentes, con pesos moleculares estimados de 91,6, 80,8, 62,8, 56,7, 27,1, 18,4 y 15,3 KDa, calculados según el patrón de proteínas del marcador de peso molecular (Cat. # S8445, Sigma-Aldrich, USA). Se observa que las proteínas más abundantes son las de 18,4 KDa y 15,3 KDa que, a pesar de una pequeña interferencia, asumimos que podrían corresponder a la quimosina y a la pepsina del cuajo de alpaca; así, resultaría novedoso este primer reporte que revelaría que las proteasas del cuajo de alpaca son de menor peso molecular en comparación con la quimosina de camello de 40 KDa (Kappeler et al., 2006), a la quimosina bovina de 35,6 KDa (Biotol, 1991), a la quimosina vegetal de 66 KDa (Mbye et al., 2021), a las quimosinas microbianas de 22,6 y 46,52 KDa (Morillo et al., 2015) o a la quimosina humana de 36 KDa y pepsina humana de 40 KDa (Moschopoulou et al., 2006). Nuestra hipótesis necesita confirmarse con más estudios, a través de cromatografía líquida en columna, donde las fracciones colectadas correspondientes a ambos picos deberían tener actividad coagulante, ya que es conocido que las proteasas aspárticas eucarióticas son monómeros de aproximadamente 35 KDa.
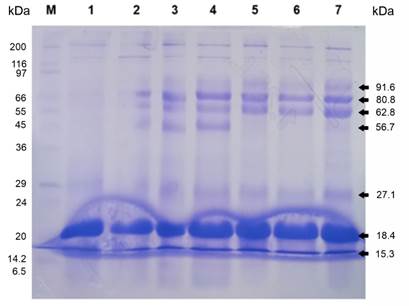
Figura 2 SDS-PAGE de cuajo de alpaca. Las proteínas fueron separadas en un gel de acrilamida de 3-13% a 110V por 2 h y 30 min y coloreadas con azul de Coomassie. Carriles: (M) 4 ml de marcador de peso molecular Sigma-Aldrich Cat. # S8445; (1) 15 ml de cuajo 1 pH 3,0; (2) 15 ml de cuajo 1 diluido 1:1; (3) 15 ml de cuajo 2 pH 4,0; (4) 15 ml de cuajo 2 diluido 1:1; (5) 15 ml de cuajo 3 pH 4,0; (6) 15 ml de cuajo 3 diluido 1:1; (7) 15 ml de cuajo 4 pH 5,0. Los cuajos corresponden a los extractos crudos separados por centrifugación a 560 x g por 10 min a 4°C. La dilución se hizo con buffer Tris HCl 0.5M a pH 6,8.
Adicionalmente, la interferencia que se observa en la parte inferior del gel de acrilamida al parecer no es un problema de polimerización, sino de la naturaleza de la muestra, el cuajo de alpaca es posible que contenga azúcares o lípidos en niveles relativamente altos, por lo que necesitaría previamente algún tipo de procedimiento para separar estos compuestos; se ha sugerido una filtración con amicones antes de volver a realizar la electroforesis. Por lo que se ve, la polimerización del gel no sería el problema, dado que se logró correr la muestra e incluso hacer la tinción y observar todas las bandas. Además, hay que considerar que las muestras de cuajo de alpaca tienen pH ácidos: CA1 pH 3,0; CA2 pH 4,0; CA3 pH 4,0; y CA4 pH 5,0; al realizar la preparación de las muestras antes de la electroforesis, al calentarse a ebullición por 5 min, su color no era azul (como se esperaría), por el colorante azul de bromofenol, sino, verdoso y hasta amarillento, por el pH ácido, sobre todo en el CA1 (ver Tabla 1).
Tabla 1 Contenido de proteínas y pH de los EEC (n = 4; r = 3 x 3)
| EEC (cuajo de alpaca) | Proteína (µg/ml) | pH |
|---|---|---|
| CA1 | 45,86 ± 6,98 | 3,0 |
| CA2 | 42,78 ± 0,54 | 4,0 |
| CA3 | 52,72 ± 0,27 | 4,0 |
| CA4 | 30,95 ± 1,63 | 5,0 |
Isselname y col. (2016), al estudiar el cuajo de camello adulto (Camelus dromedarius), señalan que la leche de camello no se puede coagular con quimosina bovina, probablemente debido a las grandes variaciones entre las estructuras primarias de caseína k de las dos especies. Encontraron que los extractos gástricos crudos (CGE) de dromedarios adultos tienen actividad coagulante y proteolítica satisfactoria limitada hacia la leche de camella, la principal responsable es una proteína de 38KDa con mayor actividad coagulante, que correspondería probablemente a una pepsina.
El cuajo es una mezcla de quimosina y pepsina. La quimosina es una enzima proteolítica de los rumiantes jóvenes. Cuaja la leche, lo que potencia el valor nutritivo ya que prolonga el tiempo en el intestino permitiendo que el animal joven extraiga más nutrientes. La cantidad de quimosina disminuye solo unos días después del nacimiento y se reemplaza por pepsina. La proporción entre quimosina y pepsina depende de la edad y del régimen de alimentación. La quimosina es una enzima coagulante altamente específica mientras que la pepsina tiene una actividad proteolítica general que da como resultado un menor rendimiento de queso. La quimosina escinde el enlace peptídico entre Phe 105 y Met 106 de la κ-caseína. Eso inactiva la κ-caseína convirtiéndola en para-κ-caseína insoluble, que forma la cuajada con el calcio. La quimosina también es responsable de los cambios de textura y del desarrollo del sabor durante la maduración. Tanto la quimosina como la pepsina se producen como zimógenos inactivos y son activados por el pH bajo del abomaso. Las proenzimas inactivas son importantes para la orientación, el plegamiento de la proteína y el control de activación de los zimógenos (Runesson, 2018); Andrén, 2011; Kumar y col., 2010; Vaclavik y Christian, 2008).
En relación al tiempo de coagulación, el método utilizado (Wei y col. (2016) resultó muy práctico, permitió establecer los tiempos de coagulación tanto para las muestras de cuajo de alpaca como para los cuajos comerciales Hansen y Marschall, utilizados como controles positivos. En la Figura 3, se presentan los resultados de tiempo de coagulación del cuajo de alpaca. En el ensayo, a 400 µl de leche fresca se agregaron 55 µl de CaCl2 100 mM y diferentes proporciones de EEC: 50, 10 y 8 µl en tubos eppendorf de 1,5 ml, y se mezclaron bien. A continuación, los tubos fueron incubados en baño María a 37°C por 50 min. Los tubos fueron retirados cada 5 minutos para verificar la coagulación (+), no coagulación (-) o coagulación intermedia (+/-).
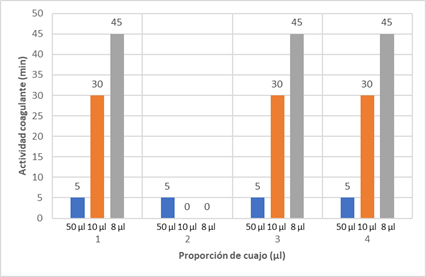
Figura 3 Ensayos de coagulación del cuajo de alpaca sobre leche bovina, a diferentes proporciones. 1, 2, 3 y 4 corresponden a CA1, CA2, CA3 y CA4. El tiempo de coagulación se midió cada 5 min, durante 50 min.
En los ensayos con 10 ml de cuajo, el EEC (cuajo de alpaca) fue diluido 1:10. El cuajo CA2 sí tuvo actividad coagulante a los 30 min, cuando se utilizó 10 ml diluido 1:2 (que no se muestra). En consecuencia, bajo las condiciones del ensayo, utilizar 8 ml de cuajo de alpaca es adecuado para estimar el tiempo de coagulación. Así, en los ensayos todos los cuajos de alpaca tuvieron actividad coagulante cuando el ensayo se hizo con 50 ml; pero cuando se utilizaron 10 ml, el cuajo CA2 no mostró actividad coagulante, menos con 8 ml. Esto significa que el cuajo CA2 es de muy baja calidad, lo que podría deberse probablemente al tiempo de uso, es decir, que era un cuajo de descarte que ya había sido utilizado en varias oportunidades, superando su vida útil.
En la Figura 4, se muestra la actividad coagulante del cuajo de alpaca. Los tubos fueron retirados cada 10 minutos para verificar la coagulación (+), no coagulación (-) o coagulación intermedia (+/-). En un ensayo más detallado (Figura 4B), se determinó que el tiempo de coagulación de los cuajos CA1 y CA3 fue de 23 min; mientras que el tiempo de coagulación del cuajo CA4, fue de 25 min. Sobre la base de estos resultados se puede establecer que los cuajos CA1 y CA3 tienen mayor actividad coagulante.
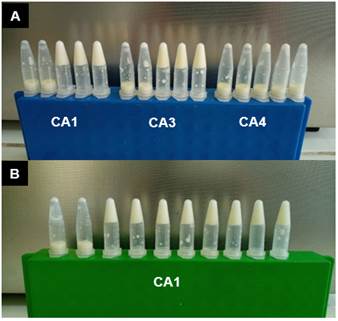
Figura 4 Determinación del tiempo de coagulación del cuajo de alpaca. (A) El tiempo de coagulación se midió cada 10 min, durante los 50 minutos de reacción. (B) El tiempo de coagulación se midió cada minuto, entre los 20 y 30 minutos de reacción.
Para establecer los tiempos de coagulación de los cuajos comerciales Hansen y Marschall en el ensayo, a 400 µl de leche fresca se agregaron 55 µl de CaCl2, 100 mM y 50µl de cuajo comercial diluido. La dilución del producto comercial en forma de polvo fue como sigue: se pesó el contenido de un sachet (1.436 g de Hansen y 1.080 de Marschall), el cual se diluyó en 100 ml de agua destilada, luego se diluyó 1:100 y finalmente 1:2. La reacción se hizo en tubos eppendorf de 1,5 ml, mezclando bien. A continuación, los tubos fueron incubados en baño María a 37°C por 50 min. Los tubos fueron retirados cada 10 min para verificar la coagulación (+) o no coagulación (-). En ambos casos se observó actividad coagulante a los 30 minutos de reacción. El Control (-) fue cuajo de alpaca (EEC) calentado a 100°C por 5 min; y el Blanco fue el tampón PBS 0.1M pH 7,4. Tanto el Control (-) y el Blanco, tuvieron actividad coagulante (-) durante los 50 minutos.
Finalmente, en relación a la actividad proteolítica del cuajo de alpaca, conforme a la Tabla 2 se observa que el método empleado (Takahashi & Ohsaka, 1970) también resultó muy práctico, permitiendo establecer la actividad proteolítica del cuajo de alpaca. En el ensayo, se incubaron 1,5 ml de caseína al 2% disuelta en buffer Tris HCl 0,2M (a pH 3.5, 4.5 y 5.5), con 0,4 ml de agua destilada y 100 ml de cuajo de alpaca (extracto crudo), durante 15 min a 37 °C. La reacción se detuvo con 1,5 ml de ácido tricloroacético 0,44 M en frío y los productos ácidos solubles obtenidos por centrifugación a 1500 x g durante 15 min, fueron leídos a 280 nm en un espectrofotómetro BioPhotometer plus (Eppendorf, Germany).
Tabla 2 Valores de A280 de los ensayos de actividad proteolítica del cuajo de alpaca (EEC).
| Cuajo | A280 pH 3,5 | pH 4,5 | pH 5,5 |
|---|---|---|---|
| CA1 | 0,593 | 0,475 | 0,453 |
| CA2 | 0,944 | 0,844 | 0,814 |
| CA3 | 0,633 | 0,602 | 0,587 |
| CA4 | 0,584 | 0,464 | 0,471 |
De acuerdo al método, la actividad proteolítica fue determinada por desaparición del sustrato (caseína), es decir que a mayor lectura de absorbancia a 280 nm (equivalente a la caseína presente) menor actividad proteolítica. Así, se observan diferencias en la actividad proteolítica de los cuajos de alpaca provenientes de los barrios queseros de Viscapalca; la actividad proteolítica mayor fue en el cuajo CA1 a pH 5,5, seguido del cuajo CA4 a pH 4,5, luego del cuajo CA3 a pH 5,5 y por último el cuajo CA2 a pH 4,5.
Conclusiones
Se logró describir la metodología tradicional para obtener, procesar y conservar cuajo de alpaca. El cuajo de alpaca analizado como EEC, tiene un contenido de proteínas entre 29,80-52,91 mg/ml. Utilizando metodologías sencillas se estableció el perfil electroforético SDS-PAGE del cuajo de alpaca, en el cual las proteínas más abundantes fueron de 18,4 KDa y 15,3 KDa, que corresponderían a las enzimas coagulantes, las cuales serían de menor peso molecular en comparación con las bovinas; lo cual necesita ser confirmado por cromatografía en estudios posteriores. El tiempo de coagulación del cuajo de alpaca fue de 23 min, bajo las condiciones del ensayo, y presenta mayor actividad proteolítica a pH 5,5.
Se recomienda realizar más estudios cromatográficos, a fin de purificar las proteínas presentes en el cuajo de alpaca y caracterizar las enzimas coagulantes. Asimismo, determinar la fuerza de cuajo y la actividad lipolítica. Y sobre la base de esta metodología, ampliar los estudios moleculares a diferentes edades, comparando con el cuajo bovino y enzimas comerciales.












 uBio
uBio