Introducción
En la actualidad los alimentos probióticos son de mucho interés tanto para investigadores como para consumidores; entre estos productos podemos destacar bebidas lácteas y no lácteas, estas últimas de provecho, pues existe un grupo de consumidores que padecen intolerancia a compuestos presentes en productos lácteos, la lactosa es el más conocido ya que se carece de una enzima (lactasa) que pueda intervenir en el metabolismo de esta, ocasionando así la privación de estos alimentos y sus derivados (Uscanga et al., 2019). Es asi que existe una tendencia creciente hacia el desarrollo de productos probióticos libres de lactosa, como es el caso de bebidas de frutas (gilaburu), de cereales, leguminosas (soja); y es debido a su gran potencial nutricional en conjunto, al efecto de los microorganismos, que estos productos son una buena opción de alimentación (Carvalho et al., 2018; Chavan, et al., 2018; et al., 2016).
El extracto vegetal de tarwi es una bebida natural que se logra a través de un proceso de molienda húmeda mediante el cual se obtiene el extracto acuoso del grano. El tarwi es fuente de valor nutricional en aminoácidos, carbohidratos, fibra, vitaminas, así como de fósforo, potasio y hierro (Muñoz et al., 2018). Contiene ácido linoleico y linolélico que son ácidos grasos esenciales, con propiedades que los hacen únicos e irremplazables ya que nuestro organismo no puede sintetizarlos y se deben adquirir en la dieta (Chirinos, 2015).
La fermentación con cultivos lácticos representa una alternativa tecnológica para la transformación del extracto de granos vegetales, o como un sustrato adecuado para el crecimiento y la actividad de bacterias debido a los oligosacáridos, aminoácidos y péptidos presentes en el grano que estimulan el crecimiento microbiano (Fazilah et al. 2018). La adición de cultivos lácticos probióticos al extracto de granos vegetales permite obtener bebidas fermentadas con propiedades funcionales, estos microorganismos vivos son capaz de mejorar el equilibrio microbiano intestinal, y producen efectos beneficiosos en la salud individual (Marin et al., 2014).
Según Valdovinos et al. (2019) indican, los alimentos probióticos son de mucho beneficio para el consumidor; entre sus bondades se destacan el desarrollo normal del sistema inmunitario, y la regulación de respuesta ante patógenos. Entre los microorganismos presentes en los alimentos probióticos tenemos algunos como el Lactobacillus fermentum, Bifidobacterim bifidum, Saccharomyces cerevisae y Saccharomyces boulardii; este último puede generar efectos farmacodinámicos fisiológicos en la flora intestinal normal; estudios realizados demostraron la viabilidad de esta en productos alimenticios como quesos, brotes de frijol, tunta, entre otros (Rodríguez y Chambi, 2019; Swieca et al., 2019; Vega et al., 2016).
Para ajustar el crecimiento de microbiano se aplica un modelo de regresión linear o no linear para todos los datos observados durante un tiempo largo. Es común notar errores del modelo no correlacionados y que sus varianzas son constantes en todo. Montgomery et al. (2012), y Silva, et al (2018) indican que el modelo más ampliamente utilizado para describir el crecimiento microbiano es la función de Gompertz. Y para realizar el ajuste del modelo para cada tratamiento se aplica los análisis estadísticos sugeridos por Torres et al. (2012).
En vista de la demanda de los alimentos consumidos y los efectos beneficiosos del tarwi y los probióticos, este trabajo tuvo como objetivo caracterizar y evaluar la cinética de crecimiento microbiano en el desarrollo de una bebida probiótica fermentada no láctea a partir de extracto vegetal de tarwi.
Materiales y métodos
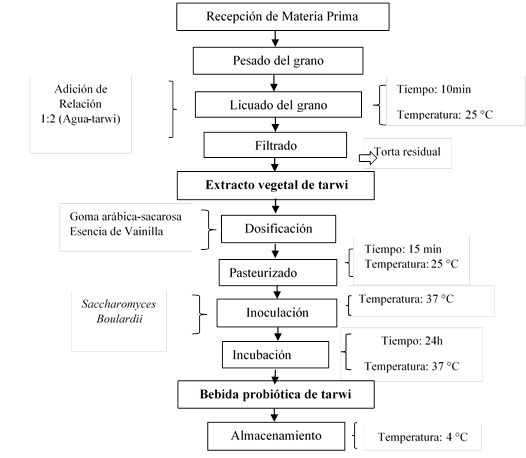
El tarwi fue obtenido en el mercado local de la provincia de Yunguyo, departamento de Puno. Fue trasladado a la Universidad Peruana Unión - Filial Juliaca. Se procedió a realizar el desamargado de esta muestra, para lo cual se sometió a remojo por 24 horas a temperatura ambiente, luego se llevó al proceso térmico de 87 °C por una hora, y finamente se realizaron lavados consecutivos durante cinco días.
Obtención del Extracto Vegetal de Tarwi
El proceso de obtención del Extracto Vegetal de Tarwi (EVT) y la bebida probiótica fue según la metodología de González (2011), como se muestra en la Figura 1.
Cepas de levadura y condiciones de crecimiento
Los experimentos se desarrollaron con cepas liofilizadas de Saccharomyces boulardii (Floratil 200 mg). Para su activación las muestras fueron inoculadas en leche desnatada estéril en relación de 1:1 (cepa: leche); luego se las incubó a temperatura de 37 °C por 12 horas en una incubadora marca Binder; más tarde se procedió a realizar la inoculación en el EVT, y a separarlas en matraces de 250 ml esterilizadas en autoclave marca STURDY a 121 ºC por 15 min, para evitar la interferencia de otros microorganismos y asegurar la esterilidad del medio.
A partir de estas se preparó una batería de matraces, de un total de 4 tratamientos codificados según se muestra en la Tabla 1, con 200 ml aproximados, y variaciones en el porcentaje de la concentración de sacarosa (CS), en la concentración de la cepa (CC), a temperatura de 37 ± 1 ºC, con agitación constante de 20 RPM regulados por un baño María BS - 11. Cada tres horas (0 - 24 horas de incubación) se retiró cada matraz para el conteo correspondiente; asimismo, se realizó monitoreo de las propiedades físicas de sólidos solubles (°Brix) medido con un refractómetro ATAGO N50, la densidad (g/cm3) de la bebida se midió con un picnómetro graduado, el potencial de hidrógeno (pH) fue medido con un potenciómetro de mesa SI Analytics modelo Lab 850; y el porcentaje de acidez titulable con hidróxido de sodio 0,1 N como titulante, y como indicador solución alcohólica de fenolftaleína al 1%.
Crecimiento microbiano y modelamiento matemático
Para las lecturas del incremento de biomasa se utilizó un microscopio monocular LW SCIENTIFIC y una cámara neubauer de 0,100 a 0,00025 mm2, expresando los resultados en unidades formadora de colonias por mililitro (ufc/mL), convertidos a logaritmos de base 10 y modelados con la siguiente formula (Castro et al., 2008).:
Modelo de Gompertz.
Donde N es el número de microorganismos a un tiempo t.
NO > 0 es el número de microorganismos en momento inicial.
C: logaritmo común de la diferencia entre la población inicial y final en la fase estacionaria.
B: representa la pendiente de la curva y describe la tasa de crecimiento.
M: tiempo en el cual la tasa de crecimiento es de mayor magnitud.
Asimismo, se calculó la velocidad especifica de crecimiento (µmáx), duración de la fase de latencia (λ) y el tiempo de generación (G); según Cayré, Vignolo, & Garro (2007).
La comparación de los diferentes tratamientos se realizó tomando la factibilidad de los mismos para alcanzar el ajuste, y determinando los parámetros de crecimiento correspondientes a cada modelo matemático (Castro et al., 2008).
Modelos de bondad de ajuste
Para realizar el ajuste del modelo para cada tratamiento se aplicó los análisis estadísticos sugeridos por Torres et al. (2012). De: interacciones, suma final de los cuadrados del error, cuadrado medio del error, la desviación estándar, y el coeficiente de variabilidad.
Resultados y discusión
Resultados en las propiedades fisicoquímicas del Extracto vegetal
La Tabla 2 muestran los resultados de las propiedades fisicoquímicas del extracto vegetal de tarwi.
Crecimiento microbiano y Modelamiento matemático
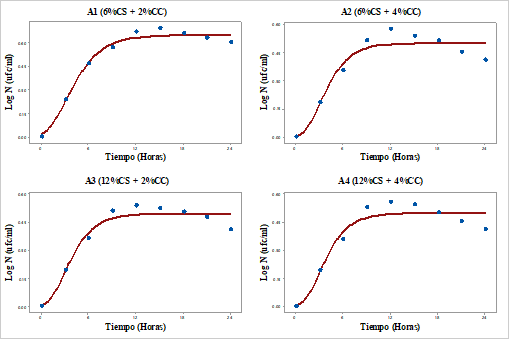
La Figura 2 muestra la construcción de las curvas de crecimiento de cada uno de los tratamientos. En ella se puede apreciar que la fase de adaptación de cada una de las curvas se da en períodos muy cortos, casi imperceptibles; con respecto a la fase de crecimiento exponencial, el tratamiento A1 da valores más elevados de biomasa en comparación a los demás tratamientos; asimismo, se puede observar los puntos de cercanía a las curvas del modelo sigmoidal, de las cuales A2 muestra un descenso más rápido seguido de A4 y A3, mientras que A1 presenta valores más estables.
Según Valbuena et al (2008), en su estudio demostraron que Gompertz establece buenos parámetros en la elaboración de las curvas de crecimiento, ya que este modelo presenta un buen ajuste en la función hiperbólica; para Oviedo et al. (2014), en el empleo del modelo Logístico hay valores sin fase “lag” o de adaptación; en comparación con nuestro estudio, con el modelo matemático de Gompertz se muestran fases “lag” cortas; asimismo, Rodríguez y Chambi (2019) mencionan que gracias al modelamiento se puede definir las fases de crecimiento de este microorganismo.
En la Tabla 3 se pueden apreciar los parámetros de la cinética de crecimiento microbiano; se ve con respecto al parámetro C, que el tratamiento A1 fue superior con 0.652 en contraste son los demás, muestra así un mayor número de biomasa, con respecto al parámetro B el tratamiento A2 presentó el mayor valor con 1.555, sin embargo el tratamiento A1 presentó el menor valor y menor pendiente en comparación con los demás tratamientos; el parámetro M muestra que el tratamiento A4 presenta el mayor valor con 0.511 y asimismo el (µmáx ) menor valor es dado por el tratamiento A1. Sobre la velocidad específica de crecimiento, el valor más alto fue dado por A1 con 0.266, seguido de A4 y A2. Respecto a la duración de la fase de latencia, A2 y A4 presentaron la mayor duración y A3 y A1 los valores más bajos, este último con un valor de 0.726. Y sobre el tiempo de generación (G) el mayor valor fue el de A3, seguido por A2 y A4, y por último A1. Asimismo, el análisis estadístico demostró que los tratamientos son estadísticamente diferentes en todos los casos, a excepción del parámetro C donde A3 y A4 son estadísticamente similares, tanto la concentración de sacarosa y la concentración de la cepa ejercieron efecto sobre las curvas de crecimiento.
Tabla 3 Parámetros cinéticos de Saccharomyces boulardii
| Tratamiento | C | B | M | µmáx | λ | G |
|---|---|---|---|---|---|---|
| (h-1) | (h) | (h) | ||||
| A1 | 0.652a | 1.296d | 0.408a | 0.266a | 0.726d | 2.607d |
| A2 | 0.503b | 1.555a | 0.496b | 0.249c | 1.119a | 2.775b |
| A3 | 0.497c | 1.463c | 0.493c | 0.245d | 0.940c | 2.831a |
| A4 | 0.499c | 1.549b | 0.511a | 0.255b | 1.076b | 2.717c |
Según Gualtieri (2007) indica, el desarrollo de los microorganismos se debe a la variación del sustrato, indispensable en obtención de biomasa; de modo que esto explica el fenómeno mostrado en las curvas de crecimiento, ya que a mayor cantidad de microorganismos el sustrato se agotará en tiempos cortos. Por otro lado, si la concentración de microorganismos es baja esta podrá tener un buen desarrollo y el incremento de células se dará sin problemas. Para Belda et al. (2014) los modelos sigmoidales de crecimiento nos permiten aprovechar las bondades de estas ecuaciones, como los datos de la tasa máxima de crecimiento (µmáx), entre otros aspectos. Igualmente, Ortiz et al. (2008) afirman que el contenido de biomasa depende de la concentración de sustrato hasta cierto punto, en su estudio se mostró que en concentración de melaza de 20 y 30 % no existe diferencia estadística de la cantidad de biomasa obtenida.
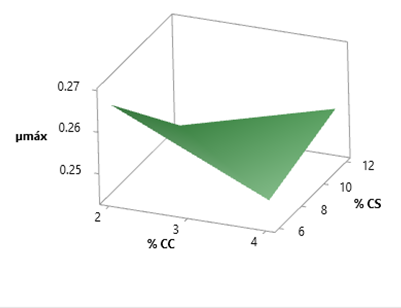
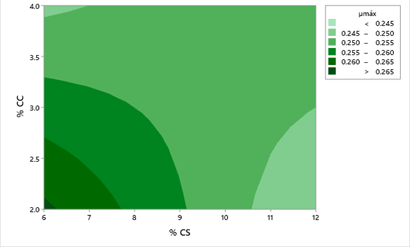
La Figura 3 presenta el gráfico de superficie de respuesta del parámetro µ máx en la cual se observa que A1 y A4, están representados por los extremos más altos de la gráfica; por otro lado, los puntos más bajos corresponden a los tratamientos A2 y A3. En la Figura 4 se observa el gráfico de contorno donde A1 presenta la región más óptima para el crecimiento en el parámetro µ máx en comparación con los demás tratamientos.
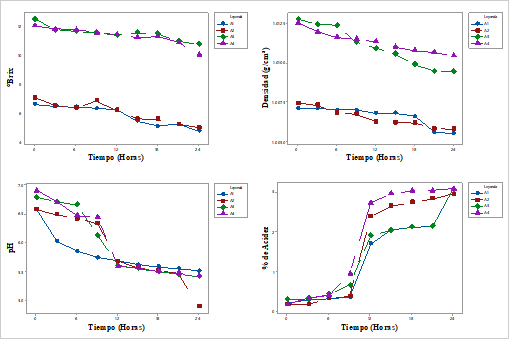
La Tabla 4 muestra el monitoreo de las propiedades físicas de la bebida probiótica. En ella se puede apreciar el descenso de algunas en todos los tratamientos, como en el caso de los grados Brix, densidad y pH; sin embargo, con respecto a la acidez en todos los tratamientos se mostró un incremento.
Tabla 4 Monitoreo de las propiedades físicas y fisicoquímicas
| Tiempo | °Brix | Densidad (g/cm3) | ||||||
|---|---|---|---|---|---|---|---|---|
| A1 | A2 | A3 | A4 | A1 | A2 | A3 | A4 | |
| 0 | 6.5 ± 0.00 | 7.0 ± 0.05 | 12.5 ± 0.50 | 12.0 ± 0.05 | 1.0071 | 1.0074 | 1.0127 | 1.0127 |
| 3 | 6.4 ± 0.02 | 6.5 ± 0.50 | 11.7 ± 0.20 | 11.8 ± 0.28 | 1.0071 | 1.0073 | 1.0123 | 1.0119 |
| 6 | 6.4 ± 0.05 | 6.3 ± 0.28 | 11.6 ± 0.41 | 11.7 ± 0.25 | 1.0070 | 1.0068 | 1.0123 | 1.0115 |
| 9 | 6.3 ± 0.27 | 6.8 ± 0.28 | 11.5 ± 0.05 | 11.5 ± 0.07 | 1.0070 | 1.0067 | 1.0112 | 1.0114 |
| 12 | 6.2 ± 0.10 | 6.1 ± 0.28 | 11.4 ± 0.10 | 11.4 ± 0.07 | 1.0068 | 1.0062 | 1.0108 | 1.0113 |
| 15 | 5.4 ± 0.11 | 5.5 ± 0.12 | 11.5 ± 0.35 | 11.2 ± 0.31 | 1.0068 | 1.0061 | 1.0105 | 1.0109 |
| 18 | 5.0 ± 0.02 | 5.5 ± 0.14 | 11.4 ± 0.05 | 11.3 ± 0.10 | 1.0066 | 1.0061 | 1.0098 | 1.0107 |
| 21 | 5.2 ± 0.25 | 5.1 ± 0.22 | 10.9 ± 0.05 | 10.9 ± 0.17 | 1.0056 | 1.0058 | 1.0094 | 1.0106 |
| 24 | 4.7 ± 0.32 | 4.9 ± 0.19 | 10.7 ± 0.20 | 10.0 ± 0.01 | 1.0055 | 1.0057 | 1.0094 | 1.0104 |
| pH | Acidez (%) | |||||||
| 0 | 6.5 ± 0.37 | 6.5 ± 0.34 | 6.7 ± 0.02 | 6.9 ± 0.00 | 0.19 ± 0.01 | 0.15 ± 0.00 | 0.28 ± 0.00 | 0.16 ± 0.02 |
| 3 | 6.0 ± 0.06 | 6.4 ± 0.12 | 6.7 ± 0.02 | 6.7 ± 0.07 | 0.28 ± 0.03 | 0.16 ± 0.04 | 0.31 ± 0.01 | 0.32 ± 0.02 |
| 6 | 5.8 ± 0.02 | 6.4 ± 0.23 | 6.6 ± 0.01 | 6.4 ± 0.05 | 0.31 ± 0.02 | 0.31 ± 0.09 | 0.42 ± 0.15 | 0.40 ± 0.03 |
| 9 | 5.7 ± 0.05 | 6.3 ± 0.13 | 6.1 ± 0.40 | 6.4 ± 0.03 | 0.34 ± 0.09 | 0.36 ± 0.07 | 0.65 ± 0.29 | 0.93 ± 0.10 |
| 12 | 5.6 ± 0.04 | 5.6 ± 0.01 | 5.6 ± 0.00 | 5.5 ± 0.02 | 1.68 ± 0.29 | 2.36 ± 0.05 | 1.88 ± 0.08 | 2.71 ± 0.01 |
| 15 | 5.6 ± 0.08 | 5.5 ± 0.01 | 5.5 ± 0.01 | 5.5 ± 0.01 | 2.03 ± 0.06 | 2.64 ± 0.04 | 2.03 ± 0.06 | 2.95 ± 0.09 |
| 18 | 5.5 ± 0.12 | 5.5 ± 0.01 | 5.4 ± 0.00 | 5.5 ± 0.00 | 2.11 ± 0.29 | 2.72 ± 0.19 | 2.11 ± 0.29 | 3.02 ± 0.11 |
| 21 | 5.5 ± 0.15 | 5.4 ± 0.00 | 5.4 ± 0.00 | 5.4 ± 0.01 | 2.13 ± 0.08 | 2.82 ± 0.13 | 2.13 ± 0.08 | 3.02 ± 0.08 |
| 24 | 5.5 ± 0.18 | 4.8 ± 0.52 | 5.4 ± 0.01 | 5.4 ± 0.02 | 3.05 ± 0.10 | 2.93 ± 0.21 | 3.05 ± 0.10 | 3.06 ± 0.05 |
En la Figura 5 se puede apreciar la tendencia lineal de los parámetros físicos; en ella se ve un descenso para todos los parámetros en los grados Brix, densidad y pH, mostrando pendientes negativas; pero en función al porcentaje de acidez se ve un incremento con pendiente positiva en todos los tratamientos.
Jover et al. (2012) en su estudio de evaluación de levaduras mostraron que estas consumen los azucares que se encuentran en el medio y claramente se puede apreciar en el descenso de los grados Brix, tal como ocurre con los tratamientos. Trigueros et al. (2016) resaltan que para el incremento de la biomasa se necesitan azucares los cuales se reducen en función al tiempo, ya que los microorganismos la utilizan para el metabolismo. Moreno et al., (2013) muestran que existe diferencia en densidades de las bebidas antes de fermentar y luego de fermentar, esto debido a los procesos de transformación de parte de los microorganismos en el sustrato (Guel et al., 2018). Bajo este principio explicamos la variación de la densidad del extracto vegetal en cada uno de los tratamientos; Nissen et al. (2020), en su trabajo de fermentación de bebidas por probióticos con diversos microorganismos mostraron descensos de pH de 7.18 ± 0.01 a pH 4.74 ± 0.10 en un tiempo de seis horas; en contraste, con lo observado en nuestro estudio (Tabla 4) se ve un descenso más lento. Con respecto a la acidez Chavan et al. (2018), reportaron un incremento de esta con respecto al tiempo tal y como ocurre en nuestros tratamientos.
Modelos de bondad de Ajuste
La Tabla 5 muestra los criterios estadísticos del modelo de Gompertz para cada tratamiento; en ella se puede apreciar que A1 muestra un mejor ajuste en comparación a los demás tratamientos; asimismo, en la Tabla 6 se muestran los criterios estadísticos de regresión lineal para los parámetros físicos monitoreados en ella.
Tabla 5 Criterios estadísticos para Gompertz correspondiente a cada tratamiento
| Criterios | A1 | A2 | A3 | A4 |
|---|---|---|---|---|
| Suma de Cuadrados del error | 0.007 | 0.022 | 0.013 | 0.020 |
| Coeficiente de determinación (R2) | 0.767 | 0.476 | 0.549 | 0.463 |
| Cuadrado medio del error | 0.001 | 0.003 | 0.002 | 0.003 |
| Desviación estándar | 0.035 | 0.061 | 0.046 | 0.059 |
Tabla 6 Criterios estadísticos para las propiedades físicas y fisicoquímicas
| Criterios | Brix | Densidad | pH | % de Acidez |
|---|---|---|---|---|
| A1 | ||||
| Suma de Cuadrados del error | 0.387 | 7.4 x 10-7 | 0.226 | 0.954 |
| R2 Coeficiente de determinación | 0.904 | 0.759 | 0.748 | 0.896 |
| Cuadrado medio del error | 0.055 | 1.07 x 10-7 | 0.032 | 0.136 |
| Desviación estándar | 0.010 | 3.2 x 10-5 | 0.179 | 0.369 |
| A2 | ||||
| Suma de Cuadrados del error | 0.495 | 1.43 x 10-7 | 0.214 | 2.109 |
| R2 Coeficiente de determinación | 0.883 | 0.950 | 0.922 | 0.843 |
| Cuadrado medio del error | 0.070 | 2.04 x 10-8 | 0.030 | 0.301 |
| Desviación estándar | 0.265 | 1.4 x 10-5 | 0.175 | 0.549 |
| A3 | ||||
| Suma de Cuadrados del error | 0.361 | 3.7 x 10-7 | 0.352 | 0.786 |
| R2 Coeficiente de determinación | 0.817 | 0.971 | 0.874 | 0.905 |
| Cuadrado medio del error | 0.051 | 5.39 x 10-8 | 0.050 | 0.112 |
| Desviación estándar | 0.227 | 2.3 x 10-5 | 0.224 | 0.335 |
| A4 | ||||
| Suma de Cuadrados del error | 0.469 | 1.2 x 10-7 | 0.369 | 2.182 |
| R2 Coeficiente de determinación | 0.838 | 0.966 | 0.874 | 0.847 |
| Cuadrado medio del error | 0.067 | 1.7 x 10-8 | 0.052 | 0.311 |
| Desviación estándar | 0.258 | 1.3 x 10-5 | 0.229 | 0.558 |
Para Torres et al. (2012), los criterios estadísticos son importantes ya que mediante estos podemos observar el mejor ajuste ya sea desde modelos de regresión lineal, modelos de primer orden, entre otros; asimismo, según Rodríguez & Chambi (2019) los criterios estadísticos pueden mostrar el ajuste correcto para las curvas de crecimiento microbiano.
Conclusiones
La bebida probiótica no láctea se desarrolló utilizando extracto vegetal de tarwi y Saccharomyces boulardii. Mediante el estudio se obtuvieron las curvas de crecimiento de cada uno de los tratamientos, de los cuales el tratamiento A1 con una concentración de sacarosa al 6% e inoculo a 2%, presentó valores óptimos tanto para los parámetros cinéticos como para los modelos de ajuste, mediante los cuales se puede predecir, optimizar y determinar las condiciones óptimas para el crecimiento de biomasa, y aprovechar cada una de sus diferentes aplicaciones.
Los parámetros físicos y fisicoquímicos presentaron comportamientos según la cantidad de sustrato, de modo que se pudo ver el comportamiento de estas en relación a la acción de Saccharomyces boulardii; en algunos casos con su disminución como los Brix, densidad y pH y en otros casos en su incremento como la acidez, mostrando así la dinámica de producción de metabolitos propios de una reacción bioquímica.












 uBio
uBio