Introducción
El PS constituye una raza especializada de doble propósito (carne y leche). Esta raza representa el 18% de la población vacuna de leche del Perú (MINAGRI, 2020), donde ha logrado adaptarse a las condiciones geográficas y climáticas de los Andes (Quispe et al., 2016). Sin embargo, para mejorar la productividad ganadera en el menor tiempo posible, es conveniente utilizar otras tecnologías reproductivas. como la ovulación múltiple y la transferencia de embriones (OMTE) de animales élite adaptados a la zona (Seguro-Correa & Montes-Pérez, 2001).
La ovulación múltiple o superovulación (SOV) en bovinos es parte de la tecnología de producción y transferencia de embriones OMTE; tiene el objetivo de incrementar la tasa de ovulación y obtener un mejor rendimiento del número de embriones aptos para ser transferidos (Armstrong, 1993; González et al., 2001). Esta tecnología en potencia puede reducir el intervalo generacional entre madres e hijos e intensificar la selección genética, y para ello es necesario identificar a la vaca ideal que pueda ser usada como donante de embriones (Bó y Mapletoft, 2018; Mutlak, 2019).
En la actualidad la SOV ha presentado resultados muy variables en cuanto a la respuesta ovárica, desarrollo y calidad embrionaria, lo cual representa una gran dificultad para la implementación de OMTE en bovinos (González et al., 2001). Diversos estudios han realizado múltiples protocolos hormonales con el objetivo de mejorar los resultados de la SOV, y eludir la variabilidad de los resultados; sin embargo, las mejoras son pocas (Sudano et al., 2011).
En los protocolos de superestimulación para vacas es común el uso de la FSH para inducir el crecimiento folicular (Monniaux et al., 1983; Walsh et al., 1993). Debido a que la vida media de la FSH en vacas es de 05 horas (Laster, 1972), en los protocolos convencionales la FSH es administrada dos veces/día a cada 12 horas por un período de 4-5 días por vía intramuscular.
Schams et al. (1978) describieron a la eCG como una glicoproteína compleja que, administrada en rumiantes, presenta actividad semejante a FSH y LH. El uso de la eCG en bovinos lecheros demostró que es capaz de inducir el reclutamiento de un mayor número de folículos antrales, de estimular una mayor tasa de crecimiento folicular, dando origen a un folículo preovulatorio mejor desarrollado; y el CL formado a partir de esos folículos es una estructura altamente funcional (Baruselli et al., 2010; Păcală et al., 2010; De Rensis & López‐Gatius, 2014). Otra ventaja de la eCG es su administración en dosis única (de entre 1500 a 3000 UI/animal), suficiente para estimular el crecimiento de los folículos (Murphy & Martinuk 1991; Bó & Mapletoft 2018); asimismo el uso de eCG puede actuar de forma semejante a la FSH y LH, lo que podría ayudar a reducir los costos de la SOV bovina (Sudano et al., 2011).
Por ello, el objetivo de este estudio fue evaluar el efecto de dos protocolos hormonales de superovulación, con FSH y con eCG, sobre la respuesta ovárica y embrionaria en vacas Pardo Suizas altoandinas de alto valor genético.
Materiales y métodos
Ubicación y características
El estudio se realizó en la Escuela Profesional de Medicina Veterinaria, de la Universidad Nacional de San Cristóbal de Huamanga, distrito de Ayacucho, Provincia de Huamanga, Región Ayacucho. En la latitud sur 13°14’43’’, 74°22’41’’del Meridiano de Greenwish, con altitud media de 2750 msnm. Existe en la zona una época de lluvias de 5 a 6 meses (noviembre - abril), con 400 a 1.000 mm de precipitaciones y una temperatura entre 6 y 12°C; y otra época seca (mayo - octubre) con alta evaporación y heladas con temperaturas por debajo de 10°C y altas variaciones (de +/- 30°C) (Solid Perú, 2007).
Animales y alimentación
Este estudio se realizó en cuatro vacas de raza Pardo Suizo altoandinas (adaptadas a crianza sobre los 2800 msnm), de alto valor genético, con edades entre 5 y 7 años, multíparas, y condición corporal de 2,5 a 3,5 (escala de 1 - 5). Previamente cada hembra fue sometida a una evaluación ginecológica ecográfica, a fin de evaluar los ovarios y constatar la ciclicidad de los ovarios y la ausencia de patologías en ellos y en el útero (Des Côteaux et al., 2010). Durante el experimento las vacas fueron alimentadas con alfalfa, ensilado de maíz chalero, heno de avena y ración balanceada para vacas lecheras.
Diseño experimental
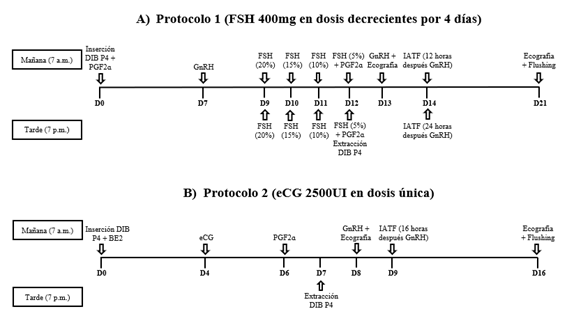
Las vacas donantes fueron sometidas a dos protocolos hormonales de superovulación: Protocolo 1 (Prot.1: FSH 400 mg en dosis decrecientes por 4 días) y protocolo 2 (Prot.2: eCG 2500 UI en dosis única) (Figura 1). Se hizo un ensayo de diseño de series temporales interrumpidas con replicaciones cambiadas; las vacas se dividieron al azar en dos grupos y fueron superestimuladas dos veces con 30 días de diferencia, de manera que cada una fue sometida a ambos protocolos hormonales.
En el Prot.1, el D0 las vacas recibieron un dispositivo intravaginal bovino (DIB) con 1g de progesterona (P4) (DIB®, Syntex) y 0,526mg de Cloprostenol sódico (Análogo sintético de PGF2ɑ, Estroplan®, Vetoquinol); el D7 se les administró 0,0105 mg de Acetato de buserelina (Análogo de la GnRH, Conceptal®, MDS Salud animal); a partir del D9 - D12, cada 12 horas se administró 400 mg de FSH (Folltropin®, Bioniche) en dosis decrecientes (20%, 15%, 10% y 5%) (Figura 1A); el D12 también se les administró 0,526mg de Cloprostenol sódico (Análogo sintético de PGF2ɑ, Estroplan®, Vetoquinol) por la mañana, y por la tarde se hizo la extracción del DIB; el D13 se les administró 0,0105 mg de Acetato de buserelina (Análogo de la GnRH, Conceptal®, MDS Salud animal) para inducir la ovulación; el D14 se realizó la IATF con doble dosis de semen criopreservado, el primero a las 12 horas y el segundo a las 24 horas después de la inducción de la ovulación.
En el Prot.2 (Figura 1B), el D0 las vacas recibieron un DIB, con 1g de P4 (DIB®, Syntex) y 2,5 mg de Benzoato de estradiol (Estrovet®, Montana); el D4 se les administró una dosis única de 2500 UI de eCG (Novormon®, Syntex); el D6 se les administró 0,526mg de Cloprostenol sódico (Análogo sintético de PGF2ɑ, Estroplan®, Vetoquinol); el D7 se realizó la extracción del DIB; el D8 se les administró 0,0105 mg de Acetato de buserelina (Análogo de la GnRH, Conceptal®, MDS Salud animal) para inducir la ovulación, la IATF se realizó con doble dosis de semen criopreservado 16 horas después de la inducción de la ovulación.
Evaluación ecográfica de los ovarios
La evaluación ecográfica de los ovarios en ambos protocolos se realizó el día de la administración de los inductores de ovulación, para el conteo y medición de los folículos pre ovulatorios (FPO); y el día del flushing, para el conteo y medición de los cuerpos lúteos (CLs) (Figura 1), para lo cual se utilizó un equipo ecográfico MyLab™One con transductor linear de 7,5MHz. El conteo de los folículos y la posterior presencia de CLs permitió estimar la tasa de ovulación (Sudano et al., 2011).
Colecta de embriones
La colecta de embriones se realizó siete días después de la última IATF (Figura 1), con la técnica de recuperación por gravedad mediante circuito cerrado; para este procedimiento se usó una sonda Foley que permitió realizar el flushing por cada cuerno uterino. Después de la anestesia epidural, el flushing se hizo con solución salina tamponada con fosfato (PBS, BOVIFLUSH®). El producto colectado fue clasificado según el método de Lindner & Wright (1983): ovocitos no fertilizados, embriones transferibles (excelentes y buenos) y embriones no transferibles (degenerados).
Análisis estadístico
Las pruebas de hipótesis de las variables discretas o continuas, número o tamaño de folículos, cuerpos lúteos y embriones fueron comparadas mediante la prueba de t de Student para muestras relacionadas mediante el software IBM®SPSS®Statistic v.25.0, para aquellos que cumplieron los supuestos de normalidad, a excepción del número de embriones de calidad bueno y número de ovocitos no fertilizados que fueron comparados mediante la prueba de rangos con signo de Wilcoxon. La tasa de ovulación para los tratamientos superovulatorios fue comparada mediante la diferencia de proporciones con el Software Minitab® 17.1.0. Para todos los casos se consideró significativa cuando p < 0.05.
Resultados
Respuesta ovárica
Los principales resultados sobre respuesta ovárica obtenidos en cada grupo experimental se muestran en la tabla 1. A pesar de que aparentemente el número de folículos es mayor con el Prot. 1 con 16,0 ± 4,5 frente a Prot. 2 con 9.3 ± 3,6 folículos preovulatorios, no existe diferencia alguna (p = 0,11). Caso similar, sucede con el número de cuerpos lúteos (12,5 ± 4,7 vs 6,00 ± 0,8, p = 0,37) y la tasa de ovulación (78.1 % vs 64.9%).
Tabla 1 Respuesta ovárica al tratamiento superovulatorio con dos protocolos hormonales (FSH vs eCG) en vacas altoandinas Pardo Suizas.
| Respuesta ovárica | Protocolos SOV | |
|---|---|---|
| Prot.1 (n=4) | Prot.2 (n=4) | |
| Prom ± D.E. | Prom ± D.E. | |
| Número de folículos preovulatorios (n) | 16,0 ± 4,5a | 9,3 ± 3,6a |
| Diámetro folicular (mm) | 13,2 ± 0,8a | 12,0 ± 0,4a |
| Número de cuerpos lúteos (n) | 12,5 ± 4,7 a | 6,00 ± 0,8 a |
| Diámetro de cuerpos lúteos (mm) | 17,6 ± 4,6 a | 17,3 ± 1,0 a |
| Tasa de ovulación (%)* | 78,1 %a | 64,9 %a |
Nota: Para cada protocolo las letras diferentes en la misma fila indican diferencias significativas (p<0,05) a la prueba de t de Student relacionado.
(*) La tasa de ovulación fue comparada mediante la prueba de hipótesis de la diferencia de proporciones.
Prot.1: Hormona folículo estimulante (FSH) en dosis decrecientes por 4 días.
Prot. 2: Gonadotropina coriónica equina (eCG) en dosis única.
Los resultados con relación a la respuesta ovárica no demostraron diferencia significativa entre protocolos, aunque numéricamente los resultados ováricos del Prot.1 son ligeramente superiores a los del Prot.2 (Tabla 1).
Respuesta embrionaria
Con relación a las estructuras colectadas, encontramos que no difiere el número total de embriones obtenidos con FSH y con eCG. (5,5 ± 1,7 vs 3,8 ± 1,3, p = 0,28), así como en cuanto a la calidad embrionaria (Tabla 2).
Tabla 2 Estructuras colectadas como respuesta al tratamiento superovulatorio con hormona folículo estimulante y gonadotropina coriónica equina en vacas altoandinas Pardo Suizo.
| Estructuras colectadas | Protocolos SOV | |||
|---|---|---|---|---|
| Prot.1 (n=4) | Prot.2 (n=4) | |||
| TOTAL | Prom ± D.E. | TOTAL | Prom ± D.E. | |
| Ovocitos no fertilizados (n)* | 2 | 0,5 ± 0,6a | 2 | 0,5 ± 0,6a |
| Embriones transferibles (n) | 22 | 5,5 ± 1,7 a | 15 | 3,8 ± 1,3 a |
| Embriones excelentes (n) | 17 | 4,3 ± 1,3a | 14 | 3,5 ± 1,3a |
| Embriones buenos (n)* | 5 | 1,3 ± 1,5a | 1 | 0,3 ± 0,5 a |
Nota: Para cada protocolo las letras diferentes en la misma fila indican diferencias significativas (p<0,05) a la prueba de t de student relacionado y rangos de signo de Wilcoxon (*).
Prot.1: Hormona folículo estimulante (FSH)
Prot.2: Gonadotropina coriónica equina (eCG)
Discusión
En cualquier programa de SOV se procura maximizar el número de embriones transferibles que posean alta probabilidad de producir preñeces (Armstrong, 1993; González et al., 2001). Un factor de riesgo significativo en campo sigue siendo la alta variabilidad de la superovulación (Lerner et al., 1986; Mapletoft & Bó, 2013; Jahnke & Youngs, 2021), que depende de una serie de factores, tales como los fármacos hormonales, condición del animal y medio ambiente (Kulus et al., 2019; Jahnke & Youngs, 2021). Sin embargo, el estado ovárico al comienzo del tratamiento explica gran parte de la variabilidad en la respuesta superovulatoria (Monniaux et al., 1983; Jahnke & Youngs, 2021). Por lo que, mientras los progresos de la fisiología reproductiva siguen avanzando, aún se necesita mayor entendimiento de los factores que influyen en la SOV del animal donante (Jahnke & Youngs, 2021).
Debido al aumento generalizado de la importancia del bienestar de los animales, ahora se buscan opciones alternativas para disminuir el número de inyecciones mediante el uso de otras gonadotropinas o afines. Por ello consideramos necesario tratar de simplificar los protocolos de superovulación (SOV) en bovinos. Para eso ha surgido el uso de la gonadotropina coriónica equina (eCG) (Mapletoft et al., 2002); otra propuesta ha sido la gonadotropina menopáusica humana, la misma que no ha tenido uso comercial (Jahnke & Youngs, 2021). Es necesario implementar protocolos hormonales de SOV que procuren el bienestar del animal idóneos en cuanto al costo-beneficio y sin afectar la calidad embrionaria. Queda por ello la eCG como posible hormona reemplazo de FSH.
El número de folículos preovulatorios en el Prot.1 observado en nuestro estudio es semejante al reportado por Mahmood et al., (2021), que obtuvieron 13,73 ± 1,31 folículos preovulatorios al administrar 400mg de FSH en vacas Holstein Friesian. Mientras que Gutiérrez-Reinoso et al. (2022), realizaron la SOV con 280 mg de FSH en vacas Red Angus y reportaron un número inferior de folículos preovulatorios y CLs en comparación con nuestros resultados en el Prot.1.
En base a los resultados obtenidos en este estudio, el Prot.2 con 2500 UI de eCG administrado en dosis única fue suficiente para generar respuesta SOV con resultados semejantes al Prot.1 con múltiples administraciones de FSH (protocolo convencional). De similar forma, Takagi et al. (2001), compararon el uso de FSH humana recombinante (rhFSH) (3000 UI) frente a la eCG (2500 UI) en novillas Holstein Friesian, y observaron que el crecimiento folicular y número de folículos (>8 mm de diámetro) después de tres días de estimulación fueron semejantes entre ambos protocolos hormonales.
En nuestro estudio utilizamos dos fuentes diferentes de gonadotropinas (FSH y eCG), para estimular el crecimiento folicular, y el número de CLs observados el día de la colecta embrionaria y los resultados fueron semejantes a Naranjo-Chacón et al., (2019) quienes superestimularon vacas multíparas Bos taurus × Bos indicus con 260 mg de FSH + 200 UI de eCG, y el día de la colecta embrionaria reportó 13,8 ± 5,3 CLs. La respuesta multiovulatoria en un protocolo de SOV depende en gran medida del número de folículos y de su estado fisiológico (Redhead et al. 2018).
Aunque el protocolo FSH para SOV sea el más tradicional, tiene problemas asociados a su eficiencia, rentabilidad (Hasler et al., 1983), bienestar (Kulus et al., 2019) y eficacia en tiempos. Las constantes aplicaciones intramusculares, dos veces diarias por cuatro a cinco días (Mapletoft & Bó, 2012; Chacón et. al, 2020) lo convierten en un protocolo bastante laborioso que podría causar un estrés innecesario en los animales, y también conlleva el riesgo de omitir involuntariamente una de las inyecciones (Kulus et al., 2019) debidas al aumento de niveles de cortisol plasmático y de progesterona de origen suprarrenal (Chacón et al., 2020).
De otro lado, existen discrepancias con respecto al uso de FSH o de eCG. La foliculogénesis en mamíferos requiere la acción de la hormona foliculoestimulante (FSH) y la hormona luteinizante (LH). Por lo tanto, la eCG cumple con ese requisito. Sin embargo, se produjo una reacción más fuerte a la estimulación ovárica después de la administración del extracto pituitario FSH que con la eCG (Elsden et al.,1978; Mapletoft et al., 2002). Así mismo, se reportó que la SOV con FSH permitía más de tres embriones transferibles que los logrados con eCG (Monniaux et al., 1983). En contraposición, algunos señalan que no existen diferencias significativas entre el número de embriones recolectados tras el uso de protocolos basados en eCG y FSH (Goulding et al., 1996).
El estado ovárico al comienzo del protocolo explica gran parte de la variabilidad en la respuesta superovulatoria (Monniaux et al., 1983; Jahnke & Youngs, 2021); igualmente, la limitación en el tamaño de la muestra al trabajar con animales mayores pudo influir en los resultados finales. Por lo tanto, es necesario realizar protocolos hormonales y evaluar sus interacciones con los diversos factores y los efectos sobre la respuesta ovariana.












 uBio
uBio