Introducción
Las microalgas (fitoplancton) son el alimento más utilizado en la acuicultura, ya que aproximadamente el 90% del total de la producción es usado como alimento para esta actividad al menos en una etapa de desarrollo de los organismos cultivados como; para moluscos, larvas de peces y crustáceos o bien en organismos intermedios, como rotíferos, cladóceros, copépodos (Duerr et al., 1998), debido a que poseen cantidades apreciables de ácidos grasos poliinsaturados (Omega 3 y Omega 6), carbohidratos, lípidos, vitaminas, minerales y antioxidantes (Méndez, 2003; Abalde et al., 1996). Las microalgas son organismos unicelulares fotosintéticos que se desarrollan en medios acuáticos de agua dulce o agua de mar, carecen de raíces, tallos y hojas (Falkowski, 1997). Además tienen una mejor disponibilidad para asimilar Carbono y otros nutrientes del medio acuoso.
La utilización de microalgas en acuicultura, permite obtener mejores resultados de crecimiento y supervivencia en relación a dietas inertes (Ponis et al., 2003). Por ello, el cultivo de las especies de género Chlorella tienen gran importancia por su facilidad de cultivo (Yamamoto et al., 2004) y su alto valor nutricional (Moronta et. al., 2006).
Uno de las etapas más críticos en el ciclo de vida de los peces, es la etapa larval. Al poseer ovas pequeñas tienen limitada cantidad de material vitelino, en este caso el desarrollo embrionario es rápido y la alimentación exógena iniciaría cuando aún hay una capacidad digestiva mínima (Dabroswki, 1984). Motivo por el cual, las microalgas principalmente la Chlorella vulgaris incidirían en el manejo óptimo de larvas de peces provenientes de óvulos menores a 7,0 mm existentes en el lago Titicaca como; Orestias (carachis e Ispi), Trichomycterus (mauri y suche) y Odontesthes bonariensis (pejerrey) quienes producen óvulos pequeños que al obtener larvas presentan problemas de nutrición y mayor mortandad, estos peces se encuentran sobreexplotadas por lo que debe darse prioridad a su conservación y al estudio de su biología y ciclo de vida. Asimismo, Lavens y Sorgeloos, (1996) indican que las etapas más críticas del cultivo de peces con óvulos pequeños es la etapa larval, por ello es importante iniciar con un régimen de alimento vivo compuesto por fito y zooplancton (Galessoupe, 1990; Reintan et al., 1993).
Al mejorar la supervivencia de peces en etapa larval conllevaría al incremento de la biomasa de Carachi amarillo, de esa manera contribuir a la recuperación y a la seguridad alimentaria de los pobladores altoandinos de la región Puno.
Además de la optimización en la nutrición de peces, las microalgas son añadidas directamente a tanques de cultivo ejerciendo una influencia positiva en el estado fisiológico de larvas de peces que se traduce en la obtención de alevines de elevada calidad (Olsen et al., 2000), como también mejora las condiciones higiénicas de estos, mediante la reducción de compuestos que polucionan (Makridis et al., 2006).
El presente estudio tuvo como objetivo identificar el efecto del uso de la microalga Chlorella vulgaris como alimento vivo en la producción de larvas de Carachi amarillo en términos de supervivencia, crecimiento.
Materiales y métodos
La investigación se llevó a cabo en el área de cultivos auxiliares del laboratorio Continental de Puno perteneciente al Instituto del Mar del Perú - IMARPE, localizado en la Ciudad de Puno. Para el desarrollo de estudio se utilizaron 1600 larvas de O. luteus de dos días de edad con talla promedio de 7,41 ± 0,38 mm y un peso 0,0046 ± 0,0012 g provenientes de desove artificial, los cuales fueron mantenidas durante 30 días en dos acuarios rectangulares de vidrio de 40 litros con respectivos aireadores a una densidad de 20 larvas por litro.
El diseño de estudio consistió determinar la supervivencia de larvas de O. luteus los primeros siete días utilizando dos formas de alimentación: (A) larvas alimentadas con Chlorella vulgaris y (B) larvas alimentadas directamente con nauplios de Artemia salina. A los ocho días las larvas que fueron alimentados con microalgas, pasaron ser alimentados con neonatos de Artemia salina.
Las cepas de Chlorella vulgaris fueron obtenidas del lago Titicaca y separadas mediante el rayado en agar, método utilizado para algas menores a 10 micras, posteriormente estas fueron acondicionadas en tubos de ensayo, a las cuales se consideró como cepas. Para el enriquecimiento de estas, se utilizó el medio no convencional abono foliar (fertilizante agrícola) los cultivos fueron siempre cosechados en su fase estacionaria, el agua utilizada para volúmenes de 10 ml, 25ml, 100 ml, y 500 ml fue destilada, mientras para un litro hasta 20 litros se utilizó agua potable filtrada y des clorada. El cultivo de microalgas se realizó en el laboratorio Continental de Puno, IMARPE en condiciones controlados, la instalación del área de cultivos auxiliares utilizada fue de 67,5 m² acondicionados a una temperatura ambiental de 20 a 25 °C, con fotoperiodo de 12 horas luz con una aireación continua. Cada tres días se registraron el conteo de número de células por 0,1 mL, además se registró la temperatura, salinidad y pH del medio de cultivo con multiparámetro marca WTW multi 3620 IDS.
La concentración celular se calculó mediante la siguiente fórmula; considerando que las células son menores a 6 µ:
Donde:
Na = Número de células por mL (cel/mL)
Σ Cel. Ca = Suma de células en la diagonal central de la cámara Neubauer
El procedimiento fue mediante la obtención de muestras diarias de cada uno de los recipientes de 3 litros que sirvieron como unidades experimentales, las que se fijaron en láminas portaobjetos la muestra con Lugol, posteriormente se procedió a contarlas en un microscopio compuesto y con un hematocímetro equipada con cuadriculado de Neubauer.
Diariamente se realizó el registro de temperatura, oxígeno y pH en los acuarios con multiparámetro marca WTW multi 3620 IDS de fabricación Alemana 2017, asimismo la separación de larvas muertas se realizó cada dos días mediante el método de sifoneo. Al final del estudio se realizó conteo y se procedió a muestrear de forma aleatoria el 5 % de las larvas supervivientes, a las cuales se les midió la longitud total en mm y el peso en g.
Para la comparación de los resultados obtenidos por cada tratamiento, se realizó un análisis de varianza (ANOVA) de una vía, utilizando un nivel de confianza de 95%.
Tabla 1 Biométrico de talla y peso de Carachi amarillo al inicio y final del ensayo (30 días)
| Parámetro/promedio | Ensayo A | Ensayo B | ||
|---|---|---|---|---|
| A | DS | B | DS | |
| Longitud total inicial (LT) (mm) | 7.41 | 1.34 | 7.41 | 1.34 |
| Peso inicial (g) | 0.0046 | 0.0016 | 0.0046 | 0.0016 |
| Longitud final (LT) (mm) | 10.98 | 1.97 | 10.88 | 1.9 |
| peso final (g) | 0.014 | 0.024 | 0.011 | 0.024 |
Resultados
En la Tabla 2, muestra Los resultados de dos ensayos; en el ensayo A, la alimentación se inició con Chlorella vulgaris por un periodo de siete días, el porcentaje de supervivencia de larvas de O. Luteus fue superior en comparación con el ensayo B donde la alimentación se inició con neonatos de Artemia salina.
Tabla 2 Supervivencia de larvas de Carachi amarillo mediante el perfil de alimentación
| Tipo de alimento | Ensayo A | Ensayo B | ||
|---|---|---|---|---|
| Chlorella vulgaris | Artemia salina | |||
| Conteo/días | Cantidad vivos | Cantidad muertos | Cantidad vivos | Cantidad muertos |
| 1 | 1250 | 0 | 1250 | 0 |
| 3 | 1250 | 0 | 1218 | 32 |
| 5 | 1240 | 10 | 1150 | 68 |
| 7 | 1231 | 9 | 910 | 180 |
| 9 | 1224 | 7 | 945 | 25 |
| 11 | 1220 | 4 | 940 | 5 |
| 13 | 1211 | 9 | 930 | 10 |
| 15 | 1211 | 0 | 930 | 0 |
| 17 | 1207 | 4 | 924 | 6 |
| 19 | 1207 | 0 | 920 | 4 |
| 21 | 1207 | 0 | 920 | 0 |
| 23 | 1203 | 4 | 920 | 0 |
| 25 | 1203 | 0 | 918 | 2 |
| 27 | 1199 | 4 | 918 | 0 |
| 29 | 1199 | 0 | 918 | 0 |
| Total | 1199 | 51 | 918 | 332 |
| % vivos y muertos | 95.9 | 4.1 | 73.4 | 26.6 |
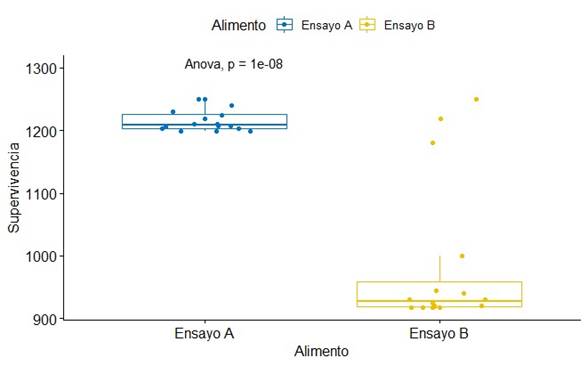
En la Fig. 3. El diagrama de cajas relacionado al tipo de alimento en el ensayo A; el valor máximo de supervivencia fue de 1199 unidades mostrando valores de cuartiles 1,2 y 3 con 1225, 1250 y 1350 individuos respectivamente. Asimismo en el ensayo B, el valor máximo fue de 918 unidades de supervivencia, para los datos de cuartiles 1,2 y 3 con 950, 975 y 950 respectivamente. Además, los cuartiles y medianas de ambos ensayos están dispersos y diferentes valores. Finalmente, se obtuvo mayor supervivencia con el ensayo
En la Tabla 3, puede mostrarse el análisis de la varianza con relación a la supervivencia según la forma del suministro de alimento. La tabla ANOVA muestra que el coeficiente F, que en este caso es igual a 61,0847, es el cociente indicado entre grupos y el estimado dentro de grupos. Puesto que el valor P de la prueba F es menor 0.05, existe una diferencia estadísticamente significativa.
Discusión
El crecimiento es una variable biológica que puede afectar cuando las condiciones del medio y la alimentación resultan limitantes. Para asegurar la supervivencia, los peces presentan diversas estrategias principalmente en la etapa larval. En este estudio las condiciones del medio y la forma de alimentación fueron favorables, asimismo el manejo higiénico - sanitario fueron controlados. En el ensayo A pudo observarse a los siete días mayor supervivencia de larvas de Orestias luteus al 78 % permitido por el suministro de Chlorella vulgaris y posteriormente con neonatos Artemia salina.
Uno de las etapas más críticos en el ciclo de vida de los peces es la etapa larval, al poseer ovas pequeñas que presenta O. luteus la reabsorción de saco vitelo ocurrió entre 3 a 4 días donde la capacidad digestiva es mínima. Al respecto Dabroswki (1984) menciona las ovas pequeñas tienen limitada cantidad de material vitelino, en este caso el desarrollo embrionario es rápido y la alimentación exógena iniciaría cuando aún hay una capacidad digestiva mínima, asimismo Devillers, (1961) indica que desde el punto de vista de la alimentación, la larva se enfrenta a la necesidad de aprender a cazar con rapidez y que además se complica aún más ya que no tienen un sistema digestivo completamente formado. Durante este periodo, el desarrollo del canal alimentario abarca cambios morfológicos, fisiológicos que están sincronizados por procesos genéticos y ambientales. Motivo por el cual, las microalgas principalmente la Chlorella vulgaris incidiría mejor en el manejo óptimo de larvas de peces provenientes de óvulos menores a 7,0 mm existentes en el lago Titicaca como; Orestias (carachis e Ispi), Trichomycterus (mauri y suche) y Odontesthes bonariensis (pejerrey) quienes producen óvulos pequeños que al obtener larvas presentan problemas de nutrición y mayor mortandad, estos peces se encuentran sobreexplotadas por lo que debe darse prioridad a su conservación y al estudio de su biología y ciclo de vida.
La Chlorella vulgaris resultó tener características atractivas como alimento para la especie Orestias luteus, principalmente en la etapa de larvas, ya que presenta tamaño adecuado para ser consumidas y una pared celular digerible, asimismo; Abalde et al., (1995) indican que las microalgas deben tener una composición bioquímica adecuada, especialmente de los ácidos grasos poliinsaturados, debido a que estos son esenciales para el desarrollo larval de los organismos acuáticos.
La microalga Chlorella vulgaris, al ser suministrados como alimento, también ejerció directamente en el ambiente acuático (acuario), interviniendo en el estado fisiológico de larvas de Orestias luteus. Al respecto, Olsen et al., (2000) indican que; una de las aplicaciones más importantes de las microalgas durante la etapa de cultivo larvario, también son añadidas directamente influyendo sobre el estado fisiológico de las larvas. Asimismo el fitoplancton, resulta esencial para alimentar muchos organismos acuáticos, como larvas de peces, moluscos y crustáceos (Spolaore et al., 2006).
Asimismo, Milhazes-Cunha y Otero, (2017) señalan que; otra de las ventajas básicas de cultivo de microalgas es mediante el uso de nutrientes provenientes de la acuicultura. También las microalgas son usados en acuicultura multitrófica para peces herbívoros y moluscos, otro de los casos es que el cultivo de microalgas se aplican para tratamiento de aguas residuales para acuicultura debido que esta actividad presenta problemas con el medio ambiente mediante el uso de alimento no digerido y la expulsión de heces de parte de los peces en cautiverio, el principal nutriente disuelto es el amonio, que se convierte en nitrato, dichos compuestos orgánicos se puede cosechar y reciclar de manera eficiente que serviría como nutriente para microalgas.
No solo se puede utilizar las microalgas como alimento vivo, también se puede reemplazar a harina de pescado, según estudios realizados por (Raji et al., 2018) las microalgas como la Spirulina platensis y Chlorella vulgaris fueron utilizados en la dieta del Bagre Africano con el propósito de reemplazar a la Harina de pescado, los resultados de este trabajo de investigación indican que aumentaron el rendimiento del crecimiento en función a la tasa de crecimiento específico, así mismo la relación de conversión alimenticia y la relación de eficiencia proteica se vieron significativamente influenciadas por las suplementaciones.
Se ha contrastado el efecto del uso microalgas en mantenimiento de larvas de O. luteus como el efecto estimulador sobre el sistema inmune, además de obtener mejor crecimiento y supervivencia, se ha visto que la capacidad de larvas de O. luteus es mayor la percepción de alimento en el que adiciona microalgas, Rocha et al., (2008 )señalan que la capacidad de larvas de peces marinos para percibir es mayor en un medio de cultivo en el que se adiciona microalgas, gracias al mayor contraste que producen estas microalgas.
Conclusiones
Al suministrar como alimento vivo la microalga Chlorella vulgaris a larvas de Orestias Luteus durante los primeros siete días, produjo mejores resultados esto se evidenció en el ensayo “A” donde el crecimiento y supervivencia fueron mejores en comparación con el ensayo “B”, cabe mencionar que es necesario abordar más intensamente en la alimentación y nutrición de larvas de peces por ser complejo.
El cultivo de microalgas en laboratorio representa una alternativa como alimento para larvas de peces por su alto contenido de cantidades apreciables de ácidos grasos poliinsaturados (Omega 3 y Omega 6), carbohidratos, lípidos, vitaminas, minerales y antioxidantes.












 uBio
uBio