Introducción
La pitahaya amarilla (S. megalanthus Haw.) pertenece a la familia Cactaceae con aproximadamente 20 especies distribuidas en Bolivia, Perú, Ecuador, Colombia y Venezuela, que muestran un amplio rango de adaptación (Cruz et al., 2016). Actualmente la producción de frutos de pitahaya amarilla se ha incrementado por la aceptación de los mercados europeos y asiáticos, debido al fruto exótico que posee con un dulzor característico y refrescante, además, por la presencia de compuestos bioactivos con actividad antioxidante que podrían modular el estrés oxidativo en las células de importante valor remunerativo para los productores de pitahaya en los países tropicales y sub-tropicales (Torres et al., 2017; Mejía et al., 2020; Mállap-Detquizán et al., 2022; Chongloi, et al., 2022).
La propagación de la pitahaya se realiza sexualmente mediante la semilla botánica y asexualmente a través de los esquejes obtenidos a partir de los cladodios. La reproducción asexual es la más empleada por ser más económica y con buena respuesta productiva, pero este método es poco eficiente por ser lento y propiciar condiciones para el desarrollo de enfermedades por exceso de humedad (Hua et al., 2015). La propagación in vitro es una herramienta biotecnológica que permite mejorar la eficiencia de la multiplicación masiva y homogénea de material élite, libre de enfermedades (Suárez et al., 2014).
Los protocolos de propagación in vitro en pitahaya amarilla (S. megalanthus) emplean segmentos nodales colocados en medio basal MS y adición de BAP 0,5 y 1 mg/L en la inducción y crecimiento de brotes (Zambrano-Forero et al., 2015); meristemos axilares (aréolas) colocados en medio basal MS, y adición de Thidiazuron (TDZ) 300 µM, en la regeneración vía organogénesis indirecta (Caetano, et al., 2014); hojas cotiledonales y fragmentos de cladodios en medio MS y adición de 6-furfurilaminopurina (KIN) 2 mg/L y bencilaminopurina (BAP) 2mg/L en la obtención de brotes y raíces adventicias (Suárez et al., 2014); secciones vegetativas colocadas en medio basal MS y adición de BAP 2 mg/L y KIN 1 mg/L en la inducción de brotes y raíces adventicias (Millones y Vásquez, 2010).
Protocolos de propagación in vitro en especies de cactáceas, comprende las condiciones ambientales de crecimiento con baja intensidad de la luz y escaso intercambio de gases en los contenedores de cultivo in vitro, siendo empleada la sacarosa como la principal fuente de carbono. En Hylocerus purpusii intensidad de la luz de 38 y 47,5 µmol m-2 s-1 y sacarosa 30 g/L (De Feria et al., 2012), Hylocereus monocanthus intensidad de la luz de 28 µmol m-2 s-1 y sacarosa 30 g/L (Montiel-Frausto et al., 2016), Selenicereus megalanthus intensidad de la luz de 37 µmol m-2 s-1 y sacarosa de 30 g/L (Suárez et al., 2014). La propagación in vitro bajo diferentes intensidades de la luz también ha sido evaluado en especies como Pouteria gardneriana registrando que la regeneración de plántulas es dependiente de la sacarosa en el medio de cultivo y que las intensidades de la luz mínimamente influenciaron en las características fenotípicas (Leite et al., 2017). Momordica grosvenori cultivada bajo condiciones fotoautotróficas registraron mejor desarrollo del sistema radicular, desarrollo de brotes alto contenido de clorofila, mayor capacidad fotosintética y alta supervivencia ex vitro (Zhang et al., 2009). Las condiciones fotoautotróficas son adecuadas porque permiten en varias especies mejorar las condiciones de aclimatación de los explantes, obteniendo altas tasas de sobrevivencia en la etapa ex vitro (Hoang et al., 2020; Nguyen et al., 2016).
Mejorar la eficiencia en las condiciones de cultivo in vitro en protocolos de la propagación in vitro de pitahaya amarilla establecidos, permite evaluar la dependencia de la sacarosa en el medio de cultivo bajo condiciones fotoautotróficas con la finalidad de obtener plántulas de alta calidad en menor tiempo, que favorezca su aclimatación en la producción masiva de esta especie, razón por la cual, la presente investigación evaluó diferentes intensidades de la luz y el empleo o no de la sacarosa en el medio de cultivo sobre la respuesta morfológica y fisiológica in vitro de plántulas de pitahaya amarilla (S. megalanthus), con la finalidad de desarrollar una metodología para la micropropagación fotoautotrófica de plántulas de pitahaya amarilla, en la producción masiva de semilla asexual de calidad.
Materiales y métodos
El estudio se realizó en el Laboratorio de Biología de la Universidad Nacional Toribio Rodríguez de Mendoza de Amazonas, Perú durante el año 2020. El material vegetativo de pitahaya amarilla (S. megalanthus) estuvo conformado por cladodios introducidos in vitro en el año 2009 colectado en el distrito de Churuja, provincia de Bongará, región Amazonas, Perú (latitud 06º01’01.2”, longitud 77º57’16,8” WO y altura de 1392 msnm).
Para el crecimiento y desarrollo de secciones vegetativas de pitahaya amarilla in vitro se formuló el medio de cultivo de crecimiento y desarrollo constituido por las sales inorgánicas y vitaminas MS (Murashige y Skoog, 1962), ácido naftalenacético (ANA) 1 mg/L y BAP 2 mg/L, m-inositol 100 mg/L, sacarosa 30 g/L, carbón activado 3g/L y phytagel SIGMA 1,5 g/L. Las secciones vegetativas de pitahaya amarilla fueron colocadas en medios de cultivo de crecimiento y desarrollo, con la finalidad de obtener esquejes de aproximadamente seis centímetros de largo para la obtención de los explantes.
Los esquejes obtenidos en la etapa anterior fueron seccionados en aproximadamente cinco mm de longitud y colocadas 16 secciones vegetativas en medio de cultivo de crecimiento y desarrollo con 0 y 30 g/L de sacarosa, respectivamente. Los recipientes fueron colocados a diferentes intensidades de la luz: 50, 100 y 150 μmol/m-2s-1, utilizando lámparas fluorescentes compactas. Las intensidades de la luz fueron ajustadas empleando un luxómetro Control Company 3251. Todos los tratamientos fueron desarrollados a temperatura de 25 ± 2 °C.
Después de 45 días de cultivo in vitro de los explantes se recopilaron datos morfológicos: longitud de brote, número y longitud de raíces, diámetro de cladodio y datos fisiológicos: peso seco (colocados los explantes en una estufa a 60 °C hasta peso constante) y contenido hídrico (CH (%) = [(Peso fresco - Peso seco)/Peso fresco] x 100) (Hoang et al., 2017).
Los experimentos empleados para evaluar los efectos de la intensidad de la luz y la presencia/ausencia de sacarosa en el medio de cultivo de crecimiento y desarrollo de esquejes de pitahaya amarilla in vitro fue bajo un diseño completamente al azar en arreglo factorial (Factor A: intensidades de la luz, Factor B: presencia/ausencia de sacarosa en el medio de cultivo de crecimiento y desarrollo), con siete repeticiones, cada una conformada por 16 explantes. Las diferencias significativas entre las medias fueron calculadas con la prueba Tukey a P ≤ 0.05. El ANOVA de dos factores se realizó para analizar los efectos combinados de los factores. El MANOVA de dos factores fue realizado con las variables establecidas en el estudio. Las diferencias significativas fueron analizadas a P ≤ 0.05 y P ≤ 0.01, respectivamente. La relación entre los caracteres evaluados fue explorada con la técnica de análisis de los componentes principales. Los resultados de os componentes principales fueron visualizados con el Biplot construido entre los dos primeros componentes principales (PC1 y PC2). El análisis estadístico de los datos se realizó con el software R versión 4.1.0.
Resultados y discusión
El MANOVA de dos factores de las variables morfológicas y fisiológicas en el crecimiento vegetativo de plántulas de pitahaya amarilla mostraron que los parámetros individuales intensidad de la luz, presencia/ausencia de la sacarosa en el medio de cultivo e intensidad de la luz x presencia/ausencia sacarosa en el medio de cultivo fueron significativos (P ≤ 0.01 y P ≤ 0.05, respectivamente) (Tabla 1).
Tabla 1 MANOVA de dos factores de los efectos de diferentes intensidades de la luz y presencia o no de sacarosa en el medio de cultivo, y sus efectos combinados en las variables morfológicas y fisiológicas del crecimiento vegetativo en plántulas de pitahaya amarilla.
| Parámetro | Wilk’s Lambda | F | P |
| Intensidad de la luz Presencia/ausencia de sacarosa Intensidad de la luz x Presencia/ausencia sacarosa | 0.361 0.557 0.484 | 3.44 4.11 2.26 | ** ** * |
**Diferencia significativa a P ≤ 0.01. *Diferencia significativa a P ≤ 0.05
Las plántulas de pitahaya amarilla respondieron de manera similar en los caracteres morfológicos como longitud de brote, número y longitud de raíces, diámetro de cladodio empleando intensidades de la luz 50, 100 y 150 μmol/m-2s-1 y 30 g/L de sacarosa, no registrando diferencias significativas. El efecto negativo marcado debido a la ausencia de sacarosa en el medio de cultivo registró diferencias significativas cuando se empleó 150 μmol/m-2s-1 afectando la respuesta morfológica de los explantes, por el contrario, el empleo de intensidades de la luz de 50 y 100 μmol/m-2s-1 y en ausencia de sacarosa fueron registrados valores similares de respuesta morfológica al emplear 30 g/L de sacarosa en el medio de cultivo, siendo la prueba no significativa (Figura 1a-1d). El número y longitud de raíces en intensidades de la luz 50 y 100 μmol/m-2s-1 en ausencia de sacarosa, la respuesta morfológica fue similar con aquellos medios de cultivo donde se empleó sacarosa, esta respuesta es importante cuando las plántulas desarrollan bajo condiciones fotoautotróficas, porque permite mejorar el estatus de agua del brote y por consiguiente una mejor absorción de los nutrientes a través de la raíz (Sasongko et al., 2016).
La longitud de brotes a los 45 días de cultivo in vitro registró valores de 1,71; 2,5 y 2,15 cm en intensidades de la luz 50, 100 y 150 μmol/m-2s-1 más sacarosa 30 g/L en el medio de cultivo, incluso similares longitudes de 2,11 y 2,56 cm fueron registradas en intensidad de la luz 50 y 100 μmol/m-2s-1 sin el uso de sacarosa en el medio de cultivo (Figura 1). La intensidad de la luz de 150 μmol/m-2s-1 en ausencia de sacarosa en el medio de cultivo la longitud de brote disminuyó (1,0 cm) siendo la prueba significativa. Investigaciones en pitahaya amarilla empleando intensidad de la luz de 2000 lux (37 μmol/m-2s-1) más 30 g/L de sacarosa en el medio de multiplicación registraron longitudes de cladodios de 2,7 cm de largo, pero a los 60 días de cultivo in vitro (Suárez et al., 2014). Especies emparentadas con la pitahaya amarilla, el empleo de intensidad de la luz 38 μmol/m-2s-1, 20 g/L de sacarosa y BAP 2 mg/L en Hylocereus purpusii registraron longitud de cladodio de 1,75 cm a los 45 días de cultivo in vitro en (De Feria et al., 2012); asimismo, el empleo de intensidad de la luz 28 μmol/m-2s-1, 30 g/L de sacarosa y BAP 2 mg/L en H. monocanthus registraron longitud de cladodio de 2 cm a los 60 días de cultivo in vitro (Montiel-Frausto et al., 2016). Ambas especies, experimentaron menor longitud de cladodios en bajas intensidades de la luz comparados a los reportados en la presente investigación con intensidad de la luz de 150 y 100 μmol/m-2s-1 (2,15 y 2,50 cm, respectivamente). En Capsicum chinense el empleo de alta intensidad de la luz 225 μmol/m-2s-1 más 30 g/L de sacarosa en el medio de cultivo afectó los parámetros de crecimiento como longitud de brote, número de hojas, área foliar comparado con la intensidad de luz intensidad de la luz 28 μmol/m-2s-1 (Barrales-López, 2015). La respuesta fotoautotrófica en las plántulas de pitahaya amarilla fue distinta a la reportada en Pouteria gardneriana que solo registraron regeneración de brotes cuando el medio de cultivo contenía como fuente de carbono la sacarosa, siendo indispensable la sacarosa en el medio de cultivo para el crecimiento y desarrollo in vitro de esta especie (Leite et al., 2017).
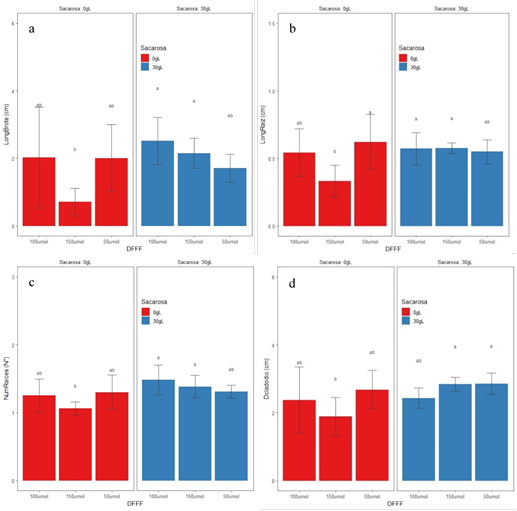
Figura 1 Respuesta morfológica de las plántulas de pitahaya amarilla sometidas a diferentes intensidades de luz y presencia/ausencia de sacarosa en el medio de cultivo. a) longitud de brote, b) longitud de raíz, c) número de raíces, d) diámetro de cladodio.
Los caracteres fisiológicos mostraron diferencias significativas en la respuesta frente a la intensidad de la luz y presencia/ausencia de la sacarosa en el medio de cultivo. El peso seco mostró una respuesta similar a la registrada en los caracteres morfológicos cuando se empleó 50 y 100 μmol/m-2s-1 en ausencia de sacarosa no mostraron diferencias significativas en el peso seco comparadas con aquellas cultivadas en medio de cultivo con sacarosa 30% (Figura 2a). La ausencia de la sacarosa en el medio de cultivo no afectó la fotosíntesis, esta respuesta puede estar relacionada con la presencia de componentes en el medio de cultivo que permitieron el desarrollo fotoautotrófico en ausencia de la sacarosa, tomando los explantes una fuente alterna de carbono, o quizá podría estar relacionada con la fotosíntesis CAM de la pitahaya amarilla (Weiss et al., 2010).
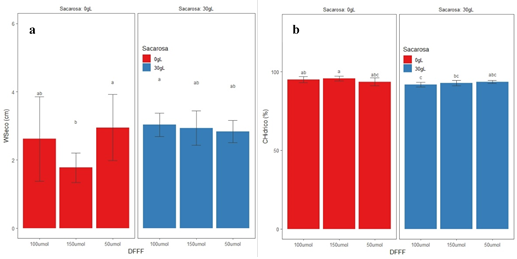
Figura 2 Respuesta fisiológica de plántulas de pitahaya amarilla sometidas a diferentes intensidades de luz y presencia/ausencia de sacarosa en el medio de cultivo. a) peso seco, b) contenido hídrico.
El proceso de la fotosíntesis requiere mayor cantidad de agua en la plántula para llevar a cabo las reacciones catalizadas por el fotosistema II (Shen et al., 2015). Bajo condiciones fotoautotróficas es importante el estatus de agua en la plántula, porque mejora positivamente la eficiencia del fotosistema II y produce un escaso desorden anatómico en la propagación in vitro de Aechmea blanchetiana (Martins et al., 2020). El contenido hídrico en intensidades de la luz 100 y 150 μmol/m-2s-1 y ausencia de sacarosa en el medio de cultivo registró mayores porcentajes de contenido hídrico en comparación cuando se empleó la sacarosa en el medio de cultivo, siendo la prueba significativa. El empleo de 50 μmol/m-2s-1 con presencia/ausencia de la sacarosa en el medio de cultivo registraron datos similares, siendo la prueba no significativa (Figura 2b). En condiciones fotoautotróficas el crecimiento y desarrollo de las plántulas de pitahaya amarilla mostraron mejor estatus hídrico de saturación que influyó en mayor crecimiento del brote, probablemente al obtener una mayor longitud de raíces que permitieron mayor eficiencia en la absorción de nutrientes del medio de cultivo. Sin embargo, la disminución del estatus hídrico en plántulas sometidas a mayor intensidad de luz (150 μmol/m-2s-1) registraron disminución de la longitud del brote, probablemente por una disminución de la turgencia celular.
La intensidad de la luz debe ser incrementada a un nivel que estimule el comportamiento fotoautotrófico de las plántulas cultivadas in vitro cuando se utilizan medios con ausencia de sacarosa (Nguyen et al., 2016). Las respuestas morfológicas y fisiológicas de las plántulas de pitahaya amarilla reportadas en el presente estudio son de importancia en el cultivo fotoautotrófico para establecer las condiciones de intensidad lumínica de las plántulas, porque al aumentar la intensidad de luz a 150 μmol/m-2s-1 requiere del uso de sacarosa. Cuando las intensidades de luz fueron de 50 y 100 μmol/m-2s-1 las plántulas pueden ser cultivadas sin suministro de fuente de carbono en el medio de cultivo. El comportamiento fotoautotrófico ha sido reportado en Mouriri elliptica (Melastomataceae), en intensidades de luz de 100 y 150 μmol/m-2s-1 y medios de cultivo con y sin sacarosa (De Assis et al., 2016). En Aechmea blanchetiana (Bromeliaceae) en intensidades de 90 μmol/m-2s-1 con diferentes niveles de sacarosa 0, 15, 30 y 45 g/L de sacarosa en el medio de cultivo (Martins et al., 2020). En Castanea sativa la alta intensidad de la luz 150 μmol/m-2s-1 y empleo de bajas concentraciones de sacarosa (5 g/L) en el medio de cultivo favorece el crecimiento y la fotosíntesis en esta especie (Sáez et al., 2016).
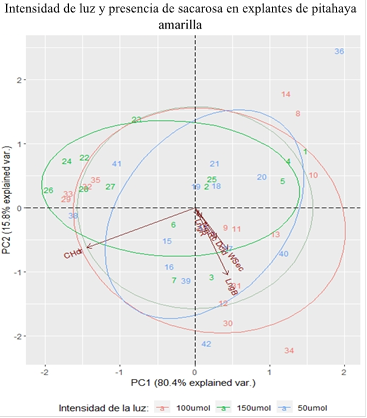
Las variables evaluadas en el crecimiento y desarrollo de plántulas de pitahaya amarilla sometidas a diferentes intensidades de luz y cultivadas en medios de cultivo con presencia/ausencia de sacarosa a través del análisis de componentes principales (PC) las PC1 y PC2 explican el 96,2% de la varianza de los datos (Figura 3). Las puntaciones positivas de la PC1 (representa el 80,4% de la varianza total) muestran que la proyección de la longitud de brote y el peso seco mostraron estar altamente correlacionados. El contenido hídrico registró puntaciones negativas y mejor representadas en la PC1, no muestra una dependencia con la variable longitud de brote, en tanto, tiene una correlación fuerte pero inversa con el peso seco. Estos resultados muestran que a intensidad de la luz de 50 y 100 μmol/m-2s-1 las variables fisiológicas y morfológicas como peso seco, contenido hídrico y longitud brote explican la respuesta fotoautotrófica de las plántulas de pitahaya amarilla a los 45 días de cultivo in vitro.
Conclusiones
Los rasgos relacionados con el contenido hídrico, peso seco y longitud de brote permiten explicar la respuesta fotoautotrófica de las plántulas de pitahaya amarilla cultivada in vitro empleando intensidades de luz de 50 y 100 μmol/m-2s-1 en ausencia de sacarosa.
El empleo de intensidad de la luz de 150 μmol/m-2s-1 en ausencia de sacarosa de cultivo, afectó las variables morfológicas y fisiológicas en plántulas de pitahaya amarilla.












 uBio
uBio