Introducción
La presencia de fármacos en las masas de agua plantea la necesidad de implementar métodos de remoción, y en este contexto, se ha comprobado que diversas plantas son exitosas en la remedición de compuestos farmacéuticos (Singh et al., 2018). Entre ellas, el helecho de agua (Azolla filiculoides) ha demostrado eficiencia en la remoción de sulfonamidas (Forni et al., 2002), y especies de lenteja de agua (Lemna gibba) que también han mostrado eficacia en la remoción de fármacos como el ibuprofeno, diclofenaco, paracetamol, carbamazepina, ácido clofibrico, propanolol y hormonas endocrinas disruptoras como el bisfenol A (Garcia-Rodríguez et al., 2015).
Sin embargo, frente a elevadas concentraciones éstas plantas manifiestan algunos sintomas de estrés, como la reducción en la capacidad fotosintética (Hájková et al., 2019) y alteración en los pigmentos (Sree et al., 2015; Singh, Pandey, & Suthar, 2018). Además, estos compuestos pueden ocasionar cambios histo-bioquímicos internos que afectan el crecimiento y desarrollo normal de las plantas (Kummerová et al., 2016), lo cual se refleja en la inhibición del crecimiento y el incremento de la biomasa (Hattink & Wolterbeek, 2001).
No obstante, los efectos de estas sustancias en las plantas no se limitan únicamente a nivel interno; también generan cambios morfológicos, como la disminución en el proceso de crecimiento y desarrollo (Singh et al., 2018), así como pequeñas alteraciones en las hojas, cuyas características fenotípicas pueden ser evaluadas mediante imágenes de las plantas afectadas (Minervini et al., 2016). Además, en situaciones de estrés, se observa una reducción en los colores asociados a las bandas RGB (rojo, verde y azul, en inglés), lo cual puede ser percibido y capturado mediante una cámara fotográfica (Li et al., 2020; Zhu et al., 2020).
Por lo tanto, la aplicación del análisis de imágenes puede contribuir al estudio de los efectos del estrés en las plantas. En este estudio, se analizaron los efectos del estrés en Lemna gibba y Azolla filiculoides causados por antibióticos ampliamente utilizados en la población, con el objetivo de determinar las concentraciones que estas especies pueden tolerar o que las afectan.
Materiales y métodos
Diseño de investigación
Para analizar los efectos del estrés causado por los antibióticos en las plantas Lemna gibba y Azolla filiculoides, se utilizó un diseño completo aleatorizado de un factor. Se seleccionaron cuatro concentraciones (0, 2.5, 5, 7.5 mg/L) de antibióticos, que incluyeron azitromicina, ciprofloxacina, amoxicilina, cefalexina, ampicilina y clindamicina. Cada concentración se replicó tres veces, lo que resultó en un total de 12 unidades experimentales por especie y un total de 24 unidades experimentales en total. La asignación de las unidades experimentales en el área de estudio se realizó de manera aleatoria (Singh et al., 2018).
Cultivo y desarrollo de las macrófitas
La especie Azolla filiculoides se colectó del riachuelo del centro poblado de Jayllihuaya - Puno, mientras que Lemna gibba se colectó en el Malecón ecoturístico de Puno. Ambas especies fueron cultivadas en un sistema hidropónico en el invernadero de la Oficina de Gestión Ambiental de la Universidad Nacional del Altiplano-Puno durante un período de seis meses para permitir su adaptación a las condiciones de laboratorio (Garcia-Rodríguez et al., 2015). En el caso de Azolla filiculoides, se redujo la concentración de nitrógeno en el medio de cultivo, ya que esta especie tiene la capacidad de fijar su propio nitrógeno a través de la simbiosis que establece con bacterias fijadoras de nitrógeno (Taghi ganji et al., 2005).
La solución madre de antibióticos se diluyó en agua y se agregó la concentración requerida en cada unidad experimental, mezclándola con el medio de cultivo hidropónico. En cada unidad experimental se añadieron 2 gramos de Azolla y Lemna, respectivamente (Garcia-Rodríguez et al., 2015). El ensayo se llevó a cabo a una temperatura promedio de 23 °C, con un fotoperiodo de 12 horas de luz y 12 horas de oscuridad. La duración total del estudio fue de siete días. Al finalizar este período, se realizaron las mediciones de biomasa húmeda. A partir de estos datos de biomasa, se calculó el ratio de crecimiento relativo (RCR) utilizando la siguiente fórmula:
Donde:
Donde: Bfinal es la biomasa final, Binicial es la biomasa inicial y N es el número de días (7días) (Kadir et al., 2020).
Análisis de imágenes
Se tomaron fotografías diarias de cada unidad experimental utilizando una cámara Canon EOS Rebel T100 - 4000D, con el objetivo de evaluar características fenotípicas como la forma, tamaño y color. La captura de imágenes se llevó a cabo durante una semana, bajo condiciones de luz natural y con un fondo negro. Se utilizó una regla milimétrica como referencia para calibrar la escala y tener una referencia del área evaluada.
El análisis de imágenes se llevó a cabo mediante la aplicación de algoritmos (Medina et al., 2010; Minervini et al., 2016), utilizando el software libre ImageJ 1.50b, en un equipo con sistema operativo Windows 10 Home de 64 bits y un procesador Intel(R) Core (TM) i7-7500U CPU @ 2.70GHz 2.90 GHz. Las variables obtenidas durante el análisis incluyeron el área foliar (cm2), las bandas RGB y los niveles de clorofila (Riccardi et al., 2014).
Durante el análisis, el área de la planta se determinó mediante la conversión de la imagen en una imagen de 8 bits (Figura 1). Además, las imágenes originales de 24 bits se filtraron en las bandas roja, verde y azul, y se calcularon los valores medios de R, G y B para cada imagen de núcleo. Estos valores se utilizaron para estimar la concentración de clorofila en cada unidad experimental (Ali et al., 2012; Riccardi et al., 2014). La ecuación utilizada para determinar la concentración de clorofila en las hojas a partir de las imágenes es la siguiente: Clorofila = (R - B)/(R + B), desarrollada por Kawashima y Nakatani en 1998 (Riccardi et al., 2014).
Análisis estadístico
Para analizar la biomasa en Azolla y Lemna, se utilizó un análisis de varianza (ANOVA) de una vía después de verificar los supuestos necesarios. En cuanto al área de cobertura en Azolla y Lemna, se aplicó un ANOVA de dos vías para evaluar el efecto de las concentraciones y los días de estudio. Para analizar el efecto de las concentraciones de antibióticos sobre la clorofila, se utilizó el test de Kruskal-Wallis debido a que no se cumplieron los supuestos requeridos. Todos estos análisis se llevaron a cabo utilizando el software libre R Studio.
Resultados
Efecto de los antibióticos en la biomasa y el RCR
El análisis de varianza (ANOVA) reveló un efecto significativo de las concentraciones de antibióticos testeados en la biomasa de A. filiculoides (p=0.043<0.05) (Figura 2). Se observó una disminución en el porcentaje de biomasa, que varió entre el 13% y el 37%, y aumentó en función de las concentraciones probadas.
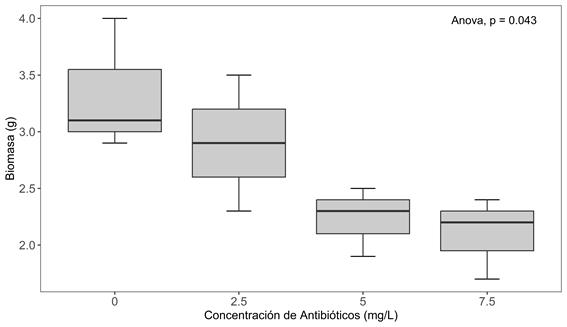
Figura 2 Diagrama de caja y bigotes de la biomasa de Azolla en función de las concentraciones de antibióticos.
El test de comparación múltiple de Dunnet, muestra que existe diferencia entre el grupo control y la mayor concetración (7.5 mg/L) (Tabla 1).
Tabla 1 Resultado del test de Dunnet de la biomasa en las concentraciones de antibióticos en plantas.
| Azolla filiculoides | ||||
|---|---|---|---|---|
| Comparaciones | diff | lwr.ci | upr.ci | p-val |
| 2.5-0 | -0.433 | -1.566 | 0.699 | 0.580 |
| 5-0 | -1.100 | -2.232 | 0.032 | 0.056 |
| 7.5-0 | -1.233 | -2.366 | -0.101 | 0.034* |
Respecto a L. gibba el ANOVA indica que la biomasa no es afectada por las concentraciones de antibióticos testeados (p=0.065>0.05). No obstante, se observa una leve disminución de la biomasa en función de las concentraciones usadas en el estudio, variando desde 22.5 a 34.2%.
Por otro lado, el RCR muestra un mayor efecto en la inhibición de crecimiento en Azolla que en Lemna, el cual se acentúa a medida que la concentración del antibiótico se incrementa (Figura 3).
Análisis de imágenes
El análisis de varianza de dos factores reveló que la concentración de antibióticos no tuvo un efecto significativo en el porcentaje del área de cobertura de Azolla (p-valor = 0.358), mientras que en Lemna sí fue significativo (p-valor = 0.00161). Por otro lado, se observó que los días de estudio tuvieron una influencia significativa en el porcentaje del área de cobertura en ambas especies (Tabla 2).
Tabla 2 ANOVA para analizar la influencia de los antibióticos en la biomasa de las especies de plantas Azolla Y Lemna.
| Porcentaje del área de cobertura en Azolla | Porcentaje del área de cobertura en Lemna | |||||||
|---|---|---|---|---|---|---|---|---|
| GL | F-valor | P - valor | Sig | GL | F-valor | P valor | Sig | |
| Concentración | 3 | 1.096 | 0.358 | 3 | 5.787 | 0.00161 | ** | |
| Dia | 6 | 52.210 | <2e-16 | *** | 6 | 17.774 | 2.1e-11 | *** |
| Concentración:Dia | 18 | 0.630 | 0.860 | 18 | 0.199 | 0.99978 | ||
| Residuales | 56 | 56 | ||||||
En cuanto al porcentaje de área de cobertura de Azolla y Lemna, el análisis de Duncan reveló diferencias significativas entre los días (con letras iguales para medias similares). Estas diferencias se pueden visualizar claramente en los diagramas de caja y bigotes correspondientes a cada día (Figura 4). Además, se observa que los efectos negativos son más pronunciados en los primeros días, lo que se refleja en una inhibición del crecimiento. Sin embargo, en los días posteriores se observa un incremento en el área de cobertura en ambas especies.

Figura 4 Incremento del % de cobertura de área durante los días experimentales (7). A) Azolla y B) Lemna.
Mientras que, en el caso de la clorofila, se aplicó el análisis de Kruskal-Wallis, cuyo resultado indica que la concentración de antibióticos no existe una influencia significativa sobre este parámetro, con p-valores de 0.8162 y 0.6856 para Azolla y Lemna respectivamente.
Discusión
Efecto de los antibióticos en la biomasa y el RCR
Las concentraciones testeadas mostraron efectos negativos en la biomasa de Azolla filiculoides (13-37%), así como el RCR; mientras que, en Lemna el impacto es menor (22.5-34.2%). Esta alteración se incrementa en función de la concentración de antibióticos en el medio de cultivo. Del mismo modo Singh et al. (2018) realizaron un estudio con una especie Spirodela polyrhiza, en el que analizaron los efectos de 4 concentraciones de amoxicilina (0.0001, 0.01, 0.1 y 1 mg/L), y hallaron que la amoxicilina tuvo efectos tóxicos a mayores concentraciones, influenciando principalmente en la disminución de la biomasa. Asimismo, en otro estudio con Lemna minuta en el que se expuso a ofloxacino en concentraciones de un rango de 0.01-1.0 mg/L causó la disminución de la biomasa entre un 4.8 y 41.3%, y en relación a la RCR los resultados son similares, observándose una disminución en comparación al grupo control.
Sin embargo, según Bianchi et al. (2020), se encontró que concentraciones bajas (1 μg/L) de un antibiótico tuvo efectos positivos en la biomasa de Lemna, incluso incrementando la biomasa, y que en Azolla tampoco tuvo efectos significativos tanto en la biomasa como en el RCR. Esta diferencia podría atribuirse a la tolerancia de la especie a valores bajos de antibióticos, y como mecanismo de respuesta al estrés, la planta incrementa su biomasa y RCR Por otro lado, concentraciones más altas, como las utilizadas en este estudio, tienen efectos más pronunciados, lo cual es respaldado por otros estudios (Baciak et al., 2016; Drobniewska et al., 2017; Hájková et al., 2019; Hu et al., 2019; Iatrou et al., 2017; Pomati et al., 2004; Singh et al., 2018) (Tabla 3). Por lo tanto, las concentraciones evaluadas en este estudio tienen un impacto en la disminución de la biomasa, pero no causan efectos perjudiciales en la planta.
Tabla 3 Efecto de antibióticos en la biomasa de las plantas
| Compuesto | Concentración | Especie | Efecto en biomasa | Autor |
|---|---|---|---|---|
| Eritromicina | 1 mg/L | Lemna minor | Disminución de la biomasa en 20% | (Pomati et al., 2004) |
| Levofloxacino | 1 µg/L | Lemna minor y Azolla filiculoides | Incremento de la biomasa en 20% | (Bianchi et al., 2020) |
| Oxitetraciclina | 3,6,9,10,12,15, 50 y 100 mg/L | Lemna minor | Disminución de la biomasa en función del incremento de la concentración | (Pro et al., 2003) |
| Sulfametoxazol | 500 µg/L | Lemna minor | Disminución de la biomasa | (Grenni et al., 2019) |
| Amoxicilina, enrofloxacina y oxitetraciclina | 2 µg/L 2 µg/L 1 µg/L | Lemna minor | Disminución de la biomasa | |
| Levofloxacina y sulfametoxazol | 7, 14, 21, 28, 35 | Lemna gibba | Disminución de la biomasa | (Brain, Johnson, Richards, Hanson, et al., 2004) |
| Lomefloxacina, sulfametoxazol, y clortetraciclina | 38 µg/L, 37 µg/L, 114 µg/L | Lemna gibba | Disminución de la biomasa | (Brain, Johnson, Richards, Sanderson, et al., 2004) |
La especie más afectada en este estudio fue Azolla filiculoides, lo cual es comprensible debido a su simbiosis con bacterias fijadoras de nitrógeno como Anabaena y Arthobacter (Carrapico, 2014; Forni et al., 2002; Taghi ganji et al., 2005), las cuales le confieren capacidad de tolerancia y eliminación de compuestos tóxicos (Bianchi et al., 2020; Forni et al., 2002). Sin embargo, a concentraciones elevadas de antibióticos, Azolla se ve directamente afectada, lo que también repercute en la inhibición del aumento de su biomasa. De manera similar, en un estudio en el que se probaron elevadas concentraciones de sulfadimetoxina (50, 150, 300 y 450 mg/L), este antibiótico afectó la tasa de crecimiento (como rendimiento de biomasa por semana), la fijación de N2 y la frecuencia de heterocistos. A pesar de esto, las plantas fueron capaces de sobrevivir y seguir eliminando el antibiótico, aunque en menor proporción (Forni et al., 2002). En un estudio adicional donde se expuso a Azolla a Ciprofloxacino, se observó que este antibiótico tuvo un impacto negativo en la fotosíntesis y la actividad de la nitrogenasa, además de alterar el perfil aminoacídico de la planta, lo que resultó en una disminución del contenido de nitrógeno celular (Gomes et al., 2018).
Área por concentración y día
En relación al porcentaje del área de cobertura de Azolla y Lemna, se observaron diferencias significativas a lo largo de los días del experimento. Esto indica que los efectos de inhibición y disminución del área de crecimiento son más pronunciados en los primeros días. Sin embargo, a medida que las especies se adaptan fisiológicamente, se observa un aumento en el área de cobertura, lo que demuestra la capacidad de tolerancia de estas especies a los antibióticos.
Además, otro estudio encontró que, durante los primeros días, tanto Lemna como Azolla absorbieron una mayor cantidad de antibióticos a través de su estructura, para luego estabilizarse. Este proceso tiene un impacto directo en el desarrollo y crecimiento de las plantas (Bianchi et al., 2020). Adicionalmente, se realizó otro estudio en el que se expuso a Azolla a diferentes concentraciones (0.1, 1, 10 y 100 mg/L) de un fármaco llamado diclofenaco. Los resultados revelaron que esta especie no solo fue afectada por las concentraciones más altas del fármaco, sino también por el tiempo de exposición. Esto indica que tanto la concentración como la duración de la exposición son factores importantes que influyen en los efectos negativos observados en Azolla (Vannini et al., 2018). Sin embargo, en ambos estudios se observó que las especies evaluadas, tanto Azolla como Lemna, fueron capaces de sobrevivir y eliminar los compuestos del medio, especialmente en el caso de bajas concentraciones de los fármacos estudiados (Bianchi et al., 2020; Lu & Lu, 2019). Por lo que, su capacidad de supervivencia y capacidad de eliminar los contaminantes las convierten en candidatas potenciales para su uso en aplicaciones de fitorremediación de aguas contaminadas con residuos de antibióticos.
Clorofila por imágenes
Los resultados del análisis de imágenes revelaron que las concentraciones de antibióticos no tuvieron un impacto significativo en la concentración de clorofila. Esto concuerda con otro estudio que examinó los efectos del fármaco acetaminofeno en diversas concentraciones (22.5, 45.0 y 90.0 mg/L) y tampoco encontró influencia en la concentración de clorofila (Nunes et al., 2014). Aunque, otros estudios indican que los antibióticos ejercen una influencia negativa en la concentración de clorofila (Gomes et al., 2017; Hu et al., 2019; Singh et al., 2018; Sree et al., 2015). Además, es importante considerar que estos resultados pueden estar influenciados por el proceso de obtención de datos en sí. En el caso de estas macrófitas flotantes, como Azolla y Lemna, puede ocurrir el solapamiento de las hojas, lo que dificulta la captura de imágenes de todas las hojas presentes. Por lo tanto, es crucial realizar un análisis cuidadoso de la expansión del área y el cálculo de la concentración de clorofila para garantizar resultados precisos (Costa et al., 2019).
Conclusión
Las concentraciones de antibióticos afectan negativamente a la biomasa y al ratio de crecimiento, siendo en mayor proporción en Azolla que en Lemna. Adicionalmente, el porcentaje de área de la cobertura de Azolla y Lemna, muestran que el efecto negativo es más acentuado en los primeros días que en los últimos, lo que demuestra que después de un periodo de adaptación, estas plantas continúan desarrollándose. Respecto a clorofila, en este estudio no se demostró efectos sobre la clorofila de Azolla y Lemna. Lo que demuestra que, estas especies son capaces de tolerar y sobrevivir a estos contaminantes, siendo candidatas adecuadas para procesos de fitorremediación.












 uBio
uBio 




