Introducción
Los compuestos bioactivos de origen vegetal han ganado popularidad recientemente, en gran medida debido a sus numerosas propiedades nutracéuticas y saludables, y como tal, ha aumentado la demanda de dichos alimentos por parte de los consumidores. Entre estos alimentos se encuentra la quinua (Chenopodium quinoa Willd.), que es un pseudocereal perteneciente a la familia Chenopodiaceae (Motta et al., 2017). Los granos de quinua tienen un alto contenido de proteínas de buena calidad y un excelente equilibrio de aminoácidos, también son aptos para el consumo de pacientes celiacos debido a que no contienen gluten (Filho et al., 2017).
La quinua ha ganado cada vez más atención gracias al contenido nutricional y su abundancia de fitoquímicos (fenólicos, carotenoides, flavonoides, etc.) que son muy beneficios para la salud (Al-Qabba et al., 2020). Este cultivo andino tiene una producción global de 1,580,920 toneladas, siendo Perú principalmente el que produce 86,011 toneladas de quinua cultivada en 64,660 ha, seguido de Bolivia con 70,763 toneladas (51,605 ha) y Ecuador con 21,460 toneladas (18,560 ha) (FAOSTAT, 2022).
Este pseudocereal es una rica fuente de ingredientes funcionales, como polifenoles, flavonoides y péptidos activos, lo que ha aumentado las perspectivas de aplicación de este grano y sus productos en las industrias alimentaria y farmacéutica (Ren et al., 2023). La creciente evidencia in vivo e in vitro sugiere que los fitoquímicos derivados de la quinua pueden tener numerosos beneficios potenciales para la salud (Cao et al., 2020). Además, el consumo a largo plazo de quinua premium sin gluten contribuye a la prevención y el tratamiento de diversas enfermedades, entre ellas la inflamación, la obesidad, la diabetes, el cáncer, las enfermedades cardiovasculares y la celiaquía (Stikić et al., 2020).
Sin embargo, las semillas de quinua contienen una serie de factores antinutricionales, incluidas las saponinas y el ácido fítico. Los niveles de saponina en las variedades de quinua oscilan entre 0,01% y 4,65%, y un promedio de 0,65% (Demir & Bilgiçli, 2020). Consisten en una aglicona o esteroide triterpenoide y una o más cadenas de azúcar, que tienen un sabor amargo. Además, el ácido fítico de la quinua puede unirse a minerales, proteínas y almidón, disminuyendo así su absorción, digestión, solubilidad y funcionalidad (Pilco-Quesada et al., 2020). Estos factores exacerban la amplia aplicación de la quinua en la industria alimentaria. Por ello, muchos investigadores y organizaciones de salud se han concentrado recientemente en disminuir los factores antinutricionales de la quinua, mejorar la biodisponibilidad nutricional y la calidad organoléptica (Graziano et al., 2022). Debido a la baja temperatura de procesamiento, la operación simple, la seguridad en el procesamiento de alimentos y la eficiencia ecológica, la germinación se considera uno de los métodos de procesamiento de alimentos no térmicos más efectivos para mejorar las propiedades generales de la quinua (Wu et al., 2020).
Durante la germinación de quinua ocurren cambios fisiológicos y morfológicos, debido a que las semillas secas estáticas absorben agua y el sistema de enzimas biológicas naturales dentro de las semillas se activa para descomponer los nutrientes primarios, como almidón, proteínas y lípidos, aumentando las concentraciones de ciertas sustancias activas (Thakur et al., 2021). La germinación de quinua puede mejorar eficazmente el contenido de fibra dietética, almidón resistente, capacidad antioxidante, aminoácidos y la biodisponibilidad de proteínas, así como sus propiedades de procesamiento de alimentos y cualidades organolépticas (Joy Ujiroghene et al., 2019). La conservación de componentes nutricionales como los ácidos fenólicos y los flavonoides en la cubierta de la semilla se ve facilitada por el hecho de que el proceso de germinación no destruye la cubierta de la semilla. Dadas estas ventajas, la germinación se ha utilizado para tratar arroz integral, arroz rojo, trigo sarraceno, avena, cebada, soja, frijol mungo, maíz y quinua, entre otros cultivos, y ha surgido como una técnica de procesamiento de alimentos muy prometedora (Liu et al., 2022). Las investigaciones actuales sobre la germinación de la quinua han ido atrayendo el interés de un número cada vez mayor de investigadores. Esta tecnología se puede utilizar para suavizar la estructura del tejido de la quinua y mejorar sus propiedades nutricionales y funcionales, ampliando así el uso de la quinua en el desarrollo de alimentos (Yañez-Yazlle et al., 2021).
La presente revisión tiene como objetivo proporcionar una información actualizada, sobre la influencia de la germinación de quinua en las propiedades funcionales y el contenido de compuestos bioactivos. Para ello, se empleó la metodología PRISMA (Urrútia & Bonfill, 2010) el cual contribuyo a la recopilación de artículos científicos de las bases de datos (Scopus, Scielo y Science Direct) y para la visualización de redes y conexiones se empleó la herramienta VOSviewer.
Materiales y métodos
Tipo de investigación
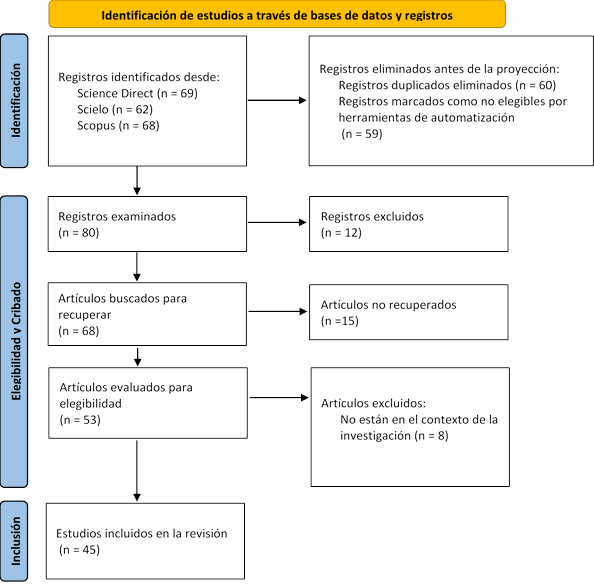
El estudio de revisión sistemática se llevó a cabo en diciembre del año 2023 bajo las directrices de la declaración PRISMA para una correcta revisión sistemática (Figura1).
Diseño de investigación
Las principales fuentes y bases de datos consideradas en la revisión sistemática fueron: Science Direct, Scielo y Scopus. Para determinar las palabras claves se empleó la estrategia PIO (Población, Intervención, Outputs), el cual permitió identificar los términos de búsqueda clave.
Población: La población de estudio fue el efecto de la germinación de quinua sobre las propiedades nutricionales, biológicas y funcionales.
Intervención: Se investigaron los compuestos fenólicos, capacidad antioxidante, propiedades nutraceúticas y factores anti nutricionales de la quinua germinada.
Outputs: Valorización nutricional, biológica y funcional de la quinua germinada en la industria alimentaria.
Tabla 1 Aplicación de la estrategia PIO, para determinar las ecuaciones de búsqueda
| PIO Category | Keywords |
| Population | “Chenopodium quinoa Willd.” OR “Germinated quinoa” OR “Bioactive compounds” |
| Intervention | “Phenolic compounds” OR “Antioxidant capacity” OR “Nutraceutical properties” OR “Anti nutritional factors” |
| Outputs | “Food industry” OR “Nutritional, biological and functional valorization” OR “Phytic acid and saponins” |
Antes de proceder a la selección de artículos se definieron los criterios de inclusión y exclusión.
Población de estudio
La combinación de términos ((Chenopodium quinoa Willd OR Germinated quinoa OR Bioactive compounds) AND (Phenolic compounds OR Antioxidant capacity OR Nutraceutical properties OR Anti nutritional factors) AND (Food industry OR Nutritional, biological and functional valorization OR Phytic acid and saponins)), permitió seleccionar información de 45 artículos científicos encontrados en la base de datos (Science Direct, Scielo y Scopus), las cuales contribuyeron a la fundamentación y sustento teórico.
Resultados y discusiones
Análisis cualitativo y extracción de datos
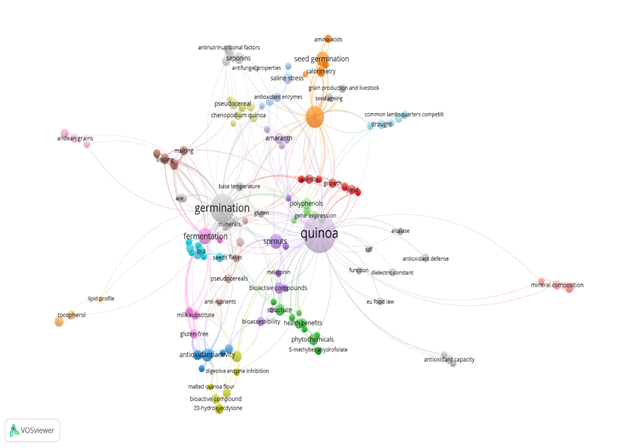
La ecuación de búsqueda permitió encontrar un total de 199 documentos. Una vez identificadas todas las publicaciones, se realizó una preselección considerando el tema «Efecto de la germinación de quinua (Chenopodium quinoa Willd.) sobre las propiedades nutricionales, biológicas y funcionales». Todos los resultados de búsqueda se exportaron en formato CSV y se subieron al programa VOSviewer, el cual permitió visualizar las temáticas de estudio.
El análisis por palabras clave permitió establecer las áreas temáticas de las investigaciones (Figura 2). Con ello fue posible identificar las propiedades nutricionales, biológicas y funcionales de la quinua germinada con gran potencial en la industria alimentaria.
Cambios fisiológicos y bioquímicos durante la germinación de la quinua
La composición aproximada y el valor nutricional de las semillas de quinua cambian sustancialmente, después de la germinación en diversas condiciones. Los granos crudos de quinua contienen pocas enzimas activas y la mayoría están unidas (Suárez-Estrella et al., 2020). Cuando la viabilidad celular de los granos de quinua se restablece después de la germinación, la hidrolasa se activa de manera memorable y una variedad de nutrientes se descomponen y transforman mediante una reacción enzimática (Darwish et al., 2021). El transporte y distribución de nutrientes entre el embrión y la radícula finalmente enriquecen la composición química de los granos de quinua (Bhinder et al., 2021).
Proteínas y aminoácidos
Durante la germinación ocurren dos procesos de proteólisis, así como nueva síntesis de proteínas; como resultado, el contenido de proteína de la quinua fluctúa (Aguilar et al., 2019). Según informes, el contenido total de proteínas de la quinua aumentó en un rango de 5,5% a 170,83%, 72 h después de la germinación (Pilco-Quesada et al., 2020). También, se reportaron que las diferentes condiciones de germinación tienen cierto efecto sobre el nivel de proteína de la quinua (Paucar-Menacho et al., 2018). Los factores como el agotamiento de los carbohidratos provocado por la respiración celular, la producción y movilización de nutrientes durante la germinación, son los responsables del aumento en el contenido de proteínas después de las 72 h de germinación. Teóricamente, el contenido absoluto de proteína de la quinua no cambiará si se germina en agua pura sin la adición de fuentes de nitrógeno, como es la práctica habitual (Xu et al., 2019). En consecuencia, el aumento del contenido de proteínas detectables en la quinua puede ser un fenómeno obvio. Darwish et al., también demostraron que el contenido de proteína de la quinua disminuyó significativamente de 15,31% a 13,50% después de 72 h de germinación (Darwish et al., 2021); esta disminución se puede atribuir a la disolución del nitrógeno soluble, la degradación de las proteínas en péptidos y aminoácidos más pequeños y la síntesis de nuevas proteínas. La germinación es un proceso complejo de transformación de materiales en el que las principales fracciones proteicas de la quinua con pesos moleculares superiores a 24 kDa se someten a hidrólisis en presencia de enzimas relevantes, incrementando la cantidad de aminoácidos libres en la quinua (Obaroakpo et al., 2020). En general, la germinación es ventajosa para mejorar la digestibilidad de las proteínas y el valor nutricional de la quinua (Kumari et al., 2023).
Carbohidrato
El almidón de quinua exhibe una estabilidad de congelación y descongelación relativamente alta, una buena capacidad de absorción de agua, baja coagulación, fuerte resistencia al envejecimiento y buena resistencia al almacenamiento a temperatura ambiente; en consecuencia, tiene un amplio potencial de aplicación en la industria alimentaria, como por ejemplo en la elaboración de salsas, sopas, harinas y otros alimentos (Guo et al., 2022).
Durante la germinación, el almidón total, la amilosa y la amilopectina presentes en el endospermo de la quinua se transforman gradualmente de un estado insoluble a uno disuelto. Luego son descompuestos por hidrolasas activadas (α-amilasa y β-amilasa) para sufrir respiración y anabolismo de las semillas, lo que resulta en una disminución significativa en el contenido total de almidón (Xing et al., 2021). Las dextrinas de pequeño peso molecular producidas por el almidón de quinua se hidrolizan aún más a maltosa y se convierten en glucosa con la ayuda de α-glucosidasa, lo que facilita un aumento en el contenido de azúcar reductor. Estos azúcares de pequeño peso molecular sirven como fuente de energía para estimular el desarrollo embrionario (Vicente-Sánchez et al., 2023).
La investigación realizada por Suárez-Estrella et al., (2020), evidencio que el contenido de almidón de la quinua disminuyó de 60,6% a 50,7% durante las 0-72 h de germinación. Además, la actividad de la α-amilasa de las semillas de quinua aumentó continuamente dentro de las 48 h posteriores a la germinación, también en ese tiempo la actividad de la α-amilasa alcanzó casi 27 veces la de las semillas no tratadas, lo que indica una migración progresiva de enzimas desde el embrión al perispermo almidonado (Prasad & Sahu, 2023). El remojo aumentó moderadamente las actividades de la β-amilasa y las proteasas. Sin embargo, la actividad de la β-amilasa no cambió significativamente durante el proceso de germinación posterior, mientras que la actividad de las proteasas aumentó significativamente después de 24 h de germinación. La mayor parte del aumento en la actividad de la β-amilasa durante la etapa de remojo se atribuyó a las proteasas intracelulares que liberaban algo de β-amilasa libre (Zhang et al., 2022). En otro estudio, se confirmó que el contenido total de almidón disminuyó mientras que el contenido de azúcares, como fructosa y glucosa, aumentó durante la germinación de quinua (Guardianelli et al., 2022).
La fibra alimentaria, un polisacárido resistente a la digestión por las enzimas digestivas humanas, es extremadamente importante porque previene el estreñimiento, ayuda a la digestión y aumenta la diversidad de los microbios intestinales (Venlet et al., 2021). La quinua es rica en fibra dietética, con un contenido total de aproximadamente 7-10% (de estos, 1,3-6,1% comprende fibra dietética soluble), siendo mayor que el de la mayoría de los cereales (Ren et al., 2023). Cada vez hay más evidencia que sugiere que el contenido de fibra de la quinua podría aumentar mediante la germinación. Según un estudio de Darwish et al., el contenido de fibra dietética de la quinua aumentó significativamente del 10,77% al 12,54% después de 72 h de germinación (Darwish et al., 2021). Los cambios en el contenido de fibra dietética durante la germinación pueden ser atribuibles a la pérdida de otras sustancias nutritivas (Pilco-Quesada et al., 2020).
Lípidos y vitamina E
La quinua es una semilla oleaginosa alternativa rica en lípidos, contiene más grasa que el trigo y el arroz, su contenido de grasa varia del 5,5 al 7,4 % y tiene un rendimiento de aceite del 2,0 al 9,5 % (Filho et al., 2017). Los lípidos de la quinua se componen principalmente de ácidos grasos insaturados, que constituyen el 88% del total de lípidos. Estos ácidos grasos incluyen el ácido linoleico (49,0-56,4%), el ácido oleico (19,7-29,5%) y el ácido linolénico (8,7-11,7%). Además, los ácidos grasos saturados de la quinua están compuestos predominantemente de ácido palmítico, que representa aproximadamente el 10% del contenido total de ácidos grasos (Ren et al., 2023).
Según informes publicados, la germinación podría reducir el contenido de lípidos de la quinua, donde aproximadamente el 25% de los lípidos fueron hidrolizados para promover la actividad respiratoria de la semilla y satisfacer la demanda energética (Pachari Vera et al., 2019). También se evidencio que el contenido de lípidos crudos de la quinua disminuye gradualmente con la variación de tiempo (72 h) y temperatura (22°C) de germinación. Pilco-Quesada et al., (2020), encontraron que el contenido de grasa cruda de la quinua disminuyó de 15,2% a 7,6%. Esto se debe a que durante el proceso de germinación de las semillas, los lípidos se consideran una importante fuente de energía (Balakrishnan & Schneider, 2023). Cuando el suministro de energía dentro de la semilla es insuficiente, la lipasa cataliza la descomposición de los lípidos para complementar la energía necesaria para la germinación de las semillas. En la vía metabólica bioquímica de las semillas, el glicerol y los ácidos grasos derivados de la descomposición de las grasas son sustancias esenciales (Song & Peng, 2023).
Por otro lado, la vitamina E se considera uno de los antioxidantes naturales más importantes que pueden prevenir la oxidación de lípidos en el tejido vegetal. La vitamina E también participa en la regulación de la señalización celular y la expresión genética (Oliveira et al., 2022). Es una vitamina liposoluble esencial para el cuerpo humano que existe en ocho formas diferentes, incluidos cuatro tocoferoles (α-T, β-T, γ-T y δ-T) y cuatro tocotrienoles (α-T3, β- T3, γ-T3 y δ-T3) (Filho et al., 2017). El contenido de vitamina E de la quinua es mayor que el trigo sarraceno, el mijo y casi toda ella se compone de tocoferoles, particularmente α-T y γ-T, lo que la convierte en una excelente fuente de vitamina E (De-La-Cruz-Yoshiura et al., 2023). Según los informes, la quinua contiene 34,49-77,73 μg/g de vitamina E, de los cuales 8,03-16,02 μg/g están compuestos de α-tocoferol, que protege a las células del daño oxidativo y 25,89-55,32 μg/g están compuestos de γ-tocoferol, lo que reduce el riesgo de enfermedades cardiovasculares. Curiosamente, el α-tocoferol es la única forma de tocoferol que se encuentra en la sangre y la ingesta diaria recomendada es de 15 mg (Tang et al., 2016). Se cree que los ricos lípidos y ácidos grasos insaturados de las semillas de quinua explican su alto contenido de tocoferol. Actualmente, estudios han confirmado que los contenidos de tocoferol total, α-tocoferol, β-tocoferol y δ-tocoferol en la quinua aumentan con la progresión de la germinación (0-72 h), mientras que el contenido de γ-tocoferol disminuye (Pachari Vera et al., 2019). Cabe resaltar que existen diferencias en los cambios de tocoferoles monoméricos entre variedades de quinua debido a la presencia de distintos metabolitos secundarios (Vilcacundo & Hernández-Ledesma, 2017). La germinación representa un método eficaz para aumentar el nivel de vitaminas liposolubles en la quinua, debido a que regula la expresión de genes relacionados con la biosíntesis y actividades enzimáticas (Ceyhun Sezgin & Sanlier, 2019).
Cambios de componentes funcionales durante la germinación de la quinua
La quinua contiene polifenoles, flavonoides, saponinas y otros metabolitos secundarios, todos los cuales tienen poderosos efectos antioxidantes, antitumorales, antibacterianas y antihipertensivas (Wang et al., 2022). La germinación se considera un método rentable y eficiente para aumentar el valor nutricional, las propiedades antioxidantes y los ingredientes activos, debido a que afecta tanto la estructura de la semilla como la composición química de la quinua (Seal et al., 2021). Mediante el enriquecimiento direccional de ciertos componentes funcionales y la reducción de la mala calidad de la quinua al mismo tiempo, será posible proporcionar mejores materias primas para la aplicación de la quinua en el sector alimentario, lo que será de vital importancia para promover la salud humana y reducir el riesgo de diversas enfermedades (Abbasi et al., 2022). La Tabla 2 enumera los principales constituyentes funcionales de la quinua germinada.
Tabla 2 Contenido de los principales componentes bioactivos de la quinua germinada.
| Componente funcional | Tipo quinua | Tiempo de germinación | Contenido | Unidad | Principales compuestos fenólicos | Referencias | |
|---|---|---|---|---|---|---|---|
| Antes de la germinación | Después de la germinación | ||||||
| Polifenoles totales | Miltop Quinua Blanca | 24-96h | 7.09 | 7.3-8.56 | mg EAG/g | Gallic acid, protocatechuic acid, vanillic acid, p-hydroxybenzoic acid, trans-ferulic acid, caffeic acid, sinapic acid, p-coumaric acid, catechin, epicatechin, rutin, quercetin, kaempferol | (Bhinder et al., 2021) |
| Chullpi | 24-72 h | 2319.1 | 2575.1-3925.6 | μg/g DW | Protocatechuic acid, vanillic acid derivative, quercetin glycosides, kaempferol glycosides, vanillic acid, caffeic acid derivative | (Pilco-Quesada et al., 2020) | |
| INIA Salcedo | 48 h | 59.9 | 87.6 | mg GAE/100 g | N.D. | (Aguilar et al., 2019) | |
| Pasankalla Roja | 48 h | 97.5 | 145.9 | mg GAE/100 g | N.D. | (Aguilar et al., 2019) | |
| Negra Collana | 48 h | 84.4 | 118.7 | mg GAE/100 g | p-hydroxybenzoic acid, vanillic acid, p-coumaric acid, ferulic acid, quercetin, kaempferol | (Aguilar et al., 2019) | |
| Red quinoa (Chenopodium quinoa Will.) | 3-9 days | 105.16 | 251.23-293.35 | mg GAE/100 g | Protocatechuic acid, p-hydroxybenzoic acid, ferulic acid, sinapic acid, rutin, rosmarinic acid, quercetin, kaempferol | (Al-Qabba et al., 2020) | |
| Yellow quinoa (Chenopodium quinoa Will.) | 3-9 days | 112.42 | 190.43-259.02 | mg GAE/100 g | N.D. | (Al-Qabba et al., 2020) | |
| Mengli 1 (Inner Mongolia Province, China) | 48 h | 217.4 | 232.3 | mg GAE/100 g | Kempferol, aempferol-3-glucorhamnoside, Kaempferol-3-O-rutinoside, epicatechin, luteolin, morin, quercetin, 7-methoxycoumarin, 7-hydroxycoumarin, cinnamic acid, methyl vanillate, ferulic acid, isoferulic acid, artemisimic acid, gentisic acid, azelaic acid, protocatechuic acid, dihydroartemisimic acid, lonicerin, 5-hydroxy-1-tetralone, abscisic acid, herbacetin, hydroxyecdysone β, p-hydroxy-cinnamic acid | (Joy Ujiroghene et al., 2019) | |
| Polifenol libre | Miltop White quinoa | 24-96 h | 2.39 | 2.32-3.09 | mg GAE/g | N.D. | (Bhinder et al., 2021) |
| Miltop Black quinoa | 24-96 h | 2.29 | 2.37-3.54 | mg GAE/g | N.D. | (Bhinder et al., 2021) | |
| Polifenol unido | Miltop White quinoa | 24-96 h | 4.71 | 4.62-5.38 | mg GAE/g | N.D. | (Bhinder et al., 2021) |
| Miltop Black quinoa | 24-96 h | 5.54 | 5.81-6.49 | mg GAE/g | N.D. | (Bhinder et al., 2021) | |
| Flavonoides totales | Pasankalla Roja | 48 h | 83.7 | 98.8 | mg QE/100 g | N.D. | (Aguilar et al., 2019) |
| Negra Collana | 48 h | 88.3 | 143.6 | mg QE/100 g | N.D. | (Aguilar et al., 2019) | |
| Red quinoa (Chenopodium quinoa Will.) | 3-9 days | 7.05 | 9.59-13.17 | mg QE/100 g | N.D. | (Al-Qabba et al., 2020) | |
| Yellow quinoa (Chenopodium quinoa Will.) | 3-9 days | 9.04 | 19.24-24.36 | mg QE/100 g | N.D. | (Al-Qabba et al., 2020) | |
| GABA | Chenopodium quinoa Willd var. INIA-415 Pasankalla | 42 h | 22.41 | 17.97-122.32 | mg/100 g | N.D. | (Paucar-Menacho et al., 2018) |
| JQ-00003 | 24-72 h | ∼65 | 90∼135 | mg/100 g DW | N.D. | (Zhang et al., 2022) | |
| JQ-00125 | 24-72 h | ∼60 | 50∼95 | mg/100 g DW | N.D. | (Zhang et al., 2022) | |
| JQ-00145 | 24-72 h | ∼50 | 70∼110 | mg/100 g DW | N.D. | (Zhang et al., 2022) | |
| Saponina | Miltop White quinoa | 24-96 h | 1.63 | 0.93-1.36 | mg/g | N.D. | (Bhinder et al., 2021) |
| Miltop Black quinoa | 24-96 h | 2.42 | 1.01-1.76 | mg/g | N.D. | (Bhinder et al., 2021) | |
| Red quinoa (Chenopodium quinoa Will.) | 3-9 days | 6.53 | 0.93-6.1 | mg/g | N.D. | (Al-Qabba et al., 2020) | |
| Yellow quinoa (Chenopodium quinoa Will.) | 3-9 days | 6.1 | 0.5-3.52 | mg/g | N.D. | (Al-Qabba et al., 2020) | |
| White organic quinoa seeds (Quinua Real, Bolivia) | 72 h | ∼2.5 | ∼1.0 | g/100 g | N.D. | (Darwish et al., 2021) | |
| GABA: γ-Aminobutyric acid; GAE: gallic acid equivalence; RE: rutin equivalents; QE: quercetin equivalent; DW: dry weight; N.D: not detected. | |||||||
Polifenoles
Los polifenoles de la quinua, son una clase de antioxidantes con diversas actividades fisiológicas, estas se sintetizan durante el desarrollo normal de la planta, particularmente en respuesta al estrés (Serra et al., 2018). Los compuestos de ácido fenólico predominantes en la quinua son; ácido vanílico, ácido ferúlico, ácido p -cumárico, ácido salicílico, ácido benzoico y ácido verátrico, mientras que los compuestos flavonoides predominantes son quercetina, kaempferol, rutina, naringina y miricetina (Chaudhary et al., 2023). En pruebas de antioxidantes, el contenido fenólico total de varios tipos de quinua oscila entre 39,29 y 782,15 mg/100 g, lo que indica una potente capacidad de eliminación de radicales libres (Lopes et al., 2019).
Estudios recientes evidencian que una germinación moderada puede aumentar significativamente el contenido de polifenoles de la quinua, lo que puede atribuirse a la liberación de fenoles unidos y a la biosíntesis y transformación de novo que se produce durante la germinación (Chen et al., 2019).
La clave para mejorar significativamente el contenido fenólico y la capacidad antioxidante de las semillas de quinua es la regulación de las condiciones de germinación (Tabla 2). La observación de la germinación de diferentes variedades de quinua muestra que el tratamiento de germinación de 72 a 82 h es más propicio para el enriquecimiento de polifenoles, particularmente fenoles monoméricos como ácido p-cumárico, ácido vanílico, ácido ferúlico, ácido p-hidroxibenzoico, quercetina y catequina (Kibar et al., 2021). El contenido de polifenoles varía según las condiciones de germinación y las variedades de semilla, donde la quinua evidencio un mayor incremento de contenido de polifenoles en comparación con el trigo sarraceno y la cebada germinada (Jiménez et al., 2020).
Saponinas
El sabor amargo de las semillas y harina de quinua se debe a la presencia de las saponinas, siendo este compuesto susceptible a formar complejos insolubles con minerales como el hierro y el zinc, lo que reduce la biodisponibilidad de los minerales; a pesar de su amplia gama de bioactividades, incluidas antifúngicas, antiinflamatorias, anticancerígenas y diuréticas (Ding et al., 2021). Las saponinas de la quinua se encuentran predominantemente en el epicarpio como saponinas triterpenoides con una aglicona hidrófoba unida a una cadena de azúcar hidrófila. El contenido de saponina de la quinua oscila entre 0,22 mg/g y 15,04 mg/g, incluidos los derivados del ácido oleanólico (OA), la hederagenina (HD), el ácido serjánico (SA) y el ácido fitolacagénico (Pandya et al., 2021). Las investigaciones actuales indican que la germinación modifica el contenido de saponinas de la quinua, pero los patrones son inconsistentes.
Estudios demuestran que el contenido de saponina en la quinua blanca y negra disminuyó un 42,94% y un 58,26% después de 96 h de germinación, respectivamente (Bhinder et al., 2021). Sin embargo, el contenido de saponina en la quinua blanca aumentó a las 48 h y 72 h de germinación. Las razones del aumento del contenido de saponinas durante la etapa media de la germinación se deben a la activación y síntesis de diferentes sistemas enzimáticos durante la germinación, el cual promueve la síntesis de saponinas y mejora la protección de las semillas frente a estímulos externos (Causin et al., 2020). En un estudio separado, una disminución en el contenido de saponina de las semillas de quinua germinadas se atribuyó a la pérdida de saponinas durante la limpieza y el remojo, así como a la lixiviación de saponina de las semillas hidratadas durante la germinación (Darwish et al., 2021). Fenómenos similares también se observaron en el trigo sarraceno y el mijo en germinación, en los que el contenido de saponina disminuyó de 0,58, 0,39 y 0,44 mg/g a 0,06, 0,02 y 0,07 mg/g, significativamente más bajo que el nivel en la quinua germinada después de 96 h (Kumari et al., 2023).
Desarrollo de alimentos a partir de quinua germinada
La quinua germinada es una de las materias primas con gran potencial para la formulación de alimentos funcionales, debido a que este grano contiene todo tipo de nutrientes y compuestos bioactivos que son esenciales para la salud, también este pseudocereal juega un papel importante en la seguridad alimentaria mundial (José Rodríguez Gómez et al., 2023). Existen numerosas aplicaciones para la quinua, incluidas comestibles, medicinales, forrajeras y paisajísticas, y sus perspectivas de desarrollo integral son amplias (Lalaleo et al., 2020). Actualmente, la quinua se muele principalmente para hacer harina y se combina con harina de amaranto, trigo sarraceno, trigo u otros granos para producir alimentos para el desayuno y el ocio, como pan, pasta, panqueques, pasteles, galletas y pudines (Ceyhun Sezgin & Sanlier, 2019). Sin embargo, el estado actual del procesamiento de la quinua aún está en sus inicios, y los productos de quinua procesados mediante diversas tecnologías como horneado, cocción, extrusión y fermentación parecen ser escasos, especialmente los productos funcionales y con capacidad nutraceútica (Niu et al., 2023).
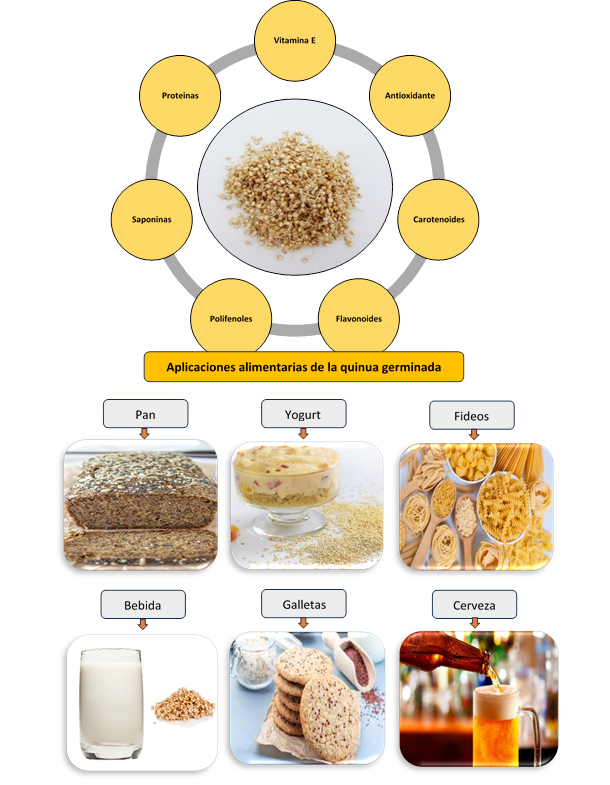
La gran ventaja de la germinación es la conversión de las sustancias macromoleculares de las semillas comestibles en moléculas más pequeñas que el cuerpo absorbe más fácilmente, también permite reducir los factores antinutricionales y mejora la digestibilidad de las proteínas (Sánchez-García et al., 2023). La quinua germinada tiene un valor nutricional, calidad de procesamiento y actividades funcionales superiores en comparación con la quinua no germinada, lo que ha atraído el creciente interés de la industria alimentaria (Romano & Ferranti, 2023). La figura 3 ilustra las aplicaciones de la quinua germinada en el sector alimentario. Por ejemplo, la quinua germinada se consume directamente como alimento tradicional germinado en forma de platos fríos, ensaladas y gachas (Zhu, 2023).
Además, la harina elaborada a partir de semillas germinadas de quinua se utiliza como ingrediente alimentario nutricional en panaderías y en la industria de bebidas. La germinación de la quinua realza el sabor de los productos horneados y reduce el amargor de la harina de quinua cruda (Sánchez-García et al., 2024). Se ha demostrado que la masa madre elaborada con harina de quinua germinada es una rica fuente de polifenoles, lo que resulta en una alta actividad antioxidante. Adicionalmente, se ha demostrado que el uso de masa madre con harina de quinua germinada para elaborar pan aumenta la digestibilidad de las proteínas y disminuye el índice glucémico (Montemurro et al., 2019). Tanto los productos lácteos como los sustitutos no lácteos pueden formularse con harina de quinua germinada para lograr un alto valor nutricional y una buena aceptabilidad sensorial, brindando así opciones naturales y saludables para vegetarianos, veganos y consumidores interesados en dietas bajas en carbono (Cáceres et al., 2019). Además de las aplicaciones enumeradas anteriormente, la quinua germinada se puede utilizar como excipiente funcional para producir alimentos funcionales específicos ricos en GABA o alimentos fortificados para niños desnutridos (Badia-Olmos et al., 2024).
En particular, la hidrólisis de la quinua germinada por la α-amilasa y la α-glucosidasa puede reducir su contenido de azúcar, lo que da como resultado productos procesados con valores de índice glucémico (IG) relativamente bajos (Maleki et al., 2023). Además, los polifenoles y péptidos activos de la quinua germinada pueden liberarse aún más mediante la fermentación por cepas específicas, lo que brinda a los productos nutraceúticos el potencial de regular la presión arterial y mejorar la hiperglucemia posprandial (Joy Ujiroghene et al., 2019). La leche vegetal elaborada con polvo de brotes de quinua y otros cereales en polvo tiene los beneficios de estimular la inmunidad y promover la salud de los niños (Chaudhary et al., 2023). Por ello, la quinua germinada y sus productos son excelentes complementos dietéticos, y su inclusión en alimentos funcionales podría ser una estrategia nutricional para prevenir y tratar el desarrollo de múltiples enfermedades metabólicas crónicas prevalentes a nivel mundial (Ren et al., 2023).
Conclusiones
Los hallazgos de la revisión sistemática, evidencian que la germinación es un método rentable, ecológico y eficiente para aumentar el valor nutricional, las propiedades antioxidantes y los ingredientes activos de la quinua, también permite reducir los factores anti nutricionales y mejora la digestibilidad de las proteínas. En cuanto a la composición de compuestos bioactivos, un estudio reciente confirmó que el contenido total de polifenoles y flavonoides de la quinua amarilla y roja aumentó significativamente después de 4 días de germinación, siendo el ácido ferúlico y la quercetina los ácidos fenólicos y flavonoides predominantes.
Por otro lado, la quinua germinada ha demostrado ser una materia prima con gran potencial en la industria alimentaria, debido a su contenido de fibra dietética, vitaminas, polifenoles, flavonoides, antioxidantes y aminoácidos libres, a la vez que contiene niveles más bajos de factores antinutricionales como las saponinas y el ácido fítico. Estas características de la quinua germinada permiten formular alimentos funcionales como fideos, pan, galletas, bebidas, yogurt, queso, etc. Los cuales tienen propiedades nutraceúticas e impacto significativo en el cuidado de la salud de las personas.












 uBio
uBio