Introducción
Los hipocloritos son los agentes oxidantes más fuertes entre los oxi-aniones de cloro, capaces de oxidar a casi cualquier sustancia reductora. El hipoclorito de calcio es un compuesto químico de fórmula Ca (ClO)2 ampliamente empleado y que suele conocerse también como cal clorada. Constituye una alternativa al hipoclorito de sodio ya que, una de las ventajas del hipoclorito de calcio es que contiene una mayor cantidad de cloro (en un porcentaje del 65% a 70%), por lo que resulta ser un producto con un nivel más alto de efectividad. Este compuesto se descompone fácilmente en el agua, en donde libera oxígeno y cloro, específicamente, se disuelven 21 gramos por cada 100 ml de agua. Cuando se añade al agua, el cloro genera ácido hipocloroso (HOCl) el cual se disocia en ion hipoclorito (OCl-). El HOCl es una forma de cloro que trabaja como un desinfectante tan fuerte como el hipoclorito. Para asegurar la formación de hipoclorito, se debe tener en cuenta el pH de la muestra. En pH cercanos al 7.5, tanto el ácido hipocloroso, así como el ion hipoclorito se encuentran presentes en cantidades iguales; por debajo de 7.5 el equilibrio cambia en favor del ácido, mientras que sobre 7.5 el equilibrio favorece al ion hipoclorito que es el agente oxidante que necesitamos para la remoción de los metales pesados. Además, es importante señalar que es un compuesto más estable y fácil de manejar que el hipoclorito de sodio (Fukuzaki, 2006; Jan et al, 2024).
En cuanto al cloruro férrico o cloruro de hierro es un compuesto químico de fórmula FeCl3 que tiene diversos usos en múltiples industrias. Sin embargo, alrededor del 60% de cloruro de hierro que se fabrica es utilizado para el tratamiento de aguas debido a que es un excelente agente coagulante. En cuanto al proceso de remoción de metales pesados vía cloruro férrico, este logra remover una significativa cantidad de estos metales por adsorción superficial y coprecipitación. Es importante tener presente que el comportamiento de remoción de metales debe ser desarrollado para cada tipo de efluente. Al igual que el cloruro férrico existen otros compuestos como el sulfato de aluminio, el sulfato ferroso, el sulfato férrico, e incluso, algunos derivados del cloro como el gas cloro, el hipoclorito de sodio y el hipoclorito de calcio; sin embargo, a diferencia de estos componentes, el cloruro férrico es más económico y eficiente ya que logra la coagulación con solo la mitad de la cantidad que se necesitaría de un compuesto como el sulfato de aluminio, un producto tradicional en estos procedimientos de tratamiento de aguas (Prada Fonseca, 2015; Bastías y Gentina, 2010). Tal es el caso de la eficiente remoción con cloruro férrico de variados iones metálicos de acuerdo con la función del pH del medio, donde se registra que a partir de pH>7.5 la remoción es eficiente para los iones Cu, Pb, Zn y para el Cadmio a partir de pH>8.5 (Caviedes Rubio et al., 2015; Calderón de Alvarado & Tuiro, 2021).
Hay que señalar que el metal pesado es un elemento químico de relativa alta densidad y que se caracteriza por ser tóxico o venenoso en concentraciones bajas, como es el caso del mercurio, cobre, cadmio, arsénico, cromo, plomo, zinc, hierro, talio, etc. La presencia de metales pesados en efluentes mineros es peligrosa y dañina para el medio ambiente y amerita su remoción (ANA, 2011; ANA,2016). Es importante tener presente que la remoción de metales pesados debe ser desarrollada para cada tipo de efluente, puesto que las características no siempre son las mismas (Lucho et al., 2005; Al-Shannag, 2015).
En este escenario la generación de aguas con contenidos de metales pesados provenientes de las relaveras tiene un impacto sobre el componente físico del rio Yauli, de tal manera, que estas aguas se filtran por fracturas, diaclasas y fallas sin que se conozca con exactitud hacia donde se derivan. El vertimiento de las aguas de la relavera, cuyos valores de los principales componentes o sea los metales pesados en estudio y que estuvieran por encima de los LMP, alterarían el hábitat natural del rio Yauli, el cual sirve de refugio y fuente de alimento para muchas especies de la fauna silvestre de la región. En la ribera se afectan los pastos naturales y la calidad del agua para el ganado que bebe en los alrededores. Aunado a ello, la degradación de las aguas y riberas del rio Yauli, trae consigo que las comunidades aledañas o de influencia directa, entren en conflicto con la empresa minera; esto trae consigo, pérdidas económicas tanto a las comunidades que se ven afectados en relación con la ganadería, así como a la empresa, ya que está expuesta a paralizaciones y demás conflictos en su entorno (Pulido Capurro et al., 2021; Castillo Ungaro et al., 2022).
En ese sentido el objetivo del presente artículo es evaluar la remoción de metales pesados Cu+2, Pb+2, Zn+2, Fe+2 de las aguas provenientes del depósito de relave de la planta concentradora Mahr Túnel, Distrito de Yauli, Provincia de Yauli, Región Junín, a fin de atenuar los impactos físicos, biológicos y sociales.
Materiales y Métodos
Ubicación del Área
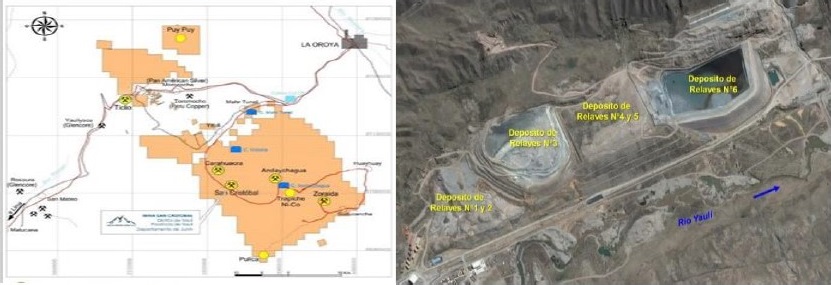
La Concentradora Mahr Túnel es parte de la Unidad de Producción de San Cristóbal y pertenece a la Empresa Minera Volcán S.A.A. Existen 06 presas de relaves, donde la N°6 es la única que quedó operativa (ver foto), las otras están en calidad de abandono y plan de cierre. El efluente de la relavera 6 es vertido al cuerpo receptor que es el rio Yauli, donde existe un punto de monitoreo declarado ante el MINAM y es donde los valores de concentraciones de iones de metales pesados deberán estar por debajo del LMP que exige la autoridad competente mediante el DS 010-2010-MINAM (Ministerio del Ambiente, 2010).
La relavera está ubicada en el Distrito Yauli, Provincia de Yauli, Departamento de Junín. Geográficamente se encuentra en el flanco Este de la Cordillera Occidental de los Andes, a 165 kilómetros de Lima y a 22 kilómetros de la ciudad de La Oroya, en el valle del Río Yauli y a 3,993 metros sobre el nivel del mar. Sus coordenadas geográficas son 76° 05´ Longitud Oeste y 11° 43´ Latitud Sur. Es accesible por la carretera central a partir del ramal de 18 kilómetros desde el poblado Pachachaca y por vía férrea, mediante el ferrocarril central desde Lima hasta La Oroya (transporte de solo materiales). Ver mapa siguiente.
Método utilizado para la remoción de los metales pesados presentes
El pH de las aguas de la relavera N°6 están en el rango de 7.0 a 7.8; cabe indicar, que la planta concentradora Mahr Tunel ya está fuera de servicio y su última relavera que estuvo en operación hasta antes de su paralización fue la N°6; esta relavera vierte sus aguas remanentes al rio Yauli y de acuerdo a la normativa legal establecida en el Estándar de Calidad Ambiental (ECA-2017) y el D.S. 010-2010-LMP - Vertimiento de Aguas Industriales-MINAM), el objetivo es reducir la concentración o cantidad de los metales pesados tales como: Pb2+, Cu2+, Fe2+, Zn2+ entre otros. El efluente de la relavera actualmente cumple con la normativa legal, pero algunos valores de metales pesados (Zn+2 y Fe+2) están cercanos a los LMP y eso es peligroso por una posible contaminación del rio Yauli. Las pruebas de laboratorio se llevaron a cabo usando un agente alcalinizante NaOH para mantener el pH en un rango entre 8,5 y 8,8 para luego utilizar un agente oxidante como el hipoclorito de calcio Ca (ClO)2; también se utilizó un coagulante FeCl3 y floculante aniónico para incrementar la velocidad de remoción de los metales pesados precipitados.
Reactivos y Materiales
Las muestras de agua industrial provienen del efluente de la relavera N°6, que fueron recolectadas en forma manual y dispuestas en envases de polietileno, el rango de pH de las muestras fue de 7.39 a 7.80. Se obtuvieron un total de 24 muestras, colectadas durante 60 días a intervalos de 01 hora las 24 horas del día, y usando envases de polietileno de un litro. El muestreo se realizó de acuerdo con el Protocolo Nacional de Monitoreo de la Calidad de los Cuerpos Naturales de Agua Superficial (Autoridad Nacional del Agua-ANA), aprobado por Resolución Jefatural N°182-2011-ANA, (ANA, 2011). Todas las pruebas de laboratorio fueron realizadas en el Instituto de Minería y Medio Ambiente de la Universidad Nacional de Ingeniería (UNI) y los análisis químicos de cada una de las pruebas fueron reportados por el laboratorio ambiental JRamón del Perú SAC.
Metodología Experimental
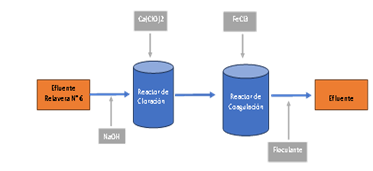
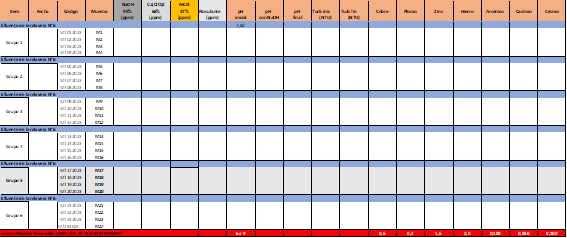
Se explican los procesos ejecutados con los siguientes productos químicos: soda cáustica (regulador de pH inicial), Hipoclorito de Calcio (agente oxidante) y Cloruro Férrico (agente coagulante) con el fin de establecer dosis óptimas del uso de los mismos, a fin de remover el contenido metálico del efluente procedente de la Relavera N°6, para con ello garantizar que el efluente conteniendo metales pesados en forma iónica se encuentren por debajo de los Límites Máximos Permisibles, de acuerdo con el D.S. 010-2010-MINAM, para su posterior evacuación a un cuerpo receptor. La obtención de las muestras se llevó a cabo en 06 grupos consistentes en 04 muestras por grupo, haciendo un total de 24 muestras. El muestreo de cada grupo se llevó a cabo en diferentes fechas que van desde enero hasta mayo del 2023. Se midió el pH inicial, turbidez, la concentración inicial del Cu+2, Pb+2, Zn+2, Fe+2, As+3 y Cd+2. Se utilizaron los productos químicos: NaOH, CaClO2, FeCl3. Se varió la dosificación y la combinación entre ellos para determinar el mejor resultado a ser aplicado al efluente de la relavera con las características mostradas en la tabla 1. En algunos casos se acondicionó el pH, en otros no, se mantuvo el pH inicial; también, se dosificó el CaClO2 en algunas combinaciones y en otras no se dosificó; del mismo modo, se dosificó el FeCl3 en varias combinaciones. Cabe mencionar que también se utilizó floculante con una misma dosificación para incrementar la velocidad de sedimentación de los óxidos e hidróxidos producidos. A continuación, se muestra (Figura 1) el diagrama de flujo del tratamiento o pruebas a las que fue sometida el efluente de la relavera N°6.
Resultados
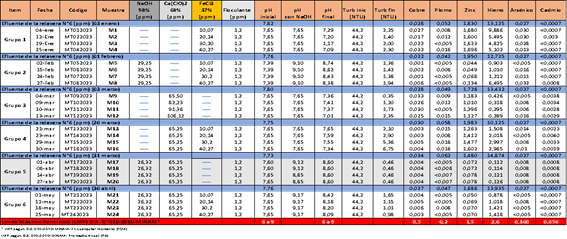
En la tabla N°2, se registran las características de las muestras del agua en el efluente de la relavera en cada fecha de muestreo, así como, los reactivos o productos químicos y dosificaciones utilizadas y los resultados obtenidos en cada grupo de muestreo. En la última fila, de color rojo, se muestra el LMP para cada elemento de acuerdo con el D.S. 010-2010-MINAM. En las filas de color azul se muestra las características del efluente de la relavera N°6 en cada fecha de muestreo para los seis grupos considerados. A continuación, se describe los resultados obtenidos durante las pruebas de laboratorio, así como, los resultados obtenidos por cada grupo. También hay que tener en cuenta los límites “En Cualquier Momento” (ECM) y límites “Promedio Anual” (PA), tal como está descrito en el D.S. 010-2010-MINAM-Límites Máximos Permisibles.
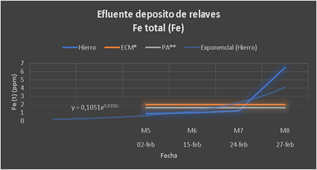
En el Grupo 1, se utilizó FeCl3 en diferentes dosificaciones; los resultados no fueron satisfactorios para el zinc y el hierro. Como puede observarse en ambas gráficas, las concentraciones de iones Zn +2 (1.696 ppm) y Fe+2 (9.886 ppm) están por encima del LMP (2 ppm).
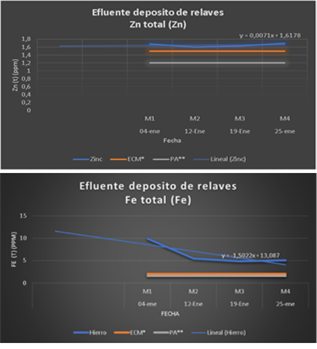
Figura 3 FeCl3 en diferentes dosificaciones; los resultados no fueron satisfactorios para el zinc y el hierro
En el Grupo 2, de acuerdo con la tabla N°2 se acondicionó el pH con NaOH (entre 8.4 y 8.7) y se utilizó igual dosificación de FeCl3 que el grupo 1; se nota que el zinc se redujo considerablemente por debajo del LMP (1.5 ppm), pero el contenido de hierro aún sigue alto (6.495 ppm) vs el LMP (2 ppm); todo lleva a plantearse que el FeCl3 incrementa el contenido de hierro y esto dificulta su remoción. En la gráfica siguiente se observa que existen valores de Fe+2 por encima del LMP.
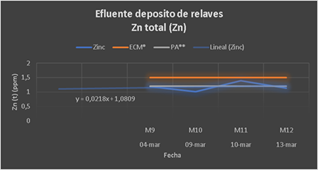
En el Grupo 3, se trabajó solo con Ca(ClO)2 a diferentes dosificaciones y se observó como muestra la gráfica que el elemento zinc (1.3 ppm) está por encima del promedio anual (1 ppm) y cercano a 1.5 ppm que es valor en cualquier momento; por lo tanto, son valores cercanos al límite contemplado en la normativa legal. Esto puede haberse dado porque no se utilizó NaOH para acondicionar el pH. El resto de los iones metálicos son menores al LMP.
En el Grupo 4, se trabajó con Ca(ClO)2 y FeCl3, donde se fijó el primero en 65,25 ppm y se varió el FeCl3 desde 10 hasta 40 ppm. Se observa en las gráficas mostradas que el Zn (1.6 ppm) está por encima del LMP (1.5 ppm) y el hierro (2.99 ppm) está por encima del LMP (2 ppm); asimismo, se observa en los resultados de la tabla N°2 que a medida que se incrementa la dosificación del FeCl3, se incrementa el contenido de hierro; por lo tanto, se recomendaría en este caso usar NaOH para aumentar el pH y usar una mayor dosificación de Ca(ClO)2.
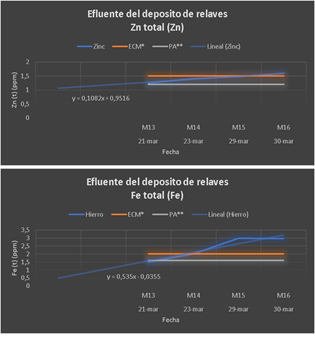
Figura 6 Ca(ClO)2 y FeCl3, donde se fijó el primero en 65,25 ppm y se varió el FeCl3 desde 10 hasta 40 ppm
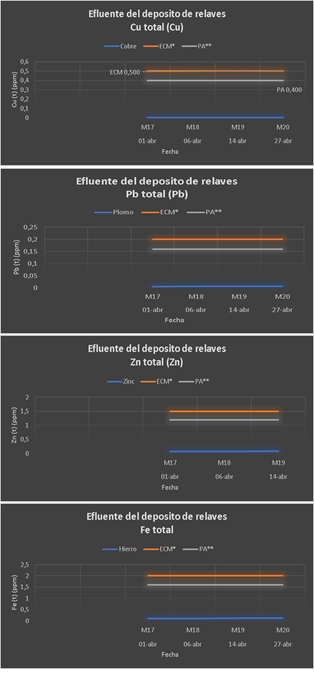
En el Grupo 5, se fijó el NaOH en 26,32 ppm hasta un pH de 8,60 y también se fijó el Ca(ClO)2 en 65,25 ppm; como se puede apreciar en las gráficas siguientes esta prueba dio como resultado valores muy por debajo de los LMP. Esta prueba con los productos químicos utilizados y con las dosificaciones usadas, son las recomendadas para utilizar en el tratamiento de aguas industriales, como en este caso lo es del efluente de la relavera N°6.
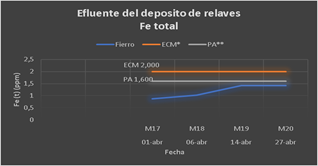
En el Grupo 6, se fijó el NaOH en 26,32 ppm, así también el Ca(ClO)2 en 65,25 ppm y se varió el FeCl3 desde 10 hasta 40 ppm; en los resultados se aprecia que todos los valores están muy por debajo del LMP con excepción del hierro (1.421 ppm) tal como se observa en la gráfica siguiente, en el que sus valores están próximos al LMP (2 ppm), por lo tanto, como ya se comentó anteriormente el FeCl3 no contribuye a la remoción del hierro en la muestra del agua de la relavera en estudio.
Discusión
En trabajos anteriores en los cuales se tratan las aguas ácidas ya sean estos de interior mina, de botaderos o desmontes de minerales y de efluentes de relaveras; se han utilizado compuestos químicos tales como agentes oxidantes (hipoclorito de sodio o calcio, inyección de oxígeno, etc.), coagulantes (cloruro férrico, sulfato de aluminio, sulfato férrico, etc.), floculantes (aniónicos en este caso) y también modificadores de pH (hidróxido de sodio o soda e hidróxido de calcio) (Calderón de Alvarado & Tuiro, 2021). Y todos ellos contribuyen a reducir la concentración iónica de los metales pesados presentes en el efluente según sea el caso (Villachica, 2002; MINAGRI, 2010). De acuerdo con nuestros resultados, no todos contribuyen como es el caso del cloruro férrico, que eleva la concentración del hierro en el efluente final, no lo reduce. Esta situación se da a nuestro entender porque las muestras iniciales recolectadas contienen “baja” concentración de hierro (aprox. 13 ppm) comparada a otros casos (agua ácida de mina, botaderos) que contienen concentraciones de hierro por encima de 100 ppm; por lo tanto, el cloruro férrico se satura y empieza a contribuir en el incremento del hierro en el efluente final. Debido a esto es que, se sugiere que antes de utilizar el cloruro férrico, hay que caracterizar el contenido de hierro presente en la muestra inicial (Flores Cotrado, 2021).
FeCl3 + 3 NaOH 3ClNa + Fe(OH)3
De acuerdo con la reacción química anterior, al adicionar cloruro férrico en un medio alcalino, da lugar a la formación del hidróxido férrico. Pero si el contenido de hierro tiene baja concentración en la muestra, entonces el hierro presente en el cloruro férrico pasa a ser parte del hidróxido férrico incrementando su concentración en la muestra final (Prasetyaningrum et al., 2021).
En cuanto al uso del hipoclorito (de sodio o calcio) contribuye en la remoción de los metales pesados, siempre y cuando el medio esté acondicionado al pH adecuado; cuando se añade hipoclorito de calcio al agua, se forma el ion hipoclorito (ClO-) el cual al reaccionar con el agua forma el ácido hipocloroso (ClOH) (Aduvire, 2006), mediante las siguientes reacciones:
(ClO)2 Ca ( Ca2+ + 2ClO (ecuación 1)
ClO- + H2O ( ClOH + OH (ecuación 2)
El ácido hipocloroso es un ácido débil, que se disocia parcialmente a ion hipoclorito (ClO-). Cuando el cloro se añade en forma líquida como hipoclorito sódico (NaOCl), en forma sólida como el hipoclorito de calcio Ca (ClO)2 o en forma gaseosa, se formarán los equilibrios químicos respectivos. El hipoclorito sódico e hipoclorito cálcico son bases, ambas, elevarán el pH del agua. La extensión del cambio de pH dependerá de la alcalinidad del agua (Chen et al., 2018).
El propósito de utilizar hipoclorito de calcio en el proceso es el de oxidar rápidamente el Fe+2, Cu+2, Pb+2, Zn+2, As+3; Cd+2 y otros metales pesados, disminuyendo el tiempo de contacto y facilitando la remoción de estos en los procesos subsiguientes. El pH recomendado de la reacción debe estar entre 6 y 9 (Cáceres Pom et al., 2021).
A medida que aumenta el pH por encima de 6 la concentración de ion hipoclorito aumenta y el ácido hipocloroso disminuye; en nuestro caso, es favorable el ion hipoclorito porque como al ser un potente agente oxidante de los metales pesados en estudio, facilita la remoción de estos de las aguas de la relavera en estudio. La aplicación de hipoclorito ya sea de sodio o calcio es viable por el alto poder oxidante; la ventaja que tiene el hipoclorito de calcio es su bajo costo y fácil manipulación que permite condiciones de seguridad en el trabajo (OEFA, 2014). Así también, es importante el uso del floculante ya que este incrementa la velocidad de sedimentación de las partículas, en nuestro caso se utiliza un floculante aniónico de cadena larga.
Conclusiones
En las pruebas realizadas a las 24 muestras obtenidas del efluente de la relavera N°6, donde el objetivo es la remoción de metales pesados, se logró la reducción de estos metales en todas las pruebas involucradas (Cu, Pb, Zn, Fe, As, Cd), salvo para el Zn+2 y Fe+2 cuando se utilizó el cloruro férrico; las concentraciones obtenidas de estos dos elementos si bien estuvieron ligeramente por debajo del LMP.
Se estableció una dosis óptima de hidróxido de sodio (NaOH) de 26.32 ppm (alcanzando un pH=8,60) y una dosis de Hipoclorito de calcio Ca (ClO)2 de 65.25 ppm. También se utilizó Cloruro férrico FeCl3 variando su dosificación desde 10,07 a 40,27 ppm para observar y determinar si aún se podría utilizar.
Debido a los inconvenientes con el Zn+2 y Fe+2; luego de varias pruebas se estableció una dosis optima de hidróxido de sodio de 26.32ppm (alcanzando un pH=8,6) y una dosis de hipoclorito de calcio de 65.25ppm; y de estas pruebas se concluyó que el Cloruro Férrico no debe utilizarse debido a que incrementa el contenido de Fe+2 en el efluente final.
Es importante la adición como última etapa, el floculante aniónico con una dosificación de 1,2 ppm.
Se concluye que los resultados del Grupo 5, es la mejor alternativa por lo que se determina que es necesario utilizar NaOH para regular el pH inicial de aprox. 7,60 hasta 8,6; también, dosificar Hipoclorito de calcio y finalmente dosificar Floculante aniónico, para que con ello los valores de concentración de los iones metálicos se encuentren por debajo de los LMP que exigen las normativas legales.
Es posible la aplicación de este grupo de productos químicos en efluentes de relaveras que tengan características similares a la de la relavera N°6 de Mahr Tunel.
Su aplicación no tiene alta inversión económica, ya que, el hidróxido de sodio (NaOH) se reemplaza por hidróxido de calcio (Ca (OH)2) y además el hipoclorito de calcio (Ca (ClO)2) que a nivel industrial es relativamente económico, por lo tanto, su aplicación es viable.












 uBio
uBio