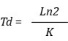INTRODUCCIÓN
En el último decenio la acuicultura es una de las actividades productivas de obtención de prote- ína animal de excelente calidad, convirtiéndola en una prometedora actividad económica en crecimiento, los peces son los organismos más cultivados y donde existe mayor tecnología (FAO, 2020). Sin embargo, en la producción de alevinos existen limitaciones que dificultan su despegue, una de estas limitaciones es la mortalidad en las primeras etapas de vida de los peces por dife- rentes factores, como protocolos inadecuados de alimentación (Pedreira & Sipaúba-Tavares, 2001). Debido a que la mayoría de larvas de peces requieren de dietas vivas como alimento inicial (Prieto & Atencio, 2008), que poseen característi- cas como fácil digestión, no alteran la calidad del agua y tienen nutrientes esenciales como ácidos grasos y aminoácidos (New, 1998). Una de éstas dietas vivas, la constituyen los rotíferos, pues presentan características que los convierten en una buena alternativa nutritiva, al ser filtradores no selectivos, pueden alimentarse de microalgas, levaduras e incluso dietas comerciales y ade- más de tener una natación lenta que facilita la captura por las larvas de peces (Heneash et al., 2015; Eryalçın et al., 2019). Uno de los géneros de rotíferos más usados son los Brachionus, pues mejoran la sobrevivencia y el crecimiento de las larvas de peces (Kumar et al., 2010); y dentro del género, una de las especies más usadas tenemos a Brachionus calyciflorus, que es producida inten- sivamente en laboratorio debido a su pequeño tamaño (136 a 231 μm), fácil captura y rápida reproducción (Lim & Wong, 1997; Park et al., 2001; Arimoro, 2006;). En base a lo argumen- tado, el objetivo del presente estudio fue evaluar la influencia de las microalgas (clorofitas) en el crecimiento poblacional del rotífero Brachionus calyciflorus, bajo condiciones controladas.
MATERIAL Y MÉTODOS
LUGAR DE ESTUDIO
El presente estudio se realizó en el Laboratorio de Cultivos Auxiliares del Centro de investiga- ciones Fernando Alcántara Bocanegra (CIFAB)- Instituto de Investigaciones de la Amazonía Peruana (IIAP), localizado en el km 4,5 de la carretera Iquitos-Nauta, Loreto-Perú. El rotífero Brachionus calyciflorus (Pallas, 1766) fue ais- lado de los estanques de la estación del CIFAB mediante la técnica de micropipeteo e identifi- cado de acuerdo a las claves taxonómicas de Eddy & Hodson (1961) y Pennak (1978).
DISEÑO EXPERIMENTAL
El cultivo experimental se realizó en nueve reci- pientes de polietileno de 4L, con volumen útil de 800 mL de agua filtrada (20 µm), donde se sem- braron 10 individuos de Brachionus calyciflorus en cada recipiente, con luz las 24 horas del día y aireación constante. Para la alimentación de los rotíferos se utilizaron tres dietas de alimentación con microalgas en concentración de 6x106 cel mL-1 con: Chlorella sp. (Ch), Scenedesmus sp. (Sc) y Chlorella sp. + Scenedesmus sp. (Ch + Sc), cada tratamiento con tres réplicas, durante 15 días de cultivo.
Cada día, se registraron la temperatura (°C) y oxígeno disuelto (mg L-1) con un oxímetro digital (YSI 550a), y el pH con un potenciómetro digital (WTW).
CULTIVO
Las microalgas fueron obtenidas de los estanques de piscicultura, desde donde se identificaron, ais- laron y cultivaron en el laboratorio de cultivos auxiliares del CIFAB-IIAP con el medio de cultivo H.M. a una temperatura de 26 °C, aireación cons- tante y luz las 24 horas. La concentración de microalga se determinó con una cámara Neubauer en un microscopio compuesto (Leica DM750) (Pérez, 1995).
CRECIMIENTO POBLACIONAL
El conteo de los rotíferos se realizó diariamente con una cámara de Sedgwick- Rafter bajo un estereoscopio (Zeiss Stemi 305). Con los datos obtenidos de las unidades experimentales se elaboró la curva de crecimiento. Para ello, se utilizaron las ecuaciones de las variables pobla- cionales citadas por Prieto et al. (2006):
Rendimiento (r) expresado como ind mL-1 día-1
Velocidad de crecimiento (K)
Tiempo de duplicación (Td)
Densidad máxima de organismos (Dmo) expresado en ind mL-1
Día de máxima densidad (Dmd) expresado en el día de cultivo en donde se obtiene la máxima densidad.
ANÁLISIS ESTADÍSTICOS
El estudio se realizó bajo un diseño completa- mente al azar. Los valores cuantitativos fueron expresados como promedio ± la desviación están- dar como medida de dispersión y variabilidad de los datos. Se realizó el análisis de varianza (ANOVA) de una vía, la prueba de Tukey (p ≤ 0,05) se usó para determinar las diferencias entre las medias con el software estadístico “Sigma plot 11”.
RESULTADOS Y DISCUSION
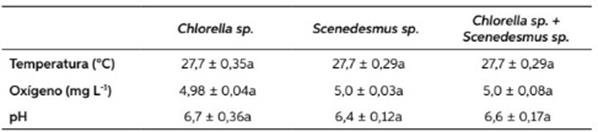
Los valores fisicoquímicos durante el estudio se pueden observar en la Tabla 1. La tempera- tura tuvo un promedio de 28 °C, encontrándose dentro de los parámetros aceptables para el crecimiento y mejora del metabolismo de estos organismos bajo condiciones controladas, coin- cidiendo con (Rodríguez-Estrada et al., 2003; Sipaúba-Tavares & Brachion, 2002; Sipaúba- Tavares & Rocha, 2003), aunque por debajo de lo reportado por (Rico-Martínez & Dopson, 1992 y Park et al., 2001), quienes afirman que tuvie- ron mejores resultados de crecimiento entre 30 y 32 °C, respectivamente. En cuanto al oxígeno disuelto, se obtuvo un promedio de 4,9 mg L-1 en todos los tratamientos y el pH osciló entre 6 a 7, concordando con (Lee & Wickins, 1992; Clifford, 1994; Park et al., 2001).
En el tratamiento de la mezcla de Chlorella sp. + Scenedesmus sp. a una concentración de 6x106 cel mL-1, se obtuvieron los mayores valores de desarrollo poblacional (7894 ind mL-1), mucho más de lo reportado en la alimentación de B. ibericus solo con Isochrysis galbana (Hernández y Ruiz, 2020), una especie marina, pudiendo inferir que las especies dulceacuícolas como las tratadas en este estudio mejoran el metabolismo de B. calyciflorus, coincidiendo con Sarma et al., 2001, al sugerir que un aumento en la concentración de microalgas mejoraba la densidad poblacional de B. calyciflorus. A concentraciones más bajas, 3x106 y 4,5x106 cel mL-1, se alcanzaron menos densidades de rotíferos (Larios, 1999; Mostary et al., 2007), lo que sustentaría que una de las mejores concentraciones para la obtención de un desarrollo poblacional óptimo, es como mínimo el propuesto en este estudio.
En la Figura 1 se muestra el proceso diario del crecimiento poblacional de B. calyciflorus en todos los tratamientos, cada curva constituye el promedio de tres réplicas. Los tratamientos de la mezcla de Chlorella sp. + Scenedesmus sp. y en solo Scenedesmus sp., presentaron una fase de latencia de aproximadamente tres días, iniciando el crecimiento los días 4, 5 y 6, y alcanzando la máxima densidad de producción de rotíferos a 28 °C, el día 7 con 7894 ind mL-1 (Chlorella sp. + Scenedesmus sp.) y en Scenedesmus sp. con 6141 ind mL-1, y el segundo pico de producción, aunque más bajo, con Chlorella sp. dos días después, con 3977 ind mL-1; pero sin diferencias significativas entre sí, luego todos los tratamientos descendie- ron gradualmente hasta completar el tiempo de cultivo probado. Aunque por debajo de los repor- tados por Park et al., 2001 (8600 ind mL-1), a la misma temperatura y especie.
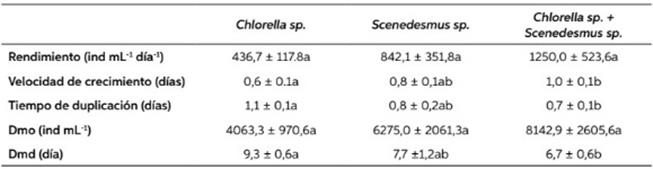
Los valores del rendimiento se muestran en la Tabla 2. El mayor rendimiento fue con la mezcla de Chlorella sp. + Scenedesmus sp. 1250 ± 523,6 ind mL-1.día, seguido del Scenedesmus sp. con 842± 351,8 ind mL-1, pero sin diferencias estadísticas entre sí (p>0,05), no obstante, Torres-Valencia et al., (2018), aunque con menos densidad, encon- tró que en siete días la monodieta de Scenedesmus sp. mostró el mayor crecimiento poblacional 108 ± 21,2 ind mL-1. Por su parte, Espinoza-Barrera et al. (2014) con otra monodieta Chlorella vulgaris, también encontraron una menor densidad 105 ± 17 ind mL-1, sugiriendo que para el cultivo de B. patulus, la combinación de microalgas brinda mejor densidad poblacional. A esto se suma lo manifestado por Hirayama (1987) y Maruyama et al., (1997) que Chlorella sp. carece de vitamina B12, esencial para el crecimiento del cultivo y por ende, también registraron los menores valo- res de densidad. Este hallazgo indicaría que la combinación de microalgas para el cultivo de B. calyciflorus resulta mejor que la alimentación con una monodieta.
En cuanto a la velocidad de crecimiento, el tratamiento que tuvo mayor valor fue la dieta de Chlorella sp. + Scenedesmus sp., con 1,0 ± 0,1 días, seguido del tratamiento con Scenedesmus sp. con 0,8 ± 0,1 y Chlorella sp. con 0,6 ± 0,1, con diferencia significativa (p<0,05) entre la dieta de Chlorella sp. y Chlorella sp. + Scenedesmus sp. Coincidiendo con Imués-Figueroa et al. (2018), que manifiestan también que la combinación de dietas, presenta mejores resultados. Así mismo, Sarma et al. (2001) aseguran que B. calyciflorus presenta alta velocidad de crecimiento (0,63 ± 0,04) cuando se alimenta solo con C. vulgaris o en combinación con levadura. A pesar, que algunos hayan utilizado enriquecedores comerciales para mejorar desarrollos poblacionales más eficaces, sus velocidades de crecimiento no se acercaron a los reportados en el presente trabajo (Cisneros, 2011).
En el tiempo de duplicación (Td) el menor tiempo se registró en la combinación de Chlorella sp. y Scenedesmus sp., con diferencia significativa (p<0,05) respecto a Chlorella sp., las microalgas dosificadas se duplicaron en menos tiempo que las otras dietas a diferencia de Hernández & Ruiz (2020) que obtuvieron un tiempo de duplica- ción más alto (3,42 días) con Nannochloropsis sp. para Brachionus ibericus. La densidad máxima de organismos (Dmo) fue mayor en la dieta combi- nada de Chlorella sp. y Scenedesmus sp., todos los tratamientos no mostraron diferencia significa- tiva (p>0,05). El día de máxima densidad entre tratamientos oscilaron entre el día 6 y 9, donde los tratamientos de Chlorella sp. y Chlorella sp. + Scenedesmus sp. mostraron diferencia significa- tiva (p<0,05). Bajo las condiciones desarrolladas, se estimaría la cosecha entre el sexto y octavo día de cultivo.
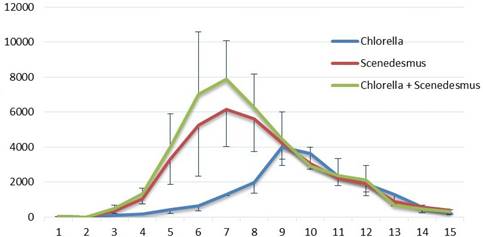
Figura 1 Curva del crecimiento poblacional de Brachionus calyciflorus alimentados con Chlorella sp., Scenedesmus sp. y Chlorella sp. + Scenedesmus sp.
Tabla 1 Valores promedios y desvío estándar de temperatura, oxígeno disuelto y pH durante el cultivo de Brachionus calyciflorus
CONCLUSIÓN
Los mayores valores de rendimiento, velocidad de crecimiento, densidad máxima de organismos y tiempo de duplicación del rotífero Brachionus calyciflorus, se obtuvieron de la dieta mezclada con las microalgas Chlorella sp. y Scenedesmus sp. (Ch + Sc), permitiendo un mejor crecimiento poblacional de la especie en cultivo.












 uBio
uBio