INTRODUCCIÓN
La bolaina blanca (Guazuma crinita Mart), es una especie promisoria con demanda en el mercado y viene siendo utilizada en la Amazonía peruana para el desarrollo de plantaciones; sin embargo, se cuenta con insuficiente cantidad y calidad de semillas genéticamente deseadas que garanticen el éxito comercial de la plantación (Xavier et al., 2013; Revilla-Chávez et al., 2021). Sin embargo, esta carencia de semillas en calidad y cantidad, puede ser fácilmente superada mediante técnicas de micropropagación In vitro, como lo logrado a partir de la selección de semillas de Raulinoa echinata, Eucalyptus grandis, entre otras, la cual permitió una producción suficiente de plantas en calidad y cantidad adecuada (Alcântara et al., 2011; Lencina et al., 2014; Hoffmann et al., 2022). En la micropropagación, existen diversas fases (Erig & Schuch, 2005; Frota et al., 2006), como la selección y preparación de la planta madre, desinfección de las yemas de la planta y/o des- infección de semillas, introducción del material seleccionado In vitro, multiplicación de brotes, enraizamiento y aclimatación, las cuales pueden ser aplicadas en diferentes especies vegetales
Un problema serio en el establecimiento de un cultivo primario In vitro, es la contaminación de la semilla y el explante, el cual es determinante al momento de la multiplicación (Hernández & González, 2010; Monfort et al., 2015;); por lo que la asepsia del germoplasma es fundamental en la micropropagación, donde la aplicación de diferentes insumos desinfectantes es esencial (Xavier et al., 2009). Los explantes que pueden ser segmentos nodales, trozos de hojas, porcio- nes de raíces, semillas, entre otros, que se extraen con la debida desinfección para eliminar hongos y bacterias que habitan en forma natural en el ambiente, la asepsia deben mantenerse hasta la siembra (Castillo, 2004).
Para este proceso, los segmentos nodales o semillas ya esterilizados por diferentes métodos, se inoculan en medio de cultivo estéril, pero a pesar de ello, luego de aproximadamente siete a quince días se podían observar contaminaciones por bacterias y hongos asociados, que sobreviven a los tratamientos de esterilización del material inoculado por patógenos endógenos latentes dentro del sistema vascular (Sharry et al., 2020); Por lo que Maruyama et al. (1997), inició los estudios para la desinfección y asepsia de las semillas para la micropropagación In vitro de G. crinita, por lo que el mismo autor, utilizó alcohol etílico de 70° por 3 minutos, y luego de aplicar una solución de peróxido de hidrógeno al 5% por 10 minutos, hasta en tres ocasiones en agua des- tilada estéril, obtuvo una desinfección al 100% libre de patógenos; más en la actualidad, se sigue buscando mejorar los protocolos de desinfección hacia técnicas más sencillas y económicas, como el aplicado por Villegas (2008) en semillas de G. crinita, que mediante la exposición de semillas a hipoclorito de sodio (NaClO) al 2%, a distintos tiempos de exposición, logró eliminar la contami- nación de semillas por completo de manera más sencilla, por lo que demuestra que estos protoco- los aún pueden ser mejorados.
Así mismo, en la micropropagación de G. crinita Mart y otras especies, es usual utilizar medios de cultivo, como el Murashige Skoog (MS) (Murashige & Skoog, 1962), suplementado con alguna fitohormona como el Acido Indol Acético (AIA) y Acido Naftalen Acético (ANA) (Ruiz, 2010); también se puede utilizar Woody Plant Medium (WPM) suplementado con trans-zeatina [trans- 6- (4-Hydroxy- 3- metilbut-2-enilamino) purina] (ZEA), por lo que luego de 45 días se puede lograr plántulas con mayor número de brotes a dosis de 10 µM; mientras que para la fase mul- tiplicación de brotes y enraizamiento utilizando como medio de cultivo WPM suplementado con la fitohormona kinetina [6-furfurilaminopurina] (KIN) con una dosificación de 1 µM se puede obtener similares resultados; este tratamiento puede conseguir el crecimiento de brotes y altos porcentajes de enraizamiento en periodos de sesenta (60) días (Maruyama et al., 1996). Por lo que los medios de cultivo son importantes para sostener el desarrollo del explante en la propagación, puesto que las sales inorgánicas y compuestos orgánicos presentes en estos medios son requeridos para la nutrición y manipulación de diversos cultivos (Pereira et al., 2008).
Por lo mismo, la multiplicación de brotes en la fase final, espera explantes que sobrevivieron a fases anteriores; estos brotes se sub cultivan en nuevos medios de cultivo, mediante divisiones y resiembras en tubos de cultivo u otros recipien- tes adecuados (Castillo, 2004), maximizando la cantidad de brotes para nuevos ciclos de mul- tiplicación, la misma que se complementa con sustancias reguladoras, como auxinas (ANA, 2,4-D, AIA, AIB, NOA,) y/o citoquininas (6-Ba, KIN, ZEA, 2iP, Thidiazurón) (Moraes et al., 2021), mientras que las giberelinas (especialmente GA3) también son requeridas en ocasiones para el cultivo de meristemas o para la elongación de brotes (Levitus, 1997), para que una vez logradas, estas pueden ser repicadas en sustratos adecua- dos para su crecimiento y puestas en los terrenos definitivos.
Por lo que el presente estudio, tuvo como objetivo determinar la influencia de procesos de desinfección, medio de cultivo y fitohormonas en el desarrollo morfogénico In vitro de explantes obtenidas a partir de semilla biológica de la espe- cie Guazuma crinita Mart (Bolaina) en Ucayali.
MATERIAL Y MÉTODOS
ÁREA DE ESTUDIO
Este estudio se realizó en el laboratorio de cul- tivo de tejidos y meristemas, de la Universidad Nacional de Ucayali, ubicado en la Carretera Federico Basadre Km. 6,200, ciudad de Pucallpa, distrito de Calleria, provincia de Coronel Portillo, departamento de Ucayali, en Perú, en coordena- das UTM 18L 546674 Este; 9071610 Sur.
METODOLOGÍA
La presente investigación, se desarrolló en tres fases consecutivas.
Fase 1, influencia del tiempo de desinfección con hipoclorito de sodio. Se lavó las semillas con agua destilada durante 30 minutos, luego fueron sumergidas por 30 minutos en 100 ml de agua destilada en la que se disolvió 3 g de Benlate®. Después, las semillas fueron lavadas tres veces con agua destilada, luego fueron lle- vadas a la cámara de flujo laminar donde se les sumergió en un frasco conteniendo Alcohol de 96° durante 1 minuto, en seguida fueron extraí- das y colocadas en cinco 5 diferentes frascos para aplicar los tratamientos de diferentes tiem- pos de exposición de (NaClO) al 2%, luego que las semillas expuestas en NaClO, fueron enjua- gadas cinco 5 veces con agua destilada estéril e inmediatamente fueron introducidas 4 semillas en los frascos conteniendo 25ml de medio geli- ficante Fitogel. Luego de 15 días de sembradas las semillas, se evaluó la variable de porcentaje de desinfección en los frascos que contenían las semillas. Los tratamientos aplicados en esta fase se presentan en la Tabla 1a.
Fase 2, influencia del medio de cultivo en la germinación. Las semillas utilizadas en esta fase se desinfectaron siguiendo el mismo proce- dimiento descrito en la fase 1, pero se consideró el tiempo de 20 minutos de exposición a NaClO al 2% (T5), tras obtener un mayor porcentaje de desinfección.
Preparación de medios de cultivo
En esta fase de utilizo cuatro diferentes trata- mientos de medios de cultivos, siendo descrita en la Tabla 2. b, y cuya preparación se describen a continuación: Para la preparación del primer tratamiento (M1), se utilizó 7 g L-1 de Fitogel disuelto en agua destilada, para los otros medios de cultivos se utilizó la misma cantidad de Fitogel, suplementado con otros compuestos; El tratamiento dos (M2), se suplementó con 30 g L-1 de sacarosa; El tratamiento tres (M3), se suple- mentó con 30 g L-1 de sacarosa más Murashige and Skoog (MS) y el cuarto tratamiento (M4), se suplementó con 30 g L-1 de sacarosa más ½ de Murashige and Skoog (½ MS); todos los trata- mientos se ajustaron a un pH de 5,8.
Tabla 1 Tratamientos aplicados y número de repeticiones en las fases 1, de influencia del proceso de desinfección (a), Fase 2, del medio de germinación (b) y fase 3, efecto de fitohormonas (c, d, e) en el desarrollo morfogénico In vitro de G. crinita Mart.
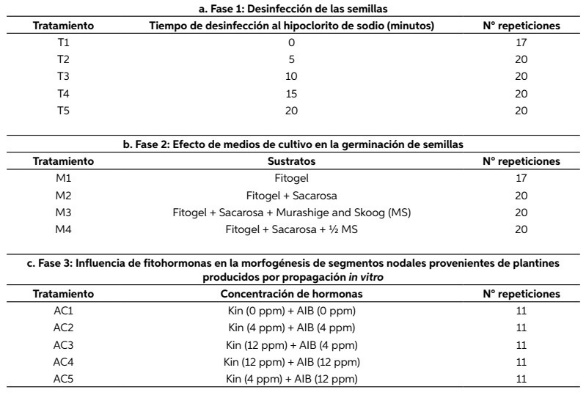
Tabla 2 Evaluación del proceso de desinfección e influencia del sustrato en la germinación In vitro de semillas de G. crinita Mart.
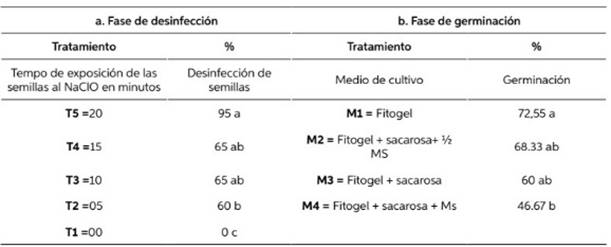
Letras iguales no presentan diferencias significativas. Tukey p≥ 0,05
Con el objeto de mantener la asepsia del pro- ceso, se procedió a esterilizar los frascos que fueron utilizados, en una autoclave a 15 libras de presión y 131°C por 20 minutos, al culminar se extrajeron los frascos y se dejaron enfriar por 24 horas en un ambiente libre de patógenos, poste- riormente se sembraron 3 semillas por frasco con diferente número de repeticiones esto se puede visualizar en la Tabla 1. b. Luego los frascos fueron expuestos en una cámara de crecimiento con el fotoperiodo de 12 horas y la temperatura de 25 °C ± 2 °C, 75% de humedad. 30 días después de la siembra, se evaluó la variable de número de semillas germinadas.
Fase 3, Influencia de las fitohormonas en la morfogénesis. En esta fase se utilizó cuatro tratamientos de medios de cultivos, considerando los resultados de la fase anterior, se utilizó como medio de cultivo el tratamiento 5, para evitar la oxidación se suplemento con 1 g L-1 de carbón activado con pH ajustado a 5,8 y diferentes dosis de Kinetina (Kin) y Ácido Indol Butírico (AIB), como está indicado en la Tabla 1. c.
Como explantes se utilizó segmentos nodales, provenientes de plántulas obtenidas de la fase de germinación del tratamiento M4, obteniendo como unidad experimental un tubo de ensayo con 20ml de medio de cultivo con un segmento nodal de aproximadamente 1,0-1,5 cm de longi- tud. A los 120 días, se evaluó diferentes variables.
POBLACIÓN Y MUESTRA
La población fue conformada por un lote de semillas de G. crinita, donde aproximadamente 0,5 g de semillas colectadas de individuos con caracte- rísticas fenotípicas superiores en altura, diámetro y un estado fitosanitario sano. De este lote, en la fase 1 se tomó una muestra de 388 semillas; para la fase 2,192 semillas germinadas; en la fase 3, se utilizaron 55 segmentos nodales provenientes de las semillas germinadas In vitro.
Diseño experimental, variables y procesamiento de la información
En las tres fases del experimento se utilizó un diseño experimental completamente al azar (DCA), a cuyos resultados se aplicó el Análisis de Varianza (ANVA) y la prueba de comparación de medias de TUKEY y LSD con un 5% de significan- cia (ᾳ= 0.05).
La información obtenida fue procesada en OpenOffice y el programa computacional “Sistema para Análisis de Variancia” (SISVAR 5.6) (Ferreira, 2011).
En la fase 1, se aplicaron 5 tratamientos con el número de repeticiones que se mencionan en la tabla 1. Para esta fase, las variables evaluadas fueron porcentaje de semillas sin contaminación y semilla contaminada. La evaluación se realizó a los 15 días de instalado el experimento.
En la fase 2, se aplicaron 4 tratamientos con el número de repeticiones detalladas en la Tabla 1. En esta fase se evaluó el número de semillas germinadas y se expresó en %. La evaluación se realizó después de 30 días de instalado el experimento.
En la fase 3, de morfogénesis, se aplicaron 5 tratamientos, con repeticiones indicadas en la Tabla 1. Las variables evaluadas fueron presencia de callos, existencia de diferenciación radicular, número de primordios radiculares y número de brotes. La evaluación se realizó después de 120 días de la inoculación de los segmentos nodales.
RESULTADOS
Los resultados obtenidos en la fase de desinfección de las semillas por efecto del tiempo de acción del hipoclorito de sodio al 2%, así como el efecto del medio de cultivo en la germinación de las semillas desinfectadas se presentan en la Tabla 2.
De los tratamientos aplicados para la desinfección de semillas de G. crinita Mart por bacterias y hongos, mediante la prueba de medias de Tukey (p≥ 0,05) se determinó que el tratamiento T5 fue el más eficiente; por el contrario, con el trata- miento control T1 se obtuvo total contaminación de las semillas en el medio de cultivo (Tabla 2, a). Mientras que los mayores porcentajes de germinación de las semillas In vitro (Tabla 2. b) se obtuvieron utilizando sólo Fitogel (tratamiento M1) y en el tratamiento M4 se obtuvo el menor porcentaje de germinación.
La Tabla 3, presenta los resultados de la morfo- génesis en la fase 3, donde se observa que existe una mayor formación de callos mediante el trata- miento AC4 el cual es significativamente superior a los demás tratamientos mediante la prueba de medias de Tukey (p≥ 0,05) y del mismo modo para primordios radiculares el tratamiento AC4 fue significativamente superior determinado por la prueba de medias LSD (p≥ 0,05), más con el tratamiento AC1 no se formaron callos y tuvo también el menor número de primordios radi- culares (Tabla 3. a, b). Mientras que mediante la prueba de medias LSD (p≥ 0,05), se determinó que la mayor cantidad de brotes se obtuvo con el tratamiento AC5 y las más bajas se obtuvieron con los tratamientos AC1 y AC2 (Tabla 3. c).
La Figura 1, presenta el desarrollo morfogé- nico de los explantes, en el que podemos ver la proliferación de callos (Figura 1, a), formación de primordios radiculares (Figura 1, b), formación de brotes (Figura 1, c) y diferentes grados de for- mación de brotes (Figura 1, d).

Figura 1 Morfogenesis en explantes de G. crinita Mart; a. Proliferación de callos en explantes, por efecto de la combinación de auxinas y citoquininas en los medios de cultivo; b. Primordios radiculares; c. Producción de brotes; d. diferenciación entre el tratamiento T4 y tratamiento T1 luego de 4 meses.
Tabla 3 Evaluación del efecto de diferentes concentraciones de kinetina (Kin) y Ácido Indol Butírico (AIB) en la fase de desarrollo morfogéncio de explantes provenientes de semillas germinadas In vitro de G. crinita Mart.
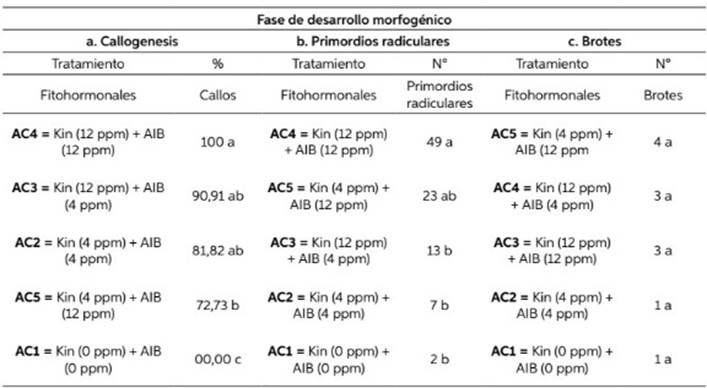
Letras iguales no presentan diferencias significativas. Tukey (p≥ 0,05) para primordios radiculares (b.) y LSD (p≥ 0,05) para callogénesis (a.) y brotes (c.).
Finalmente, realizando el análisis de varianza de los resultados de las tres fases del experi- mento se determinó que en todas las fases del experimento existe diferencia estadísticamente significativa entre los tratamientos aplicados
DISCUSIÓN
Teniendo en cuenta los resultados presenta- dos en la Tabla 2. a, la misma demuestra que existe una relación inversamente proporcional entre el tiempo de exposición al (NaClO) al 2% y la contaminación de las semillas, resultado que es corroborado con lo manifestado por Chudzikiewicz (2019), que menciona que la exposición de los explantes a un tiempo mayor y un conjunto de fungicidas, resulta en un por- centaje menor de contaminación, por su parte Arbeláez et al. (2016) menciona que el hipoclo- rito de sodio es uno de los mejores desinfectantes utilizados en técnicas de cultivo In vitro, evitando contaminaciones por diversos patógenos. Así mismo, los resultados obtenidos en la fase 1, de desinfección (Tabla 1) son similares a los obte- nidos por Villegas (2008). Así mismo Ramírez, et al. (2014) y Ticona & Triguero (2019), logra- ron controlar la contaminación con tratamientos similares.
Respecto a los resultados obtenidos, en la segunda fase (Tabla 2. b.) los resultados difieren a lo afirmado por Ali-Rachedi et al. (2004), que menciona que las semillas de P. nitida y P. ledifo- lia, obtienen una mayor proporción germinación, se adiciona al medio de cultivo una fitohor- mona GA3; sin embargo, Flores-Hernandez et al. (2017), menciona que los medios de cultivo (MS) al 50%, tiene una mayor eficiencia en el desarro- llo vegetal; por lo que Devlin (1980) menciona, que el desarrollo de los vegetales en el creci- miento y diferenciación de órganos, es regulado por la acción de la fitohormona; los mismos que Diaz-Pillasca et al. (2022), indican que estos acti- van o inhiben determinados procesos fisiológicos interactuando entre sí; más las altas concentra- ciones de azúcares, son agentes promotores del crecimiento (Tacoronte et al., 2017), lo que justi- ficaría el hecho de que, la combinación de Fitogel y sacarosa (M4), es el mejor tratamiento que se visualizó en un periodo de incubación (4 meses), en tanto que estadísticamente el mejor trata- miento fue el M1, evaluado en un mes.
En base al ANVA, se determinó que existen diferencias significativas entre los tratamientos aplicados en todas las fases del estudio tal como se presenta en la Tabla 2 y 3, el cual se presenta que los tratamientos que poseen la misma letra forman grupos con resultados estadísticamente iguales.
Es importante destacar que en todos los resultados obtuvieron más de un grupo de tra- tamientos estadísticamente iguales, a excepción de la formación de brotes, donde todos los tra- tamientos dieron resultados estadísticamente iguales, pudiéndose suponer que se necesita incrementar la concentración de fitohormonas que incrementan la producción de brotes.
En la fase tres, se logró la formación de callo en todos los tratamientos a excepción del trata- miento AC1 que no tenía ninguna fitohormona,demostrándose que todas las concentraciones tanto de kinetina y de AIB son suficientes para incentivar la formación de callos en esta especie; por lo que para Gordon et al. (2009), la forma- ción de callos responden al uso de fitohormonas pudiendo incluso llegar a generar dificultades por su aplicación excesiva; por lo que las auxinas como el AIB, son utilizados para promover la división celular y proliferación de raíces (George et al., 2008), que en conjunto con las citoquininas como la kinetina, son capaces de inducir el creci- miento del callo (Vageeshbabu & Boopal, 2016) y como también del desarrollo de embriones androgénicos (Olszewska et al., 2014) .
En relación a la formación de primordios radiculares, Ruiz (2010) y Garay-Arroyo et al. (2014), afirman que las auxinas, son los únicos fitohor- monas que propician la formación de primordios radiculares, esto guarda relación con los resul- tados obtenidos en el presente estudio, donde los tratamientos AC4 y AC5, que tienen la mayor concentración de AIB (12ppm), presentaron la mayor formación de primordios radiculares, sin embargo un inadecuado control puede afectar la calidad de las raíces y el desarrollo de obtención de estas (Uribe et al., 2012).
Se debe tener en cuenta que, en la fase de desarrollo o formación de primordios radiculares, las células se diferencian, de acuerdo a las concen- traciones de auxinas (AIB) y citoquininas (Kin) en los medios de cultivo, por lo que, si este tiene mayor cantidad de auxina, se obtiene primor- dios radiculares, y si este tiene concentración de citoquininas la diferenciación se encamina hacia la proliferación de brotes o en la obtención de yemas apicales.
Así mismo Couto et al. (2021), refiere que la utilización de citoquininas con determinadas auxinas, son óptimas inductoras de brotes en los explantes, y determinan que la mejor relación de ácido indol butírico (AIB) y citoquininas (KIN) en la propagación de yemas axilares de sauce es de 1/1 en el medio Murashige and Skoog (1962), esto podría explicar el hecho que en el presente experimento, se obtuvo la mayor proliferación de primordios radiculares en el tratamiento AC4, donde la relación entre auxinas y citoquininas es de 1:1.
CONCLUSIONES
El control de la contaminación de semillas de G. crinita Mart, con soluciones de Hipoclorito de sodio (NaClO) al 2%, es inversamente pro- porcional al tiempo de exposición, siendo que los tiempos entre 10 y 20 minutos presenta- ron una eficiencia en su aplicación.
El porcentaje de germinación de las semillas de G. crinita Mart. In vitro depende del tipo de sustrato y el tiempo a la exposición a estas, cuando los nutrientes disminuyen por el con- sumo de las plantas, estas utilizan sus reservas llegando a auto consumirse y posteriormente mueren si es que el sustrato no tiene nutrientes adicionales.
Las concentraciones de auxinas y citoquininas utilizadas promovieron una abundante formación de callos.
Las concentraciones de auxinas (AIB) y citoquininas (Kin) utilizadas permitieron la formación de primordios radiculares.
Las concentraciones de auxinas y citoquininas utilizadas, permitieron la formación de igual número de brotes, siendo necesario probar el efecto de diferentes dosis de citoquininas para formar una mayor cantidad de brotes.












 uBio
uBio 

