INTRODUCCIÓN
La Amazonia Peruana es un ecosistema dominado por frondosos bosques que son interrumpidos únicamente por el cauce de los ríos que discurren ininterrumpidamente hacia el océano Atlántico (Rodríguez-Achung, 2016). Estos ecosistemas acuáticos albergan una gran diversidad, destacando a los peces con alrededor de 3000 especies conocidas para la región; siendo muchas de ellas el sustento alimenticio más importante del poblador amazónico (García-Dávila et al., 2018).
Los ríos son, desde épocas remotas, la principal fuente de obtención de proteína para el poblador amazónico, siendo la pesca una de las actividades más importantes en su quehacer diario. La pesca es una actividad muy compleja y difícil de monitorear, parte de esta complejidad viene del carácter multi-específico de esta actividad con gran número de especies explotadas y aprovechadas en diferentes rubros científicos y comerciales (FAO, 2020).
Otra parte de su complejidad proviene de la estructura de la actividad, que está dividida entre la pesca de subsistencia, que representa alrededor del 75% de los desembarques, y la pesca comercial, que representa el 25% (García-Vásquez et al., 2012). Las únicas estadísticas pesqueras oficiales para la Amazonía Peruana son registradas por el Ministerio de la Producción, registrando la pesca comercial en las regiones de Loreto, Ucayali, Madre de Dios y San Martín. Los volúmenes de desembarque entre las regiones de la Amazonia Peruana están muy desequilibrados, Loreto representa en promedio alrededor del 67,4% de las capturas, seguido del Ucayali (26%), San Martín (13,8%) y finalmente Madre de Dios que representa apenas alrededor del 3,3% de los desembarques (Ministerio de la Producción, 2021).
En la Amazonia Peruana encontramos 79 especies taxonómicas de peces que vienen siendo comercializadas en los mercados de las regiones Loreto, Ucayali y Madre de Dios. En la región Loreto, el pescado es comercializado en 3 estados de conservación distintos: fresco, salpreso y seco-salado (García-Dávila et al., 2018).
Los peces son considerados como los seres vivos que están en contacto por más tiempo a diferentes organismos, entre ellos, los parásitos (Kuhn et al., 2016; Wood & Lafferty, 2015). Estos parásitos se propagan a través de las cadenas tróficas por medio de las interacciones entre las poblaciones de los hospederos, predadores, presas y competidores (Sures et al., 2017). La dieta de los peces influye fuertemente en la composición de la fauna parasitaria de los mismos, debido a que es la vía por la cual un pez puede infectarse por endoparásitos, los cuales pueden ser perjudiciales para la salud del consumidor (Baia et al., 2018).
Estudios realizados a nivel nacional e internacional demuestran la presencia de especies parasitarias en los recursos hidrobiológicos (Murrieta-Morey, 2019). En el caso de parásitos con potencial zoonótico, pueden ingresar al ser humano al consumir carne de pescado infectada. La transmisión de patógenos al humano puede constituir un problema de importancia en salud pública, debido a las consecuencias negativas en la salud que pueden llevar la ingesta accidental de parásitos zoonóticos (Murrieta-Morey, 2019). Dentro de este gran grupo de parásitos zoonóticos destacan a parásitos anisakídeos, los cuales pueden ser ingeridos en platos gastronómicos muy consumidos en la Amazonia Peruana como es el caso del sushi y el ceviche (Tavares et al., 2017). A la fecha no hay ningún reporte de parásitos zoonóticos en la ciudad de Iquitos, en tal sentido, el presente estudio tuvo como objetivo, dar a conocer los principales endoparásitos de peces amazónicos comercializados en mercados de la ciudad de Iquitos, en Loreto-Perú.
METODOLOGÍA
PECES
Fueron adquiridos de cuatro principales mercados de la ciudad de Iquitos: mercado “Modelo” (-3.7405624613921313, -73.24278920347851), mercado “Secada” (-3.7858162104723294, -73.29184412067438), mercado “Cardozo” (-3.7434807902904272, -73.25163260347847) y mercado “Belén” (-3.757160345455666, -73.24783179112812) en el periodo de agosto 2020 hasta agosto 2022. La frecuencia con la que se visitó los lugares de muestreo fue de 2 a 3 veces por semana en horas de la mañana aproximadamente entre las 6:00-7:00 am adquiriendo para cada punto de muestreo 10 ejemplares de cada especie de pez analizada (Tabla 1). Se seleccionaron a los ejemplares que estaban en buen estado (frescos) basándose en la coloración de la piel y branquias (color rojizo), textura de la musculatura, entre otras características que indicasen su buen estado.
Tabla 1 Lista de endoparásitos descritas en el trabajo, local de fijación y nombre común de los hospederos
| Endoparásitos | Local de fijación | Hospederos |
|---|---|---|
| TREMATODA | ||
| Ithyoclinostomun dimorphum (Diesing, 1850) | Músculo, cavidad | Shuyo Hoplerythrinus unitaeniatus (Erythrinidae) |
| Caballerotrema arapaimense Thatcher, 1991 | Hígado | Paiche Arapaima gigas (Arapaimidae) |
| Austrodiplostomum compactum (Lutz, 1928) | Cavidad ocular | Gamitana Colossoma macropomum (Serrasalmidae) |
| Diplostomun sp. | Piel | Gamitana Colossoma macropomum (Serrasalmidae) |
| Clinostomum marginatum (Rudolphi, 1819) | Músculo, cavidad | Pimelodella Pimelodella cristata (Pimelodidae), Shuyo, Hoplerythrinus unitaeniatus (Erythrinidae), Cachorro; Acestrorynchus falcirostris (Acestrorhynchidae), Novia; Trachelyopterus galeatus (Auchenipteridae), Piraña roja Pygocentrus nattereri (Serrasalmidae) |
| Doradamphistoma bacuense Thatcher, 1999 | Intestino | Cahuara Pterodoras granulosus (Doradidae) |
| Genarchella sp. | Cavidad, hígado, bazo | Manitoa Brachyplatystoma vaillantii (Pimelodidae) |
| Dadayius sp. | Hígado | Churero Megalodoras uranoscopus (Doradidae), Cahuara Pterodoras granulosus (Doradidae) |
| CESTODA | ||
| Monticellia sp. | Intestino | Cahuara Pterodoras granulosus (Doradidae) |
| Proteocephalus kuyukuyu Woodland, 1935 | Intestino | Churero Megalodoras uranoscopus (Doradidae) |
| Proteocephalus platystomi Lynsdale, 1959 | Intestino | Doncella Pseudoplatystoma punctifer (pimelodidae) |
| Schizochoerus liguloideus(Diesing, 1850) | Cavidad | Paiche Arapaima gigas (Arapaimidae) |
| ACANTOCEPHALA | ||
| Quadrigyrus machadoi Fabio, 1983 | Intestino, Cavidad | Shuyo Hoplerythrinus unitaeniatus (Erythrinidae) |
| Neochynorynchus (Neochynorynchus) veropesoi Melo, Costa, Giesse, Gardner & Santos, 2015. | Intestino | Corvina Plagioscion squamosissimus (Sciaenidae) |
| NEMATODA | ||
| Anisakis sp. | Intestino, cavidad, músculo, vejiga, estómago, hígado | Doncella Pseudoplatystoma punctifer (pimelodidae), Manitoa Brachyplatystoma vaillantii (Pimelodidae), Bocón Ageneiosus inermis (Auchenipteridae), Cachorro Acestrorynchus falcirostris (Acestrorhynchidae), Chambira Rhaphiodonvulpinus (Cynodontidae), Corvina Plagioscion squamosissimus (Sciaenidae), Maparate Hypophthalmus edentatus (Pimelodidae), Pimelodella Pimelodella cristata (Pimelodidae), Piraña negra Serrasalmus rhombeus (Serrasalmidae), Shuyo Hoplerythrinus unitaeniatus (Erythrinidae), Palometa curuhuara Myloplus rubripinnis(Serrasalmidae), TucunareCichla monoculus (Cichlidae), Piraña roja Pygocentrus nattereri (Serrasalmidae), Tigre zúngaro Pseudoplatystoma tigrinum (Pimelodidae). |
| Contracaecum sp | Intestino, cavidad, hígado, músculo | Doncella Pseudoplatystoma punctifer (pimelodidae), Manitoa Brachyplatystoma vaillantii (Pimelodidae), Acarahuazú Astronotus ocellatus (Cichlidae), Bocón Ageneiosus inermis (Auchenipteridae), Cachorro Acestrorynchus falcirostris (Acestrorhynchidae), Chambira Rhaphiodon vulpinus (Cynodontidae), Corvina Plagioscion squamosissimus (Sciaenidae), Fasaco Hoplias malabaricus (Erythrinidae), Huapeta Hydrolycus scomberoides (Cynodontidae), Maparate Hypophthalmus edentatus (Pimelodidae), Pimelodella Pimelodella cristata (Pimelodidae), Tucunare Cichla monoculus (Cichlidae) , Piraña roja Pygocentrus nattereri (Serrasalmidae), Tigre zúngaro Pseudoplatystoma tigrinum (Pimelodidae) |
| Eustrongylides sp. | Intestino, músculo, cavidad | Doncella Pseudoplatystoma punctifer (pimelodidae), Cachorro Acestrorynchus falcirostris (Acestrorhynchidae), Chambira Rhaphiodon vulpinus (Cynodontidae), Fasaco Hoplias malabaricus (Erythrinidae), Paiche Arapaima gigas (Arapaimidae), Piraña negra Serrasalmus rhombeus (Serrasalmidae), Tucunare Cichla monoculus (Cichlidae), Arahuana Osteoglossum bicirrhosum (Osteoglossidae) |
| Terranova sp. | Intestino | Chambira,Rhaphiodon vulpinus,(Cynodontidae), Corvina Plagioscion squamosissimus (Sciaenidae). |
| Pseudoterranova sp. | Intestino, gónadas, cavidad, músculo | Doncella Pseudoplatystoma punctifer (pimelodidae), Corvina Plagioscion squamosissimus (Sciaenidae), Tucunare Cichla monoculus (Cichlidae), Piraña roja Pygocentrus nattereri (Serrasalmidae), Tigre zúngaro Pseudoplatystoma tigrinum (Pimelodidae. |
| Hysterothylacium sp. | Intestino, ojo | Chambira Rhaphiodon vulpinus (Cynodontidae), Corvina Plagioscion squamosissimus (Sciaenidae). |
| Cucullanus pseudoplatystomae Moravec, Kohn & Fernandes, 1993 | Intestino | Doncella Pseudoplatystoma punctifer (pimelodidae) |
| Cucullanus (Cucullanus) pinnai pterodorasi Moravec, Kohn & Fernandes, 1997 | Intestino | Cahuara Pterodoras granulosus (Doradidae) |
| Spiroxys sp. | Intestino, ojo | Bocón Ageneiosus inermis (Auchenipteridae), Corvina Plagioscion squamosissimus (Sciaenidae), Fasaco Hoplias malabaricus (Erythrinidae), Huapeta Hydrolycus scomberoides (Cynodontidae), Pimelodella Pimelodella cristata (Pimelodidae). |
| Rondonia rondoni Travassos, 1920 | Intestino y estómago | Cahuara Pterodoras granulosus (Doradidae) |
| Heliconema sp. | Intestino, cavidad | Fasaco Hoplias malabaricus (Erythrinidae), Novia Trachelyopterus galeatus (Auchenipteridae), Tucunare Cichla monoculus (Cichlidae) |
| Pseudoproleptus sp. | Hígado, cavidad, intestino | Fasaco Hoplias malabaricus (Erythrinidae), Tucunare Cichla monoculus (Cichlidae) |
| Cucullanus (Cucullanus) sp. | Cavidad | Tucunare Cichla monoculus (Cichlidae) |
| Nilonema senticosum (Baylis, 1927) | Músculo | Paiche Arapaima gigas (Arapaimidae) |
| Goezia spinulosa (Diesing, 1839) | Intestino | Paiche Arapaima gigas (Arapaimidae) |
| Raphidascaroides brasiliensisMoravec & Thatcher, 1997 | Intestino | Churero Megalodoras uranoscopus (Doradidae) |
| Raphidascaroides moraveci Pereira, Tavares, Scholz & Luque, 2015 | Intestino | Churero Megalodoras uranoscopus (Doradidae) |
| Larva de nemátodo | Intestino | Bocón Ageneiosus inermis (Auchenipteridae) |
| Procamallanus krameri (Petter, 1974) | Intestino | Shuyo Hoplerythrinus unitaeniatus (Erythrinidae) |
| Procamallanus (Spirocamallanus) juana Ramallo & Ailán, 2017 | Intestino | Manitoa Brachyplatystoma vaillantii (Pimelodidae) |
| Procamallanus (Spirocamallanus) inopinatus Travassos, Artigas & Pereira, 1928 | Cavidad, estómago, intestino, ciegos pilóricos | Doncella Pseudoplatystoma punctifer (pimelodidae), Cachorro Acestrorynchus falcirostris (Acestrorhynchidae), Corvina Plagioscion squamosissimus(Sciaenidae), fasaco Hoplias malabaricus (Erythrinidae), Huapeta Hydrolycus scomberoides (Cynodontidae), Palometa Mylossoma duriventre (Serrasalmidae), GamitanaColossoma macropomum (Serrasalmidae), Piraña negra Serrasalmus rhombeus (Serrasalmidae), Sábalo Brycon amazonicus (Bryconidae), Piraña roja Pygocentrus nattereri (Serrasalmidae), Sardina Triportheus angulatus (Triportheidae), Tigre zúngaro Pseudoplatystoma tigrinum (Pimelodidae). |
| Procamallanus (Spirocamallanus) iheringi Travassos, Artigas & Pereira, 1928 | Intestino | Lisa Megaleporinus trifasciatus (Anostomidae) |
| Paracamallanus amazonensis Ferraz & Thatcher, 1992 | Intestino | Maparate Hypophthalmus edentatus (Pimelodidae) |
| PENTASTOMIDA | ||
| Sebekia sp. (Pentastómido) | Cavidad, músculo, intestino | Manitoa Brachyplatystoma vaillantii (Pimelodidae), Acarahuazú Astronotus ocellatus, Tucunaré Cichla monoculus (Cichlidae), Shuyo Hoplerythrinus unitaeniatus (Erythrinidae), Fasaco Hoplias malabaricus(Erythrinidae), Piraña roja Hoplias malabaricus (Erythrinidae). |
CONSERVACIÓN DE ÓRGANOS
Para la conservación de los órganos internos se procedió a realizar un corte longitudinal desde la abertura del ano hasta las aberturas branquiales, posteriormente se extrajeron los órganos internos con ayuda de pinzas. Cada tracto digestivo se extrajo y se colocó en frascos de plástico de 120 ml previamente rotulados los cuales contuvieron alcohol etílico al 70% para la conservación y fijación de las muestras para su posterior análisis, esto se aplicó para aquellos especímenes con tamaños menores a 30 cm. Para los especímenes más grandes, los órganos del tracto digestivo (estómago, intestino, hígado, etc.) se colocaron en frascos separados. Los frascos fueron rotulados con informaciones concernientes al pez, órgano, fecha y local de colecta (Murrieta-Morey, 2019).
FILETEO DE LOS PECES
La musculatura fue revisada teniendo en consideración que el pez tuvo que estar lo más fresco posible. Lo primero que se realizó, en el caso de peces con escamas, fue quitar las escamas con materiales elaborados de madera lo cual nos facilitó la descamación. Luego se realizaron finos cortes longitudinales para obtener filetes, los cuales fueron analizados capa por capa en búsqueda de algún parásito alojado en la musculatura. Los parásitos encontrados fueron separados en placas Petri pequeñas para su posterior análisis.
ANÁLISIS DE LOS ÓRGANOS
Cada órgano fue colocado por separado en distintas placas Petri con agua destilada, posteriormente con ayuda de estiletes se procedió a romper el tejido de los órganos y a la vista del estereoscopio ir buscando los endoparásitos. Los parásitos que se lograron encontrar en los órganos internos de los peces fueron registrados en un cuadernillo de apuntes para la elaboración de la base de datos en hojas de cálculo Excel. Los parásitos encontrados fueron separados en placas pequeñas y analizados de manera minuciosa para su posterior identificación taxonómica (Murrieta-Morey, 2019).
PROCESAMIENTO DE LOS PARÁSITOS ENCONTRADOS
En el caso de digeneos, céstodos y acantocéfa- los se realizó la tinción con Carmín alcohólico de Langeron (Langeron, 1949).
Para la identificación de cada especie se utilizó la guía taxonómica especializada para estos grupos parasitarios (Thatcher, 2006).
En el caso de los nemátodos se utilizó la meto- dología explicada por (Murrieta-Morey, 2019) La identificación de los nemátodos utilizando bibliografía taxonómica especializada (Moravec, 1998).
Los pentastómidos fueron conservados en etanol etílico al 70%. Para su identificación taxo- nómica, fue necesario clarificarlos, utilizando el medio Hoyer. Los parásitos fueron depositados en la colección del Laboratorio de Parasitología y Sanidad Acuícola del Instituto de investigaciones de la Amazonia Peruana.
RESULTADOS
ENDOPARASITOS EN PECES DE CONSUMO DE LA AMAZONÍA PERUANA
Los parásitos encontrados fueron registrados según el hospedero, los cuales, a su vez, fueron clasificados de acuerdo al orden taxonómico al cual corresponden. Los datos mencionados se pueden apreciar en la Tabla 1.
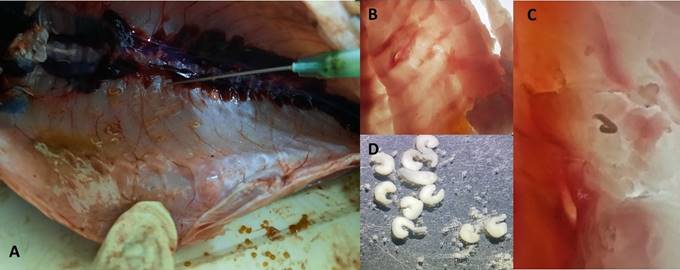
Algunas evidencias de los parásitos encontra- dos en sus hospederos se muestran en las figuras 1 al 5. Para digeneos, se muestra a metacerca- rias de Clinostomum marginatum adheridas a la musculatura de Pygocentrus nattereri “piraña roja” (Fig. 1A-C), Diplostomum sp. en piel de Colossoma macropomum “gamitana” (Fig. 1D), metacercarias de Ithyoclinostomun dimorphum en la musculatura de Hoplerithrinus unitaeniatus “shuyo” (Fig. 1E-F). Para el caso de nemátodos, se aprecia a Eustrongylides sp. parasitando la mus- culatura de Osteoglossum bicirrhosum “arahuana” (Fig. 2A-B), también a este nemátodo en la cavidad y músculo de Cichla monoculus “tucunaré” (Fig. 2C-D) y en músculo de Hoplias malabaricus “fasaco” (Fig. 2E). Nemátodos anisakideos son mostrados parasitando la cavidad abdominal y mesenterio de Brachyplatystoma vaillantii “mani- toa” y Astronotus ocellatus “acarahuazú” (Fig. 3). Otros registros muestran a nemátodos, céstodos y digeneos parasitando a Pterodoras granulosus “cahuara” (Fig. 4A-C), así como a nemátodos de Raphidascaroides spp. parasitando a Megalodoras uranoscopus “churero” (Fig. 4D-E). Para el caso de pentastómidos, se reporta a Sebekia sp. parasitando la musculatura de C. monoculus “tucunaré” (Fig. 5A-C) y a B. vaillantii (Fig. 5D).

Figura 1 Tremátodos identificados en peces amazónicos. A. Vista lateral de Pygocentrus nattereri “piraña roja”, B, C. Tremátodos en musculatura de P. nattereri, D. Diplostomum sp. en la piel de Colossoma macropomum “gamitana”, E, F. Ithioclinostomun dimorphum en músculo de Hoplerithrinus unitaeniatus “shuyo”.
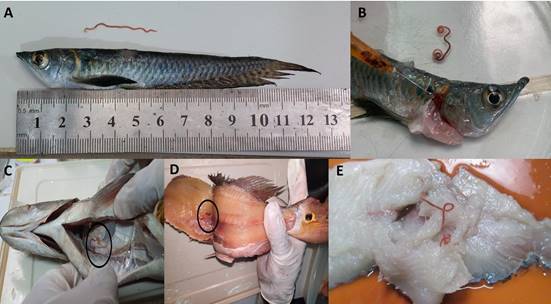
Figura 2 Eustrongylides sp. (Nematoda). A, B. Eustrongylides sp. extraído de músculo de Osteoglossum bicirrhosum “arahuana”. C, D. Presencia de Eustrongylides sp. en la musculatura de Cichla monoculus “tucunaré”, E. Vista de Eustrongylides sp. en musculatura de Hoplias malabaricus “fasaco”
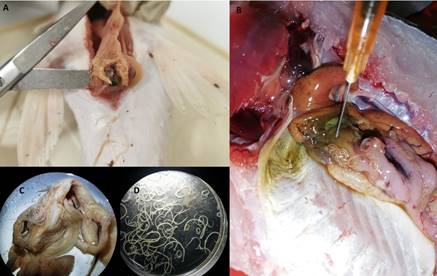
Figura 3 Nemátodos anisakídeos colectados em peces amazónicos. A. Anisakideos siendo extraídos de la cavidade abdominal de Brachyplatystoma vaillantii. B. Contracaecum sp. adheridos al mesenterio de Astronotus ocellatus “acarahuazú”. C. Anisakídeos adheridos a intestino, D. Anisakídeos en placas Petri.
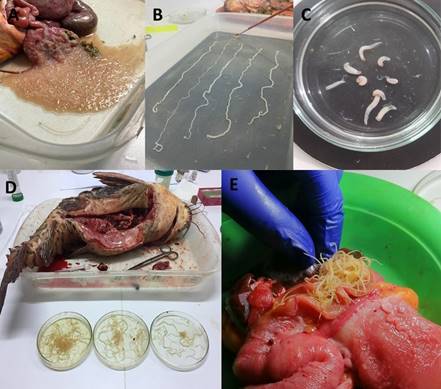
Figura 4 A. Nemátodos Rondonia rondoni de intestino de Pterodoras granulosus “cahuara”, B. Céstodos colectados de intestino de P. granulosus, C. Digeneos colectados de estómago e intestino de Pterodoras granulosus, D. Nemátodos colectados de intestino de Megalodoras uranoscopus “churero”, E. Intestino de M. uranoscopus com nemátodos.
DISCUSIÓN
Se analizaron en total 27 especies de peces ama- zónicos los cuales estuvieron parasitados por al menos una especie de parásito con potencial zoonótico; así mismo, se identificó en la mayo- ría de peces a los parásitos Eustrongylides sp., Anisakis sp., Contracaecum sp., Pseudoterranova sp., Clinostomum marginatum, Ithioclinostomun compactum; y Sebekia sp. los cuales son parásitos con potencial zoonótico.
La presencia de estos parásitos en una gran cantidad de especies comercializadas en los mercados de la ciudad despierta una alerta ante la posibilidad de ingerir accidentalmente algún parasito alojado en la musculatura o cavidad de los peces. Algunos registros de parásitos zoonóticos reportados en la Amazonia son descritos por Tuesta Rojas(2021) con ejemplares de P. punctifer “doncella” y P. tigrinum “tigre zúngaro” colectados del mercado Belén, en Iquitos-Perú, donde se identificaron parásitos zoonóticos correspondientes a Anisakis sp., Contracaecum sp., Pseudoterranova sp. y Eustrongylides sp. Todos estos parásitos fueron encontrados parasitando el intestino. En el presente estudio, analizando peces de mercados de la ciudad, se registraron los mismos parásitos, con el adicional de haber encontrado a Eustrongylides sp. parasitando no solo órganos internos, mas también la musculatura de P. punctifer “doncella” (Tuesta Rojas, 2021).
Así mismo el estudio realizado por (Morey et al., 2022) en donde se reporta la presencia de Eustrongylides sp. parasitando a especies de Paiche, Arahuana, pez cachorro, trigrinum, entre otros peces nos demuestra la presencia de este parásito zoonótico en especies de mucha demanda en los mercados de la ciudad. De igual manera el presente estudio demuestra que este parásito es uno de los que mayormente se encontró en los peces analizados.
El nemátodo de la familia Anisakidae Contracaecum sp. fue reportado por primera vez en la Amazonía peruana en Astronotus ocellatus (Agassiz, 1831) conocido popularmente en Perú como “acarahuazú” (Serrano et al., 2015). De muestras obtenidas del medio natural, se encontraron estos parásitos en el mesenterio de los peces. En el presente estudio, adicional a Contracaecum sp. se registró la presencia del pentastómido Sebekia sp. parasitando la piel y el estómago de A. ocellatus.
Para A. gigas “paiche” se registra la presen- cia del nemátodo Nilonema senticosum con una prevalencia de 100% parasitando la vejiga nata- toria de ejemplares provenientes de un centro de cultivo semiintensivo en Maynas, Loreto-Perú (Mathews et al., 2014). De igual forma Cotrina (2012) identificó también a N. senticosum y al trematodo Caballerotrema sp. en ejemplares A. gigas criados en cautiverio en estanques piscíco- las de Ucayali. En el presente estudio también se reporta a este parásito en la vejiga natatoria de ejemplares de A. gigas.
El parásito Eustrongylides sp. fue citado parasitando peces del mercado Belén, en la ciudad de Iquitos, Perú. Las especies de peces de consumo parasitadas por este nemátodo correspondieron a A. falcirostris, P. punctifer, C. monoculus, H. mala- baricus, H. scomberoides, R. vulpinus y S. rhombeus. La presencia de estos parásitos estuvo a nivel de músculo y cavidad visceral. En el presente trabajo, se encontró nuevamente a Eustrongylides sp. parasitando estos peces, confirmando su presencia en diferentes especies de peces de consumo comercializados en los mercados de la ciudad de Iquitos.
Un total de 78 especies de peces amazónicos fueron reportados por García Dávila et al. (2018) como peces de consumo en la Amazonía peruana, de los cuales, la mayoría son utilizados para la preparación, tanto de ceviche como de sushi regional. Estos platos típicos podrían aumentar el riesgo de infección accidental (Morey et al., 2022).
En conclusión, nuestro estudio ratifica la existencia de parásitos zoonóticos en peces de la Amazonía peruana, siendo importante como medida de alerta y precaución a la población y las autoridades debido a la ingesta de peces parasita- dos. La falta de reportes de parásitos zoonóticos afectando a humanos sea por la falta de estudios y profesionales especializados en la identificación y diagnóstico de este tipo de organismos, lo que puede estar llevando a manifestaciones erróneos, confundidas con casos de cólicos, náuseas, dolores abdominales, urticaria, alergias, las cuales pueden ser atribuidas a factores diversos sin considerar que realmente puedan deberse a la ingesta accidental de algún parásito zoonótico presente en la carne de pescado.












 uBio
uBio