Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Arnaldoa
Print version ISSN 1815-8242On-line version ISSN 2413-3299
Arnaldoa vol.25 no.1 Trujillo Jan./abr. 2018
http://dx.doi.org/http://doi.org/10.22497/arnaldoa.251.25106
ARTÍCULOS ORIGINALES
Desarrollo y efecto antimicótico in vitro de una crema de Tropaeolum majus L. (Tropaeolaceae) sobre Trichophyton rubrum (Arthrodermataceae)
Development and Antifungal in Vitro Effect of a Tropaeolum Majus L. (Tropaeolaceae) Cream on Trichophyton Rubrum (Arthrodermataceae)
Carmen Isolina Ayala Jara1a, Ericson Felix Castillo Saavedra1b, Lucy Carmen Villanueva Sedano1c, Tania Magaly Medina Espinoza1d & Luis Ernesto Seclén Ayala2e
1 Facultad de Farmacia y Bioquímica, Universidad Nacional de Trujillo, Trujillo, PERÚ.
2 Facultad de Medicina, Universidad Nacional de Trujillo, Trujillo, PERÚ.
Resumen
El estudio estuvo orientado en desarrollar una crema a base de flores de Tropaeolum majus L. (Tropaeolaceae) y evaluar su efecto in vitro en cepas de Trichophyton rubrum (Arthrodermataceae). Se obtuvo el extracto estandarizado de las flores, luego se determinó la concentración mínima inhibitoria (CMI) y la concentración mínima fungicida (CMF); se diseñó y elaboró la formulación de la crema y se evaluó su efecto antifúngico in vitro, usando como patrón la crema de isoconazol al 1%. Para determinar diferencia significativa en ambas cremas, se compararon los halos de inhibición obtenidos mediante la prueba "t" de Student con un nivel de significancia estadística de 0,05. La CMI fue de 1,8 g/mL y la CMF fue de 1,9 g/mL; en el estudio de preformulación de excipientes con el extracto estandarizado de Tropaeolum majus no ocurrieron cambios. Los controles de calidad organolépticos, fisicoquímicos y microbiológicos de la crema antimicótica coincidieron con las especificaciones establecidas. Se logró desarrollar la crema antimicótica con calidad farmacéutica; la evaluación del efecto in vitro en cepas de Trichophyton rubrum, con halos de inhibición semejantes de 33,15 + 3,26 mm, demuestran que tiene efecto antimicótico similar a la crema patrón de isoconazol al 1%.
Palabras clave: crema antimicótica, Tropaeolum majus, Trichophyton rubrum.
Abstract
The study was aimed to develop a flower-based cream of Tropaeolum majus L. (Tropaeolaceae) and to evaluate its in vitro effect on Trichophyton rubrum (Arthrodermataceae) strains. The standardized extract of the flowers was obtained, then the minimum inhibitory concentration (MIC) and minimum fungicide concentration (MFC) were determined; the cream formulation was designed and elaborated and its antifungal in vitro effect was evaluated, using isoconazole 1% cream as standard. To determine significant difference in both creams, we compared the obtained inhibition halos by Student’s t-test with a level of statistical significance of 0.05. The MIC was 1.8 g/mL and the MFC was 1.9 g/mL; in the study of preformulation of excipients with the standardized extract of Tropaeolum majus there were no changes. The organoleptic, physicochemical and microbiological quality controls of the antifungal cream matched with the established specifications. We could develop the antifungal cream with pharmaceutical quality; the evaluation of the in vitro effect on Trichophyton rubrum strains, with inbibition halos of 33.15 + 3.26 mm, shows that it has an antifungal effect similar with the standard cream isoconazole 1%.
Keywords: antifungal cream, Tropaeolum majus, Trichophyton rubrum.
Introducción
La dermatofitosis representa la micosis superficial causada por un grupo heterogéneo de hongos que tienen la capacidad de invadir tejidos queratinizados de hombres y animales, los géneros comúnmente involucrados en estas infecciones son Trichophyton, Microsporum y Epidermophyton. A nivel mundial se estima que aproximadamente el 20-25% de la población es afectada por esta patología. En la región Amazonas, este problema presenta la mayor incidencia de las infecciones superficiales micóticas, respecto al Perú la dermatomicosis más frecuente es la onicomicosis con un 43,6% y el agente patógeno de mayor prevalencia es el Trichophyton rubrum con un 33,2%, siendo el responsable de las principales consultas médicas por micosis en el pie, ingle y uñas (Bejar et al., 2014; Pires et al., 2014; Uribe & Cardona, 2013).
Los dermatofitos actualmente muestran respuesta ante los anti fúngicos en el mercado; no obstante el tratamiento para estas patologías es prolongado, ocasionando un elevado gasto en el sector salud de todos los países; por lo que, la necesidad de encontrar nuevas fuentes de alternativas terapéuticas es indiscutible, frente a esta situación el uso de productos naturales ha surgido como respuesta a este problema, entre ellos, el uso de plantas medicinales, que contienen diversidad química y actividad biológica para combatir enfermedades (Biasi et al., 2016).
Tropaeolum majus es un cultivo originario de los andes de Sudamérica perteneciente a la familia Tropaeolaceae, planta anual o perenne, posee hojas orbiculares, ligeramente lobulado o peltadas con el limbo entero, fuertemente divididas con una notable venación, tienen de 4 a 10 cm de diámetro; largos pecíolos, encogidos en espiral. Pétalos enteros, unguiculados, los tres inferiores más angostos, con las uñas laciniadas. Flores tubulares rojizas, anaranjadas o amarillas, abiertas al final en forma de trompeta, de 3 a 4 cm de diámetro; cáliz amarillento, prolongado hacia atrás en un espolón de 2 a 3 cm de largo; fruto subcarnoso, de 1 - 1,5 cm de diámetro, globoso, con tres ángulos redondeados (Arellano et al., 2015; Sánchez et al., 2003).
Según la literatura esta planta presenta propiedades antibacterianas, antiinflamatorias, antisépticas y antifúngicas, debido a que posee dentro de su composición química a flavonoides como quercetina, isoquercetina, luteína, kaempferol, zeaxantina, ácido clorogénico, taninos, sales minerales, ácido oxálico, espilantol. Compuestos de azufre: glucotropaeolósido que es un heterósido sulfurado o también llamado glucosinolato que es el responsable del sabor picante de la planta, y se descompone en isocianato de bencilo o glucotropaeolina que posee propiedades antibióticas, expectorantes. Las hojas contienen ácido ascórbico e isoquercitrósido. Las flores contienen helenina, mirosina. Además, posee pigmentos: la sorbusina y carotenoides, resinas, pectinas (Aguilar et al., 2017; Arellano et al., 2015).
En este contexto, se planteó el desarrollo de una crema antimicótica a base del extracto estandarizado de flores de Tropaeolum majus L. (Tropaeolaceae) y evaluación de su efecto in vitro en cepas de Trichophyton rubrum (Arthrodermataceae).
Material y métodos
Material
Se utilizó como material de estudio 100 g de flores color rojo semillas de Tropaeolum majus obtenidos de la prov. Otuzco, región La Libertad, Perú; cepas clínicas de Trichophyton rubrum, e Isoconazol al 1 % en crema por 20 g
Método
Para la obtención de extracto hidroalcohólico estandarizado se trabajó con flores exclusivamente de color rojo, para tal fin se procedió a seleccionar las flores en buen estado, luego se dejó secar a temperatura ambiente por 21 días, protegido de la luz, después se realizó la molienda durante 2 minutos, obteniéndose un índice de finura de 2,2; luego se colocó en etanol al 80%, se mezcló y se dejó en reposo durante 1 semana, con agitación diaria de un lapso de 10 minutos; transcurrido el tiempo indicado, se colocó en un agitador magnético durante 01 hora, seguidamente se procedió a centrifugar a 4000 rpm durante 20 minutos, después se filtró y almaceno a 4°C. Se realizaron los controles de calidad respectivos en muestras del extracto.
La determinación de la concentración mínima inhibitoria (CMI) y concentración mínima fungicida (CMF) del extracto estandarizado de flores de T. majus fue realizada en el Laboratorio de Microbiología de la Facultad de Ciencias Biológicas de la Universidad Nacional de Trujillo (Bernal et al., 2005; Thomson et al., 2011).
Respecto a la composición de la crema, se utilizó el extracto estandarizado de flores de T. majus, excipientes y conservantes. Los excipientes utilizados fueron de uso generalizado para esta forma farmacéutica. La crema obtenida se preservó de la luz en frascos opacos debido a la fotosensibilidad del extracto de flores de T. majus (Martini, 2005).
En el estudio de preformulación, se colocó el extracto en proporciones adecuadas con cada uno de los excipientes de la formulación. Se envasaron en botellas de polietileno blancas con válvula de dispensación de 4 cc previamente esterilizadas, y se colocaran a temperatura ambiente por un mes, valorando aspectos organolépticos y pH. Las determinaciones se realizaron a tiempo 0, 7, 15 y 30 días (Gómez et al., 1998).
El control de calidad de la crema a base de flores de T. majus consideró las características organolépticas (aspecto, color y olor); evaluación de la sensación en piel; nivel de acidez y ensayos de estabilidad (Bezada et al., 2016).
Respecto a la estabilidad, la crema elaborada se sometió a estudios acelerados de estabilidad en estufa a 40oC durante 8 días y luego en refrigerador a 4oC por un período de tiempo igual; para observar signos de inestabilidad (cremado, ruptura, entre otros). También, se observaron muestras a temperatura ambiente durante 3 meses, valorando aspectos organolépticos y pH. Las determinaciones se realizaron a tiempo 0, 7 y 15 días, primer, segundo y tercer mes (Gómez et al., 1998; Rodríguez et al., 1996).
El control microbiológico se realizó en el Laboratorio de Microbiología de la Facultad de Ciencias Biológicas de la Universidad Nacional de Trujillo, mediante el método de recuento de microorganismos mesófilos aerobios totales (Gómez et al., 1998; Thomson et al., 2011).
Finalmente, después de todos los estudios respectivos antes, durante y después de la elaboración de la crema a base de flores de T. majus, se procedió a la evaluación de su efecto in vitro en cepas de T. rubrum en el Laboratorio de Microbiología de la Facultad de Ciencias Biológicas de la Universidad Nacional de Trujillo.
Para la evaluación del efecto in vitro de la crema a base de T. majus sobe cepas de Trichophyton rubrum se utilizaron tablas de distribución de frecuencia bidimensional con sus valores absolutos y relativos; así mismo se utilizaron indicadores como la media y desviación estándar para obtener los resultados de la investigación. Para determinar si existe diferencia en cada una de las cremas a base de T. majus y la crema antimicótica de Isonocazol al 1%, se compararon los halos de inhibición obtenidos en milímetros mediante la prueba "t" de Student con un nivel de significancia estadística de 0,05. Los datos fueron procesados con ayuda de una hoja de cálculo Excel y el software statistic VER 22 (Cano et al., 2008; Rodríguez et al., 1996).
Resultados y discusión
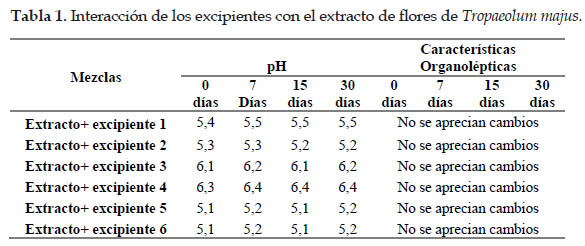
En el estudio de preformulación se evaluó la posibilidad de interacción entre el extracto de Tropaeolum majus y los componentes de la formulación en ensayo (Tabla 1), observándose que no ocurrieron cambios en los parámetros analizados. La influencia de los excipientes en la estabilidad física del producto aportó datos valiosos y necesarios para seleccionar la formulación final.
Los excipientes utilizados para la elaboración de la crema son de uso generalizado para esta forma farmacéutica. El control de calidad de la crema terminada se realizó por evaluación de sus características organolépticas, pH, estabilidad térmica y control microbiológico (Bezada et al., 2016; Gómez et al., 1998). En el análisis de la evaluación de la sensación al aplicar en la piel, no se observaron fenómenos de irritación o inflamación, lo que le proporciona buena tolerancia en la piel, y se le atribuiría a la presencia de fenoles totales, flavonoides y taninos (Arellano et al., 2015; Cano et al., 2008; Thomson et al., 2011). En este sentido, las flores de "mastuerzo" (Tropaeolum majus L.) se constituye en una alternativa de uso en la industria farmacéutica, a un costo accesible a la población y con potencial efecto terapéutico.
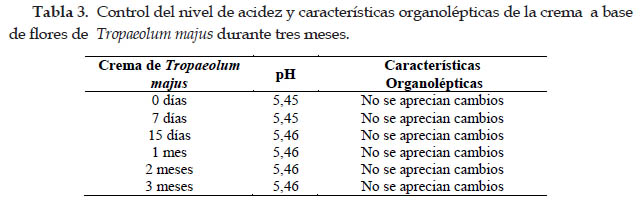
Para el control de calidad de la formulación se llevó a cabo el análisis de los parámetros fisicoquímicos característicos de este tipo de formulación (Tablas 2, 3 y 4), encontrándose dentro de las especificaciones aceptables.
Los ensayos de estabilidad mostraron que no existe variación en las características organolépticas de la formulación tanto en estufa, refrigeración y a temperatura ambiente. Los excipientes utilizados en el desarrollo de esta formulación, proporcionan al producto la máxima estabilidad de acuerdo a los resultados de los ensayos realizados (Tablas 3 y 4).
El pH no sufrió un decrecimiento a los 3 meses de formulada, pero dentro de los límites propuestos, con muy bajos valores de desviación estándar, lo cual avala la precisión de la determinación. El pH resultante en la crema viene dado fundamentalmente por el sistema buffer formado entre la forma disociada y no disociada, especies en equilibrio en la formulación. Ambos son insolubles en la fase acuosa, pero la forma base lo es aún más, por lo que, se encuentra en estado sólido o en mayor proporción disuelta en la fase oleosa, con la cual tiene mayor afinidad. Por esta razón, durante el almacenamiento, la tendencia es a que la concentración disminuya en fase acuosa (Calzadilla et al., 2014).
El control microbiológico de la crema realizado mediante el recuento total de bacterias aerobias mesófilas viables, fue en promedio de 4 UFC/g de la crema (Tabla 5).
Los ensayos del control de calidad de la crema elaborada se realizaron según regulaciones actuales vigentes en el país, obteniéndose resultados satisfactorios, que aseguran la obtención final de un producto de calidad farmacéutica (Bezada et al., 2016).
En cuanto a la evaluación in vitro de la formulación desarrollada, se observó efecto similar a la crema usada como patrón (Isoconazol al 1%), debido a la semejanza del promedio de los halos de inhibición de 33,15 + 3,26 mm frente a las cepas de Trichophyton rubrum. Los datos obtenidos motivarían a continuar con esta investigación a nivel clínico; siendo la eficacia y la seguridad los parámetros que se evalúan en el desarrollo de medicamentos.
En la actualidad, existen investigaciones sobre la efectividad de cremas formuladas a base del extracto hidroalcohólico de las flores y hojas de T. majus en cepas de Trichophyton mentagrophytes, que utilizaron el modelo animal "cuy" como prototipo para el tratamiento de la dermatomicosis (Bezada et al., 2016). De la misma forma, otro estudio determinó el efecto in vitro del extracto etanólico de Tropaeolum majus sobre cepas de Trichophyton mentagrophytes a concentraciones de 0,1%; 0,2%; 0,3%; 0,35% y 0,4% (Aguilar et al., 2017).
Conclusiones
La evaluación in vitro de la crema de Tropaeolum majus L. (Tropaeolaceae) desarrollada sobre cepas de Trichophyton rubrum (Artrodermataceae), demostró que tiene efecto antimicótico similar a la crema de isoconazol al 1% utilizada como patrón debido a la presencia de halos de imbibición semejante de 33,15 + 3,26 mm, no existiendo diferencia significativa; lo que permite concluir que es una potencial alternativa de tratamiento para las micosis de la piel producidas por la cepa estudiada; no obstante, se recomienda seguir con el estudio en animales de experimentación, para posteriormente realizar un ensayo clínico y demostrar su efecto antimicótico y brindar a la comunidad un nuevo fitomedicamento.
Contribución de los autores
C. A. & E. C.: Concepción, revisión crítica del proyecto y aprobación de la versión final. L. S.: Recolección de datos, análisis de datos, revisión crítica del texto.
L.V. & T. M.: Análisis, interpretación de los datos, revisión crítica del texto.
Conflictos de interés
Los autores declaran no tener conflictos de interés.
Literatura citada
Aguilar, D.; S. Avalos; P. Rojas; I. Marquillo & M. Ayala. 2017. Efecto del extracto etanólico de Tropaeolum majus "mastuerzo" sobre la micosis inducida por Trichophyton mentagrophytes en Rattus norvegicus. Acta Med Perú 34(3):196-202. [ Links ]
Arellano, K.; J. Herrera; M. Solano; C. Espinoza; N. Veliz & W. Orihuela. 2015. Evaluación de los compuestos fenólicos y capacidad antioxidante de tres colores de pétalos de mastuerzo (Tropaeolum majus L.). Rev. Soc. Quím. Perú 81 (4): 319-327. [ Links ]
Bejar, V.; F. Villanueva; J. Guevara; S. González; G. Vergaray; E. Abanto; K. Napám; L. Velásquez & Vergaray. 2014. Epidemiología de las dermatomicosis en 30 años de estudio en el Instituto de Medicina Tropical Daniel A Carrión, Universidad Nacional Mayor de San Marcos, Lima, Perú. An Fac Med. 75 (2):167-172 [ Links ]
Bernal, A.; J. Zamora; G. Virgen & R. Nuño. 2005. Actividad biológica in vitro de extractos de Lupinus spp. sobre hongos fitopatógenos. Rev. mex. fitopatol. 23 (2):140-146. [ Links ]
Bezada, S.; F. Ramírez; J. Ruiz; J. Guevara; F. Carcelén. 2016. Evaluación del extracto hidroalcohólico de "mastuerzo" (Tropaeolum majus) en formulación crema para el tratamiento de la dermatomicosis causada por Trichophyton mentagrophytes en el "cuy" (Cavia porcellus). Rev. Per. Quím. Ing. Quím. 19(1): 55-61. [ Links ]
Biasi, R.; F. Demitto; R. Ribeiro; M. Assunção; L. Lira; Estivalet; L. Baeza & S. Yamada. 2016. Antifungal potential of plant species from Brazilian Caatinga against dermatophytes. Rev Inst Med Trop Sao Paulo 58: 18. [ Links ]
Calzadilla, W.; S. Moreno; O. García; E. Besada & Y. Suárez. 2014. Estabilidad de la crema reformulada de nitrato de miconazol al 2 %. Rev Cubana Farm 48 (4): 562-572. [ Links ]
Cano, C.; P. Bonilla; M. Roque & J. Ruiz. 2008. Actividad antimicótica in vitro y metabolitos del aceite esencial de las hojas de Minthostachys mollis (muña). Rev. perú. med. exp. salud publica 25 (3): 298-301. [ Links ]
Gómez, M.; M. López & G. García. 1998. Diseño de una formulación antimicótica. Rev Cubana Farm 32 (1): 13-20. [ Links ]
Martini, M. 2005. Introducción a la Dermofarmacia y a la Cosmetología. España: Acribia, S. A. 2005. [ Links ]
Pires, C.; N. Cruz; A, Lobato; P. Sousa; F. Carneiro & A. Mendes. 2014. Clinical, epidemiological, and therapeutic profile of dermatophytosis. An Bras Dermatol. 89 (2):259-265. [ Links ]
Rodríguez, A.; M. León; A. Hernández & J. Junco. 1996. Actividad antifúngica in vitro de una crema de Plantago major L. Rev Cubana Plant Med 1 (3): 9-12. [ Links ]
Sánchez, P.; P. Gil & D. Sánchez. 2003. Las plantas silvestres. Los remedios históricos dermatológicos. Med Cutan Iber Lat Am 31 (5): 337-346. [ Links ]
Thomson, P.; S. Anticevic; B. Rodríguez & V. Silva. 2011. Actividad antifúngica y perfil de seguridad del producto natural derivado del aceite de maravilla ozonizado (AMO3) en dermatofitos. Rev. chil. Infectol 28 (6): 512-519. [ Links ]
Uribe, M. & N. Cardona. 2013. Mecanismos de adherencia e invasión de dermatofitos a la piel. Rev CES Med 27 (1): 67-75. [ Links ]
Recibido: 10-I-2018
Aceptado: 20-II-2018
Publicado online: 15-III-2018
Publicado impreso: 30-IV-2018