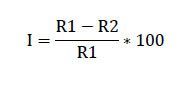Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Arnaldoa
versión impresa ISSN 1815-8242versión On-line ISSN 2413-3299
Arnaldoa vol.25 no.2 Trujillo mayo/ago. 2018
http://dx.doi.org/http://doi.org/10.22497/arnaldoa.252.25209
ARTÍCULOS ORIGINALES
Eficacia de fungicidas químicos para el control in vitro de diferentes fitopatógenos en condiciones controladas
Effectiveness of Chemical Fungicides for in Vitro Control of Different Phytopathogens in Controlled Conditions
Diana Alburqueque Andrade & Roberto Gusqui Mata
Especialidad de Manejo Integrado de Plagas, Escuela de Posgrado, Universidad Nacional Agraria La Molina. Av. La Molina s/n, La Molina – Lima, PERÚ
diana_16065@hotmail.com ; rober togm_83@yahoo.es
Resumen
El Perú presenta un alto potencial productivo debido a las condiciones climáticas idóneas y un suelo favorable para el cultivo de diferentes productos de agroexportación, pero los problemas fitosanitarios causados por distintos patógenos en las diferentes etapas fenológicas del cultivo generan mermas de importancia en calidad y cantidad de producto cosechado en campo y en poscosecha. Por ello, esta investigación tuvo como objetivo medir la eficacia de productos químicos mediante la prueba de alimento envenenado in vitro. Se probaron siete ingredientes activos: tiabendazol, azoxistrobin, carbendazim, sulfato de cobre pentahidratado, fosfito de cobre, clorotalonil y extracto de Melaleuca alternifolia. Para ello, se evaluó el porcentaje de inhibición de crecimiento de micelio (PICM); en esta prueba in vitro se obtuvo un 100 % PICM para: R. solani con sulfato de cobre pentahidratado; P. infestans y S. sclerotiorum con azoxystrobin; R. solani, F. oxysporum, L. theobromae, S. sclerotiorum, C. gloeosporoides y Penicillium spp. con carbendazim; F. oxysporum, B. cinerea, L. theobromae, S. sclerotiorum con fosfito de cobre; R. solani, F. oxysporum, L. theobromae y Penicillium spp. con tiabendazol. El extracto de Melaleuca alternifolia presentó el menor PICM para F. oxysporum y R. solani con una inhibición del patógeno del 69,50 y 64,75 % respectivamente.
Palabras clave: tiabendazol, azoxistrobin, carbendazim, sulfato de cobre pentahidratado, fosfito de cobre, clorotalonil, in vitro, R. solani, P. infestans, S. sclerotiorum, F. oxysporum, L. theobromae, C. gloeosporoides, B. cinerea, Penicillium spp.
Abstract
Peru has a high productive potential due to ideal climatic conditions and a favorable soil for the cultivation of different agricultural export products, but the phytosanitary problems caused by different pathogens in the different phenological stages of the crop generate significant losses in quality and quantity of product harvested in the field and after harvest. Therefore, this research aimed to measure the effectiveness of chemical products through the poisoned food test. In vitro, seven active ingredients were tested: tiabendazole, azoxystrobin, carbendazim, copper sulfate pentahydrate, copper phosphite, chlorothalonil and extract of Melaleuca alternifolia. For this, the percentage of inhibition of mycelial growth (PIMG) was evaluated. In this in vitro test, 100 % PIMG was obtained for: R. solani with copper sulfate pentahydrate; P. infestans and S. sclerotiorum with azoxystrobin; R. solani, F. oxysporum, L. theobromae, S. sclerotiorum, C. gloeosporoides and Penicillium spp with carbendazim; F. oxysporum. B. cinerea, L. theobromae, S. sclerotiorum with copper phosphite; R. solani, F. oxysporum, L. theobromae and Penicillium spp. with tiabendazole. The extract of Melaleuca alternifolia had the lowest PIMG for F. oxysporum and R. solani with an inhibition of the pathogen of 69.50 and 64.75 % respectively.
Keywords: tiabendazole, azoxystrobin, carbendazim, copper sulfate pentahydrate, copper phosphite, chlorothalonil, in vitro. R. solani, P. infestans, S. sclerotiorum, F. oxysporum, L. theobromae, C. gloeosporoides, B. cinerea, Penicillium spp.
Introducción
En la agricultura mundial los hongos fitopatógenos son causantes de enfermedadesenpreyposcosechaencultivos de hortalizas, cereales y frutas. Generando pérdidas económicas cuantiosas (Agrios, 2005). Una amplia gama de estos hongos son causantes del deterioro patológico en una variedad de productos y se estiman perdidas de 5-25% en paises desarrollados y 20-50% en paises en desarrollo (FHIA, 2007). Las enfermedades en las plantas son una limitante para cualquier cultivo (Investigación y Desarrollo, 2010). Los hongos de los géneros Phythophthora spp., Fusarium spp., Colletotrichum spp., Rhizoctonia spp., Botrytis spp., Sclerotinia spp., Lasiodiplodia spp. y Penicillium spp. constituyen un grupo de patógenos de mucha importancia en ocasionar diferentes enfermedades en cultivos de hortalizas y frutales debido a su gran número y ha su enorme capacidad de reproducción (García, 2004). Los hospederos de estos hongos pueden ser la semilla, la parte vegetativa, frutos y las malezas adyacentes al cultivo (Dávila, 2000). Por ello, el objetivo de esta investigación es conocer la eficacia de fungicidas químicos para el control de hongos que causan enfermedad a diferentes cultivos de exportación.
Materiales y métodos
El presente trabajo de investigación se realizó en el laboratorio de Fitopatología de la Universidad Nacional Agraria La Molina (UNALM).
Especies de hongos y origen. Se aisló Lasiodiplodia teobromae de "palto" (Persea americana Will), Rhizoctonia solani de "frijól" (Phaseolus vulgaris L), Fusarium oxysporum de "tomate" (Solanum licopersicum Will), Botrytis cinerea de "fresa" (Fragaria vesca L.), Colletotrichum gloeosporoide de "mango" (Mangifera indica), Sclerotinia sclerotiorum de "pimiento" (Capsicum annum L.), Penicillun spp. de "mandarina" (Citrus reticulata) mientras que, para Phythophthora spp. se utilizó un cultivo puro aislado previamente en el laboratorio de fitopatología de la UNALM.
Aislamiento e identificación de hongos patógenos. Las muestras se obtuvieron del campo del Programa de Frutales y hortalizas de la UNALM, estas muestras fueron desinfestadas con hipoclorito de sodio al 1% por 1 minuto y fueron enjuagadas 3 veces con agua destilada y secadas en la cámara de flujo laminar por un lapso de 30 minutos. Posteriormente, se cortaron porciones de tejidos de tallo y ramas con síntomas del patógeno para el caso de (L. teobromae, R. solani, F. oxysporum, S. sclerotiorum). Fracciones de micelio para el caso de (B. cinerea, C. gloeosporoides). Se sembraron en placas Petri con papa, dextrosa, agar (PDA) + azitromicina y colocaron en una incubadora a 25°C hasta el desarrollo de micelio. Al cabo de tres a siete días después, se obtuvieron colonias axénicas y se realizó la identificación morfológica utilizando la clave de Barnett y Hunter (1972). Para el caso de Penicillium spp. Se realizó un cultivo monospórico. Phythophthora spp. fue proporcionado por un alumno de Post grado de la especialidad de Fitopatología de la UNALM. Estos últimos patógenos fueron sembrados medio PDA, al igual que el resto de hongos e incubados a la misma temperatura.
Pruebas de eficacia de fungicidas químicos. Se empleó la técnica de alimento envenenamiento (Dhingra & Sinclair, 1985) que consistió en, colocar discos de 5 mm de diámetro con micelio del patógeno al centro de la placa Petri contenido con medio agar papa dextrosa (PDA) más fungicida a la dosis comerciales (Tabla 1). Como testigo se empleó discos del patógeno sobre medio PDA sin fungicida. Todas las placas sembradas fueron incubadas a 25°C y se evaluaron diariamente midiéndose el crecimiento radial del patógeno en (mm) de los 4 cuadrantes trazados en la parte posterior de las placas Petri. La evaluación concluyó cuando el micelio del patógeno cubrió totalmente la placa del tratamiento testigo. La eficacia de los fungicidas en el control del patógeno, se expresó como el porcentaje de inhibición del crecimiento micelial (PICM). Para esto se empleó la fórmula de Pandey et al. (1982) que se muestra a continuación.
Donde:
Diseño Experimental. Se empleó un diseño completamente al azar (DCA), el cual tuvo 07 tratamientos (con fungicida), 01 testigo (sin fungicida) y cada tratamiento con 05 repeticiones. Se utilizó el programa estadístico SAS versión 9,1 para procesar los datos y se analizaron mediante un ANOVA y comparación de medias a través de la prueba de Tukey (α≤0.05).
Resultados y discusión
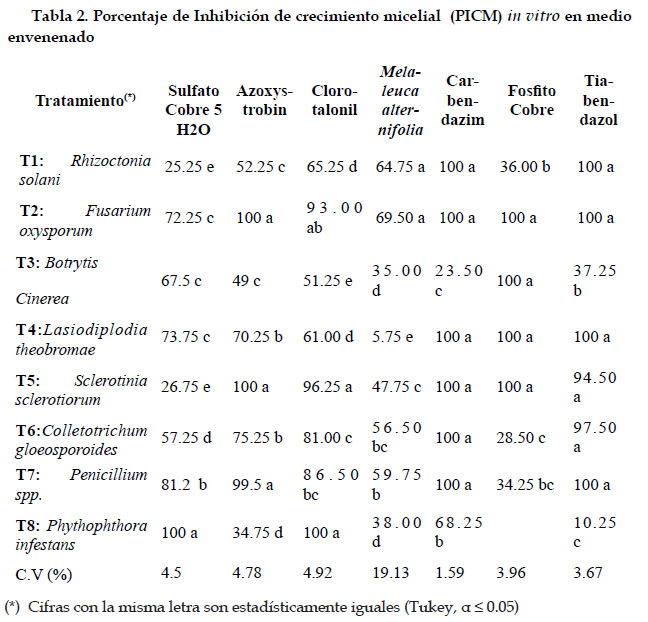
En la tabla N°2 se observa el porcentaje de inhibición del crecimiento micelial de los diferentes patógenos en los cuales para el análisis de varianza realizado para un alfa de 0,05 se observa que existen diferencias significativas para cada uno de los tratamientos.
Sulfato de cobre pentahidratado.
El mejor control fue para el tratamiento T8 (P. infestans) el mismo que presento 100% de PICM. Seguido de los tratamientos T7 (Penicillium spp.) y los tratamientos T2, T3 y T4 (F. oxyxporum, B. cinerea y L. theobromae) respectivamente, estos últimos no presentaron diferencias significativas entre sí, y los tratamientos que presentaron menor PICM fueron los tratamientos T6 (C. gloeosporoides) y el T1 (R. solani). El coeficiente de variación para esta prueba fue de 4,5 %. El fungicida sulfato de cobre penta-hidratado resulto ser el mejor tratamiento para el control de P. infestans in vitro. Pertenece al grupo químico inorgánico y actúa por contacto en varios sitios (FRAC, 2016). Inhibiendo la germinación de esporas, intoxicación y bloqueo de procesos respitarios, disminuye la biosíntesis de proteínas de los hongos (Herrero, 2005).
Azoxystrobin. Los tratamientos con mayor PICM fueron: T2 (F. oxysporum), T5 (S. sclerotiorum) y T7 (Penicillum spp.), con un valor superior a 99,5 % los mismos que no presentaron diferencias significativas entre sí. Los tratamientos: T4 (L. theobromae), T6 (C. gloeosporoides) no presentaron diferencias significativas entre sí con un PICM de 70,25% y 75,25% respectivamente, lo propio ocurrió con los tratamientos T1 (R. solani), T3 (B. cinerea), que no tuvieron diferencia significativa entre si y presentaron un PICM de 52,25% y 49% respectivamente. Estos últimos cuatro tratamientos tuvieron un control parcial de los diferentes patógenos. El tratamiento T8 (P. infestans) presentó un menor PICM con un valor de 34,75%. El coeficiente de variación para esta prueba fue de 4,78%. La acción antifúngica del Azoxystrobin se vio reflejada en el control in vitro de F. oxysporum, S. sclerotiorum y Penicillium spp. Dejando que estos patógenos no se desarrollen en el medio envenenado.
Este fungicida pertenece al grupo químico Metoxi-acrilatos. Inhibe la respiración mitocondrial en las células de los patógenos (FRAC, 2016). Detiene la transferencia de electrones entre el citocromo b al c1, en el sitio de oxidación del ubiquinol, causando la no formación de ATP, energía para el trabajo celular en el complejo III del citocromo bc1 (ROTAM, 2016). Puede ser transportado acropetalmente y de forma translaminar dentro de las hojas. Debido a este particular debe ser aplicado de manera preventiva (SYNGENTA, 2017).
Clorotalonil. Presentó mayor control en los tratamientos T8 (P. infestans), T5 (S. sclerotiorum) con un PICM de 100% y 96,25% respectivamente. El tratamiento T2 (F. oxysporum) es estadísticamente similar al T7 (Penicillium spp.) y a su vez este tratamiento es estadísticamente similar al T6 (C. gloeosporoides), pero este último tratamiento es estadísticamente diferente al T2 (F. oxysporum). Los tratamientos con menor PICM fueron los tratamiento T4 (L. theobromae) y T3 (B. cinerea) con valores de 61% y 51,25% respectivamente. El coeficiente variación para este esta prueba fue de 4,92%. Este fungicida inhibió el crecimiento de P. infestans, S. sclerotiorum en alimento envenenado en las pruebas in vitro. La acción anti fúngica es por contacto con actividad multisitio (FRAC, 2017). El producto inhibe la respiración de las células del hongo, debido a que las moléculas del Clorotalonil se unen a grupos sulfhidrilo de los aminoácidos. Las enzimas que afectan al ciclo de Krebs se desactivan y no se produce ATP (ARISTA, 2017).
Melaleuca alternifolia. El mayor PICM se presentó en los tratamientos T1 (R. solani) y T2 (F. oxysporum) que presentaron valores de 64,75% y 69,50% respectivamente, en estos dos tratamientos no hubo diferencias estadísticas entre sí. Un PICM parcial se presentó en los tratamientos T7 (Penicillium spp.) y T6 (C. gloeosporoides) que son estadísticamente similares, a su vez el T6 (C. gloeosporoides) es estadísticamente similar al T5 (S. sclerotiorum) y este último tratamiento es estadísticamente diferente al T7 (Penicillium spp). Los tratamientos con menor grado de PICM fueron: T8 (P. infestans), T3 (B. cinerea) y T4 (L. theobromae) con valores de 38%, 35% y 5,75% respectivamente. Cabe destacar que entre los tratamientos T8 (P. infestans) Y T3 (B. cinerea) no hay diferencias significativas entre sí. El coeficiente de variación para esta prueba fue de 19,13%. En la prueba de efectividad del extracto de M. alternifolia se observó mayor control para R. solani y F. oxysporum. Mediante la inhibición del desarrollo de la germinación de esporas, inhibición del crecimiento del micelio (SYNGENTA, 2017).
Carbendazim. El mejor control se presentó en los tratamientos: T1 (R. solani), T2 (F. oxysporum), T4 (L. theobromae), T5 (S. sclerotiorum), T6 (C. gloeosporoides) y T7 (Penicillium spp.) con un PICM del 100% para cada tratamiento, cabe destacar que en todos estos tratamientos no hubo diferencias estadísticas entre sí. Un control parcial se observó en el T8 (P. infestans) con un PICM de 68,25%. El menor control se observó en el tratamiento T3 (B. cinerea) con un PICM de 23,50%. El coeficiente de variación para esta prueba fue de 1,59%. La efectividad de este fungicida en la prueba de alimento envenenado in vitro arrojo los mejores resultados para R. solani, F. oxysporum, L. theobromae, T5 S. sclerotiorum, C. gloeosporoides y Penicillium spp. El carbendazin pertenece al grupo químico de los benzimidazoles. Inhibe el ensamble de la Beta-tubulina en la mitosis (FRAC, 2017). También Inhibe la formación del apresorio, el crecimiento y desarrollo del micelio de Alburqueque & Gusqui: Eficacia de fungicidas químicos para el control in vitro de diferentes fitopatógenos en condiciones controladas los patógenos (SILVESTRE, 2017).
Fosfito de Cobre. El mejor control se presentó en los tratamientos T2 (F. oxysporum), T3 (B. cinerea), T4 (L. theobromae) y T5 (S. sclerotiorum) con un PICM del 100% para cada tratamiento, cabe destacar que no hubo diferencias estadísticas entre estos tratamientos. Un control parcial se observó en los tratamientos T1 (R. solani) y T7 (Penicillium spp.) con un PICM de 36% y 34,25% respectivamente, cabe mencionar que estos tratamientos son estadísticamente similares, a su vez el tratamiento T7 (Penicillium spp.) es estadísticamente similar al tratamiento T6 (C. gloeosporoides), pero el T6 (C. gloeosporoides) es estadísticamente diferente al T1 (R. solani). El coeficiente de variación para esta prueba fue de 3,96%. Se observó mayor eficacia del fosfito de cobre sobre F. oxysporum, B. cinerea, L. teobromae y S. sclerotiorum. Este ion compite con el fósforo en diversas rutas metabólicas catalizadas por diversas enzimas fosforilativas. Obstruye los procesos implicados en transferencia energética del hongo, sufren un considerable retraso e incluso pueden llegar a bloquearse (Alfaro, 2011).
Tiabendazol. Los mejores controles con un 100 % PICM se observó en los tratamientos T1 (R. solani), T2 (F. oxysporum), T4 (L. theobromae) y T7 (Penicillium spp.) A su vez, los tratamientos T5 (S. sclerotiorum) y T6 (C. gloeosporoides) presentan un PICM de 94,50 y 97,50 % respectivamente. Cabe destacar que estos tratamientos no presentan diferencias significativas entre sí. En los tratamientos T3 (B. cinerea) y T8 (P. infestans) se observó un control deficiente de los patógenos con un PICM de 37,25 y 10,25 respectivamente. Estos dos últimos tratamientos presentan diferencias significativas entre sí. El coeficiente de variación para esta prueba fue de 3,67 %. La mayor eficacia de este fungicida se observó en R. solani, F. oxysporum, L. theobromae y Penicillium spp. Evitando el crecimiento de los patógenos en la prueba de alimento envenenado in vitro. Este fungicida pertenece al grupo químico de los benzimidazoles. Su modo de acción es sistémico, protector y curativo. Inhibe la mitosis, afectando el crecimiento y desarrollo del patógeno (FRAC, 2017).
Conclusiones
Para la prueba de inhibición del crecimiento micelial (PICM) se concluyó lo siguiente:
Los ingredientes activos eficientes para el control de Rhizoctonia solani in vitro fueron Carbendazim, Fosfito de cobre y Tiabendazol.
Para el control in vitro Fusarium oxysporum se encuentran los ingredientes activos Azoxystrobin, Carbendazim, Fosfito de cobre, Tiabendazol y Clorotalonil.
Para el control in vitro de Botrytis cinerea se encuentra únicamente el Fosfito de cobre.
Para el control in vitro Lasidoplodia theobromae se encuentran los ingredientes activos Carbendazim, Fosfito de cobre y Tiabendazol.
Para el control in vitro Sclerotinia sclerotium se encuentran los ingredientes activos Azoxystrobim, Clorotalonil, Carbendazim, Fosfito de cobre y Tiabendazol.
Para el control in vitro de Colletotrichum gloeosporoides se encuentran únicamente el ingrediente activo Fosfito de cobre y Tiabendazol.
Los ingredientes activos eficientes para el control de Penicillum spp in vitro fueron Carbendazim, Tiabendazol, y Azoxystrobim.
Los ingredientes activos eficientes para el control de Phytophthora infestans in vitro fueron Sulfato de cobre penta hidratado, y Clorotalonil.
Agradecimiento
Agradecemos a la Escuela de Posgrado de la especialidad de Fitopatología de la Universidad Nacional Agraria la Molina por permitir usar sus laboratorios e instalaciones para el desarrollo de la presente investigación.
Contribución de los autores
D. A.: & R. G.: Análisis de laboratorio, redacción del manuscrito original, tomaron las fotografías.
Conflicto de intereses
Los autores declaran no tener conflictos de intereses.
Literatura Citada
Agrios, G .N. 2005. fitopatología, 2da edición. México, Limusa, 952 p. [ Links ]
Alfaro, G. 2011. Fosfitos para el control de hongos patógenos. Consultado el 12 Dic 2017. Disponible en: http://www.hor talizas.com/proteccion-de-cultivos/fosfitos-para-el-control-de-hongos-patogenos/ [ Links ]
Arista, C. 2017. Fungitox. Consultado el 12 Dic 2017.Disponible en: http://www.arysta.com.co/ProductosProteccion/PDF/F.T.%20FUNGITOX%20(vr.%202).pdf [ Links ]
Dávila, M. 2000. Doenças das culturas de soja, milho e feijão associadas ao sistema de PD sobre a palha. In: Guia para Plantio Direto. Grupo Plantio Direto (Eds). Ponta Grossa, Brasil. 110 pp.
Dingra, D. & J. Sinclair. 1985. Basic Plant Pathology Methods. Editorial CRC Press. ISBN 10: 084935921. 448p. [ Links ]
Fundación Hondureña de Investigación Agrícola (FHIA). 2007. Deterioro poscosecha de las frutas y hortalizas frescas por hongos y bacterias. 4:2- 5. Disponible en:http://www.fhia.org.hn/dowloads/fhia_informa/fhiainfdic2007.pdf [ Links ]
Fungicide Resistance Action Commitee (FRAC). 2016. List of Fungicide Common Names. Consultado el 01 Dic. 2017. Disponible en: http://www.frac.info/what-s-new/2016/02/15/publication-of-the-frac-code-list-2016 [ Links ]
Fungicide Resistance Action Commitee (FRAC). 2017. List of Fungicide Common Names. Consultado el 01 Dic. 2017. Disponible en: http://www.frac.info/docs/default-source/publications/frac-code-list/frac-code-list-2017-final.pdf [ Links ]
García, C. 2004. Introducción a la microbiología. Segunda edición. Editorial EUNED. Costa Rica. 103 – 107 p. [ Links ]
Herrero, J. 2005. Flora de Iberia. Consultado el 06 dic2017. Disponible en: http://floradeiberia.com/ [ Links ]
Investigación y Desarrollo. 2010. Hongos entomopatógenos y su uso como plaguicidas. [ Links ]
Pande, M. B.; P. M. Talpada; Z. N. Patel; B. H. Patel & P. C. Shukla. 1982. Utilization of processed Babul seed in the ration of Kankrej bullocks for maintenance. Indian J. Dairy Sci., 35 (4): 613-615 [ Links ]
ROTAM. 2016. Ficha técnica Azoxystrobin. Consultado 07 dic 2017. Disponible en: https://www.rotam.com/andina/UserFiles/ufyhto/image/products/fungicida/FT_Quattro_250_SC.pdf [ Links ]
Silvestre. 2017. Ficha Técnica PROTEXIN. Consultado el 18 Nov. 2017. Disponible en: http://www.silvestre.com.pe/site/images/Fichas_Tecnicas/FT_PRO-TEXIN_500_FW_09.pdf [ Links ]
Syngenta. 2017. Ficha Técnica AMISTAR. Consultado el 15 Nov. 2017. Disponible en: https://www.syngenta.co.uk/product/crop-protection/fungicide/amistar. [ Links ]
Syngenta. 2017. Ficha Técnica TIMOREX GOLD. Consultado el 20 Nov. 2017. Disponible en: https://www.syngenta.cl/product/crop-protection/fungicidas/timorex-goldr-1 [ Links ]
Anexos
Recibido: 20-IV-2018
Aceptado: 28-V-2018
Publicado online: 30-VII-2018
Publicado impreso: 30-VIII-2018