Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Arnaldoa
versión impresa ISSN 1815-8242versión On-line ISSN 2413-3299
Arnaldoa vol.25 no.2 Trujillo mayo/ago. 2018
http://dx.doi.org/http://doi.org/10.22497/arnaldoa.252.25210
Artículos originales
Remoción de nitratos y fosfatos por cepas nativas de Chlorella sp. (Chlorellaceae) y Chlamydomonas sp. (Chlamydomonadaceae) libres e inmovilizadas en aguas residuales municipales
Nitrate and phosphate removal by free and immobilized native strains of Chlorella sp. (Chlorellaceae) and Chlamydomonas sp. (Chlamydomonadaceae) in municipal wastewaters
José Giovanni Jesus Avila Peltroche1, Andrea Laos Ayala1 & Rosa Marina Verano Silvera1
Haydeé Montoya Terreros2
1 Laboratorio de Biología Marina, Facultad de Ciencias Biológicas. Universidad Ricardo Palma. Av. Benavides 5440, Apdo 1801, Lima 33, PERÚ
jose_avila22@hotmail.com /laos.andrea90@gmail.com /rmverano.silvera@gmail.com
2 Departamento de Simbiosis Vegetal, Museo de Historia Natural, UNMSM, Av. Arenales 1256, Apdo 14-0434, Jesús María, Lima, Perú. Instituto de Investigación de Ciencias Biológicas, Facultad de Ciencias Biológicas, UNMSM, Ciudad Universitaria, Av. Venezuela cuadra 34, Lima 1, PERÚ
Resumen
La remoción de nutrientes inorgánicos en aguas residuales mediante microalgas es un método eficiente y productivo, en la que, a la par de la oxigenación los cuerpos de agua, la biomasa obtenida puede ser utilizada como materia prima en diversas industrias. El principal objetivo del presente trabajo fue determinar la capacidad de remoción de nitratos (N-NO3-) y fosfatos (PO43-) en aguas residuales municipales por cultivos libres e inmovilizados de Chlorella sp. (Chlorelaceae) y Chlamydomonas sp. (Chlamydomonadaceae) nativas de dichas aguas. Los experimentos de remoción se realizaron en los efluentes residuales estériles de dicha planta durante 10 días. Las cepas se inmovilizaron en discos de alginato de sodio al 4%. Chlamydomonas sp. libre reportó el máximo porcentaje de remoción de N-NO3- (75.08%) mientras que Chlorella sp. libre obtuvo el valor más alto de remoción de PO43- (83.69%). En la mayoría de cultivos, más del 50% y 70% de N-NO3- y PO43-, respectivamente, fueron removidos durante el primer día. La inmovilización afectó negativamente la remoción de nutrientes, sin embargo estos valores superaron o se encontraron dentro de rangos altos de remoción reportados en estudios previos. En este sentido, ambas cepas, cultivadas de forma libre o inmovilizada, tienen el potencial de ser utilizadas en la remoción de nutrientes inorgánicos en aguas residuales municipales, especialmente de PO43-.
Palabras clave: microalgas, aguas residuales, remoción, inmovilización, cultivos.
Abstract
Removal of inorganic nutrients from wastewaters by microalgae is an efficient and productive method, which provides oxygenation to waterbodies and useful biomass for several industries. The aim of this investigation was to determinate the nitrate (N-NO3-) and phosphate (PO43-) removal capacity by free and immobilized cultures of native strains of Chlorella sp. (Chlorelaceae) and Chlamydomonas sp. (Chlamydomonadaceae) in municipal wastewaters. Removal experiments were performed in sterile wastewater effluents from the same plant during 10 days. Microalgae were immobilized in 4% sodium alginate discs. Free Chlamydomonas sp. reported the maximum N-NO3- removal percentage (75.08%) while free Chlorella sp. showed the highest PO43- removal (83.69%). Most of the cultures removed more than 50% and 70% of N-NO3- and PO43-, respectively, during the first day. Immobilization affected negatively the nutrient removal, however, these values were higher or within high ranges of removal reported in previous studies. The results showed that both strains in free or immobilized cultures have the potential to be used for removal of inorganic nutrients in municipal wastewaters, especially for PO43- removal.
Keywords: microalgae, municipal wastewaters, removal, immobilization, culture.
Introducción
En la actualidad, el tratamiento convencional de aguas residuales enfrenta el reto de disminuir el exceso de nutrientes (tratamiento terciario), en especial fosfatos (PO43-) y nitratos (N-NO3-), a niveles normales con el fin de evitar impactos negativos en los cuerpos de agua receptores (Mallick, 2002; UNESCO, 2003). Los métodos químicos y físicos, que son los más utilizados, son costosos, no tan efectivos y, al ser no naturales, tienen un impacto considerable en el ecosistema (Abdel Hameed & Hammouda, 2007). El Tratamiento Terciario Biológico (TBT) usando microalgas tiene la ventaja de ser un método eficiente y productivo, ya que la biomasa obtenida en el proceso puede ser utilizada en la producción de fertilizantes, biocombustibles, suplemento alimenticio en acuicultura, entre otros. A esto se suma, la oxigenación natural de los cuerpos de agua por parte de estos microorganismos, lo que reestablece el equilibrio ecológico (Gonzalez et al., 1997).
No obstante, el mayor problema que enfrenta este método es la remoción de la biomasa microalgal en suspensión del agua tratada. Los procesos convencionales son costosos, con alta demanda energética y requieren de una serie de etapas para recuperar por completo dicha biomasa (Robinson et al., 1985; Rai & Mallick, 1992; Gonzalez & Bashan, 2000; Abdel Hameed, 2002; Moreno-Garrido, 2008). Ante esto, surge la posibilidad de utilizar matrices de diferente naturaleza que puedan inmovilizar microalgas y evitar el proceso engorroso de removerlas de la forma convencional. Asimismo, una de las principales ventajas que ha presentado la inmovilización en estudios previos es el aumento de la eficiencia de remoción de PO43- y N-NO3- al compararlas con sus contrapartes no inmovilizadas (Abdel Hameed & Hammouda, 2007; Moreno-Garrido, 2008; de-Bashan & Bashan, 2010).
Pocos estudios han utilizado cepas nativas de aguas residuales en biorremediación (Jiménez-Perez et al., 2004; Singh et al., 2011; Hernández-Reyes et al., 2012; Zhang et al., 2012, Zhou et al., 2012), las cuales abarcan especies de Chlorella, Auxenochlorella protothecoides, Desmodesmus intermedius, Nannochloris sp., Oscillatoria sp. y Spirulina subsalsa. Se sabe que especies y/o cepas que naturalmente viven en aguas residuales presentan un mejor crecimiento comparado a sus contrapartes provenientes de bancos comerciales cuando son cultivadas en aguas residuales (Jiménez-Perez et al., 2004; Zhou et al., 2012), por lo que, las primeras representan una opción ideal para la remoción de nutrientes.
En Sudamérica, las investigaciones referentes al uso de microalgas inmovilizadas para el tratamiento de aguas residuales son muy escasas considerando los bajos porcentajes de aguas tratadas en la región (Campos & Saconi, 2014). En Ecuador, Moreno et al. (2010) evaluaron la reducción de nitrógeno y fósforo en aguas residuales sintéticas y semi-sintéticas por parte de una cepa axénica de Nostoc sp. y un consorcio de cianobacterias. Los cultivos inmovilizados en perlas de alginato de ambas cepas mostraron tener una mayor eficiencia en la remoción de estos compuestos en comparación a sus contrapartes libres. El consorcio inmovilizado logró el mayor porcentaje de remoción de fósforo (93,4%) en comparación a la cepa axénica (76,3%). Por otro lado, en Colombia, Infante et al. (2013) inmovilizaron Chlorella sp. en poliuretano con el fin de remover NH4+ y PO43- de aguas residuales provenientes de lagunas de oxidación. Luego de 32 horas, la cepa inmovilizada removió el 68% y 65% de nutrientes, respectivamente, con un pH óptimo de 6,5 y 7,5 en cada caso.
El objetivo principal del presente trabajo fue determinar la capacidad de remoción de N-NO3- y PO43- en aguas residuales municipales por cultivos libres e inmovilizados de Chlorella sp. y Chlamydomonas sp. nativas de dichas aguas. Adicionalmente, se caracterizó el crecimiento de las cepas en medio residual, así como la viabilidad post-inmovilización.
Materiales y métodos
Aislamiento y mantenimiento de las cepas
Cepas no axénicas de Chlorella sp. y Chlamydomonas sp. se aislaron durante Octubre a Diciembre del 2013 del afluente de la Planta de Tratamiento de Aguas Residuales (PTAR) "Ing. Alejandro Vinces Araoz" del distrito de Surco, Lima, Perú (12°6’43.52" S y 76°59’38.17"O; pH=8.2±0.27; temperatura=19,64±0,17°C) mediante la técnica de raspado en agar. Las cepas se mantuvieron en Medio Basal Bold (MBB) suplementado con 0,1% de las mismas aguas residuales autoclavadas, a 21,8 ± 0,5 °C y fotoperiodo constante utilizando 2 lámparas fluorescentes de 18W cada una.
Descripción de las aguas residuales municipales
La PTAR recibe las aguas contaminadas del Río Surco, las cuales son sometidas a un pre-tratamiento a base de cámara de rejas y un desarenador. A continuación, los sólidos en suspensión son floculados con sulfato de aluminio (Al2 (SO4)3) para ser removidos por una serie de filtros (tratamiento primario fisicoquímico). Finalmente, las aguas son desinfectadas con cloro y se almacenan en una cisterna de 350 m3 (Burstein, 2004; Moscoso, 2011; Prieto, 2011). El motivo de la elección de dicha planta para el presente trabajo es la carencia de algún tipo de tratamiento biológico en los diferentes pasos del tratamiento de las aguas. Los principales parámetros fisicoquímicos de las aguas residuales utilizadas se detallan en la Tabla 1.
Caracterización y crecimiento de las cepas unialgales en medio residual
Los efluentes provenientes de la PTAR (medio residual) fueron filtrados dos veces utilizando papel filtro Rundfilter 125 mm, esterilizados en autoclave y guardados a 4°C hasta su uso. Una vez alcanzada la fase exponencial, las cepas (libres e inmovilizadas) se inocularon en 250 ml de medio residual y se mantuvieron con aireación constante durante 10 días. La temperatura y fotoperiodo fueron las mismas descritas para la etapa de aislamiento. En los cultivos libres, la concentración celular se determinó diariamente con ayuda de un hemocitómetro (Neubauer improved, Marienfeld, Alemania) y se calcularon los valores de tasa intrínseca de crecimiento (r), número de divisiones por día (k) y tiempo de duplicación (T2) según Wood et al. (2005)
Inmovilización
Las cepas de Chlorella sp. o Chlamydomonas sp. en MBB (15 ml) fueron mezcladas con 60 ml de una solución de alginato de sodio (Solegraells) al 4% previamente esterilizada en autoclave. A continuación, 2,1 mL de la mezcla se añadió a placas Petri de 15 x 100 mm estériles y se agregó una solución al 2% de CaCl para su gelificación durante 2 horas y media. Los discos resultantes tuvieron un diámetro promedio de 26 ± 0,70 mm y un grosor 3,22±0,44 mm. Estos se lavaron dos veces en agua destilada estéril para eliminar cualquier exceso de CaCl2 y se colocaron en medio residual. La disolución de los discos se realizó en citrato de sodio al 0,05 M.
La viabilidad celular post-inmovilización se determinó mediante la comparación de la concentración celular con cultivos controles (no inmovilizados previamente ni cultivados en medio residual) luego de 5 días de crecimiento en MBB en las condiciones antes mencionadas.
Diseño experimental
Se utilizó un diseño factorial completamente aleatorizado del tipo 22. Los factores considerados fueron "cepa" (Chlorella sp. o Chlamydomona sp.) y "forma de cultivo" (libre o inmovilizado). Adicionalmente, se añadieron los tratamientos "Control" (solo aguas residuales) y "Alginato" (aguas residuales + discos de alginato sin microalgas) con el fin de determinar si factores ajenos al metabolismo microalgal estuvieron involucrados en la reducción de nutrientes. Cada tratamiento se llevó a cabo en 5 repeticiones.
Cuantificación de clorofila a, N-NO3- y PO43-
El proceso de extracción de clorofila a (chl a) se llevó a cabo al inicio y final del experimento según lo indicado por Henriques et al. (2007) y Porra (1990), y se leyó en un espectrofotómetro Thermo Spectronic Genesys 20 a 665 y 650 nm. Para el tratamiento con microalgas inmovilizadas, los discos fueron disueltos previamente. El contenido total de chl a, en µg, se calculó según lo indicado por Lee & Shen (2004). Los niveles de N-NO3- y PO43- se determinaron en el Instituto del Mar del Perú (IMARPE) mediante las técnicas colorimétricas de reducción/diazotización y azul de molibdeno, respectivamente, usando un fotómetro YSI 9500 y se expresaron en mg/l. Los porcentajes de remoción para cada nutriente se calcularon según Aslan & Kapdan (2006) (mg/l/día).
Análisis estadístico
La normalidad de los datos se evaluó mediante el test de Shapiro-Wilk y la homogeneidad de varianzas, con el test de Levene. En el caso de que no existiera homocedasticidad, los datos se transformaron con raíz cuadrada. Para las comparaciones entre los parámetros cinéticos de crecimientos de ambas cepas y el contenido final de chl a entre cultivos libres e inmovilizados se utilizó la prueba T para muestras independientes. El aumento significativo de chl a al finalizar el experimento se determinó en cada cultivo con la prueba T para muestras relacionadas. Con el fin de determinar si la concentración y la remoción de nutrientes en los cultivos microalgales fueron estadísticamente diferentes a los tratamientos Control y Alginato se aplicó la prueba de ANOVA de 1 vía con el post-hoc de Dunnet. Asimismo, se llevó a cabo la prueba de ANOVA de dos vías con el fin de determinar si hubo influencia e interacción entre los factores "cepa" y "forma de cultivo" sobre los porcentajes de remoción de N-NO3- y PO43-. El test post-hoc de Tukey se utilizó para determinar las diferencias significativas entre los factores o, en el caso de interacción, los tratamientos. Los análisis se realizaron con un 95% de confiabilidad en el paquete estadístico SPSS v.21.
Resultados
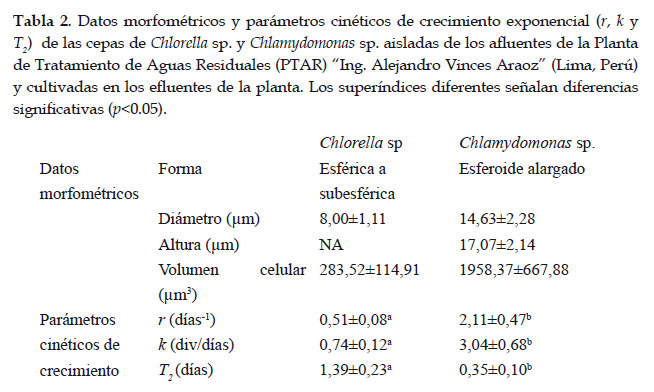
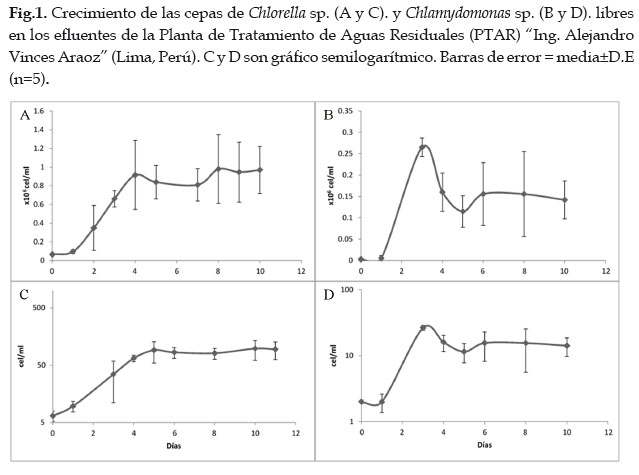
La Tabla 2 detalla la forma, dimensiones y volumen celular de las cepas aisladas en el presente estudio. En los cultivos libres, Chlamydomonas sp. presentó un crecimiento exponencial mayor a pesar de haber alcanzado una densidad celular máxima inferior a la de Chlorella sp (Fig. 1).
La duración de la fase de exponencial fue de 5 días para Chlorella sp. y 2 días para Chlamydomonas sp. Esta última presentó una fase de adaptación de 2 días. En el periodo evaluado no se evidenció fase de muerte (Fig.1). Los parámetros de crecimiento fueron estadísticamente superiores en Chlamydomonas ps. (Tabla 2).
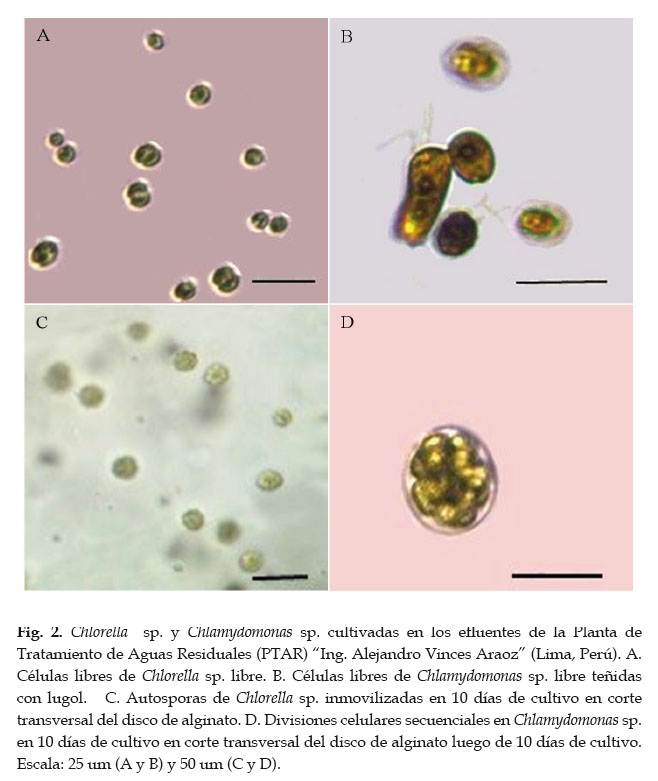
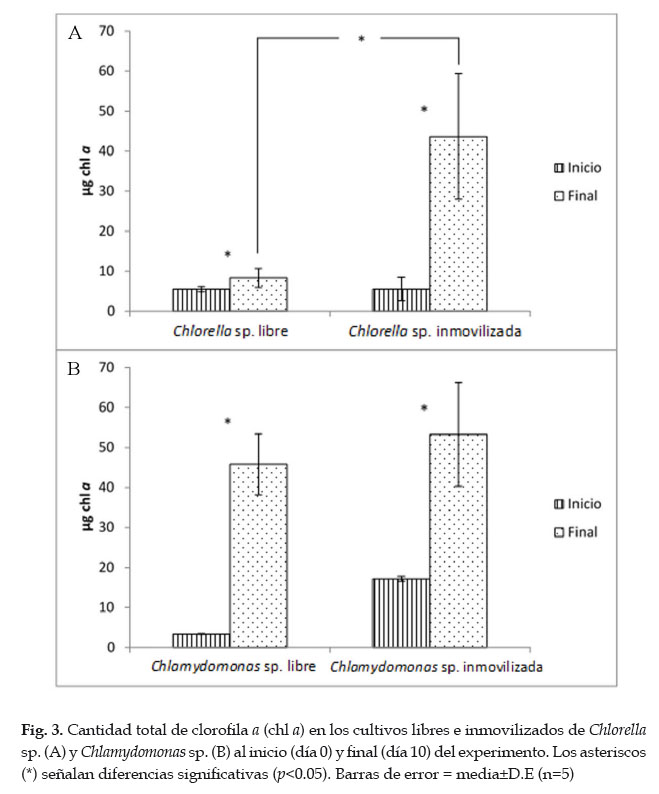
Para el caso de los cultivos inmovilizados, hubo un crecimiento muy notorio en ambas cepas. La densidad celular inicial por disco (2,50±0,51 x106 cel/disco) se incrementó aproximadamente 6 veces (17,67±2,81 x106 cel/disco) para Chlorella sp., y 27 veces para Chlamydomonas sp. (0,23±0,12 a 6,50±2,04 x106 cel/disco). Al finalizar los cultivos inmovilizados por 10 días, Chlorella sp. presentó autosporas de 16 a 32 individuos y Chlamydomonas sp. hasta 16 células hijas resultantes de divisiones secuenciales dentro de la pared parental (Fig. 2). No se evidenció el fenómeno de "fuga" (leakeage) ni inestabilidad en la matriz. El contenido total de chl a en los cultivos inmovilizados de ambas cepas se incrementó significativamente al finalizar el cultivo. Esta fue mayor en los cultivos inmovilizados de Chlorella sp., mientras que en Chlamydomonas sp. dicho valor fue similar para ambos tipos de cultivo (Fig. 3).
Las concentraciones iniciales de N-NO3- y PO43- en todos los tratamientos fueron de 5,06±0,03 y 1,00±0,04 mg/l, respectivamente. Al finalizar los cultivos, los valores mínimos alcanzados de N-NO3- y PO43- fueron 1,26±0,11 mg/l en Chlamydomonas sp. libre y 0,09±0,04 mg/l en Chlorella sp. libre, respectivamente. Las fluctuaciones del pH fueron entre 8,75±0,40 (día 0) y 8,19±0,17 (día 10). Las concentraciones N-NO3- y PO43-se mantuvieron constantes durante todo el experimento en los tratamientos Control y Alginato (p>0,05, Fig. 4).
El máximo porcentaje de remoción de N-NO3- lo presentó Chlamydomonas sp. (75,08±2,32%). En todos los tratamientos, con excepción de Chlorella sp. libre, el porcentaje de remoción de N-NO3- fue más del 50% durante el primer día de cultivo. Los porcentajes finales de remoción de los cultivo libres fueron estadísticamente superiores a los reportados por los cultivos inmovilizados. (Tabla 3).
Chlorella sp. libre tuvo el valor más alto de porcentaje de remoción de PO43- (83,69±1,85 %). En todos los cultivos, con excepción de Chlorella sp. libre, la remoción de PO43- durante el primer día estuvo entre 74,87±4,38 % y 80,10±2,19 %. Los porcentajes de remoción al finalizar el experimento fueron estadísticamente similares en todos los cultivos, con excepción de Chlamydomonas sp. inmovilizada (78±2,79 %; Tabla 3).
La forma de cultivo fue un factor significativo en la remoción de ambos nutrientes. Los cultivos inmovilizados presentaron menores porcentajes de remoción en comparación a sus contrapartes libres. El tipo de cepa tan solo afectó la remoción de PO43-. Las interacciones fueron no significativas (Tabla 4).
La viabilidad de las cepas previamente inmovilizadas fue evidenciada luego de 5 días de crecimiento en MBB (Chlorella sp.: 13,21±3,73 x106 cel/ml; Chlamydomonas sp.: 16,15±3,62 x106 cel/ml) . Los valores de densidad celular final fueron mayores (p<0,01) a la de sus contrapartes no inmovilizadas previamente (Chlorella sp.: 4,38±0,70 x106 cel/ml; Chlamydomonas sp.: 1,09±0,25 x106 cel/ml). La morfología celular no se vio alterada en comparación a los cultivos iniciales.
Discusión
Este trabajo representa el primer estudio en Perú sobre el uso de microalgas nativas de aguas residuales, inmovilizadas y libres, para la remoción de nutrientes inorgánicos. De igual forma, este es el primer reporte del uso de Chlamydomonas sp. aislada de aguas residuales en este tipo de investigaciones.
Con respecto al crecimiento en medio residual, la ausencia de una fase lag para Chlorella sp. fue similar a lo reportado por Tam & Wong (1989), Yang et al. (2008), Wang et al. (2010) y Wang et al. (2013) para este género en diversos tipos de efluentes residuales. Para el caso de Chlamydomonas sp., sus parámetros cinéticos de crecimiento fueron superiores a los de Chlorella sp. Esto en conjunto muestra que ambas especies tuvieron buena adaptación al medio residual. El ratio inorgánico N/P en los efluentes de la PTAR fue bajo (Darley, 1982; Reynolds, 1984; Martin et al., 1985), por lo que la adaptación de las cepas a dicho medio se podría deber a la flexibilización de la cuota celular de los nutrientes inorgánicos a través de la disminución de sus constantes medias de saturación (Grobbelaar, 2013).
Los valores iniciales y finales de densidad celular y el contenido total de chl a de las cepas evidenciaron que la matriz de alginato no limitó el crecimiento las microalgas. El tamaño reducido de los poros (17 nm; Lupo et al., 2012) presentes en la matriz permite el entrampamiento de las células, pero no impide el paso de moléculas pequeñas y altamente solubles, como N-NO3- y PO43-, para su incorporación en el metabolismo y crecimiento microalgal (Lau et al., 1998; Cohen, 2001; Moreira et al., 2006).
Abdel Hameed & Hammouda (2007) y Moreno-Garrido (2008) señalaron que la principal razón del incremento de la concentración de chl a en cultivos inmovilizados sería el efecto de auto-sombreado (self-shading). Este es ocasionado por el crecimiento microalgal en matrices en forma de "perlas", lo cual disminuye la incidencia de luz y promueve la síntesis de clorofila y otros pigmentos. En el presente estudio, el contenido total final de chl a en Chlamydomonas sp. fue similar en ambos tipos de cultivos (libre e inmovilizados). Esto sugiere que la matriz no provocó el efecto de auto-sombreado debido a que la forma en disco utilizada tiene una mayor incidencia de luz que la forma tradicional en "perlas" (Zamani et al., 2012). Sin embargo, la diferencia encontrada en el contenido total final de chl a en Chlorella sp. para ambos tipos de cultivos se atribuiría a características fisiológicas más que a la matriz en sí misma (Lau et al., 1998; Safi et al., 2014).
Para las cepas microalgales investigadas, los rangos de remoción de N-NO3- estuvieron entre 56% y 75% y de PO43-, entre 78% a 84%, siendo más eficiente Chlamydomona sp. libre en la remoción de N-NO3- y Chlorella sp. libre en la de PO43-. Zamani et al. (2012) reportaron una remoción de PO43- en un período de 12 días entre 55% a 68% para diferentes cepas de Chlorella sp. y de 71,91% para Chlamydomonas sp., ambas inmovilizadas en discos de alginato. Shi et al. (2007) obtuvieron una remoción de 82,9% de N-NO3- y 70,4% de PO43- en 24 horas usando una cepa Hallochlorella rubescens inmovilizada en un sistema de capa doble de láminas de nitrocelulosa. Otros estudios con concentraciones iniciales similares de PO43- han reportado porcentajes de remoción de entre 74% a 100% en un período mínimo de 4 horas y máximo de 24 días (Larsdotter et al., 2007; Zhang et al., 2012; Wang et al., 2013). Los porcentajes de remoción de PO43- reportados en este estudio estuvieron dentro de rangos de remoción altos de PO43- reportados por otros autores, lo que sugiere que las cepas de Chlorella sp. y Chlamydomonas sp. son más efectivas en la remoción de dicho nutriente. Esta diferencia en la remoción de ambos nutrientes se debe principalmente a que el ratio inorgánico de N/P no estuvo dentro del rango óptimo (6-10) lo que pudo haber ralentizado la absorción de N-NO3- (Cai et al., 2013).
En comparación con otros métodos de tratamiento terciario, altos porcentajes de remoción de PO43- (76-80%) fueron removidos tan solo en un día en la mayoría de cultivos utilizados en el presente estudio. Esto es superior a lo reportado en Lagunas Algales de Alta Tasa (hasta un 80% en 2 a 6 días) pero inferior a lo removido por los métodos químicos (80 %-100% en 0,3 a 0,5 días) según Oswald, 1998; Hoffman, 1998 y Shi et al., 2007.
El análisis de ANOVA indicó que la forma de cultivo fue el factor más influyente en el porcentaje de remoción de N-NO3- y PO43-. Dichos parámetros se vieron afectados negativamente por la técnica de inmovilización. Diversos estudios han demostrado que la inmovilización favorece la remoción de nutrientes en cultivos microalgales (Hoffmaan, 1998; Mallick, 2002; Abdel Hameed & Hammouda, 2007; de-Bashan & Bashan, 2010). No obstante, esta tendencia no es apoyada por nuestros resultados y compartida, en el caso de nitrógeno, con Jiménez-Perez et al. (2004). Una posible explicación es que solamente una proporción de las células inmovilizadas se encontró metabólicamente activa (Tam et al., 1994). Por otro lado, Zhang et al. (2012) reportó un incremento en la remoción de nutrientes al elevar la concentración celular inicial en los cultivos. Esto podría explicar las diferencias encontradas en los cultivos de Chlorella sp., los cuales presentaron un número total de células (NTC) iniciales diferentes (Chlorella sp. libre: NTC=19,65 x106 cel; Chlorella sp. inmovilizada: NTC= 10 x106 cel).
Finalmente, Zamani et al. (2012) señalaron tres características ventajosas que debería tener una cepa microalgal para ser considerada como candidata en el tratamiento de aguas residuales mediante inmovilización: 1) alta remoción de nutrientes; 2) adecuado crecimiento en la matriz de inmovilización con baja "fuga" celular; y 3) manejabilidad y fácil cultivo en el laboratorio. Las cepas de Chlorella sp. y Chlamydomonas sp. utilizadas en el presente estudio reúnen estas características debido a que: 1) han presentado altos porcentajes de remoción, especialmente de PO43-; 2) su crecimiento no se vio afectado significativamente por el proceso de inmovilización ni se detectó "fuga" alguna de células; y 3) son cepas que no tienen requerimientos especiales para su cultivo en laboratorio. Adicionalmente, se demostró que el proceso de inmovilización no afectó la viabilidad celular de las cepas utilizadas en esta investigación, lo que coincidió con lo reportado por Roa & Cañizares (2012) y Zhang et al. (2012). Esto nos indica que las microalgas empleadas en el tratamiento de aguas residuales podrían ser reutilizadas en procesos posteriores o mantenerse en ciclos alternados o continuos de tratamiento. Esto, aunado a la facilidad de cosecha, podría economizar el tratamiento de aguas residuales a mayor escala. Futuros estudios son necesarios para determinar los parámetros ideales de estas cepas y aquellas nativas de aguas residuales para su uso a una escala mayor.
Agradecimientos
A la Universidad Ricardo Palma por el financiamiento otorgado a este trabajo gracias al "II Concurso de Proyectos de Tesis de Pregrado" (Acuerdo de Consejo Universitario N°2790-2013) y a sus laboratorios de Biotecnología y Fisiología Animal, y Microbiología e Inmunología por el apoyo brindado en diversos análisis durante esta investigación. Asimismo, a la Planta de Recuperación de las Aguas del Río Surco "Ing. Alejandro Vinces Araoz" por las facilidades brindadas en la colecta y uso de sus aguas residuales, y al Banco de Germoplasma del Instituto del Mar del Perú por facilitar los análisis fisicoquímicos en sus ambientes.
Contribución de los autores
J. A.: aislamiento y mantenimiento de las cepas microalgales, diseño, ejecución, análisis de datos y redacción del manuscrito; A. L.: mantenimiento de las cepas microalgales y ejecución; R. V.: ejecución y redacción del manuscrito; H. M.: identificación taxonómica y diseño. Todos los autores han leído el manuscrito final y aprobado la revisión.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.
Literatura citada
Abdel Hameed, M. S. 2002. Effect of immobilization on growth and photosynthesis of the green alga Chlorella vulgaris and its efficiency in heavy metals removal. Bull Fac Sci Assiut Univ 31:233–240. [ Links ]
Abdel Hameed, M. S. & O. Hammouda. 2007. Biotechnological potential uses of immobilized algae. Int J Agric Biol 9 (1):183-192. [ Links ]
Aslan, S. & I. K. Kapdan. 2006. Batch kinetics of nitrogen and phosphorus removal from synthetic wastewater by algae. Ecol Eng 28 (1):64–70. [ Links ]
Burstein, Z. 2004. Ingeniero Alejandro Vinces Araoz (1919-1999). Rev Peru Med Exp Salud Pública 21 (2):111-112. [ Links ]
Cai, T.; S. Y. Park & Y. Li. 2013. Nutrient recovery from wastewater streams by microalgae: Status and prospects. Renew Sust Energy Rev 19: 360-369. [ Links ]
Campos, C. & A. Saconi. 2014. Gestión del agua en América del Sur: el estado de los recursos hídricos en Argentina, Brasil y Colombia. 1ra edición. Editorial Pontificia, Bogotá. 15p. [ Links ]
Cohen, Y. 2001. Biofiltration – the treatment of fluids by microorganisms immobilized into the filter bedding material: a review. Bioresource Technol 77 (3): 257-274. [ Links ]
Darley, W. M. 1982. Algal biology: A physiological approach. Basic microbiology. Vol. 9. Blackwell, Oxford. 168p. [ Links ]
de-Bashan, L. E. & Y. Bashan. 2010. Immobilized microalgae for removing pollutants: review of practical aspects. Bioresource Technol 101 (6): 1611-1627. [ Links ]
Gonzalez L. E. & Y. Bashan. 2000. Increased growth of the microalga Chlorella vulgaris when coimmobilized and cocultured in alginate beads with the growth-promoting bacteria Azospirillum brasilense. Appl Environ Microbiol 66(4):1527–1531. [ Links ]
Gonzalez, L. E.; R. O. Canizares & S. Baena. 1997. Efficiency of ammonia and phosphorus removal from a Colombian agroindustrial wastewater by the microalgae Chlorella vulgaris and Scenedesmus dimorphus. Bioresource Technol 60 (3): 259–262. [ Links ]
Grobbelaar, J. U. 2013. Inorganic Algal Nutrition. Pp. 123-133. En: A. Richmond & Q. Hu (editores), Handbook of Microalgal Culture: Applied Phycology and Biotechnology. Wiley-Blackwell, Oxford, Reino Unido. [ Links ]
Henriques, M.; A. Silva & J. Rocha. 2007. Extraction and quantification of pigments from a marine microalga: a simple and reproducible method. Pp. 586–593. En: A. Méndez-Vilas (editor), Communicating Current Research and Educational Topics and Trends in Applied Microbiology. Formatex, Madrid, España. [ Links ]
Hernández-Reyes, B. M.; M. C. Rodríguez-Palacios; C. Lozano-Ramírez & P. Castilla-Hernández. 2012. Remoción de nutrientes por tres cultivos de microalgas libres e inmovilizados. Rev. Latinoam. Biotecnol. Amb. Algal 3 (1): 80-94. [ Links ]
Hoffman, J.P. 1998. Wastewater treatment with suspended and nonsuspended algae. J Phycol 34(5):757-763. [ Links ]
Infante, C.; I. León; J. Florez; A. Zárate; F. Barrios & C. Zapata. 2013. Removal of ammonium and phosphate ions from wastewater samples by immobilized Chlorella sp. Int J Environ Stud 70 (1): 1-7. [ Links ]
Jiménez-Perez, M. V.; P. Sánchez-Castillo; O. Romera; D. Fernández-Moreno & C. Pérez-Martínez. 2004. Growth and nutrient removal in free and immobilized planktonic green algae isolated from pig manure. Enzyme Microb Technol 34: 392-398. [ Links ]
Larsdotter, K.; J. Janse & G. Dalhammar. 2007. Biologically mediated phosphorus precipitation in wastewater treatment with microalgae. Environm Technol 28 (9): 953-960. [ Links ]
Lau, P. S.; N. F. Y. Tam & Y. S. Wong. 1998. Effect on carrageenam immobilization on the physiological activities of Chlorella vulgaris. Bioresource Technol 63 (2): 115-121. [ Links ]
Lee, Y. K. & H. Shen. 2004. Basic Culturing Techniques. En: Richmond, A. (Ed). Handbook of Microalgal Culture: Biotechnology and Applied Phycology. Blackwell, Oxford. 47-48p. [ Links ]
Lupo, B.; C. Gonzáles & A. Maestro. 2012. Microencapsulación con alginato en alimentos. Técnicas y aplicaciones. Rev Venez Cienc Technol Aliment 3 (1): 130-151. [ Links ]
Mallick, N. 2002. Biotechnological potential of immobilized algae for wastewater N, P and metal removal: A review. Biometals 15 (4): 377-390. [ Links ]
Martin, C.; J. de la Noüe & G. Picard. 1985. Intensive cultivation of freshwater microalgae on aerated pig manure. Biomass 7 (4): 245–259. [ Links ]
Moreno-Garrido, I. 2008. Microalgae immobilization: current techniques and uses. Bioresource Technol 99 (10): 3949-3964. [ Links ]
Moreno, M.; B. Naranjo & A. Koch. 2010. Evaluación de dos métodos para la reducción de nitrógeno, fósforo y DQO de aguas residuales, mediante un cultivo axénico de cianobacterias y un consorcio microbiano, inmovilizados y en suspensión. Ciencia 13 (1): 55-61. [ Links ]
Moreira, S. M.; M. Moreira-Santos; L. Guilhermino & R. Ribeiro. 2006. Immobilization of the marine microalga Phaeodactylum tricornutum in alginate for in situ experiments: Bead stability and suitability. Enzyme Microb Technol 38 (1-2): 135-141. [ Links ]
Moscoso, J. 2011. Estudio de Opciones de Tratamiento y Reuso de Aguas Residuales en Lima Metropolitana [Informe en Internet]. Lima Water, Lima [acceso 9 de noviembre de 2013]. Disponible en: http://www.lima-water.de/documents/jmoscoso_informe.pdf [ Links ]
Oswald, W. J. 1988. The role of microalgae in liquid waste treatment and reclamation. En: Lembi, C. A., Waaland, J. R. (Eds). Algae and human affairs. Cambridge University Press, Cambridge. 255-281p. [ Links ]
Porra, R. J. 1990. A simple method for extracting chlorophylls from the recalcitrant alga, Nannochloris atomus, without formation of spectroscopically-different magnesium-rhodoclorin derivatives. Biochim Biophys Acta 1019 (2): 137-141. [ Links ]
Prieto D. 2011. Blog de Procesos de Manufactura II [Internet]. David Prieto, Lima [acceso el 10 de noviembre de 2013]. Disponible en: http://procesosdemanufactura2.blogspot.com/2011/04/visita-la-planta-intihuatana.html [ Links ]
Rai, L. C. & N. Mallick. 1992. Removal and assessment of toxicity of Cu and Fe to Anabaena doliolum and Chlorella vulgaris using free and immobilized cells. World J Microbiol Biotechnol 8 (2): 110–114. [ Links ]
Reynolds, C. S. 1984. The ecology of freshwater phytoplankton. Cambridge. University Press, Cambridge. 157–191p. [ Links ]
Roa, A. L. & R. O. Cañizares. 2012. Bioremediación de aguas con fosfatos y nitratos utilizando Scenedesmus incrasssatulus inmovilizado. Bistua: Revista de la Facultad de Ciencias Básicas 10 (1): 71-79. [ Links ]
Robinson, P. K.; A. L. Dainty; K. H. Goulding; I. Simpkins & M. D. Tervan. 1985. Physiology of alginate immobilized Chlorella. Enzyme Microb Technol 7 (5): 212–216. [ Links ]
Safi, C.; B. Zebib; O. Merah; P-Y. Pontalier & C. Vaca-Garcia. 2014. Morphology, composition, production, processing and applications of Chlorella vulgaris: A review. Renew Sust Energ Rev. 35:265-278. [ Links ]
Shi, J.; B. Podola & M. Melkonian. 2007. Removal of nitrogen and phosphorus from wastewater using microalgae immobilized on twin layers: an experimental study. J Appl Phycol 19 (5): 417-423. [ Links ]
Singh, S. K.; A. Bansal; M. K. Jha & A. Dey. 2011. Comparative studies on uptake of wastewater nutrients by immobilized cells of Chlorella minutissima and dairy waste isolated algae. Indian Chemical Engineer 53 (4): 211-219. [ Links ]
Subgerencia de Parques y Jardines. 2006. Memoria Descriptiva de la Planta de Recuperación y Tratamiento de Aguas de Regadío – Intihuatana. Municipalidad de Surco (Lima, Perú). Anexo I. [ Links ]
Tam, N. F. Y.; P. S. Lau & Y. S. Wong. 1994. Wastewater inorganic N and P removal by immobilized Chlorella vulgaris. Water Sci Technol 30 (6): 369–374. [ Links ]
Tam, N. F. Y. & Y. S. Wong. 1989. Wastewater nutrient removal by Chlorella pyrenoidosa and Scenedesmus sp. Environ Pollut 58 (1): 19-34. [ Links ]
UNESCO. 2003. Agua para todos. Agua para la vida: Informe de las Naciones Unidas sobre el Desarrollo de los Recursos Hídricos en el Mundo. World Water Assessment Programme, Paris. 4-10p. [ Links ]
Wang, C.; X. Yu; H. Lu & J. Yang. 2013. Nitrogen and phosphorus removal from municipal wastewater by the green alga Chlorella sp. J Environ Biol 34 (2 Spec No):421-425. [ Links ]
Wang, L.; M. Min; Y. Li; P. Chen; Y. Chen; Y. Liu; Y. Wang & R. Ruan. 2010. Cultivation of green algae Chlorella sp. in different wastewaters from municipal wastewater treatment plant. Appl Biochem Biotechnol 162 (4): 1174-1186. [ Links ]
Wood, A. M.; R. C. Everroad & L. M. Wingard. 2005. Measuring growth rates in microalgal cultures. Pp. 269-285. En: R. A. Andersen (editor), Algal Culturing Techniques. Elsevier, Amsterdam, Países Bajos. [ Links ]
Yang, C.; Z. Ding & K. Zhang. 2008. Growth of Chlorella pyrenoidosa in wastewater from cassava ethanol fermentation. World J Microbiol Biotechnol 24 (12): 2919-2925. [ Links ]
Zamani, N.; M. Noshadi; S. Amin; A. Niazi & Y. Ghasemi. 2012. Effect of alginate structure and microalgae immobilization method on orthophosphate removal from wastewater. J Appl Phycol 24(4):649-656. [ Links ]
Zhang, E.; B. Wang; S. Ning; H. Sun; B. Yang; M. Jin & L. Hou. 2012. Ammonia-nitrogen and orthophosphate removal by immobilized Chlorella sp. isolated from municipal wastewater for potential use in tertiary treatment. Afr J Biotechnol 11 (24): 6529-6534. [ Links ]
Zhou, W.; Y. Li; M. Min; B. Hu; H. Zhang; X. Ma; L. Li; Y. Cheng; P. Chen & R. Ruan. 2012. Growing wastewater born microalga Auxenochlorella protothecoides UMN280 on concentrated municipal wastewater for simultaneous nutrient removal and energy feedstock production. Appl Energy 98:443-440. [ Links ]
Citación: Ávila, J.; A. Laos; R. Verano & H. Montoya. 2018. Remoción de nitratos y fosfatos por cepas nativas de Chlorella sp. (Chlorellaceae) y Chlamydomonas sp. (Chlamydomonadaceae) libres e inmovilizadas en aguas residuales municipales. arnal 25 (2): 499-514. doi: http://doi.org/10.22497/arnal.252.25210
Recibido: 15-III-2018; aceptado: 5-V-2018; publicado online: 30-VII-2018; publicado impreso: 30-VIII-2018.