Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Arnaldoa
versão impressa ISSN 1815-8242versão On-line ISSN 2413-3299
Arnaldoa vol.25 no.2 Trujillo mayo/ago. 2018
http://dx.doi.org/http://doi.org/10.22497/arnaldoa.252.25211
ARTÍCULOS ORIGINALES
Efecto de bacterias nativas del suelo cultivado y prístino sobre el control del nematodo agallador radicular, Meloidogyne javanica. en condiciones in vitro y producción de biomasa
Effect of Bacteria Native from Cultivated and Pristine Soil on the Control of Root Knot Nematode, Meloidogyne Javanica, Under in Vitro Conditions and Biomass Production
Carlos Condemarín Montealegre1,a, Mercedes Oyola Medina, Eric Mialhe & Juan Quimi Mujica2, Segundo Astudillo Urbina & Savina Gutierrez Calle3, Carolina Barreto Castillo, Cesar Túllume Pisfil, Paulo Duarte & Gustavo LeónTemple4
1 Biotecoop, calle Filipinas 214, Tumbes, PERÚ
2 Inca Biotec S.A.C. Calle Filipinas 212, Tumbes, PERÚ.
3 Universidad Nacional de Tumbes. Av. Universitaria s/n, Tumbes, PERÚ.
4 Ecosac Agrícola S.A.C. Carretera Chapairá s/n, Caserío Chapairá, Castilla, Piura, PERÚ.
Resumen
Los nematodos agalladores de la raíz son los patógenos más perjudiciales para la mayoría de cultivos debido a la reducción del rendimiento del cultivo. Algunos nematicidas químicos son aún aplicados en campo a pesar del efecto negativo con el medio ambiente. Nuevas alternativas como el uso de microorganismos antagonistas son necesarias para reducir el daño de estos patógenos. En este estudio, aislamos y caracterizamos molecularmente mediante los genes 16S ARNr y 18S ARNr bacterias del suelo cultivado de uva y prístino, así como el nematodo agallador respectivamente. Evaluamos el efecto de las cepas bacterianas sobre la mortalidad de los juveniles del nematodo en condiciones in vitro usando placas multipocillos. Además, evaluamos el crecimiento bacteriano sobre un medio de cultivo en base a un hidrolizado hidrobiológico más melaza. Los resultados de la secuencia identifica con una similitud del 98% al nematodo Meloidogyne javanica causante de la enfermedad en las muestras del cultivo de vid. Aislamos 66 y seleccionamos 10 cepas bacterianas de ambas muestras de suelo para evaluar su capacidad nematicida. Las cepas 9C y 11C de Pseudomonas putida; 1BSN y 2BSN de Bacillus subtilis, mostraron mayor mortalidad en los nematodos. Posteriormente, estas potenciales cepas mostraron un crecimiento optimo mayores a 107 UFC/ml al 1% del hidrolizado y 1% de melaza en comparación con los productos comerciales. Estos datos sugieren una notable reducción del costo de producción de biomasa de las cepas bacterianas controladoras de nematodos para su futura aplicación en invernadero y campo.
Palablas clave: Bacterias, nematodos, agentes biocontroladores, in vitro.
Abstract
Root-knot nematodes are the most damaging pathogens for most crops as they reduce crop yield. Some chemical nematicides are still being applied in the field in spite of their negative effect on the environment. New alternatives such as the use of antagonistic microorganisms are necessary to reduce the damage caused by these pathogens. In this study, we isolated and molecularly characterized the 16S rRNA and 18S rRNA genes from grape cultivated and pristine soil bacteria, as well as from the galling nematode, respectively. We evaluated the effect of bacterial strains on juvenile nematode mortality under in vitro conditions using multi-well plates. In addition, we evaluated bacterial growth on a culture medium composed of a hydrobiological hydrolysate supplemented with molasses. Sequencing results identified the Meloidogyne javanica nematode, which causes disease in the grapevine culture samples, with a 98% similarity. We isolated 66 bacterial strains and selected 10 of them from both crop soil samples to evaluate their nematicidal capacity. Strains 9C and 11C of Pseudomonas putida; 1BSN and 2BSN of Bacillus subtilis, caused higher mortality in nematodes. Subsequently, these potential strains showed an optimal growth level when cultured at higher concentrations than 107 CFU/ml using 1% hydrolysate and 1% molasses compared to commercial products. These data point to a significant reduction in the cost of biomass production of nematode-controlling bacterial strains for their future greenhouse and field applications.
Keywords: Bacteria, nematodes, biocontrol agents, in vitro.
Introducción
El cultivo de "vid" Vitis vinífera (Vitaceae) para vino y uva de mesa es uno de los más extensos sistemas agrícolas frutícolas en todo el mundo. La producción mundial de uva de mesa alcanza ahora más de 21 millones de toneladas y ha mostrado una fuerte tendencia importante en la última década (Seccia et al., 2015). La oferta peruana de exportación de esta fruta alcanzó un nuevo record de 320 000 tn durante la temporada 2016-2017 representando un incremento de 9% con respecto al año anterior, siendo la Región Piura la segunda mayor productora de uva de mesa después de Ica. Sin embargo, los mayores problemas para la productividad y rentabilidad de los viñedos de Piura y, subsecuentemente, para su perennidad y desarrollo son enfermedades como el oidio (Bendezú y Alvarez, 2012), mildiu, podredumbre del racimo, las enfermedades del tronco de la vid (Rodríguez et al., 2015) y nematodos principalmente del género Meloidogyne. Estos tipos de nematodos parásitos reducen el rendimiento del cultivo a través de la formación perenne de agallas radiculares impidiendo la absorción de agua y nutrientes del suelo (Sasser, 1977). Una simple agalla puede albergar a numerosas hembras adultas liberando cada una entre 500 a 1000 huevos que al eclosionar pasan a la fase infectiva, capaces invadir a otras raíces u hospederos. Aunque, esta fase infectiva en interacción con el suelo está expuesto a un ecosistema complejo, colonizado por una amplia diversidad de bacterias especialmente en la rizósfera, capaces de reducir su infección o población (Neher, 2001; Kerry, 2000; Costa et al., 2012; Li et al., 2015; Wilschut et al., 2016). Así, esta comunidad bacteriana benéfica ofrece una prometedora alternativa a los productos químicos que causan daño a los animales, humanos y al medio ambiente.
La búsqueda de nuevos agentes biocontroladores, capaces de reducir la población sobre las diversas especies de nematodos parásitos de plantas ha sido ampliamente documentado (Bird et al., 2003; Davies, 2005; Tian et al., 2007; Li et al., 2015). La investigación inicial, a través del enfrentamiento directo de pruebas in vitro, ha permitido diferenciar la eficiencia potencial de diferentes aislados bacterianos frente a los diferentes estadios de los nematodos tanto como la exposición a suspensiones bacterianas como el filtrado del cultivo (Ali et al., 2002; Siddiqui et al., 2005; El-Hadad et al., 2010; Aballay et al., 2013; Wei et al., 2014; Huang et al., 2015; Kaur et al., 2016). La secreción de los diversos compuestos bacterianos puede afectar la eclosión de los huevos, formación de agallas, reducir el movimiento o la muerte de los individuos juveniles (Castaneda-Alvarez & Aballay, 2016). Estos estudios de interacción bacteria-nematodo ayudan a comprender los posibles efectos nematicidas sobre la viabilidad, mortalidad y reproducción contra estos patógenos bajo condiciones de laboratorio.
Bajo condiciones de invernadero como en campo, la cantidad de volumen de inóculo de agentes biocontroladores de nematodos y evaluar su efectividad es mucho más grande. Los medios de cultivo comerciales para masificar las cepas bacterianas seleccionadas, limita la estrategia de manejo de control. Para ello, es necesario el uso de insumos más económicos, que produzca concentraciones de rendimiento más elevados, viables y persistentes. Una gran alternativa son los desechos hidrobiológicos industriales, que contienen grandes fuentes de nutrientes ideales para la producción de biomasa (Deraz et al., 2011; Liu et al., 2017).
En este estudio, aislamos, caracterizamos molecularmente bacterias del suelo prístino y cultivado de vid así como del nematodo agallador. Seleccionamos las bacterias con potencial actividad nematicida que reducen la viabilidad de nematodos en condiciones in vitro, así mismo, evaluamos un nuevo medio de cultivo para reducir el costo de masificación de las bacterias y su producción de biomasa para su escalamiento.
Material y métodos
Aislamiento de nematodos a partir de nódulos radiculares de vid
Las muestras de raíces de los patrones de vid variedad "Freedom" infectadas con nematodos fueron colectadas de uno de los parrones de viñedos de la empresa Ecosac Agrícola SAC, caserío Chapairá, distrito de Castilla, provincia de Piura, departamento de Piura. Se tomaron en cuenta 15 plantas con escaso follaje como sospecha de presencia de nematodos. Se escavó una calicata de 30 cm de profundidad para colectar las raíces con claros síntomas de desarrollo de la infección. Cada muestra de raíces infectadas se trasladó en bolsas de polietileno en un contenedor a 10° C hacia el laboratorio para su posterior análisis. Los diferentes estadios del nematodo (huevo, juvenil y hembra adulta) se aislaron a partir de las agallas más grandes de acuerdo con el método ligeramente modificado de Hussey y Barker (1973). Enjuagamos varias veces cada agalla hasta retirar la arena y residuos externos, y para desinfectar, usamos lejía comercial al 1% por 5 minutos. Se enjuagó varias veces con agua de caño. Cada agalla grande (10 g aprox.) lo cortamos en pequeños fragmentos de 0,5 cm3 para luego ser licuados a mínima velocidad por 15 segundos. La masa de tejidos licuados se vertió en un contenedor de vidrio y se enjuagó vigorosamente con lejía comercial al 1% por 1 minuto para romper la matriz gelatinosa. Rápidamente, dentro de un sumidero, se vertió la suspensión de huevos en un sistema tamices enjuagando con agua corriente. Con el uso de una piseta y una suave corriente de agua se colectaron los huevos a partir del tamiz de 38 µm en un tubo Falcon de 50 ml y se almacenaron a 4° C para su posterior utilidad. Para el aislamiento de juveniles, se colocó una cesta de nylon sobre una placa Petri de 10 cm de diámetro con una distancia de 1 cm entre la cesta y la base de la placa; sobre la cesta se colocó una hoja de papel absorbente comercial y se vertió una parte de la colecta de la suspensión huevos (40 ml aprox) incubándose por 4 días a temperatura ambiente (Atamian et al., 2012). Los nematodos juveniles infectivos frescos se colectaron entre el segundo y cuarto día de eclosión. Cada estadio del nematodo se desinfectó con lejía comercial al 0,5% por 5 minutos, se enjuagó cinco veces con agua estéril y se corroboró su asepsia colocándolos en placas Petri con medio de cultivo Luria Bertani Broth, Miller (LB, Microgen) por 72 horas hasta comprobar que ninguna bacteria crezca.
Aislamiento de bacterias
Las bacterias fueron aisladas a partir del suelo prístino, cultivado y rizósfera de raíces sanas de cultivo de uva. Las muestras de suelo, así como las pequeñas fracciones de raíces fueron colocadas directamente en tubos de 50 ml conteniendo 20 ml de caldo nutritivo LB y se agitaron en un shaker orbital a 120 RPM por 12 horas. Cada cultivo obtenido fue usado para realizar diluciones hasta una concentración final de 10-5. Se agregaron 25 µl de cada dilución en placas de Petri conteniendo medio LB más Agar Agar y se esparcieron en toda superficie de la placa para luego incubarlas a 27°C por 24 h. Posteriormente purificamos y recuperamos en tubos de plástico de 1.5 ml conteniendo 1 ml de caldo LB. Finalmente, un duplicado de cada bacteria fue usado para extracción de ADN y la otra fue almacenada con glicerol (15%) a -20°C.
Selección de cepas bacterianas
Se consideraron 10 cepas bacterianas aisladas de la rizósfera del cultivo de vid, para evaluar su potencial controlador de nematodos agalladores de la raíz. Cada cepa creció en 10 ml de LB por 48 horas en tubos Falcon de 15 ml a temperatura ambiente (27° C ± 2). Se ajustó a una concentración final a 1 x 107 UFC. Estos 10 ml de crecimiento bacteriano se consideran puro (100), para luego obtener tres diluciones decimales. 400 ul del cultivo bacteriano es vertido en cada pocillo de una placa multipocillo de cultivo celular plástico estéril de 4 pocilllos (Corning® Costar® TC-Treated Multiple Well Plates) más 100 ul de suspensión de nematodos juveniles infectivos frescos (J2), con aproximadamente 80 individuos. Cada placa se considera un tratamiento y cada pocillo se considera como repeticiones de cada tratamiento. El tratamiento control se agregó agua destilada estéril y la suspensión de nematodos. La viabilidad de los individuos se registró al inicio y a las 72 horas de enfrentamiento. Se tomó en cuanta la mortalidad de los J2 al no observar movimiento cuando eran expuestos al 1% de NaOH a 1N (Xiang et al., 2016).
Caracterización molecular de bacterias y nematodos
Las cepas bacterianas con mayor potencial controlador sobre los J2s se sembraron en duplicado, un grupo para conservarlas en glicerol (12%) a -20°C y al otro grupo les realizó la extracción de ADN en base al protocolo de CTAB (bromuro de cetiltrimetilamonio) descrito por Ausubel et al. (1997) modificado por Jara et al. (2008). Los ADN de las cepas aisladas fueron amplificados con la región 27/1492 del gen ARNr 16S, bajo siguientes condiciones: buffer 1x; 1,5mM de MgCl2; 1,25mM dNTPs; 0,036 μM de primers; 0,5 U de Taq polimerasa y 10 ng/μl de ADN molde. La programación de la amplificación fue: pre- desnaturalización a 94 °C durante 4 min, seguido por 35 ciclos de: desnaturalización 92 °C por 30s, Alineamiento por 1 min, extensión o elongación de la cadena 72 °C por 2 minutos; por último, la elongación Final a 72°C por 7 minutos. Los productos de PCR fueron observados mediante la técnica de electroforesis en TAE 1X mediante un gel de agarosa al 1,5%. El tamaño de los productos de amplificación se midió con un control positivo de amplificación 16S.
Para la caracterización molecular, consideramos cinco nematodos en estadio adultos previamente desinfectadas para la extracción de ADN, depositándolas en un tubo de 0,2 ml conteniendo 0,25 M de NaOH por 16 horas para después incubarlos a 95 °C por 3 min. Luego se adiciona 4 µl de HCL, 10 µl de 0,5M de buffer Tris-HCL a PH 8 y 5 µl de Triton X-100 al 2%, inmediatamente se incubó a 94 °C por 3 min y luego mantenidas a -20 °C, hasta realizar la reacción en cadena de la polimerasa (PCR). Las reacciones fueron realizadas en un volumen final de 25 µl conteniendo 2,25 mM de MgCl2, 0,2 mM de dNTP, 1,3 unidades de ADN polimerasa, 75 ng de primers SSU18A (AAAGATTAAGCCATGCATG) y SSU26R (CATTCTTGGCAAATGCTTTCG) (Blaxter et al., 1998). Las condiciones de los ciclos de la PCR fueron en primer ciclo de 94 °C por 5min, 35 ciclos (94°C por 1 min, 52 °C por 1 min 30 seg, 68 °C por 2 min), 68 °C por 1 min. El producto de PCR se confirmó mediante electroforesis a 1,5% en gel de agarosa y las bandas se visualizaron por tinción con bromuro de etidio, en un transiluminador UV.
Los amplicones obtenidos tanto como para bacterias y nemátodos fueron purificados y secuenciados por MACROGEN, USA (https://www. macrogenusa.com/). Las secuencias fueron ensambladas manualmente por sobreposición y alineadas con la base de datos GENEBANK mediante el software BLASTn (http://blast.ncbi.nlm.nih.gov).
Producción de biomasa de bacterias mediante un hidrolizado hidrobiológico
Las cepas bacterianas seleccionadas con potencial controlador fueron sometidas a un nuevo medio de cultivo líquido a partir de un hidrolizado obtenido de desechos orgánicos de concha de abanico para su producción de biomasa, como alternativa a los medios de cultivo comerciales. Preparamos diferentes concentraciones del hidrolizado de concha de abanico (H) más melaza (M) como fuente proteica y energética respectivamente. Agregamos un volumen-volumen de 0,1, 0,25, 0,5, y 1 ml de H y M, más 1 ml a 1 x 108 como inóculo por cada cepa bacteriana y se aforó con agua destilada estéril a un volumen total de 10 ml en tubo Falcon de 15 ml por triplicado. Incubamos por 48 horas a temperatura ambiente y agitamos en un shaker orbital a 120 RPM. Usamos caldo LB como control. Probamos el crecimiento bacteriano sembrando diluciones decimales en medios de cultivo solidificado en placas de Petri conteniendo LB agregando Agar Agar e incubando a temperatura ambiente
26° C ±2. Las unidades formadoras de colonias (UFC) fueron contabilizadas luego de 24 horas.
Análisis estadístico
Los datos se analizaron mediante análisis de varianza para encontrar la importancia de las diferencias observadas (P = 0,05), y las comparaciones entre los valores medios de los tratamientos se realizaron entorno a R.
Resultados
Identificación de nematodos y bacterias.
Los resultados de la extracción de ADN genómico de nematodos agalladores de raíces de vid, mostraron una secuencia de 843 nucleótidos del gen 18S ARNr, con una similitud del 98% y un Query cover de 99% para Meloidogyne javanica según el análisis de la secuencia en la base de datos de BLAST. Así mismo, se aislaron un total de 67 cepas en suelo prístino y suelo cultivado. La caracterización molecular al gen ARNr 16S identificamos 11 géneros y 38 especies bacterianas en suelo prístino más 4 géneros y 29 especies en suelo cultivado con vid. En suelo prístino predominaron los géneros Bacillus, Lactobacillus, Enterobacter, Streptomyces, Pantoea, Cupriavidus, Acinetobacter, Cronobacter, Bordetella, Inquilinus y Escherichia. Mientras que el suelo cultivado los géneros más predominantes fueron Aeromonas, Bacillus, Enterobacter, Plesiomonas y Pseudomonas. Cuatro cepas de Bacillus subtilis y seis cepas de Pseudomonas putida fueron seleccionadas para evaluar su capacidad nematicida frente a juveniles infectivos (J2s) según la mayoría de reportes científicos enfocados en estos géneros.
Enfrentamiento in vitro
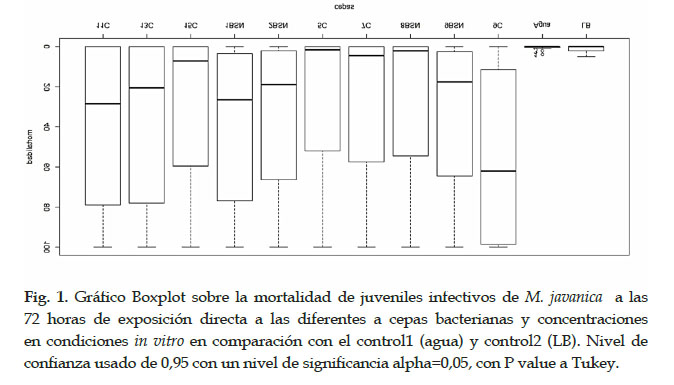
Bajo condiciones in vitro, consideramos la mortalidad de los individuos de J2s al no observar movimiento, incluso al agregar NaOH al 1%. Los ensayos mostraron que los inóculos con concentraciones puras de cada cultivo bacteriano tienen una mortalidad del 100% de los J2s a los pocos minutos de exposición. Aunque, la mortalidad de los J2s disminuye cuando es diluido a 1/10, mostrando diferencias significativas entre las demás cepas a las 72 horas de exposición. Siendo la cepa 9C, P. putida, de mayor efectividad con mayor mortalidad del 95% al contrario con la cepa 5C, Pseudomonas sp., la que mostró una escasa mortalidad, en comparación con el control con agua y LB, donde no se observó mortalidad en los J2s (Fig.1). Por lo tanto, varias especies de B. subtilis y P. putida poseen potencial efecto controlador de nematodos agalladores radiculares.
Producción de Biomasa
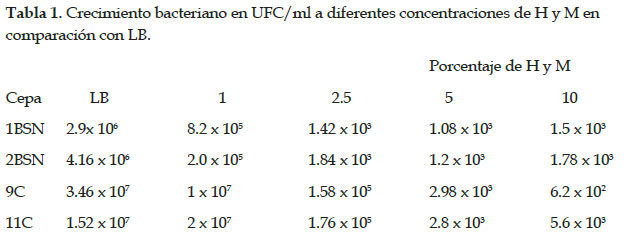
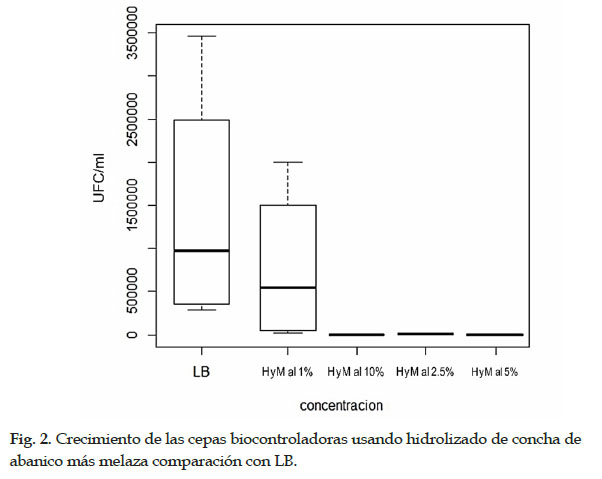
Las pruebas in vitro registraron las cepas 9C, 11C, 1BSN y 2BSN mostraron mayor efecto en la mortalidad de nematodos, y fueron sometidas a un medio de cultivo líquido basado en hidrolizado de concha de abanico más melaza para evaluar su crecimiento y eventualmente reducir el costo de producción de biomasa en remplazo de los medios de cultivo comerciales como LB. El crecimiento de bacterias se evaluó midiendo las UFC/ml en placas Petri con LB más Agar Agar. Todas las cepas mostraron un mayor crecimiento al 1% del hidrolizado más el 1% de melaza en comparación con LB y las demás concentraciones. El mayor crecimiento de las colonias se observó en la cepa 11C con 2,0 x 107 UFC/ml, 9C con 1,0 x 107 UFC/ml, seguido de las cepas 1BSN con 8,2 x 105 UFC/ml y 2BSN con 2 x 105 UFC/ml (Tabla 1). A mayor concentración, el crecimiento bacteriano no era favorable para ninguna cepa en comparación con el control de LB (Fig. 2).
Discusión
Las nuevas técnicas moleculares han permitido la identificación de comunidades microbianas en una muestra, sin necesidad de realizar un cultivo previo. No obstante, los métodos de microbiología tradicional de aislamiento de microorganismos, junto a las herramientas moleculares, son básicos para que en su posterioridad, las cepas obtenidas sean estudiadas y/o utilizadas según sus características como microorganismos promotores de crecimiento, agentes biocontroladores e inductores de resistencia sistémica. Los géneros Bacillus y Pseudomonas aisladas e identificadas molecularmente en ambas muestras de suelo han sido ampliamente reportados por los numerosos mecanismos de promoción de crecimiento vegetal, entre ellos: la fijación del nitrógeno; producción de fitohormonas; producción de sideróforos; solubilización del fosfato; producción de antibióticos para inhibir fitopatógenos; producción de enzimas líticas extracelulares; producción de enzima deaminasa ACC; producción de ácido salicílico y ácidos orgánicos necesarios para las plantas (Almaghrabi, et al. 2013; Prashar, et al. 2014). La especie B. subtilis con diversos estudios acerca de los mecanismos de biocontrol y promoción de crecimiento vegetal, tales como: la producción de péptidos antibióticos contra Fusarium oxysporum (Reddy, et al. 2016); producción de rizocticina fosfono-oligopeptida que tiene actividad antifúngica y nematicida (Borisova et al. 2010), etc. Por estos motivos se han formulado numerosos productos a base de B. subtilis y otros Bacillus, hasta el año 2011 se han reportado 20 productos (Cawoy, et al. 2011) para el control biológico de nemátodos, entre ellos Meloidogyne incognita, Meloidogyne javanica, Pratylenchus brachyurus y Pratylenchus coffeae. El género Pseudomonas considerado por promover el crecimiento de la planta igualmente produce metabolitos de amplio espectro como 2,4-diacetilfloroglucinol con actividades antifungales, antibacterianos y nematicidas (Siddiqui & Shaukat, 2003). Además han sido aislados de varios suelo supresivos para el manejo de enfermedades foliares y trasmitidas por el suelo, debido a que crecen fácilmente en laboratorio (Meena, 2014). Actualmente, nuevas especies están siendo identificadas gracias a las investigaciones del microbioma del suelo, donde las técnicas secuenciación masiva ha permitido la identificación molecular de los organismos extraídos directamente de su ambiente sin necesidad de cultivarlos.
La secuencia de 843 nucleótidos reveló una similitud del 98% para Meloidogyne javanica gracias a los protocolos de aislamiento de nematodos, de extracción de ADN y de amplificación por PCR del ADN genómico o mitocondrial que han sido publicados por numerosos autores (Floyd et al., 2002; Qiu et al., 2006; Berry et al., 2008; Hu et al., 2011; Clapp et al, 2000; Sultana et al., 2013). Igualmente se han publicado numerosos cebadores, la mayoría dirigidos al gen 18S ARNr y otros a genes de efectores implicados en la formación de nódulos. Cabe recordar que se han secuenciado hasta el momento cerca de mil genomas de nematodos lo que conduce a una enorme disponibilidad de informaciones de secuencias de genes, especialmente de genes efectores que constituyen excelentes biomarcadores de patogenicidad y especificidad de los nematodos frente a plantas hospederas (Ahmad et al., 2012; Castagnone-Sereno et al., 2013; Danchin et al., 2013). A pesar de la mayoría de reportes a nivel nacional sobre la identificación de nematodos son por características morfológicas, la tesis de Vera-Obando (2014), usó herramientas moleculares para identificar a M. incognita y determina como el principal nematodo en varias zonas de Perú, otras especies como M. javanica en Lambayeque, M. arenaria en Lima y M. hapla en Cajamarca.
El ambiente limitado de condiciones in vitro usando placas multipocillos, conduce a identificar si algunas cepas bacterianas producen compuestos que afectan directamente con la viabilidad de juveniles de M. javanica, promoviendo el ahorro de costos, tiempo y espacio sobre la selección de bacterias biocontroladoras en comparación con las pruebas en invernadero y campo. Por su modo de acción (Li et al., 2015), estos compuestos pueden ser toxinas como las proteínas Cry de B. thuringiensis que afecta a una variedad nematodos y otras plagas. Compuestos volátiles orgánicos producidas por B. nematocida que actúa como un mecanismo de caballo de Troya frente a Panagrellus redivivirus. Una vez que estas bacterias son consumidas por el nematodo liberan proteasas extracelulares que eliminan posteriormente a su hospedero (Niu et al., 2010). Otro modo de acción son las bacterias parásitas obligadas como Pasteuria penetrans, donde las esporas de esta especie que habitan en el suelo, se adhiere a la cutícula del nematodo cuando ésta se moviliza buscando una raíz hospedera. Sin afectarle inicialmente al estadio juvenil del nematodo, este invade la raíz e inicia su sitio de alimentación hasta desarrollar en una hembra adulta. Al mismo tiempo del desarrollo del nematodo, las esporas penetran la cutícula, se apoderan del sistema reproductor del nematodo e impiden la formación de huevos, produciendo y liberando consecutivamente millones de Condemarín et al.: Efecto de bacterias nativas del suelo cultivado y prístino sobre el control del nematodo agallador radicular esporas al suelo (Davies et al., 2009).
La mortalidad de los juveniles de M. javanica expuestos por 72 horas a los compuestos nematicidas producidos por las cepas 9C y 11C de P. putida, 1BSN y 2BSN de B. subtilis, demuestra resultados similares en varios reportes usando inóculos filtrados o concentrados celulares (Koberl et al., 2013; El-Sayed et al., 2014; Moghaddam et al., 2014; Park et al., 2014; Wei et al., 2014; Xiang et al., 2014; Huang et al., 2015; Chinheya et al., 2017; Jamal et al., 2017; Zhao et al., 2018). El equipo de El-Hadad et al. (2010), registraron alta mortalidad en J2 usando cultivos bacterianos a diluciones de 1/10, a partir de Paenibacillus polymyxa, Bacillus megaterium y Bacillus circulans, demostrando una alta producción de enzimas como proteasas, quitinasas y gelatinasas respectivamente frente a Meloidogyne incognita. Así mismo, Xia et al. (2011), identificaron el gen purL de B. subtilis y B. amyloliquefaciens asociado con actividad nematicida contra Aphelenchoides besseyi, Ditylenchus destructor, Bursaphelenchus xylophilus y Meloidogyne javanica. Sin embargo, a pesar de los avances en la identificación de compuestos nematicidas secretados por bacterias, los caracteres específicos del modo de acción sobre la mortalidad de nematodos es pobremente entendido (Castaneda-Álvarez & Aballay, 2016).
Para un posible desarrollo de escalamiento de producción de bacterias y su aplicación en invernadero y campo, el hidrolizado de concha de abanico es una gran alternativa como medio de cultivo. Este hidrolizado es un producto biológico producido mediante un proceso microbiológico sin adición de químicos, principalmente constituido de nitrógeno y fosfatos ideales para agricultura clásica u orgánica. La hidrólisis proteica lo hace un producto rico en aminoácidos fácilmente asimilables por plantas, animales y microorganismos. Su presentación líquida adicionando melaza como fuente energética han mostrado tener una fuente ideal de nutrientes para masificar agentes biocontroladores bacterianos. Estos insumos de bajo costo, manifestaron un mayor crecimiento eficiente a bajas concentraciones, comprobando el crecimiento en unidades formadoras de colonias usando medio sólido LB más Agar Agar. El mayor crecimiento de bacterias, donde cubrió toda la placa de Petri, para todas las cepas se observó al 1% del hidrolizado más el 1% de melaza. Sin embargo, a mayor concentración, el crecimiento bacteriano en UFC no era favorable para ninguna cepa en comparación con el control LB. El uso de residuos industriales también ha sido reportado por Najim et al. (2015), y usó HCl para lisar residuos crudos de pescado y aislar el sobrenadante para complementarlo con medios de cultivo comerciales. Se usaron tres microorganismos, Pseudomonas aeruginosa, Lactobacillus acidophilus y Saccharomyces cerevisiae, para analizar las peptonas en bruto producidas como fuentes de nitrógeno en medios de cultivo. Los resultados de OD600 indicaron que las tres especies muestran una buena eficacia de crecimiento en diferentes medios complementados con peptonas crudas o comerciales a pesar de la superioridad relativa del producto comercial.
Conclusiones
En este estudio demostramos que las muestras de suelos cultivados y prístinos alberga microorganismos con potencial fuente de agentes biocontroladoras de nematodos. Estos agentes, B. subtilis y P. putida, presentaron una eficiente mortalidad de juveniles de M. javanica en pruebas in vitro. Estas pruebas revelaron que a diluciones de 1/10 de los cultivos bacterianos permiten diferenciar la capacidad nematicida entre las cepas aisladas y reducir los costos, tiempo y espacio comparados con los ensayos de invernadero, ideal para medir la dosis y la frecuencia de aplicación. El medio de cultivo alternativo en base del hidrolizado de concha de abanico más melaza, a bajas concentraciones, mostró que es posible el crecimiento de bacterias para hacer un buen uso de los desechos hidrobiológicos producidos en grandes cantidades en las costas del Perú. Este estudio sugiere alternativas de fuentes de nutrientes dirigidas a la producción de biomasa de bacterias benéficas para la agricultura en programas de control biológico para reducir la aplicación de pesticidas.
Agradecimientos
Agradecemos a nuestros amigos y colegas que colaboraron en este trabajo. Así mismo, este estudio es apoyado con los fondos de Ecosac Agrícola SAC, Inca’Biotec SA e InnovatePerú.
Contribución de los autores
C.C.; S. G; M. O.; S.A.; J.Q, Colección de muestras, diseño experimental, siembra microbiológica, análisis de datos moleculares. C.B.; C.T.; P.D.; G.L.; E.M, colecta de muestras, metodología, redacción del manuscrito original. Los autores hemos leído el manuscrito final y, autorizamos su publicación
Conflicto de intereses
Los autores declaran no tener conflictos de intereses.
Literatura citada
Aballay, E.; P. Ordenes; A. Mårtensson & P. Persson. 2013. Effects of rhizobacteria on parasitism by Meloidogyne ethiopica on grapevines. European journal of plant pathology, 135(1): 137-145. [ Links ]
Ahmad, F.; J. Gopal & H. F. Wu. 2012. Rapid and highly sensitive detection of single nematode via direct MALDI Mass Spectrometry. Talanta, 93, 182-185 [ Links ]
Ali, N. I.; I. A. Siddiqui; S. S. Shaukat & M. J. Zaki, M. J. 2002. Nematicidal activity of somestrains of Psuedomonas spp. Soil Biol. Biochem. 34, 1051e1058.
Almaghrabi, O.A.; I. M. Samia & S. A. Tamer. 2013. Influence of inoculation with plant growth promoting rhizobacteria (PGPR) on tomato plant growth and nematode reproduction under greenhouse conditions. Saudi journal of biological sciences 20, no. 1 57-61. [ Links ]
Atamian, H. S.; P. A. Roberts & I. Kaloshian. 2012. High and Low Throughput Screens with Root-knot Nematodes Meloidogyne spp.. J. Vis. Exp. (61), e3629, doi:10.3791/3629. [ Links ]
Berry, S. D.; M. Fargette; V. W. Spaull; S. Morand & P. Cadet. 2008. Detection and quantification of root-knot nematode (Meloidogyne javanica), lesion nematode (Pratylenchus zeae) and dagger nematode (Xiphinema elongatum) parasites of sugarcane using real-time PCR. Molecular and Cellular Probes, 22(3): 168-176. [ Links ]
Bendezú, M. V. & L. A. Alvarez. 2012. The perfect stage of powdery mildew of grapevine caused by Erysiphe necator found in Peru. Plant Disease,96(5): 768-768. [ Links ]
Bird, D. M.; C. H. Opperman & K. G. Davies. 2003. Interactions between bacteria and plant-parasitic nematodes: now and then. International journal for parasitology, 33(11): 1269-1276. [ Links ]
Borisova, S. A.; B. T. Circello; J. K. Zhang; W. A. van der Donk & W. W. Metcalf. 2010. Biosynthesis of rhizocticins, antifungal phosphonate oligopeptides produced by Bacillus subtilis ATCC6633. Chemistry & biology 17, no. 1: 28-37. [ Links ]
Castaneda, C. & E. Aballay. 2016. Rhizobacteria with nematicide aptitude: enzymes and compounds associated. World Journal of Microbiology and Biotechnology, 32(12): 203. [ Links ]
Castagnone, P.; E. G. Danchin; L. Perfus & P. Abad. 2013. Diversity and evolution of rootknot nematodes, genus Meloidogyne: new insights from the genomic era. Annual review of phytopathology, 51, 203-220. [ Links ]
Cawoy, H.; W. Bettiol; P. Fickers & M. Ongena. 2011. Bacillus-based biological control of plant diseases. Pesticides in the modern world— pesticides use and management. InTech, Rijeka. 273-302. [ Links ]
Clapp, J. P.; C. D. Van Der Stoel & W. H. Van Der Putten. 2000. Rapid identification of cyst (Heterodera spp., Globodera spp.) and root‐knot (Meloidogyne spp.) nematodes on the basis of ITS2 sequence variation detected by PCR‐single‐strand conformational polymorphism (PCR‐SSCP) in cultures and field samples. Molecular Ecology, 9(9), 1223-1232. [ Links ]
Chinheya, C. C.; K. S. Yobo & M. D. Laing. 2017. Biological control of the rootknot nematode, Meloidogyne javanica (Chitwood) using Bacillus isolates, on soybean. Biological Control, 109, 37-41. [ Links ]
Costa, S. R.; B. R. Kerry; R. D. Bardgett & K. G. Davies. 2012. Interactions between nematodes and their microbial enemies in coastal sand dunes. Oecologia, 170(4), 1053-1066. [ Links ]
Danchin, E. G.; M. J. Arguel; A. Campan; L. Perfus; M. Magliano; M. N. Rosso; ... & J. Guy. 2013. Identification of novel target genes for safer and more specific control of root-knot nematodes from a pan-genome mining. PLoS pathogens, 9 (10), e1003745. [ Links ]
Davies, G.; M. J. Stear & S. C. Bishop. 2005. Genetic relationships between indicator traits and nematode parasite infection levels in 6-month-old lambs. Animal Science, 80(2), 143-150. [ Links ]
Davies, K. G. 2009. Understanding the Interaction Between an Obligate Hyperparasitic Bacterium, Pasteuria penetrans and its Obligate Plant‐Parasitic Nematode Host, Meloidogyne spp. Advances in parasitology, 68, 211-245. [ Links ]
Deraz, S. F.; G. F. El-Fawal; S. A. Abd-Ellatif & A. A. Khalil. 2011. Autohydrolysed Tilapia nilotica fish viscera as a peptone source in bacteriocin production. Indian journal of microbiology, 51(2): 171-175. [ Links ]
El-Hadad, M. E.; M. I. Mustafa; S. M. Selim; A. E. Mahgoob; T. S. El-Tayeb & N. H. A. Aziz. 2010. In vitro evaluation of some bacterial isolates as biofer tilizers and biocontrol agents against the second stage juveniles of Meloidogyne incognita. World Journal of Microbiology and Biotechnology, 26(12), 2249-2256. [ Links ]
El-Sayed, W. S.; A. Akhkha; M. Y. El-Naggar & M. Elbadry. 2014. In vitro antagonistic activity, plant growth promoting traits and phylogenetic affiliation of rhizobacteria associated with wild plants grown in arid soil. Frontiers in microbiology, 5, 651. [ Links ]
Floyd, R.; E. Abebe; A. Papert & M. Blaxter. 2002. Molecular barcodes for soil nematode identification. Molecular ecology, 11(4): 839-850. [ Links ]
Huang, Y.; L. Ma; D. H. Fang; J. Q. Xi; M. L. Zhu; M. H. Mo; ... & Y. P. Ji. 2015. Isolation and characterisation of rhizosphere bacteria active against Meloidogyne incognita, Phytophthora nicotianae and the root knot–black shank complex in tobacco. Pest management science, 71(3): 415-422. [ Links ]
Hu, M. X.; Zhuo, K. & J. L. Liao. 2011. Multiplex PCR for the simultaneous identification and detection of Meloidogyne incognita, M. enterolobii, and M. javanica using DNA extracted directly from individual galls. Phytopathology, 101(11): 1270-1277. [ Links ]
Hussey, R. S.; K. R. Barker. 1973. A comparison of methods of collecting inocula of Meloidogyne spp., including a new technique. Plant Disease Reporter; 57:1025–1028. [ Links ]
Li, J.; C. Zou; J. Xu; X. Ji; X. Niu; J. Yang; ... & K. Q. Zhang. 2015. Molecular mechanisms of nematode- nematophagous microbe interactions: basis for biological control of plant-parasitic nematodes. Annual review of phytopathology, 53, 67-95. [ Links ]
Liu, J.; J. Zhou; L. Wang; Z. Ma; G. Zhao; ... & J. Qiao. 2017. Improving nitrogen source utilization from defatted soybean meal for nisin production by enhancing proteolytic function of Lactococcus lactis F44. Scientific Reports, 7(1): 6189 [ Links ]
Jamal, Q.; J. Y. Cho; J. H. Moon; S. Munir; M. Anees; & K. Y. Kim. 2017. Identification for the First Time of Cyclo (d-Pro-l-Leu) Produced by Bacillus amyloliquefaciens Y1 as a Nematocide for Control of Meloidogyne incognita. Molecules, 22(11): 1839. [ Links ]
Köberl, M.; E. M. Ramadan; M. Adam; M. Cardinale; J. Hallmann; H. Heuer; ... & G. Berg. 2013. Bacillus and Streptomyces were selected as broad- spectrum antagonists against soilborne pathogens from arid areas in Egypt. FEMS microbiology letters, 342(2): 168-178. [ Links ]
Kaur, T.; S. Jasrotia; P. Ohri & R. K. Manhas. 2016. Evaluation of in vitro and in vivo nematicidal potential of a multifunctional streptomycete, Streptomyces hydrogenans strain DH16 against Meloidogyne incognita. Microbiological research, 192, 247-252. [ Links ]
Kerry, B. R. (2000). Rhizosphere interactions and the exploitation of microbial agents for the biological control of plant-parasitic nematodes. Annual review of phytopathology, 38(1): 423-441. [ Links ]
Ramezani, M.; E. Moghaddam; S. Ravari & H. Rouhani. 2014. The nematicidal potential of local Bacillus species against the root-knot nematode infecting greenhouse tomatoes. Biocontrol science and technology, 24(3): 279-290. [ Links ]
Meena, B. 2014. Biological control of pest and diseases using fluorescent pseudomonads. In Basic and applied aspects of biopesticides (pp. 17-29). Springer India. [ Links ]
Najim, S. M.; J. M. Al-Noor & W. A. Al-Waely. 2015. Extraction of crude peptone from fish wastes for use as a nitrogen source in microbiological media. Global Journal of Fisheries and Aquaculture Researches, 2, 29-37. [ Links ]
Neher, D. A. 2001. Role of nematodes in soil health and their use as indicators. Journal of nematology, 33(4): 161. [ Links ]
Niu, Q.; X. Huang; L. Zhang; J. Xu; D. Yang; K. Wei & J. Yang. 2010. A Trojan horse mechanism of bacterial pathogenesis against nematodes. Proceedings of the National Academy of Sciences, 107(38): 16631-16636. [ Links ]
Park, J.; Y. Seo & Y. H. Kim. 2014. Biological control of Meloidogyne hapla using an antagonistic bacterium. The plant pathology journal, 30(3): 288. [ Links ]
Prashar, P.; N. Kapoor & S. Sachdeva. 2014. Rhizosphere: its structure, bacterial diversity and significance. Reviews in Environmental Science and Bio/Technology 13(1), 63-77. [ Links ]
Qiu, J. J.; B. B. Westerdahl; C. Anderson & V. M. Williamson. 2006. Sensitive PCR detection of Meloidogyne arenaria, M. incognita, and M. javanica extracted from soil. Journal of nematology, 38(4): 434. [ Links ]
Reddy, M. S.; R. I. Ilao; P. S. Faylon; W. D. Dar; R. Sayyed; H. Sudini; K. V. K. Kumar & A. Armanda. "Recent advances in biofer tilizers and biofungicides (PGPR) for sustainable agriculture. Proceedings of 3rd Asian Conference on Plant Growth-Promoting Rhizobacteria (PGPR) and other Microbials, Manila, Philippines, 21-24 April, 2013." In Recent advances in biofer tilizers and biofungicides (PGPR) for sustainable agriculture. Proceedings of 3rd Asian Conference on Plant Growth-Promoting Rhizobacteria (PGPR) and other Microbials, Manila, Philippines, 21-24 April, 2013. Asian PGPR Society for Sustainable Agriculture, 2013 [ Links ]
Rodríguez-Gálvez, E.; E. Maldonado & A. Alves. 2015. Identification and pathogenicity of Lasiodiplodia theobromae causing dieback of table grapes in Peru. European journal of plant pathology, 141(3): 477-489. [ Links ]
Sasser, J. N. 1977. Worldwide dissemination and impor tance of the root-knot nematodes, Meloidogyne spp. Journal of Nematology, 9(1): 26. [ Links ]
Seccia, A.; F. G. Santeramo & G. Nardone. 2015. Trade competitiveness in table grapes: a global view. Outlook on AGRICULTURE, 44(2): 127-134. [ Links ]
Siddiqui, I. A. & S. S. Shaukat. 2003. Suppression of root-knot disease by Pseudomonas fluorescens CHA0 in tomato: impor tance of bacterial secondary metabolite, 2, 4-diacetylpholoroglucinol. Soil Biology and Biochemistry, 35(12): 1615-1623. [ Links ]
Siddiqui, S.; Z. A. Siddiqui & I. Ahmad. 2005. Evaluation of fluorescent Pseudomonads and Bacillus isolates for the biocontrol of a wilt disease complex of pigeonpea. World Journal of Microbiology and Biotechnology, 21(5): 729-732. [ Links ]
Sultana, T.; J. Kim; S. H. Lee; H. Han; S. Kim; G. S. Min & J. K. Park. 2013. Comparative analysis of complete mitochondrial genome sequences confirms independent origins of plant-parasitic nematodes. BMC evolutionary biology, 13(1): 12. [ Links ]
Tian, B.; J. Yang & K. Q. Zhang. 2007. Bacteria used in the biological control of plant-parasitic nematodes: populations, mechanisms of action, and future prospects. FEMS microbiology ecology, 61(2): 197-213. [ Links ]
Vera Obando, N. 2014. Técnica molecular de PCR para identificar las principales especies de Meloidogyne spp. en poblaciones provenientes de Perú. Tesis para optar el grado de Magister Scientiae en Fitopatología. [ Links ]
Wei, L.; Y. Shao; J. Wan; H. Feng; H. Zhu; H. Huang & Y. Zhou. 2014. Isolation and characterization of a rhizobacterial antagonist of root-knot nematodes. PloS one, 9(1): e85988. [ Links ]
Wilschut, R. A.; S. Geisen; F. C. Ten Hooven & W. H. Van Der Putten. 2016. Interspecific differences in nematode control between range-expanding plant species and their congeneric natives. Soil Biology and Biochemistry, 100, 233-241. [ Links ]
Xia, Y.; S. Xie; X. Ma; H. Wu; X. Wang & X. Gao. 2011. The purL gene of Bacillus subtilis is associated with nematicidal activity. FEMS microbiology letters, 322(2): 99-107. [ Links ]
Xiang, N.; K. S. Lawrence; J. W. Kloepper & J. A. Mcinroy. 2014. In vitro screening of biological control agents on Meloidogyne incognita. In Proceedings of the 2014 Beltwide Cotton Conference (Vol. 1, pp. 258-260). [ Links ]
Xiang, N. & K. S. Lawrence. 2016. Optimization of in vitro techniques for distinguishing between live and dead second stage juveniles of Heterodera glycines and Meloidogyne incognita. PloS one, 11(5): e0154818. [ Links ]
Zhao, D.; H. Zhao; D. Zhao; X. Zhu; Y. Wang; Y. Duan & L. Chen. 2018. Isolation and Identification of Bacteria from Rhizosphere Soil and Their Effect on Plant Growth Promotion and Root-knot Nematode Disease. Biological Control. [ Links ]
Recibido: 5-IV-2018
Aceptado: 25-V-2018
Publicado online: 30-VII-2018
Publicado impreso: 30VIII-2018